超声辅助提取-高效液相色谱法测定聚乙烯食品包装袋中5种酚类化合物
徐雨军,陆春良,崔桂友,刘向农
(1.扬州大学旅游烹饪学院,江苏扬州 225127;2.扬州大学测试中心,江苏扬州 225009)
超声辅助提取-高效液相色谱法测定聚乙烯食品包装袋中5种酚类化合物
徐雨军1,2,陆春良2,*,崔桂友1,刘向农2
(1.扬州大学旅游烹饪学院,江苏扬州 225127;2.扬州大学测试中心,江苏扬州 225009)
建立了超声辅助提取和高效液相色谱法结合的方法,对聚乙烯食品包装袋中的5种酚类化合物进行提取、离心浓缩、检测。对超声辅助提取方法中溶胀剂选择、溶胀剂与溶剂比例、超声时间、超声后浸泡时间等进行优化,最终选择溶胀剂为环己烷,溶胀剂环己烷与溶剂甲醇比例为3∶7(v/v),超声时间25 min,超声后浸泡时间2 h。样品分析采用Agilent Eclipse Plus C18色谱柱(2.1 mm×150 mm,5 μm),流动相甲醇和水(含0.1%甲酸,v/v)梯度洗脱,流速为0.4 mL/min,紫外检测波长280 nm。结果显示:5种酚类化合物在其线性范围内线性关系良好(R2≥0.9995),方法的定量限(S/N=10)为0.25~0.40 mg/kg。125、250、500 mg/kg添加水平的回收率为81.2%~99.1%,相对标准偏差(n=3)为1.74%~4.87%。该方法前处理简单,回收率较高,精密度好,适用于聚乙烯食品包装袋中5种酚类化合物的检测。
高效液相色谱,超声辅助提取,酚类化合物,聚乙烯,食品包装
随着生活水平的提高,食品安全问题成为关注的热点。环境雌激素对人类、环境和生态的影响受到世界范围的关注,而酚类环境激素是最为常见的环境雌激素之一,酚类有害物质可以通过直接接触或食物链进入生物体,影响动物行为和精神活动[1]、损伤DNA并诱导肿瘤[2]、干扰细胞的有丝分裂和免疫功能[3]、影响生殖发育[4]等。塑料由于其良好的性能和低廉的价格已经广泛应用于食品包装,但在塑料包装与食品长时间接触过程中,对人类健康和环境会造成一定程度的危害[5]。
双酚A(BPA)是一种重要的化工原料,添加双酚A的塑料具有轻巧、耐用和防冲击性等特点[6]。2,6-二叔丁基对甲酚(BHT)和特丁基对苯二酚(TBHQ)是两种通用的酚类抗氧化剂。已有研究表明,长期过量食用含有BHT的食品,会对身体有较大的毒副作用,对人体肝、脾、肺等均有不利的影响[7],TBHQ因具有一定的急性毒性和慢性致癌作用而被限制使用[8]。2,4-二叔丁基酚(24DTBP)和2,6-二叔丁基酚(26DTBP)在制药、化纤和橡胶行业中被广泛地用作中间媒介,用于制备抗氧化剂,抗紫外剂,严重危害人体健康[9]。
因此,很有必要对市场上塑料包装的酚类化合物含量进行研究并进行安全性评价。目前测定酚类化合物的方法主要有分光光度法[10]、气相色谱[11]、气相色谱-质谱联用法[12]、高效液相色谱法[13-15]、液相色谱-质谱联用[16]等。常用的提取方法有索氏提取法[12]、超声提取法(UAE)[9]、加速溶剂萃取法(ASE)[17]、超临界流体萃取法(SFE)[18]等。其中ASE、SFE等提取效果较好,但是仪器昂贵,使用不普及。传统索氏提取时间较长,抗氧化剂损失较多。本实验最终选择设备简单易得,提取时间较短的超声辅助萃取。
本实验对5种具有代表性的酚类化合物同时进行测定,采用超声辅助法对样品进行提取,离心浓缩仪对提取液进行低温浓缩,减少了抗氧化剂等的损失。高效液相色谱法测定提取液,利用梯度洗脱达到5种组分的完全分离,利用质谱检测器信号排除假阳性结果。前处理简单、快速,定性定量准确,适用于塑料包装的卫生监督检测工作。
1 材料与方法
1.1材料与仪器
双酚A、2,6-二叔丁基对甲酚、特丁基对苯二酚、2,4-二叔丁基酚、2,6-二叔丁基酚 分析纯购自ALaddin公司;甲醇、二氯甲烷、正己烷、环己烷 色谱纯购自Dikma公司;实验用水均为三蒸水。
阳性聚乙烯模拟保鲜膜定制于某塑料厂,厚度0.1 mm,BPA、TBHQ、BHT、24DTBP、26DTBP添加量均为0.1%(质量分数)。其中24DTBP、26DTBP添加失败,制作过程中高温导致部分挥发,添加的质量分数不准确,但BHT结构性质与其相似,可代表这两种物质;实际检测样品取自各大超市具有代表性的聚乙烯保鲜膜,聚乙烯类食品包装袋等。
Agilent 6460液质联用系统、Agilent Eclipse Plus C18色谱柱(2.1 mm×150 mm,5 μm)美国Agilent公司;CHRIST RVC 2-25 CD plus离心浓缩仪北京五洲东方科技发展有限公司;Sartorius BSA22S-CW(220 g/0.1 mg)电子天平赛多利斯科学仪器(北京)有限公司;BRANSON B-321超声波清洗仪美国必能信超声波(亚太)有限公司;优普UPH-II-5T超纯水机成都超纯有限公司。
1.2标准溶液的配制及标准曲线的绘制
称取5种标准品各(0.1±0.01) g(准确到0.0001 g),分别转移至100 mL容量瓶中,加入甲醇溶解并定容至100 mL,制成1000 mg/L的单标标准溶液。再称取5种标准品各(0.1±0.01) g(准确到0.0001 g),转移至同一个100 mL容量瓶中,加入甲醇溶解并定容至100 mL,制成1000 mg/L的混合标准溶液。标准溶液置于4 ℃冰箱中避光保存,使用时稀释成所需的浓度。
取单标标准溶液稀释至50 mg/L,依次上机,确定保留时间。混标标准溶液分别稀释至100、50.0、25.0、12.5、6.25、3.13、1.00 mg/L,各取1 mL移入进样瓶中准备上机,每个标样重复进样2针。
1.3高效液相色谱条件
Agilent Eclipse Plus C18色谱柱(2.1 mm×150 mm,5 μm);流动相A相为水(含0.1%甲酸),B相为甲醇,柱温30 ℃。梯度洗脱:0.00~5.00 min,40%~90% B;5.00~10.00 min,90% B;10.00~10.10 min,90%~40% B;10.10~15.00 min,40% B。流速为0.4 mL/min,进样量10 μL,紫外检测波长280 nm。
1.4实验方法
1.4.1提取溶剂的选择参考姚帮本等[19-20]等实验中溶剂的选择,本实验选取甲醇作为溶剂,同时选取了水,二氯甲烷,正己烷,环己烷4种物质作为溶胀剂,将4种溶胀剂分别与甲醇以1∶4的体积比混合[19],编号A、B、C、D。将剪碎后的模拟保鲜膜样品各称取四份(1±0.01) g(准确到0.0001 g)分别加入4个50 mL碘量瓶中,依次向碘量瓶中加入25 mL提取液A、B、C、D。盖紧瓶塞,移至避光处,浸泡24 h。用甲醇溶液少量多次荡洗洗碘量瓶,荡洗3次,每次3 mL。经纱布过滤倒入50 mL离心管中,合并滤液。将离心管放入离心浓缩仪中25 ℃、15 mbar、1300 r/min条件下离心浓缩至近干,氮气吹干。准确加入1000 μL甲醇溶液复溶,旋涡振荡2 min。用针头式过滤器过0.22 μm尼龙滤膜,装入2 mL进样瓶中,标记,4 ℃避光保存,待测。实验重复3个平行,取平均值。
1.4.2提取液中溶胀剂比例的选择样品各称取(1±0.01) g(准确到0.0001 g)分别移入1~8号碘量瓶中,依次加入甲醇环己烷混合提取液25 mL,参考李浩峰[19]实验优化结果,环己烷比例依次为5%、15%、20%、25%、30%、35%、40%、50%,移至避光处浸泡24 h。重复实验1.4.1中荡洗,合并滤液,浓缩,复溶,过滤膜等步骤,装瓶供高效液相色谱测定。实验重复3个平行,取平均值。
1.4.3超声时间的选择样品各称取(1±0.01) g(准确到0.0001 g)分别加入1~8号碘量瓶中,加环己烷甲醇分散液(v/v=3∶7)25 mL,依次超声5、10、15、20、25、30、45、60 min,总提取时间(超声时间加静置浸泡时间)1 h条件下,将提取液经纱布过滤倒入50 mL离心管中,重复1.4.1中荡洗,合并滤液,浓缩,复溶,过滤膜,装瓶供高效液相色谱测定。实验重复3个平行,取平均值。
1.4.4超声后浸泡时间的选择称取样品(1±0.01) g(准确到0.0001 g)移入50 mL碘量瓶中,加入环己烷甲醇分散液(V/V=3∶7)25 mL,超声25 min,移至避光处,取样时间为0、0.5、1、2、3、4、24 h,每次取样0.25 mL,分别装入离心管中,编号1~7。将1~7号离心管重复1.4.1中荡洗,合并滤液,浓缩、复溶、过滤膜,装瓶供高效液相色谱测定(结果需乘以100倍后计算回收率)。实验重复3个平行,取平均值。
1.5实际样品检测
实际样品在超纯水中荡洗30秒,放在干净的烧杯中,放入通风橱中常温通风晾干。剪成碎片大小约为0.2 cm×0.2 cm的碎片,称取样品(1±0.01) g(准确到0.0001 g)移入50 mL碘量瓶中,加环己烷甲醇分散液(V/V=3∶7)25 mL,超声25 min,移至避光处,浸泡2 h。重复1.4.1中荡洗,合并滤液,浓缩,复溶,过滤膜,装瓶供高效液相色谱测定。
2 结果与讨论
2.1提取条件的优化
2.1.1提取溶剂的选择聚乙烯保鲜膜是乙烯的结晶态聚合物,分子链结合紧密,分子间相互作用力较强,溶剂不易渗入聚合物内部,所以使用单一溶剂提取添加剂比较困难。因此,在选择提取溶剂时,不仅要考虑到溶剂对提取物的溶解能力,还要考虑选择能溶胀聚合物制品的溶胀剂。溶胀剂负责溶胀聚合物分子链,打开溶剂萃取的通道,溶剂对目标提取物要有较好的溶解性[21]。图1为不同提取溶剂对三种酚类化合物提取效果的影响。
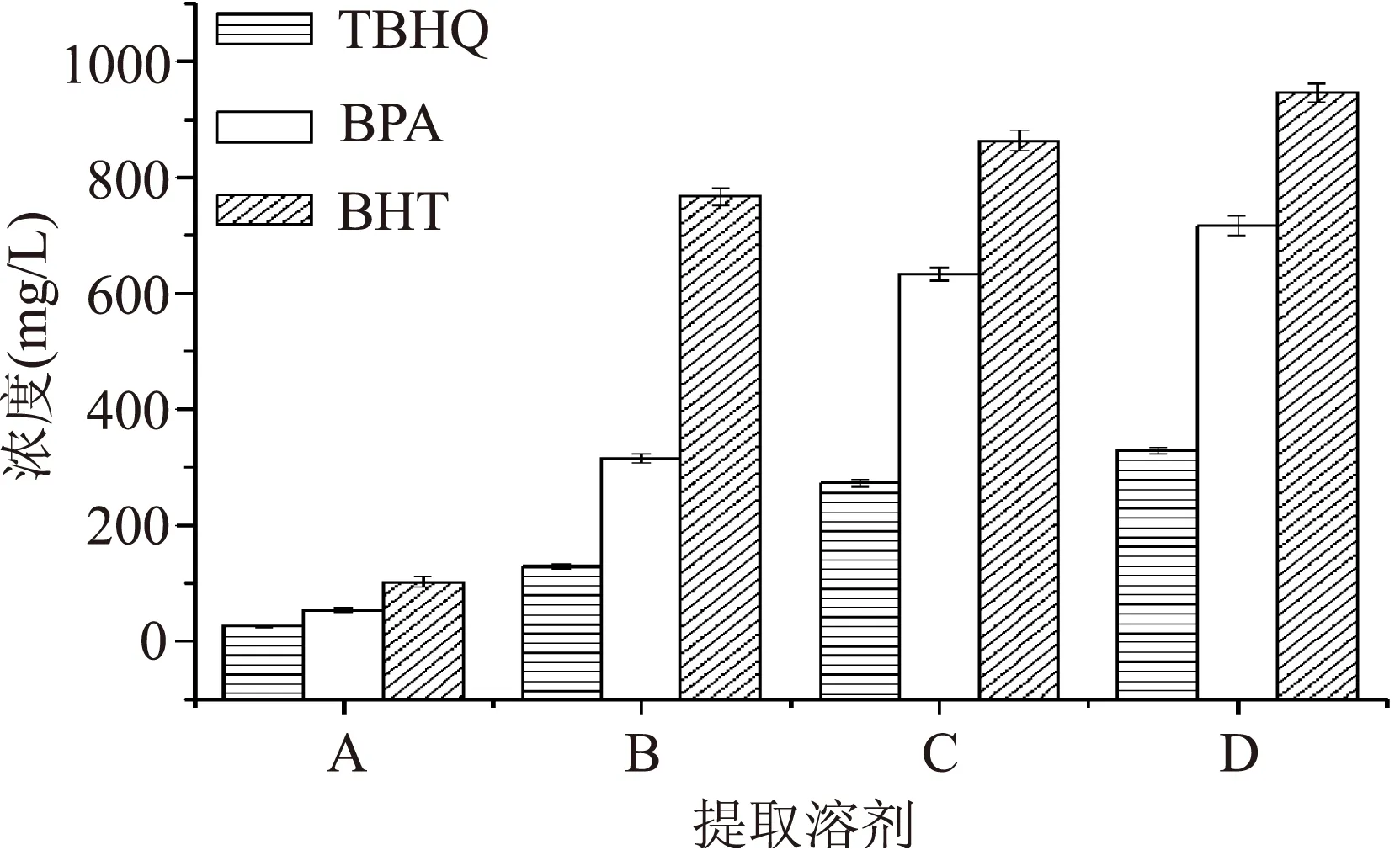
图1 不同提取溶剂对三种酚类化合物提取效果的影响Fig.1 The effect of different extraction solvents on the extraction effect of 3 phenolic compounds
由图1可以看出,A提取液的效果远低于其他3种混合溶液,可以说明水对聚乙烯的溶胀效果最差,同时可以证明其他溶胀剂对聚乙烯结构的打开有明显效果。B提取液对BHT的提取效果与C、D提取液效果相似,但TBHQ、BPA的提取效果较差。C、D提取效果相似,D略高于C。综合考虑到价格、浓缩速度、毒性等因素。最终决定使用环己烷、甲醇混合溶液作为提取液。
2.1.2提取液中溶胀剂比例的选择图2为不同溶胀剂比例对3种酚类化合物回收率的影响。
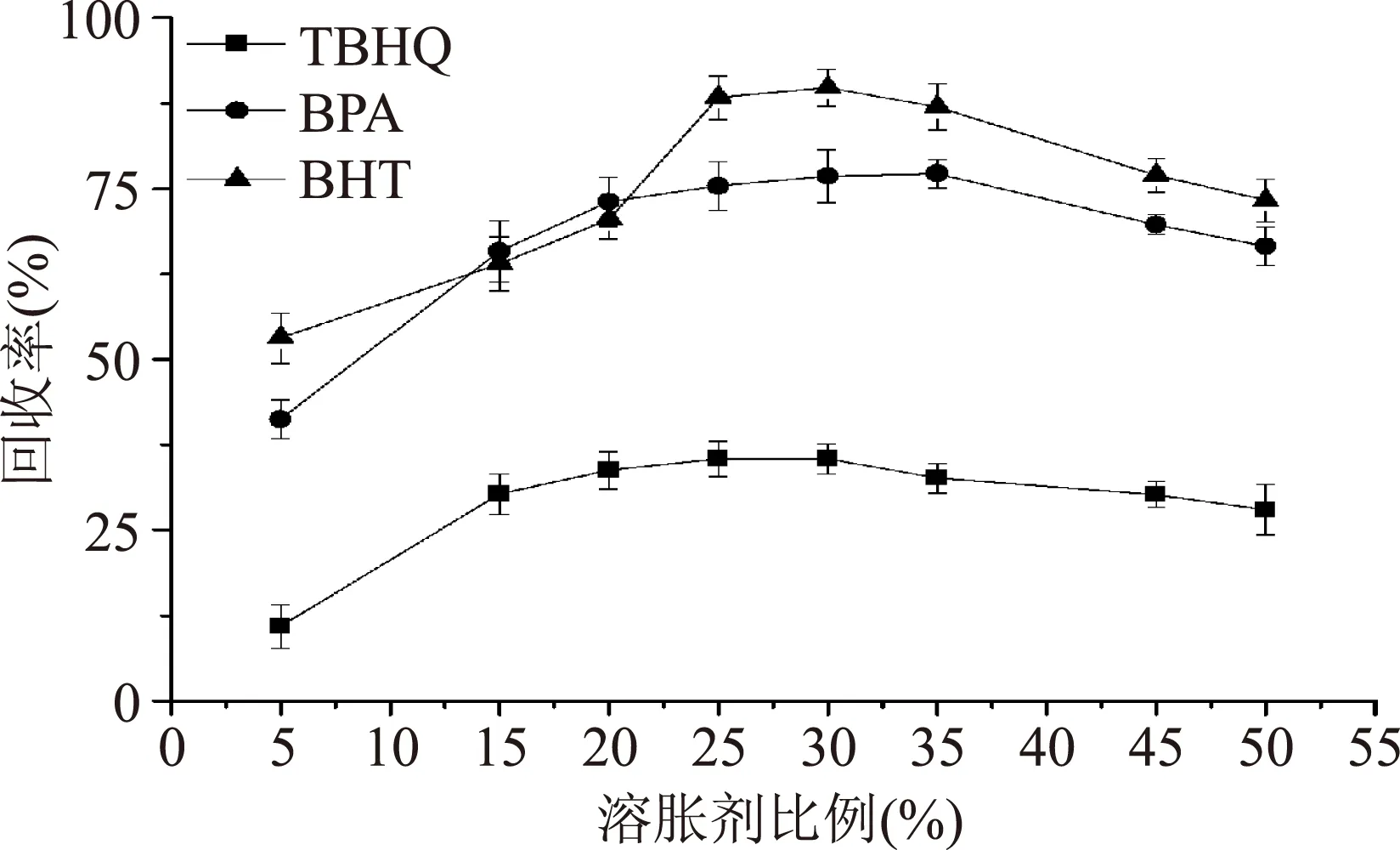
图2 不同溶胀剂比例对3种酚类化合物回收率的影响Fig.2 The effect of the ratio of swelling agent on the recoveries of 3 phenolic compounds
由图2可以看出,溶胀剂比例对添加剂回收率的影响较大。在溶胀剂比例为0~30%之间时,添加剂回收率都随着溶胀剂比例增加而升高。超过30%之后,只有BPA略微升高后开始下降,TBHQ与BHT均开始下降。可能原因为当溶胀剂比例小于30%时,聚合物没有完全被溶胀,随着溶胀剂的增加,聚合物分子链打开程度增加导致回收率快速提升,当溶胀剂比例超过30%,会造成聚合物被溶解,结晶结构塌陷,添加剂被包裹在聚合物中不易被提取出来[22]。综合溶胀剂比例对3种酚类物质回收率的影响,选择30%为溶胀剂最佳比例。
2.2超声提取条件的优化
2.2.1超声时间的选择图3为不同超声时间对3种酚类化合物回收率的影响。
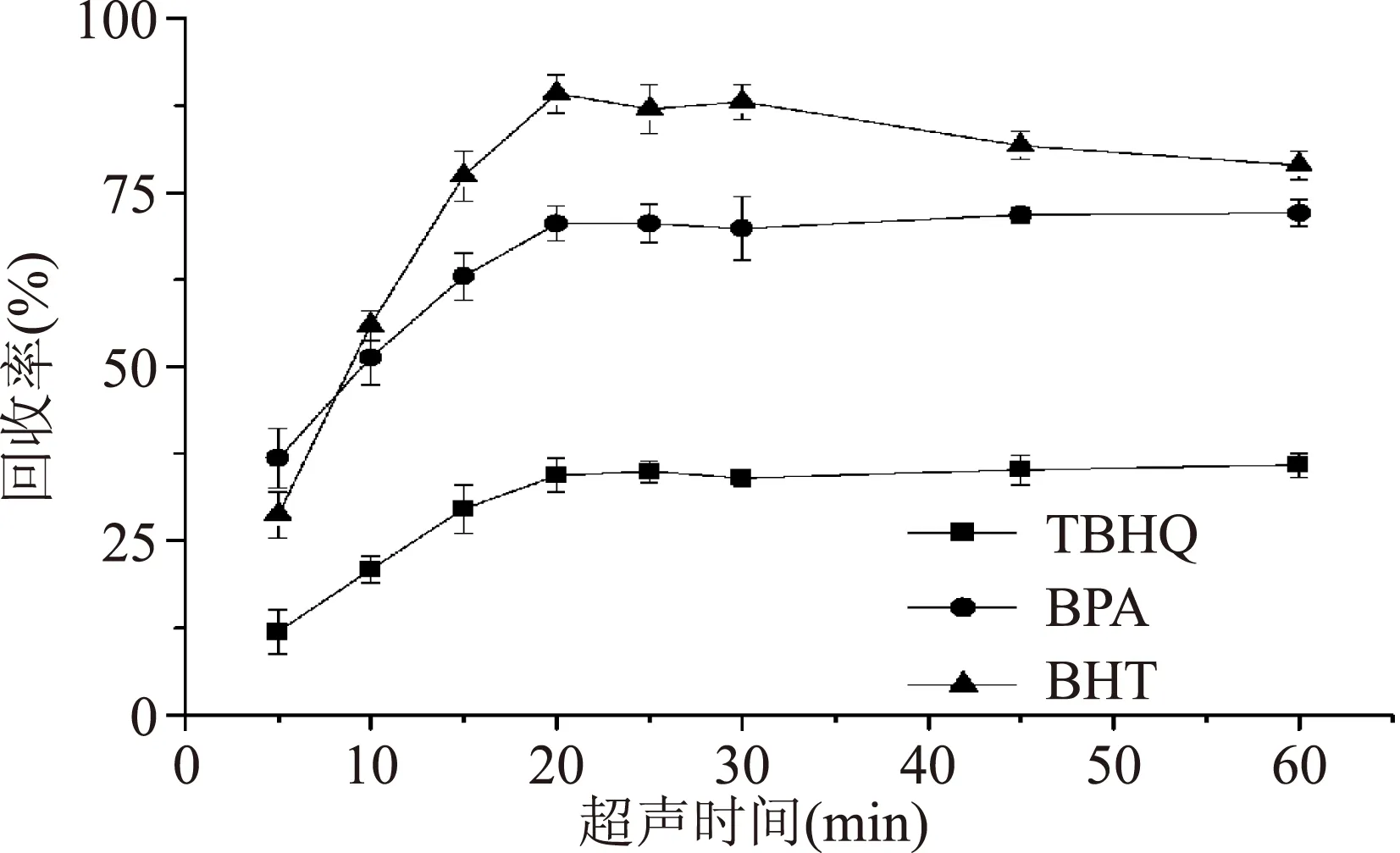
图3 不同超声时间对3种酚类化合物回收率的影响Fig.3 The effect of ultrasound time on the recoveries of 3 phenolic compounds
由图3可以看出,超声时间对3种酚类物质回收率影响较大。在0~20 min内,回收率都快速上升,上升幅度达30%以上。可能在该段时间内,聚乙烯聚合物分子链在超声及溶胀剂作用下,分子链快速打开,溶剂更容易萃取添加剂。20 min以后,TBHQ和BPA的回收率继续波动上升,但上升幅度较小,可能原因为添加剂已大部分萃取,仅剩下聚合物内部少量的添加剂缓慢释放。BHT回收率开始明显下降,可能原因为超声时间过长导致该物质氧化分解等。综合以上情况,考虑实验时间、回收率等情况下,确定最佳超声时间为25 min。
2.2.2超声后浸泡时间的选择图4为不同浸泡时间对3种酚类化合物回收率的影响。
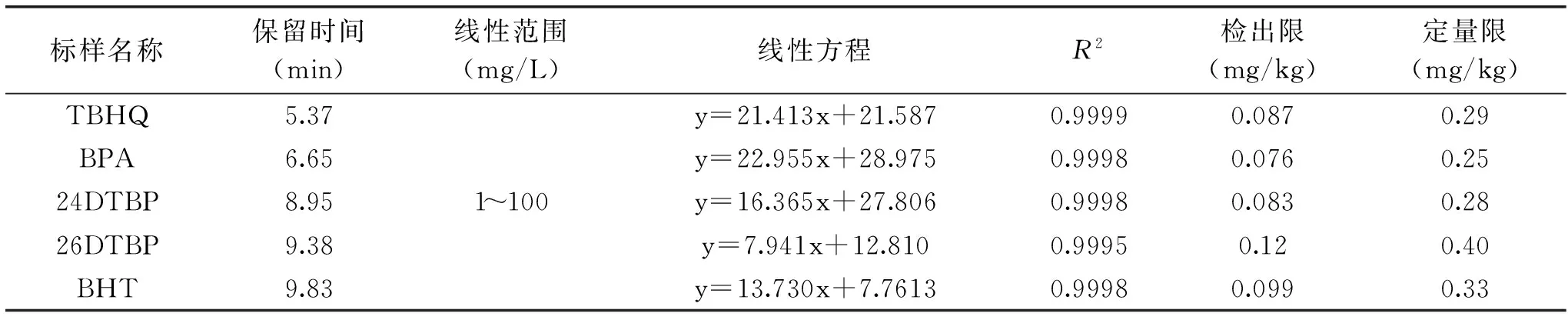
表1 5种酚类化合物的线性方程、检出限、定量限等
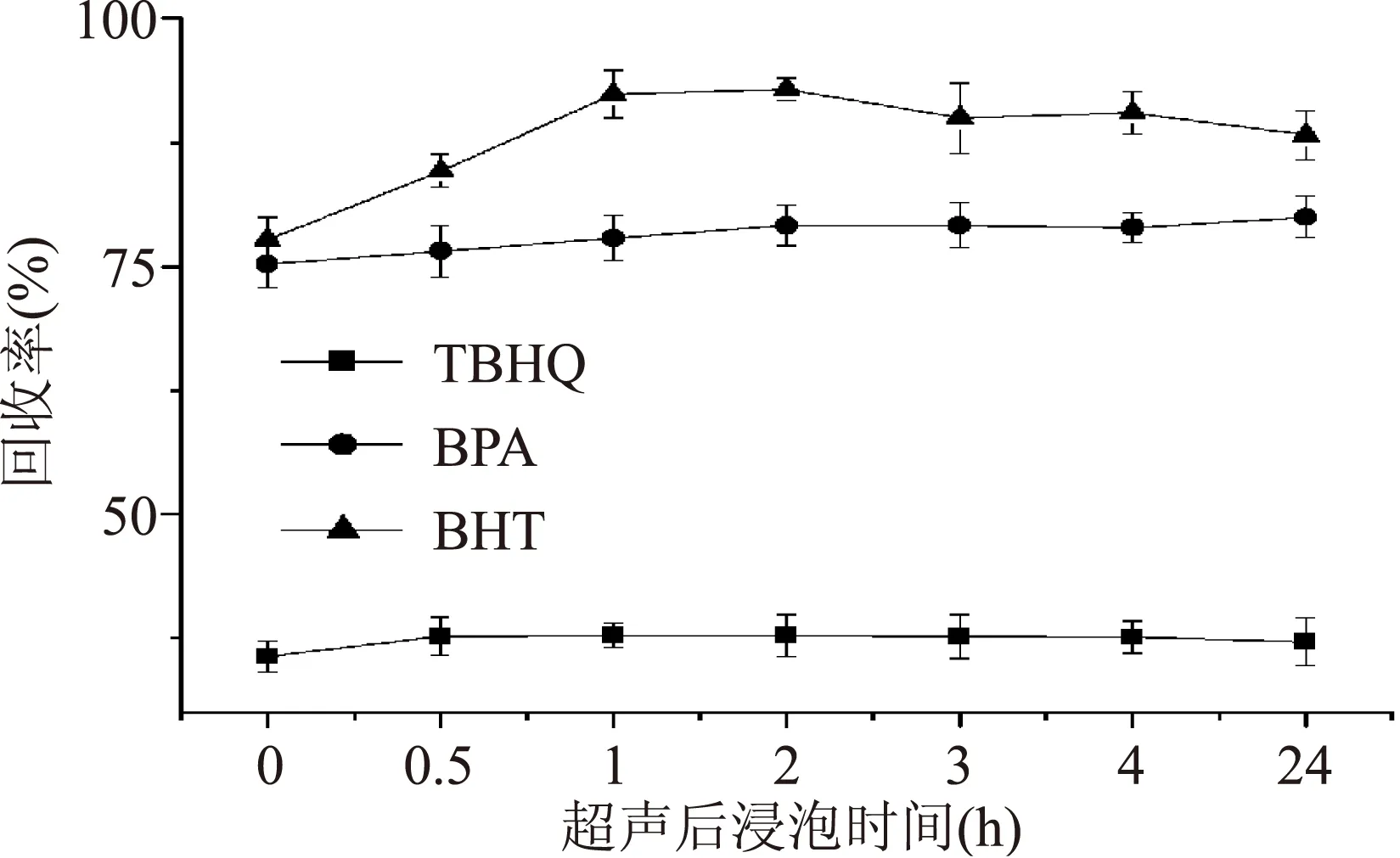
图4 不同浸泡时间对3种酚类化合物回收率的影响Fig.4 The effect of extraction time on the recoveries of 3 phenolic compounds
由图4可以看出,浸泡时间对回收率的影响不是很大,浮动在15%以内。3种添加剂在0~1 h内,3种物质回收率上升。BHT在1~24 h内呈下降趋势,可能原因为该物质结构不稳定,易为氧化分解,所以1~2 h为BHT最佳浸泡时间。BPA在24 h内回收率呈上升趋势,但2 h后上升幅度不大。TBHQ在1~24 h内回收率基本稳定。综合3种酚类化合物确定最佳浸泡时间为2 h。
2.3标准曲线的绘制
图5为25 mg/L混标色谱图。采用峰面积外标法定量,以浓度为横坐标轴,峰面积(Area)为纵坐标轴,然后根据最低浓度点1 mg/L的数据,依据信噪比(S/N)≥3可以定性,(S/N)≥10可以定量的原则,计算5种酚类物质的检出限和定量限,结果见表1。

图5 5种酚类化合物混标色谱图Fig.5 The chromatogram of 5 phenolic compounds 注:1.TBHQ;2.BPA;3.24DTBP;4.26DTBP;5.BHT。
2.4样品的加标回收实验和精密度检验
取1.2中混标标准溶液分别稀释至125、250、500 mg/L。精确称取空白样品各(1±0.01) g(准确到0.0001 g),取环己烷甲醇分散液(v/v=3∶7)25 mL,分别移入1~3号50 mL碘量瓶中,依次加入1000 μL 125、250、500 mg/L标准液,添加水平为125、250、500 mg/kg。将1~3号瓶超声25 min,浸泡2 h。每个添加水平做3次平行实验,高效液相色谱测定,计算平均回收率和精密度。
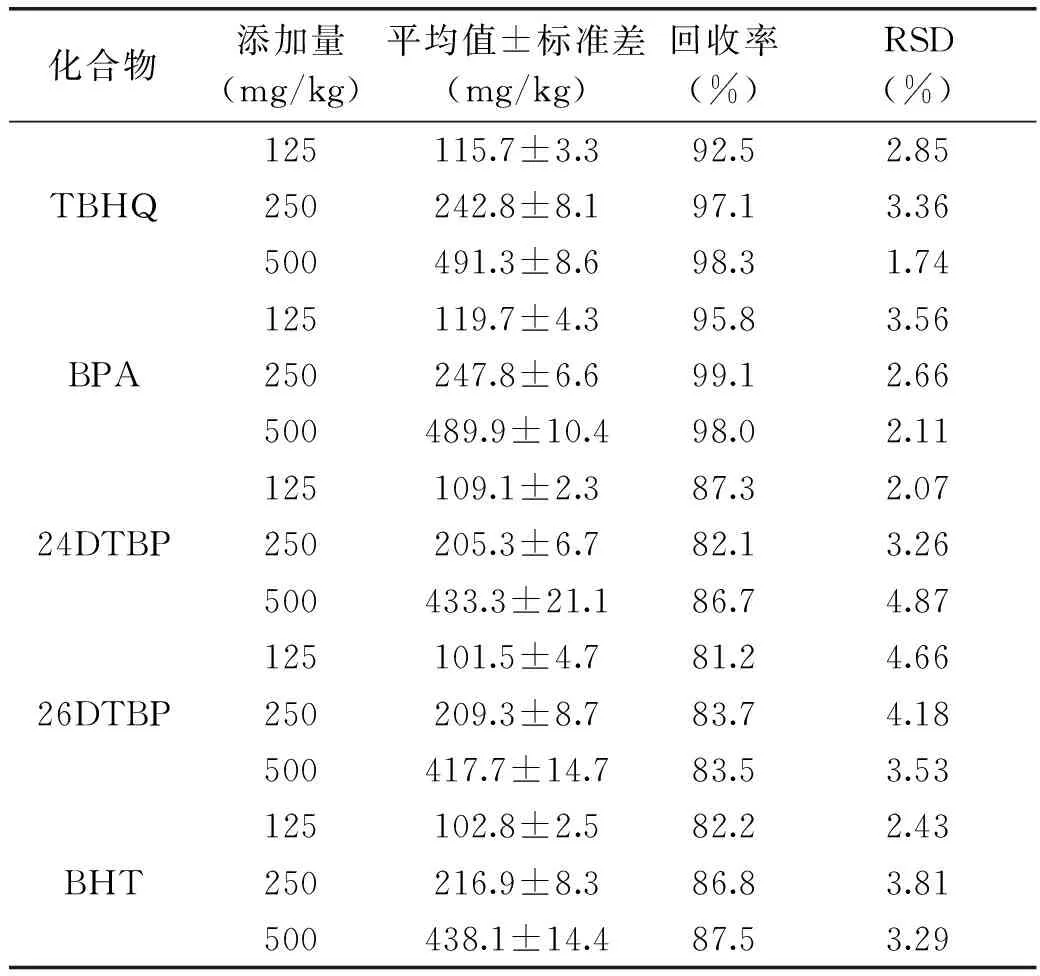
表2 5种酚类化合物的回收率和精密度
由表2可以看出,TBHQ和BPA的回收率较高,TBHQ三次平行实验平均回收率为92.5%~98.3%,高于熊中强[23]环己烷超声萃取高分子食品包装材料样品中TBHQ平均回收率(83%~97%),BPA三次平行实验平均回收率为95.8%~99.1%,结果略低于张岩[24]用快速溶解萃取法对电器塑料部件中BPA提取的回收率(95.2%~109.7%),但本实验中RSD值较小,稳定性较高。24DTBP、26DTBP、BHT回收率略低,回收率在81.2%~87.5%之间,5种酚类化合物回收率范围为81.2%~99.1%,精密度范围为1.74%~4.87%。
2.5实际样品分析
根据以上实验建立的酚类化合物的提取及检测方法,取样并检测市售食品级保鲜膜、包装袋等材料,得到表3中以下数据,图6为样品11的色谱图。检出的阳性样品经液相色谱-串联质谱法进一步确认,结果显示无假阳性样品。
从表3中可以看出,TBHQ、26DTBP在被抽中检测材料中的使用较少,TBHQ检出率为15%,含量范围在0.16~0.54 mg/kg之间,远低于GB2760-2011中规定的最大使用量200 mg/kg。26DTBP检出率为20%,含量范围在0.47~9.92 mg/kg之间,远低于EU No.10/2011中规定的规定检出限60 mg/kg。在被抽中检测材料中BPA、24DTBP、BHT的使用较多,BPA检出率为50%,含量范围在0.12~0.67 mg/kg之间,有一个被抽样品超过GB 9685-2008中特定迁移量或最大残留量0.6 mg/kg。24DTBP在所有被抽检样品中检出率最大,高达75%,范围在0.11~13.74 mg/kg之间,远低于EU No.10/2011中规定的检出限60 mg/kg。BHT在被抽检样品中检出率为50%,含量范围在0.17~46.70 mg/kg,一个样品BHT含量高达46.70 mg/kg,基本接近2007/19/EC中规定的检出限60 mg/kg,但所有样品BHT含量均不超标。
综上所述,仅有一个被抽检样品中BPA含量略高于标准,一个样品BHT含量接近标准但没有超过。所以,市售塑料包装、保鲜膜基本合格。此外,虽然含量较低,但检出率较高,长期使用依然会造成人体富集,引起危害。
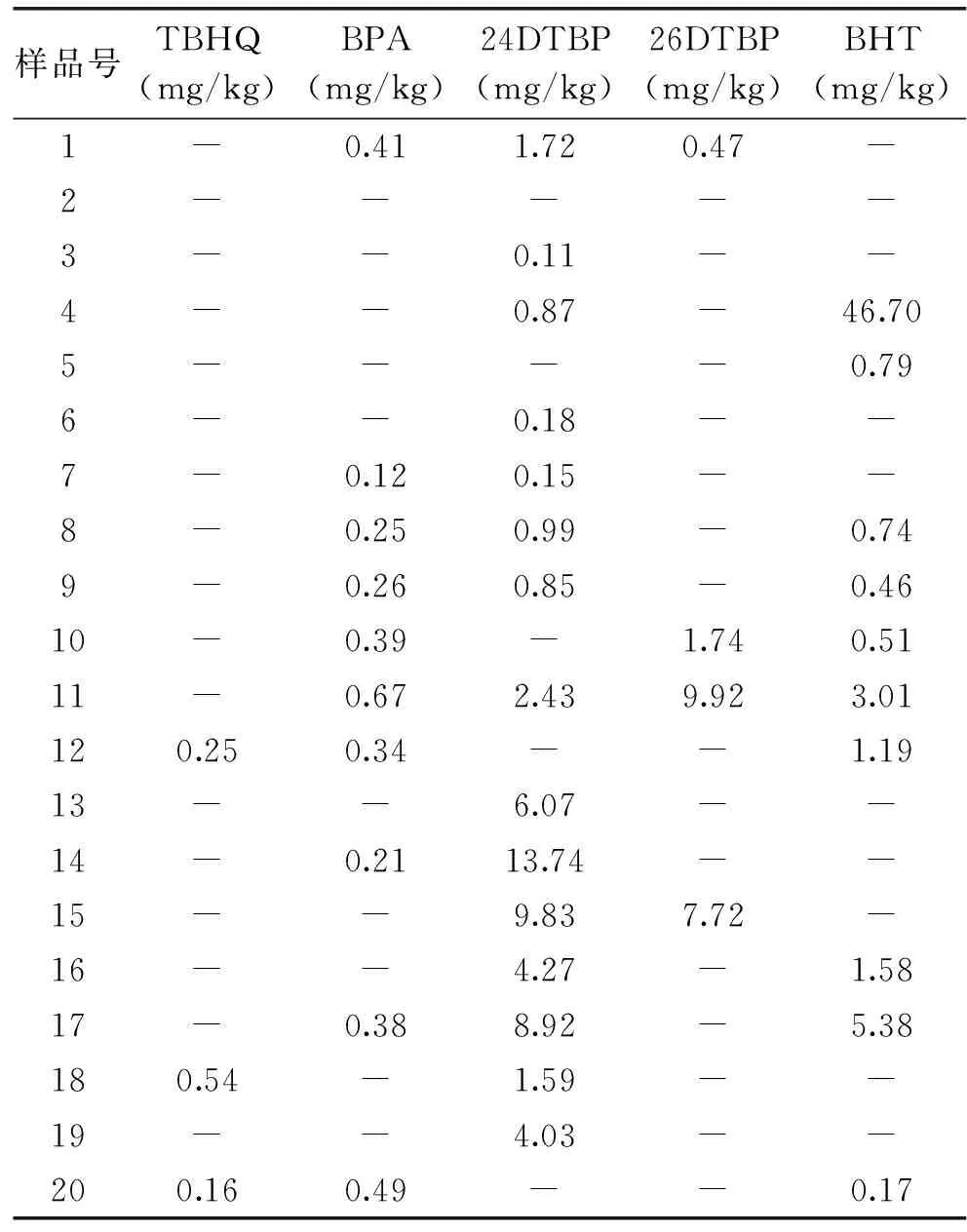
表3 市售食品包装材料中的酚类化合物含量(mg/kg)
注:“-”表示包装材料中不含该酚类添加剂或含量低于检测下限。
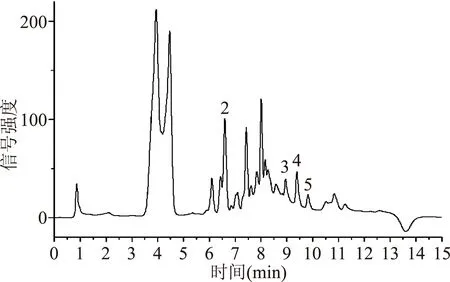
图6 样品11的液相色谱图Fig.6 HPLC chromatogram of sample 11注:1.TBHQ;2.BPA;3.24DTBP;4.26DTBP;5.BHT。
3 结论
本文采用超声辅助提取-高效液相色谱法测定聚乙烯食品包装材料中双酚A、特丁基对苯二酚、2,6-二叔丁基对甲酚、2,4-二叔丁基酚、2,6-二叔丁基酚的含量,该方法具有设备简单、样品处理快速、线性相关性好、回收率较高、定性定量准确等优点,适用于聚乙烯塑料包装材料中5种酚类化合物的卫生监督检测工作。
[1]曾怀才,陈锋. 环境雌激素与健康[J]. 实用预防医学,2003,10(5):818-820.
[2]Du Mond J W,Singh K P,Roy D. The Biphasic Stimulation of Proliferation of Leydig cells by estrogen exposure[J]. International Journal of Oncology,2001,18(3):623-628.
[3]Sakagaki H,Ufno H,Nakamuro K. Estrogen receptor alpha in Mouse splenic lymphocytes:possible involvement in immunity[J]. Toxicology Letters,2002,133(2-3):221-229.
[4]杜艳,代汉慧,伍飏,等. 双酚A毒理学特性及各国对其用于食品包装材料的评估意见[J]. 食品科技,2007,(10):1-3.
[5]闫杨娟. 长沙市液态食品塑料包装安全性评价[D]. 长沙:中南林业科技大学,2013.
[6]蒋小良,黄承斌,麦彩焕,等. 食品包装材料中双酚A检测方法的研究进展[J]. 包装与食品机械,2012,30(3):55-59.
[7]张淑玲,张志胜,邢晓慧. 气相色谱法测定食品中的抗氧化剂BHA、BHT、TBHQ[J]. 现代生物医学进展,2008,8(12):2483.
[8]陆岩,张洁萍,王俊秋,等. 高效液相色谱法测定食用油中抗氧化剂特丁基对苯二酚[J]. 中国食品卫生杂志,2008,20(5):421-423.
[9]杨春瑜,杨春莉,刘海玲,等. 塑料包装材料中2,4-二叔丁基酚迁移的研究[J]. 包装与食品机械,2014,32(2):10-13.
[10]李学锋,谢太平,张立科,等. 环境雌激素双酚A的化学发光法测定[J],河北化工,2009,32(6):59-61.
[11]Shin H S,Park C H,Park S J,et al. Sensitive determination of bisphenol A in environmental water by gas chromatography with nitrogen-phosphorus detection after cyanomethylation[J]. Journal of Chromatography A,2001,912(1):119-125.
[12]姜晓辉. 塑胶食品与药品包装材料中BHT的测定[J]. 化学分析计量,2009,18(3):65-66.
[13]赵鹏,王东凯,杨秀丽,等. HPLC测定2,6-二叔丁基对甲酚的含量及有关物质[J]. 华西药学杂志,2006,21(3):291-293.
[14]李小梅,宋欢,林勤保,等. UPLC研究塑料食品包装材料中的抗氧化剂及其迁移[J]. 化学研究与应用,2010,22(8):980-984.[15]施刚刚,程冬冬,朱勇,等. 高效液相色谱法同时测定工业废水中的2,4-二叔丁基酚和2,6-二叔丁基酚[J]. 浙江化工,2014,45(1):37-39.
[16]杨红梅,王浩,刘艳琴,等. 液相色谱-串联三重四极杆质谱测定饮料中双酚A残留[J]. 食品研究与开发,2009,30(12):137-139.
[17]Paepe A D,Erlandsson B,Ostelius J,et al. An alternative Method for Determination of Additives in Polypropylene Using Supercritical Fluid Extraction and Enhanced Solvent Extraction[J]. Journal of Liquid Chromatography & Related Technologies,2006,29(11):1541-1559.
[18]Arias M,Penichet I,Ysambertt F,et al. Fast supercritical fluid extraction of low-and high-density polyethylene additives:Comparison with conventional reflux and automatic Soxhlet extraction[J]. Journal of Supercritical Fluids,2009,50(1):22-28.
[19]李浩峰. 食品和药品包装材料中抗氧化剂的检测方法研究[D]. 长沙:中南林业科技大学,2013
[20]姚帮本,王道俊,储大勇. 固相萃取-气相色谱-串联质谱法测定塑料食品包装材料中3种抗氧化剂的残留量[J]. 化学分析计量,2014,23(6):20-24.
[21]张帆,张莹杞,黄志强,等.在线GPC-GC/MS法测定苹果中2,4-D残留[J].分析实验室,29(5):36-39.
[22]Marcate B,Vianello M. Microwave-assisted extraction by fast sample preparation for the systematic analysis of additives in polyolefins by high-performance liquid chromatography[J]. Journal of Chromatography A,2000,869(1):285-300.
[23]熊中强,王利兵,李宁涛,等. 气相色谱法测定高分子食品包装材料中抗氧化剂的残留量[J]. 色谱,2011,29(3):273-276.
[24]张岩,马晓斐,吕品,等. 液相色谱-串联质谱法测定小型家用电器塑料部件中双酚A[J]. 色谱,2012,30(1):95-98.
Determination of 5 phenolic compounds in PE film for food packaging by ultrasonic-assisted extraction with high performance liquid chromatography
XU Yu-jun1,2,LU Chun-liang2,*,CUI Gui-you1,LIU Xiang-nong2
(1.School of Tourism and Culinary Science,Yangzhou University,Yangzhou 225127,China; 2.Testing Center of Yangzhou University,Yangzhou 225009,China)
A method was established for the detection of 5 phenolic compounds in polyethylene(PE)film for food packaging by high performance liquid chromatography(HPLC)and ultrasonic-assisted extraction. The method of ultrasonic assisted extraction was optimized,such as the choice of the swelling agent,the volume ratio of swelling agent,ultrasonic time,immersion time after ultrasonic,and so on. The conditions were finally chosen was follows,choice cyclohexane as swelling agent,the volume ratio of swelling agent(cyclohexane)and solvent(methanol)was 3∶7(v/v),ultrasonic time was 25 min,immersion time of was 2 h. The samples were analyzed on a column of Agilent Eclipse Plus C18(2.1 mm×150 mm,5 μm),the mobile phase was methanol and water(containing 0.1% formic acid),gradient elution,flow rate was 0.4 mL/min,the variable wavelength detector was set at 280 nm. The results showed that the 5 phenolic compounds had good linear relationship in the linear range(R2>0.9995). The detection limits of the 5 phenolic compounds were 0.25~0.40 mg/kg(S/N=10). The recoveries were 81.2%~99.1% with the relative standard deviations(n=3)of 1.74%~4.87% at spiked levels of 125,250,500 mg/kg. This method is simple and had high recovery rate and good precision. It is suitable for the detection of 5 phenolic compounds in polyethylene food packaging.
high performance liquid chromatography(HPLC);ultrasonic-assisted extraction;phenolic compounds;polyethylene;food packaging
2016-04-01
徐雨军(1991-),男,在读硕士研究生,研究方向:营养与食品卫生学,E-mail:18352765146@163.com。
陆春良(1980-),男,博士,助理研究员,主要从事色质谱联用检测技术研究,E-mail:luchunliang@163.com。
TS201.2
A
1002-0306(2016)17-0297-06
10.13386/j.issn1002-0306.2016.17.049

