磷脂酰肌醇特异性磷脂酶C基因在乳酸乳球菌中的异源表达
汤先泽,刘 伟,皮雄娥,尹业师,王 欣,刘新利,*
(1.齐鲁工业大学 生物工程学院,山东 济南 250353; 2.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
磷脂酰肌醇特异性磷脂酶C基因在乳酸乳球菌中的异源表达
汤先泽1,刘伟2,皮雄娥2,尹业师2,王欣2,刘新利1,*
(1.齐鲁工业大学 生物工程学院,山东 济南 250353; 2.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
根据乳酸乳球菌密码子的偏好性,在不改变编码蛋白的基础上,优化设计并合成枯草芽孢杆菌磷脂酰肌醇特异性磷脂酶C基因,将其与大肠埃希菌-乳酸乳球菌穿梭质粒pAMJ399连接,构建重组质粒pAMJ399-PIPLC,并电转化至乳酸乳球菌中进行诱导表达。SDS-PAGE分析显示:重组蛋白以可溶性蛋白的形式分泌于胞外,分子质量约35 ku,与预期蛋白大小一致。重组蛋白在PI-李斯特氏菌显色平板上显现明显的乳白色晕圈,证明重组蛋白具有酶活性,磷脂酰肌醇特异性磷脂酶C(PI-PLC)在重组乳酸乳球菌中成功获得表达。通过优化培养条件,以2%转接量,在含有1%红霉素抗性的GM17液体培养基中,于32 ℃静止培养24 h,测得培养基上清液中PI-PLC的浓度为1.092 μg·mL-1。
磷脂酰肌醇特异性磷脂酶C;克隆表达;乳酸乳球菌;GPI锚定蛋白
磷脂酰肌醇特异性磷脂酶C(PI-PLC)的种类很多,在细菌、原生动物、酵母、霉菌、植物、昆虫和哺乳动物中均存在。PI-PLC的一个典型特点是:细菌PI-PLC是可分泌酶,而其他生物体内的PI-PLC是胞内酶。细菌PI-PLC是一个小型的、具有晶体结构的水溶性酶[1],可以催化水解磷酸肌醇磷酸二酯键,产生水溶性肌醇磷酸盐(1-磷酸肌醇,InsP;1,4-二磷酸肌醇,InsP2;1,4,5-三磷酸肌醇,InsP3)以及脂溶性二酰基甘油(DAG)[2]。在高等真核生物中,PI-PLC是参与大多数受体介导信号转导的关键酶[3]。研究表明,多种激素、药物和生物活性物质与细胞膜受体结合后,均会活化胞内Pl-PLC。活化的Pl-PLC可将细胞膜的结构成分磷脂酰肌醇-4,5-二磷酸(phoshatidylinsitol-4,5-bisplioshate,PIP2)水解为DAG和InsP3,两者作为第二信使,继续向胞内传递调节代谢的信息:DAG活化蛋白激酶C(PKC),InsP3动员钙库释放Ca2+。活化的PKC与Ca2+协同作用,调节多种生理功能,如平滑肌和骨骼肌收缩、离子通道变化、血小板聚集、激素分泌、免疫细胞活化、细胞增殖和肿瘤发生等[4-6]。
近年来,细菌酶PI-PLC的研究热点主要集中在其具有裂解细胞膜表面糖基(GPI)锚定蛋白方面的能力。细菌酶PI-PLC可裂解细胞膜表面糖基(GPI)锚定蛋白,从而影响细胞膜表面上糖蛋白及碳水化合物的释放,而大多数致病性寄生虫细胞膜表面抗原蛋白都是通过糖基锚定在细胞膜上的,PI-PLC能切断GPI锚定蛋白中肌醇磷脂与细胞膜的连接,使寄生虫丧失入侵宿主细胞和在宿主细胞内增殖的能力[7-10]。因此,细菌酶PI-PLC显示出显著的抗感染特性。故对PI-PLC抗感染作用的研究,以及大量生产PI-PLC进而发挥其生物学作用的研究现已成为生物化学和生化药理学研究的热门课题。
微生物来源PI-PLC较其他来源具有生产周期短、结构简单,可工业化大规模培养等优势,但大多数产PI-PLC的菌株都具有病原性[11-12],在食品安全性方面存在一定的隐患。乳酸乳球菌是一群能大量发酵碳水化合物并产生乳酸的革兰阳性细菌,在工业、农业和医药等与人类生活密切相关的领域应用价值很高,属公认的安全微生物[13]。
本研究根据乳酸乳球菌密码子的偏好性,优化设计并合成枯草芽孢杆菌磷脂酰肌醇特异性磷脂酶C基因,并以其作为模板,利用乳酸乳球菌P170表达系统表达PI-PLC基因。该系统由pH值和生长周期调控,不需要添加外源性的诱导物,并能高效提升蛋白分泌的水平[14-15]。另外,乳酸乳球菌发酵产生乳酸,酸不仅可以诱导P170启动子表达,而且酸性环境还可以提高PI-PLC的表达量及酶活性[16]。外源蛋白通过分泌表达后,无须纯化与复性等繁琐的操作过程,拓宽了其在生产实践中的应用[17]。因此,本研究初步尝试利用该途径实现PI-PLC基因的异源高效表达,为后续的工作提供参考。
1 材料与方法
1.1试验材料
1.1.1菌株及质粒
大肠埃希菌感受态细胞Trans1-T1,购自北京全式金生物技术有限公司;乳酸乳球菌MG1363及分泌型表达质粒pAMJ399,由本实验室保存。
1.1.2酶及相关试剂
高保真聚合酶2×super HIFI-MIXⅡ购自北京全式金生物技术有限公司;限制性内切酶BsaⅠ,BglⅡ,SalⅠ,DNA marker,T4 DNA连接酶等购自NEB公司;质粒提取试剂盒购自宝生物工程(大连)有限公司;DNA纯化试剂盒、胶回收试剂盒、pEASY-T1 Cloning kit试剂盒购自北京全式金生物技术有限公司;PI-PLC ELISA kit购自上海酶联生物科技有限公司;氨苄青霉素、红霉素购自上海生工生物工程有限公司;其他主要试剂为进口产品或国产分析纯产品。
1.1.3培养基及培养条件
乳酸乳球菌GM17培养基(M17培养基,0.5%葡萄糖),培养条件为32 ℃,静止培养24 h;乳酸乳球菌电转化复苏培养基SGM17(10 mL M17,1 526 μL 50%蔗糖,200 μL 50%葡萄糖,100 μL 2 mol·L-1MgCl2,40 μL 0.5mol·L-1CaCl2);大肠埃希菌培养基为LB培养基,培养条件为37 ℃,200 r·min-1,12 h。
1.2试验方法
1.2.1DNA操作技术
质粒提取、PCR扩增、PCR产物纯化、连接、转化等均参考《分子克隆实验指南》。
1.2.2目的基因的设计与合成
查阅文献资料,从NCBI数据库中得到一段蜡状芽孢杆菌PI-PLC基因(GenBank∶M30809.1)。根据乳酸乳球菌密码子的偏好性,优化设计并合成PI-PLC目的基因。目的基因由杭州擎科梓熙生物技术有限公司合成。
1.2.3引物设计与合成
利用Vector NTI基因分析软件,设计一对特异性引物:上游引物P1,5’-GGCGGTCTCAGATCTTCTAACAAAAAACTTATCCTGAAA-3’,由于目的基因本身含有BglⅡ酶切位点,因此在BglⅡ酶切位点前加入BsaⅠ酶切位点,下划线分别为BsaⅠ,BglⅡ酶切位点;下游引物P2,5’-GGCGTCGACTTATTCTTTGATTAAGGATT-3’,下划线为SalⅠ酶切位点。引物由杭州擎科梓熙生物技术有限公司合成。
1.2.4PI-PLC基因的克隆
以合成的PI-PLC基因为模板,以P1/P2为引物进行PCR扩增。PCR扩增体系为:模板1 μL,上下游引物各1 μL,2×super HIFI-MIXⅡ25 μL,灭菌的双蒸水20 μL。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸60 s,32个循环;之后,72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析鉴定。
1.2.5克隆载体pEASY-T1-PIPLC的构建
PCR产物经胶回收试剂盒纯化回收,与pEASY-T1克隆载体相连,并转入大肠埃希菌感受态细胞Trans1-T1中。经蓝白斑筛选,挑取白色单克隆,用M13 forward primer和M13 reverse primer引物进行菌落PCR,鉴定阳性重组子。将鉴定为阳性的重组子命名为pEASY-T1-PIPLC,并接入LB液体培养基(含氨苄青霉素50 μg·mL-1)培养,送杭州擎科梓熙生物技术有限公司测序。
1.2.6重组大肠埃希菌表达载体的构建
由于直接将目的基因和表达载体连接,进行电转化构建乳酸乳球菌表达载体比较难,且pAMJ399质粒是大肠埃希菌-乳酸乳球菌穿梭质粒,因此,先进行大肠埃希菌表达载体的构建。将pEASY-T1-PIPLC克隆载体和pAMJ399载体分别经BsaⅠ,SalⅠ以及BglⅡ,SalⅠ双酶切、胶回收,获得带有粘性末端的目的片段,16 ℃连接过夜。将连接产物转化到大肠埃希菌感受态细胞Trans1-T1中,将转化后的菌液涂布在含红霉素(300 μg·mL-1)的LB固体培养基平板上进行筛选,37 ℃,过夜培养。挑取转化子用P1,P2引物进行菌落PCR,挑取扩增出目的大小片段的转化子扩大培养,提取质粒。重组质粒送杭州擎科梓熙生物技术有限公司测序,正确的重组质粒命名为pAMJ399-PIPLC,将获得的重组大肠埃希菌命名为pAMJ399-PIPLC/Trans1-T1,并进行甘油管保藏。
1.2.7重组乳酸乳球菌表达载体的构建
将提取的重组质粒pAMJ399-PIPLC电转化至乳酸乳球菌MG1363,电转化仪参数设置为:电压2.0 kV,电容25 μF,电阻200 Ω,电击时间4.5~5.0 ms,电击后加入SGM17培养基,32 ℃,静止复苏2 h后,将复苏的菌液涂布于GM17(含有红霉素1 μg·mL-1)固体培养基,32 ℃厌氧培养20 h,挑取转化子用P1,P2引物进行菌落PCR,挑取扩增出目的大小片段的转化子接种于GM17(含有红霉素1 μg·mL-1)液体培养基中扩大培养,32 ℃厌氧培养过夜。将获得的重组乳酸乳球菌命名为pAMJ399-PIPLC/MG1363,并将其进行甘油管保藏。
1.2.8重组菌在乳酸乳球菌中的表达及SDS-PAGE凝胶电泳检测
挑取阳性重组菌pAMJ399-PIPLC/MG1363单菌落接种于5 mL GM17(含有红霉素1 μg·mL-1)液体培养基,32 ℃静置培养20 h后,按1∶50的比例扩大培养24 h后终止培养。取1 mL菌液于12 000 r·min-1离心10 min,上清通过TCA的方法进行10倍浓缩,沉淀用溶菌酶处理。将处理好的上清和沉淀与2×SDS加样缓冲液混合后煮沸10 min,12 000 r·min-1离心3 min,取20 μL进行SDS-PAGE(12%分离胶,5%浓缩胶)电泳分析,以蛋白质标准分子量为参考,并以同样方法处理的pAMJ399/MG1363乳酸乳球菌作为对照。
1.2.9PI-PLC的酶活力测定
磷脂酰肌醇特异性磷脂酶C及其他磷脂酶类一般采用荧光法测定酶活[18],但是由于测试底物昂贵,且步骤繁琐耗时,本文采用PI-李斯特氏菌显色平板法定性测定PI-PLC酶活力,其原理为PI-PLC水解磷酸肌醇磷酸二酯键,产生不溶于水的二酰基甘油,在平板上显示为乳白色晕圈。取10 μL发酵液置于PI-李斯特氏菌显色平板上,37 ℃温育12 h,所产生的乳白色晕圈的大小即代表酶活力的高低。由于该方法磷脂酰肌醇特异性磷脂酶C直接作用于底物磷脂酰肌醇,因此,操作简单便捷,且成本低廉,应用较为广泛。
2 结果与分析
2.1目的片段和克隆载体的获得及鉴定
PCR产物经1%的琼脂糖凝胶电泳分析,在1 000 bp处有一条特异性条带,大小与预期值相符(图1)。按1.2.5节方法构建克隆表达载体pEASY-T1-PIPLC,挑取白色单克隆进行菌落PCR,经1%的琼脂糖凝胶电泳分析,在1 200 bp处出现一条特异性条带(如果载体直连,自连带大小为199 bp),大小与预期值相符(图2)。对pEASY-T1-PIPLC上的PCR片段进行测序,结果显示目的基因全长990 bp,与优化设计的PI-PLC基因序列顺序及大小一致。
2.2重组大肠埃希菌表达载体pAMJ399-PIPLC的鉴定
按1.2.6节方法构建了重组大肠埃希菌表达载体pAMJ399-PIPLC(图3),转入大肠埃希菌感受态细胞T1中,挑取阳性单克隆进行菌落PCR,经1%的琼脂糖凝胶电泳分析,在1 000 bp处出现一条特异性条带,大小与预期值相符,且对照菌没有条带(图4)。提质粒测序,重组质粒测序结果为插入的目的片段序列,且酶切位点序列正确。
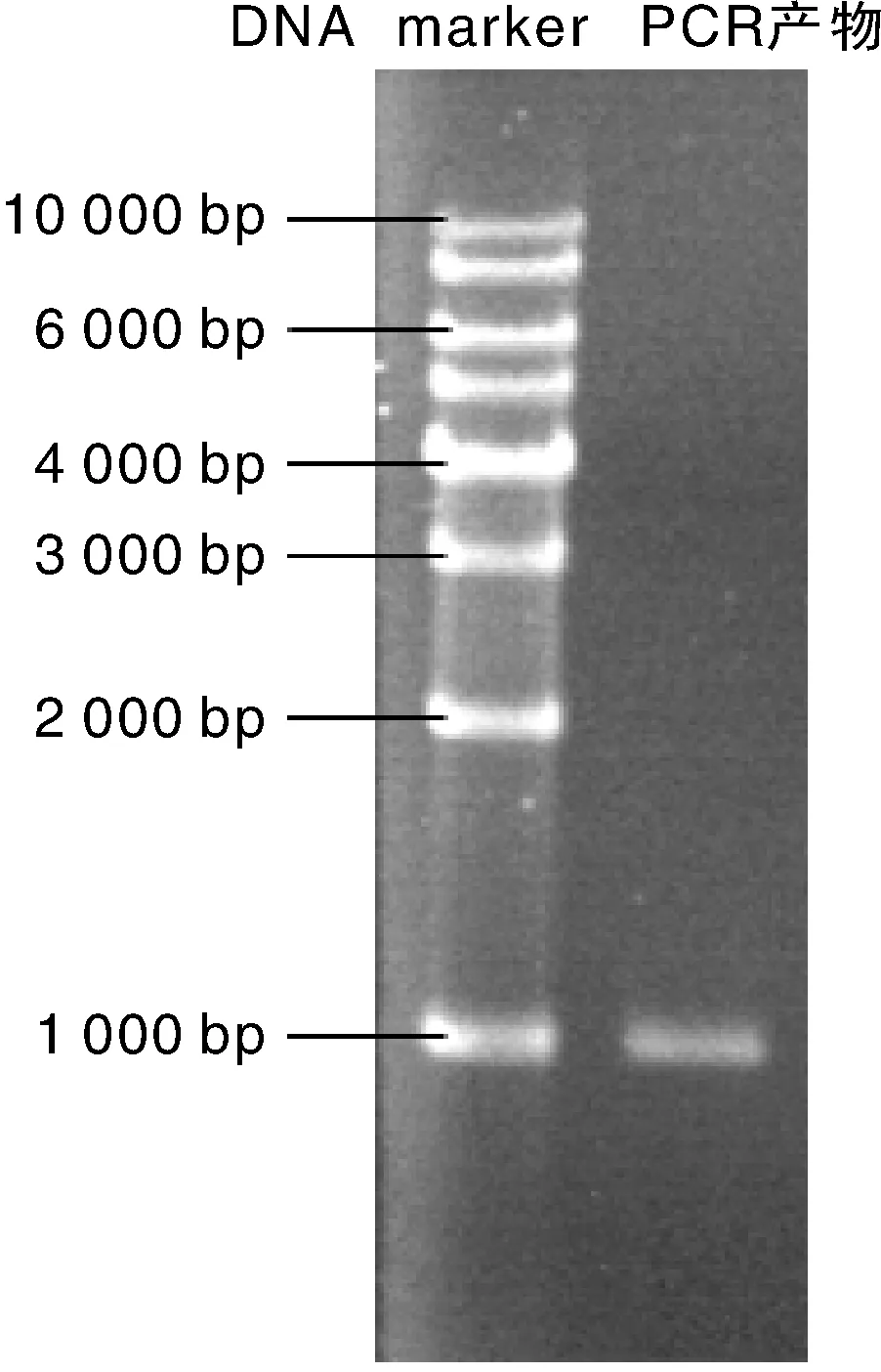
图1 目的基因扩增结果Fig.1 PCR amplification result of the target gene
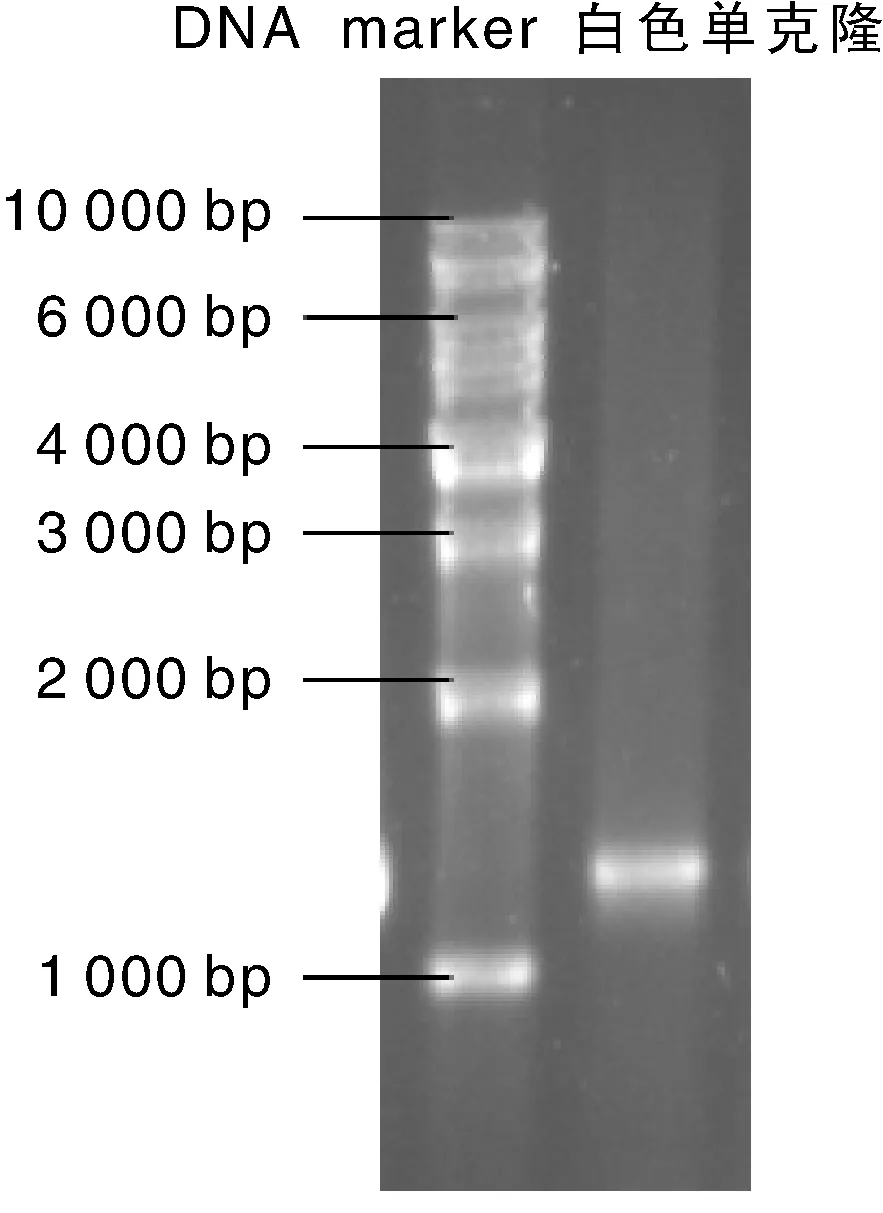
图2 菌落PCR结果Fig.2 PCR amplification result of the colonies
2.3重组乳酸乳球菌表达载体的鉴定
挑取经GM17(含有红霉素1 μg·mL-1)平板筛选的阳性克隆进行菌落PCR,结果出现一条约1 000 bp大小的条带,大小与预期值相符。
2.4重组质粒在乳酸乳球菌中的表达
重组菌pAMJ399-PIPLC/MG1363经SDS-PAGE分析后结果表明,重组菌的上清和沉淀经电泳后,在上清中出现了约35 ku的蛋白条带,与预测蛋白分子量大小相当,且沉淀中没有目的大小条带,说明重组蛋白是以可溶蛋白的形式分泌到胞外的。并且,对照菌的上清、沉淀均未出现目的大小条带(图5)。
2.5PI-PLC酶活性验证及酶联反应分析
取10 μL培养24 h的重组菌pAMJ399-PIPLC/MG1363的上清液点PI-李斯特氏菌显色平板,并以同样方法处理pAMJ399/MG1363乳酸乳球菌作为对照,37 ℃温育12 h。结果显示:重组菌pAMJ399-PIPLC/MG1363点板处出现乳白色晕圈,而对照没有乳白色晕圈(图6)。
应用双抗体夹心法测定菌液中的PI-PLC水平。用纯化的PI-PLC抗体包被微孔板,制成固相抗体,向包被单抗的微孔中依次加入PI-PLC,再与HRP标记的PI-PLC抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的PI-PLC呈正相关。用酶标仪在450 nm波长下测定吸光度(D),通过标准曲线计算样品中PI-PLC的浓度。最终测得24 h后培养液中PI-PLC的浓度为1.092 μg·mL-1(图7)。
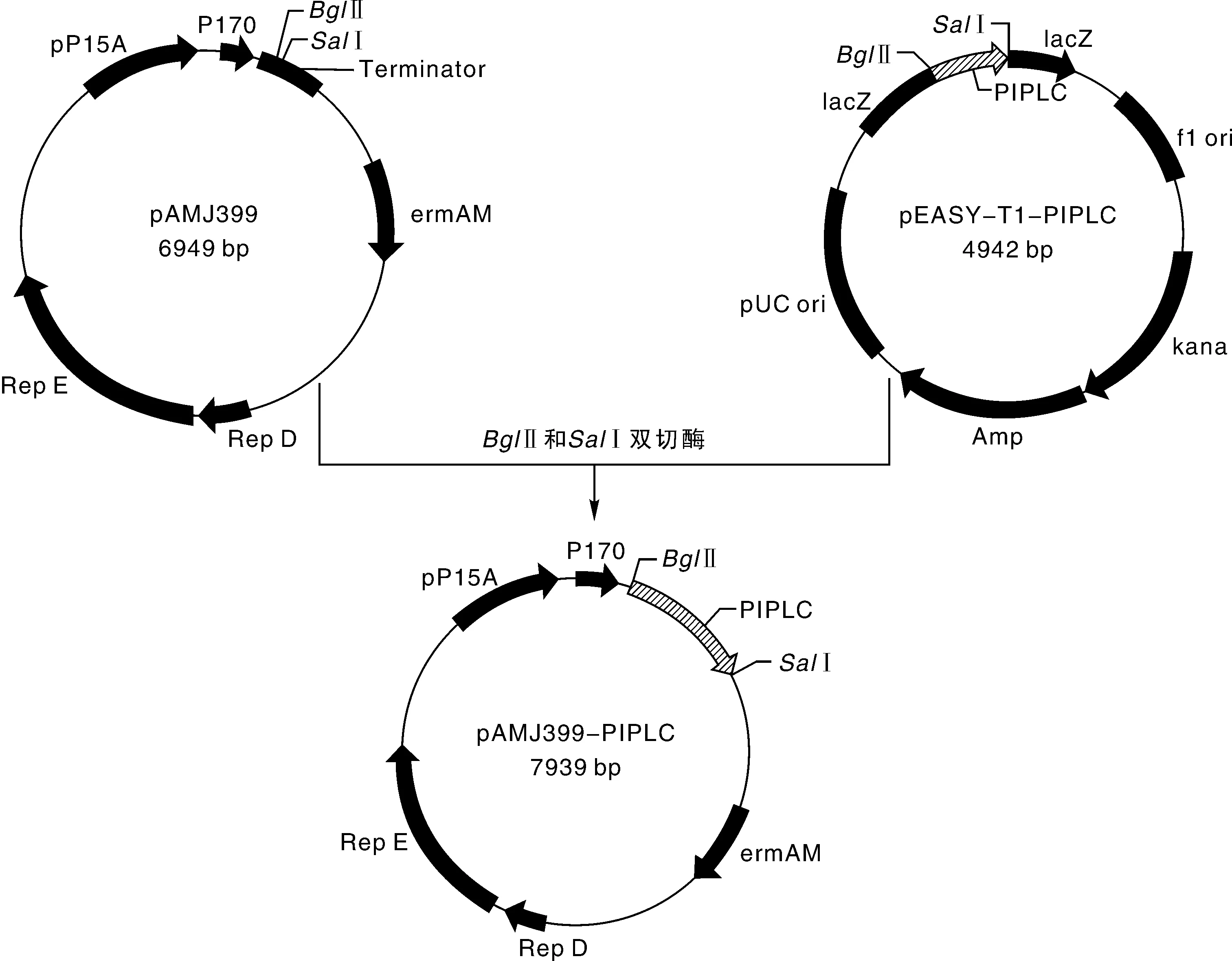
图3 表达载体pAMJ399-PIPLC的构建Fig.3 Construction of expression vectors pAMJ399-PIPLC
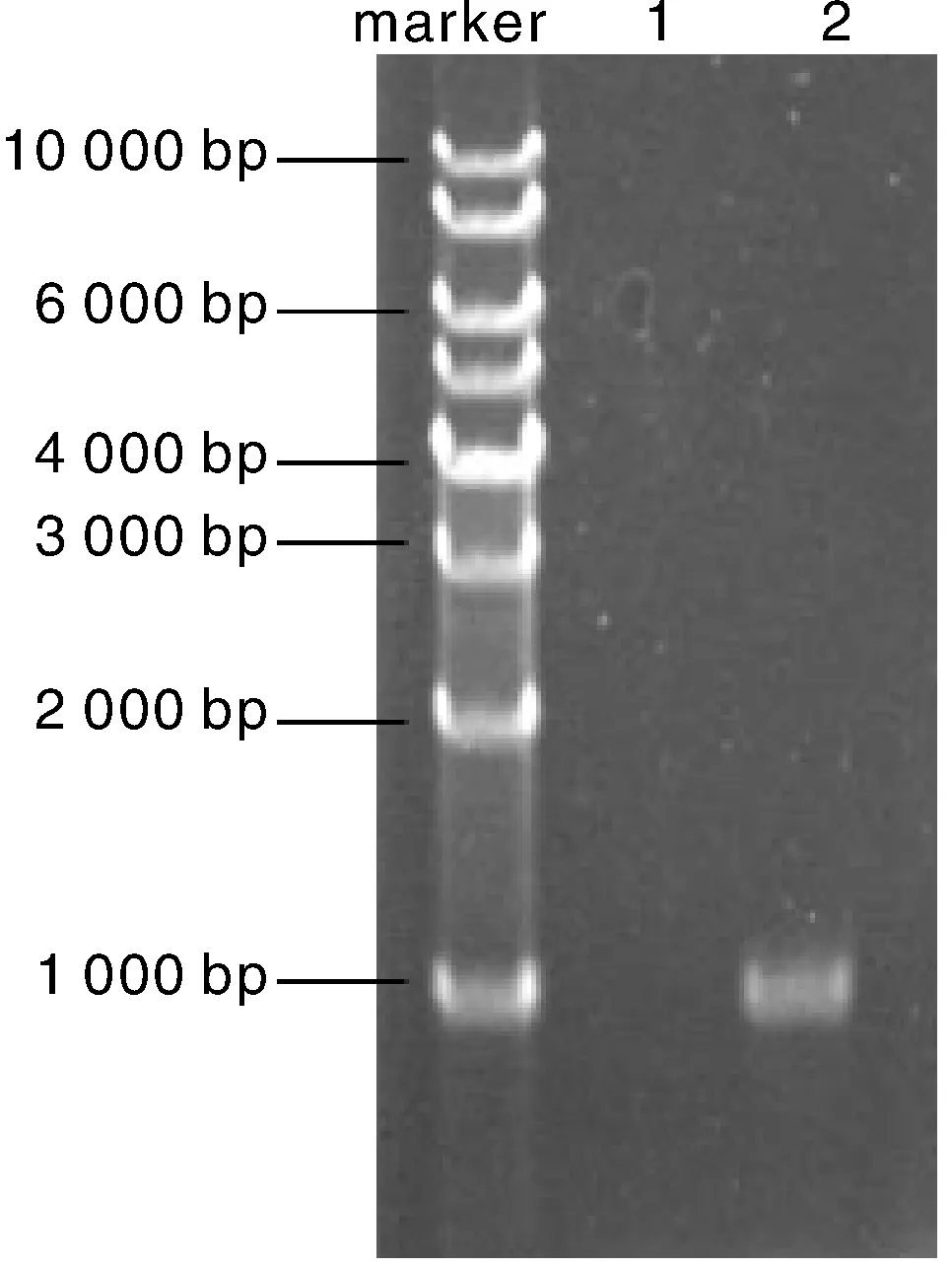
1: 重组菌pAMJ399/MG1363(CK);2: 重组菌pAMJ399-PIPLC/MG1363。图4 菌落PCR结果Fig.4 PCR amplification result of the colonies
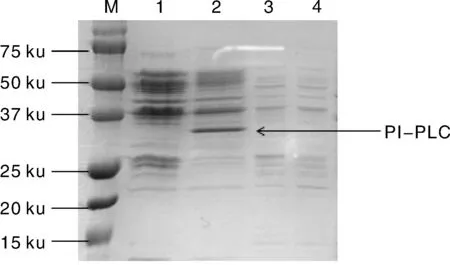
M: 蛋白marker;1: 重组菌pAMJ399/MG1363发酵液离心上清(CK);2: 重组菌pAMJ399-PIPLC/MG1363发酵液离心上清;3: 重组菌pAMJ399/MG1363发酵液离心沉淀(CK);4: 重组菌pAMJ399-PIPLC/MG1363发酵液离心沉淀。图5 SDS-PAGE电泳图Fig.5 Electrophoretogram of SDS-PAGE

1: 重组菌pAMJ399-PIPLC/MG1363发酵液离心上清;2: 重组菌pAMJ399/MG1363发酵液离心上清(CK)。图6 重组蛋白活性验证Fig.6 Verification of recombinant enzyme activity
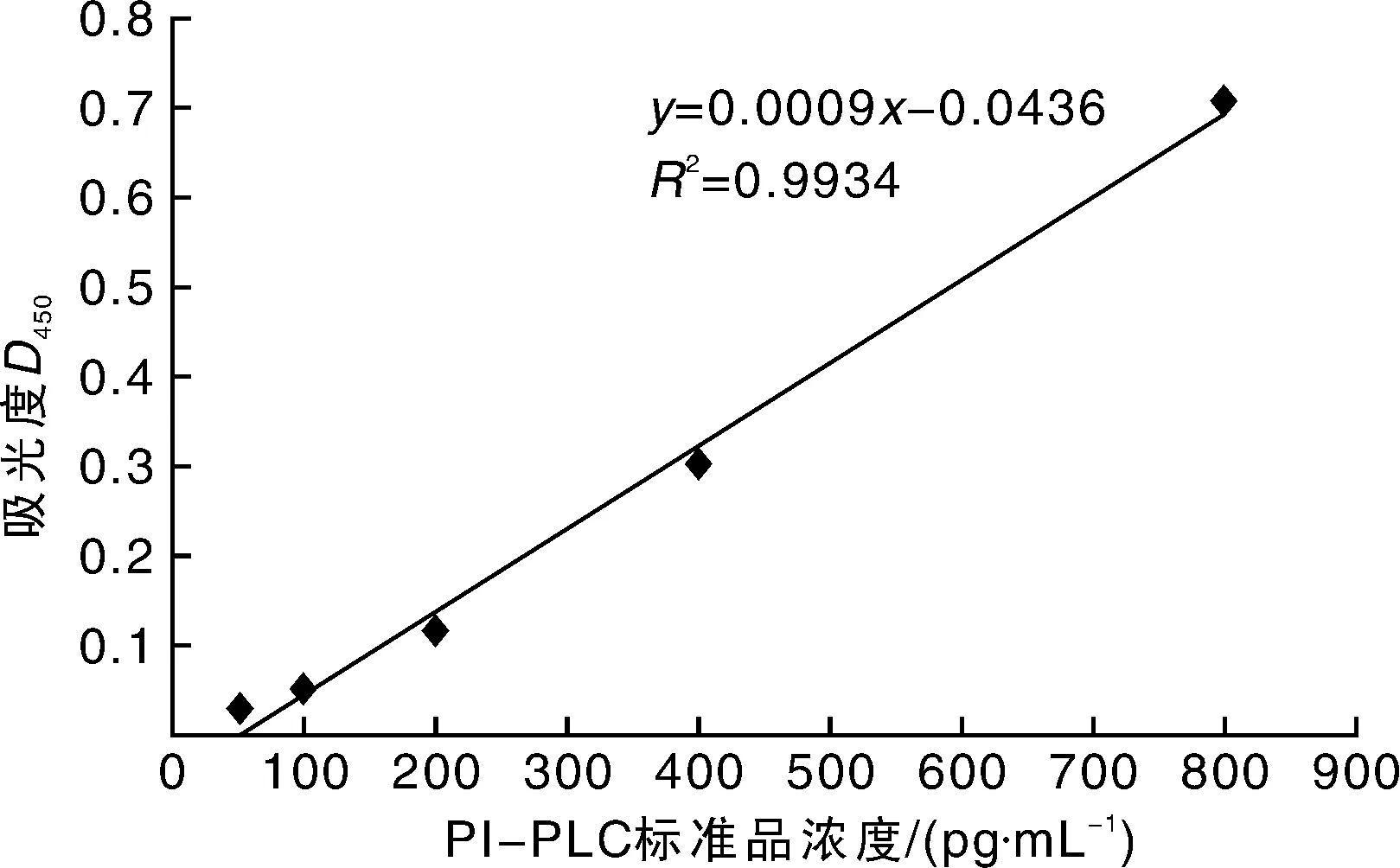
图7 PI-PLC标准品的标准曲线Fig.7 Standard curve line of PI-PLC product
3 讨论
对细菌PI-PLC基因结构及酶功能的研究始于国外20世纪80年代[1,19],该酶所特有的裂解GPI锚定蛋白的能力是目前研究的主要热点之一。GPI锚定蛋白将糖基化磷脂酰肌醇锚定于细胞膜表面,PI-PLC能切断GPI锚定蛋白中肌醇磷脂与细胞膜的连接,释放细胞膜表面上锚定的糖蛋白和碳水化合物[20]。GPI锚定机制在原生动物和高等真核生物中普遍存在。在原生动物细胞膜表面,GPI锚定似乎已被选定为表面蛋白锚定最有效的形式。有证据表明,一些寄生虫的特异性GPI锚定结构是寄生虫得以在昆虫和哺乳动物等宿主中生存、增殖、感染所必不可少的机制。因此,以细菌PI-PLC酶作为抗寄生虫药物来进行开发及研究具有广阔的前景[10]。然而目前国内对相关方面的研究及报道很少。
本文根据乳酸乳球菌密码子的偏好性,优化设计并合成蜡状芽孢杆菌PI-PLC基因,采用乳酸乳球菌-大肠埃希菌穿梭质粒pAMJ399为表达载体,成功构建重组乳酸乳球菌pAMJ399-PI-PLC/MG1363。利用P170启动子基于分子生物学途径成功实现了PI-PLC基因在乳酸乳球菌中的可溶性表达,避免了包涵体复性带来的各种麻烦。P170启动子是酸诱导启动子,乳酸乳球菌在生长过程中,自身代谢产生乳酸,使培养基pH不断下降,当pH在5.5~6.5时,启动子具有活性,诱导表达载体开始蛋白表达。这时正值菌体从指数生长期过渡到平台期,既不需要额外添加诱导物,又可将菌体生长期与外源蛋白的生产期分开[21]。通过优化培养条件, 2%转接量,在含有1%红霉素抗性的GM17液体培养基中,于 32 ℃静止培养24 h,测得培养基上清液中PI-PLC的浓度为1.092 μg·mL-1。后续工作将利用其N端6-HIS标签将PI-PLC进行分离纯化,获得的纯酶将用于PI-PLC酶学性质及其替代抗生素用来抗寄生虫效果方面的应用研究,以期为PI-PLC的产业化及工业化应用做出贡献。
[1]GRIFFITH O H, RYAN M. Bacterial phosphatidylinositol-specific phospholipase C: structure, function, and interaction with lipids[J].BiochimicaetBiophysicaActa, 1999, 1441(2): 237-254.
[2]WEHBI H, FENG J, ROBERTS M F. Water-miscible organic cosolvents enhance phosphatidylinositol-specific phospholipase C phosphotransferase as well as phosphodiesterase activity[J].BiochimicaetBiophysicaActa, 2003, 1613(1/2):15-27.
[3]HEINZ D W, ESSEN L O, WILLIAMS R L. Structural and mechanistic comparison of prokaryotic and eukaryotic phosphoinositide-specific phospholipases C[J].JournalofMolecularBiology, 1998, 275(4): 635-650.
[4]HOKIN L E. Receptors and phosphoinositide-generated second messengers[J].AnnualReviewofBiochemistry, 1985, 54(1): 205-235.
[5]NISHIZUKA Y. Intracellular signaling by hydrolysis of phospholipids and activation of protein kinase C[J].Science, 1992, 258(5082): 607-614.
[6]BERRIDGE M J. Inositol trisphosphate and calcium signaling[J].AnnalsoftheNewYorkAcademyofSciences, 1995, 766(1): 31-43.
[7]LOW M G, SALTIEL A R. Structural and functional roles of glycosyl-phosphatidylinositol in membranes[J].Science, 1988, 239(4837): 268-275.
[8]LISANTI M P, RODRIGUEZ-BOULAN E, SALTIEL A R. Emerging functional roles for the glycosyl-phosphatidylinositol membrane protein anchor[J].TheJournalofMembraneBiology, 1990, 117(1): 1-10.
[9]FERGUSON M A, HOMANS S W, DWEK R A, et al. Glycosyl-phosphatidylinositol moiety that anchorsTrypanosomabruceivariant surface glycoprotein to the membrane[J].Science, 1988, 239(4841): 753-759.
[10]MCCONVILLE M J, FERGUSON M A. The structure, biosynthesis and function of glycosylated phosphatidylinositols in the parasitic protozoa and higher eukaryotes[J].BiochemicalJournal, 1993, 294: 305-324.
[11]MENGAUD J, BRAUN-BRETON C, COSSART P. Identification of phosphatidylinositol‐specific phospholipase C activity in Listeria monocytogenes: a novel type of virulence factor?[J].MolecularMicrobiology, 1991, 5(2): 367-372.
[12]DAUGHERTY S, LOW M G. Cloning, expression, and mutagenesis of phosphatidylinositol-specific phospholipase C fromStaphylococcusaureus: a potential staphylococcal virulence factor[J].InfectionandImmunity, 1993, 61(12): 5078-5089.
[13]史达, 宋岩, 李一经. 乳酸乳球菌作为黏膜免疫活载体疫苗传递抗原的研究进展[J]. 微生物学报, 2006, 46(4):680-683.
[14]RAVN P, ARNAU J, MADSEN S M, et al. The development of TnNuc and its use for the isolation of novel secretion signals inLactococcuslactis[J].Gene, 2000, 242(1): 347-356.
[15]RAVN P, ARNAU J, MADSEN S M, et al. Optimization of signal peptide SP310 for heterologous protein production inLactococcuslactis[J].Microbiology, 2003, 149(8): 2193-2201.
[16]MARQUES M B, WELLER P F, NICHOLSON-WELLER A. Growth in acidic media increases production of phosphatidylinositol-specific phospholipase C byStaphylococcusaureus[J].CurrentMicrobiology, 1992, 25(3): 125-128.
[17]马露, 乔薪瑗, 唐丽杰, 等. 猪IL-18在乳酸乳球菌中的表达及其生物活性的检测[J]. 生物工程学报, 2014, 30(10): 1541-1548
[18]HENDRICKSON H S. Fluorescence-based assays of lipases, phospholipases, and other lipolytic enzymes[J].AnalyticalBiochemistry, 1994, 219(1): 1-8.
[19]KUPPE A, EVANS L M, MCMILLEN D A, et al. Phosphatidylinositol-specific phospholipase C ofBacilluscereus: cloning, sequencing, and relationship to other phospholipases[J].JournalofBacteriology, 1989, 171(11): 6077-6083.
[20]曹勤燕, 薛艳凤, 沈利. 日本血吸虫糖基化磷脂酰肌醇锚定蛋白的鉴定[J]. 中国寄生虫学与寄生虫病杂志, 2012, 30(5):343-348.
[21]曹晓梅, 张虎成, 李曼,等. 鼠疫抗原LcrV在乳酸乳球菌中的表达与鉴定[J]. 中国微生态学杂志, 2010, 22(5):385-388.
(责任编辑高峻)
Cloning and heterologous expression in Lactococcus lactis of phosphatidylinositol-specific phospholipase C gene from Bacillus cereus
TANG Xian-ze1, LIU Wei2, PI Xiong-e2, YIN Ye-shi2, WANG Xin2, LIU Xin-li1,*
(1.SchoolofBioengineering,QiluUniversityofTechnology,Jinan250353,China; 2.InstituteofPlantProtectionandMicrobiology,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China)
Based on the codon bias ofLactococcuslactis, phosphatidylinositol-specific phospholipase C gene fromBacilluscereuswas optimized and then synthesized for protein expression. The cloned gene was inserted intoEscherichiacoli-Lactococcuslactisshuttle vector pAMJ399, and then transformed toL.lactiscells by electroporation to induce expression. The result of SDS-PAGE showed that the recombinant protein was secreted extracellular in the form of soluble proteins, and its molecular weight was about 35 ku, which was consistent with the expected protein size. Meanwhile, the recombinant protein showed significant enzyme activity on PI-Listeria chromogenic plate. The results indicated that phosphatidylinositol-specific phospholipase C (PI-PLC) was successfully expressed inL.lactis. The growth condition was optimized as follows: 2% inoculation amount; GM17 medium with 1% erythromycin; 32 ℃. After 24 h static culture under above condition, it could produce 1.092 μg·mL-1PI-PLC in the supernatant of culture medium.
phosphatidylinositol-specific phospholipase C; cloning and expression;Lactococcuslactis; GPI-anchored proteins
10.3969/j.issn.1004-1524.2016.04.15
2016-01-26
国家“973”计划子课题项目(2012CB721006);浙江省农业科学院青年人才培养项目
汤先泽(1990—),男,山东济宁人,硕士研究生,研究方向为生物制药工程。E-mail: 1004302941@qq.com
,刘新利,E-mail: vip.lxl@163.com
Q939.9
A
1004-1524(2016)04-0640-07
汤先泽,刘伟,皮雄娥,等. 磷脂酰肌醇特异性磷脂酶C基因在乳酸乳球菌中的异源表达[J]. 浙江农业学报,2016,28(4): 640-646.

