小型犬蓄脓子宫摘除对其阴道和粪便菌群结构的影响
曾东,冯帆,卿小丹,倪学勤*,孙豪,邱贤猛,邹芙沁,杨明月,朱星星,张紫媛,罗显进
小型犬蓄脓子宫摘除对其阴道和粪便菌群结构的影响
曾东1,2,冯帆1#,卿小丹1,倪学勤1,2*,孙豪1,邱贤猛3,邹芙沁1,杨明月1,朱星星1,张紫媛1,罗显进1
(1.四川农业大学动物医学院动物微生态研究中心,四川成都 611130;2.动物疫病与人类健康四川省重点实验室,四川成都 611130;3.四川成都博爱宠物医院,四川成都 611100)
选取4只子宫蓄脓的小型犬,分别取其阴道样品和粪便样品,采用聚合酶链式反应–变性梯度凝胶电泳(PCR–DGGE)技术,回收共性及特异性条带进行克隆测序,分析小型犬蓄脓子宫摘除对其阴道及粪便菌群结构的影响。结果显示:在摘除患犬子宫的前1 天、摘除子宫后治疗第1天和第2天,患犬阴道菌群的多样性指数分别为3.22、3.35、3.05,均匀度分别为0.88、0.92、0.83,丰富度分别为25.0、28.50、21.25,均呈先增加后降低的趋势,而粪便菌群只有丰富度呈先增加后降低的趋势;大肠杆菌、假单胞菌是阴道和粪便的共同优势菌群,红球菌是共有的特异性细菌,而葡萄球菌、嗜水气单胞菌是阴道的特有细菌,不动杆菌是粪便的特有细菌。结果表明,小型犬蓄脓子宫摘除对阴道菌群结构影响较大,阴道内的大肠杆菌及假单胞菌可能源于粪便。
小型犬;子宫蓄脓;阴道菌群;肠道菌群
子宫蓄脓(pyometra)是由子宫内膜增生并继发化脓性感染而引发的子宫内膜炎,最终导致子宫内蓄积大量脓液及严重的全身症状,分为开放型和闭锁型[1],多见于6岁以上母犬及发情后第4~8周内未经产或经产后屡配不孕的中、老龄犬[2]。京巴、博美、西施等小型犬易发该病[3]。在临床上,该病是发病率最高的母犬产科疾病,一般以手术摘除子宫、卵巢为主进行治疗,治愈率较高[4]。子宫蓄脓是由细菌和激素共同作用导致的,也受年龄、生殖内分泌变化等因素的影响[5]。在发情期,子宫内膜受孕酮激素刺激后发生的腺囊性增生易导致细菌感染。子宫蓄脓的常见感染菌是大肠杆菌,此外还有葡萄球菌、链球菌、假单胞菌、变形杆菌、气杆菌等[6]。关于这些细菌的来源及其与阴道菌群和粪便菌群关系的研究尚少。笔者选择四川成都博爱宠物医院犬子宫蓄脓病例,采用PCR–DGGE技术结合特异性条带的克隆测序,分析手术切除蓄脓子宫对阴道及粪便菌群结构的影响,旨在为小型犬子宫蓄脓的防治提供参考依据。
1 材料和方法
1.1试验动物
试验动物为4只年龄6岁以上患子宫蓄脓的小型犬,平均体质量7.6 kg。病例采自四川成都博爱宠物医院。
1.2仪器和试剂
PCR引物由英潍捷基(上海)生物技术有限公司合成;2×MasterMix(含染料)购自北京康为世纪生物科技有限公司;银染药品和试剂购自四川瑞进特科技有限公司;Gel Extraction Kit购自美国OME–GA公司;pMD19–T 载体购自宝生物工程(大连)有限公司。MJ Research PTC–200 PCR仪为美国Bio–Rad公司产品;DGGE电泳仪为Dcode Universal Detection System(Bio–Rad(加拿大));核酸浓度测定仪为ND–1000 UV–Vis Spectro-Photometer (美国Nano-Drop公司);凝胶成像系统为Gs800 Cali-Brated Densitometer(美国Bio–Rad公司)。
1.3样品采集
分别用灭菌棉球蘸取4只患犬摘除子宫前1 d和摘除子宫后治疗第1天、第2天的阴道样和粪样,分别置于装有生理盐水的1.5 mL EP管中,每只犬阴道样及粪样各3个,根据采样时间的先后,1号犬3次阴道样编号为Y1、Y2、Y3,2号犬编号为Y4、Y5、Y6,3号犬编号为Y7、Y8、Y9,4号犬编号为Y10、Y11、Y12;粪样编号方法相同,编为F1~F12,共24个样品,置–80 ℃冰箱保存,备用。
1.4细菌总DNA的提取
采用酚/氯仿/异戊醇抽提、异丙醇沉淀获得样品细菌总DNA[7],测定浓度后置于–20 ℃冰箱保存,备用。
1.516S rDNA V3 区域的PCR扩增及检测
采用细菌16S rRNA基因V3片段(339~539 bp)设计合成引物进行PCR扩增,上游带GC发夹引物为5′–CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG GAC TCC TAC GGG AGG CAG CAG T–3′,下游引物为5′–GTA TTA CCG CGG CTG CTG GCA C–3′[8]。扩增体系25 μL:2×Master Mix 12.5 μL,上、下游引物各1.0 μL(10 pmol/μL),模板DNA 1.0 μL,用ddH2O补足25 μL。同时设置阴性对照。PCR 扩增程序为95 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,30个循环,最后72 ℃延伸10 min。用1.0%琼脂糖凝胶检测PCR产物。
1.6PCR–DGGE指纹图谱分析
参照文献[9]进行PCR–DGGE凝胶电泳分析。凝胶电泳梯度为35%~65%(100%的变性剂包括7 mol/L尿素和40%甲酰胺),变性方向与电泳方向一致。采用1×TAE作电泳缓冲液,于100 V、60 ℃条件下电泳14~16 h,结果经硝酸银染色后,用凝胶成像系统扫描成像。
1.7共性及特异性条带的回收及克隆测序
将DGGE图谱上的共性条带和特异性条带分别割胶回收,并浸泡在30 μL加有0.1%聚乙二醇辛基苯基醚(Triton X–100)的缓冲液中,4 ℃放置2 d。取1 μL作为模板,按1.5中的方法再次扩增16S rDNA V3区(不带GC夹子的引物),用2%琼脂糖凝胶检测,胶回收试剂盒回收DNA。采用pMD®19–T Vector试剂盒,参照使用手册对模板PCR产物进行连接,并转化到大肠杆菌DH5α感受态细胞中,采用蓝白斑筛选出阳性克隆子,每个条带选取3个阳性克隆送公司测序。测序结果在GenBank数据库中进行比对,确定亲缘关系最近的细菌。
1.8数据分析
用如下公式计算多样性指数(Shannon diversity index)、均匀度(evenness)和丰富度(richness)。;=/max;=。式中:为物种的相对丰度比例;max为当为所有样品总物种数时的多样性指数;为样品在DGGE 的条带数。
将DGGE图谱数字化、标准化后得到图谱中条带迁移位置数字化矩阵导入SPSS 22.0软件和NTSYS 2.1软件进行主成分分析及聚类分析。
2 结果与分析
2.1阴道及粪样细菌的16S rDNA V3区 PCR– DGGE图谱分析
如图1、图2所示,患犬摘除蓄脓子宫前1 d和摘除子宫后期治疗的第1天、第2天,阴道和粪便细菌的PCR–DGGE图谱中均产生了较为丰富的电泳条带,强的电泳条带反映了阴道和粪便中的优势菌群,条带数量和位置的复杂性代表细菌菌群的多样性。阴道样品平均条带数为25条,略低于粪便样品的(27条)。摘除子宫后第1天的阴道及粪便菌群丰富度大多高于摘除前的,且阴道菌群丰富度在同一时间段的不同个体中无明显差异,而在同一个体的不同阶段有显著差异,呈现摘除子宫后第1天的阴道菌群丰富度较摘除前1 d的增加、摘除第2天的较摘除前1 d减少的趋势,而粪便菌群丰富度摘除前后变化较小。结果表明,摘除子宫及摘除子宫后的后期治疗对阴道菌群结构的影响较大,对粪便菌群结构的影响较小。
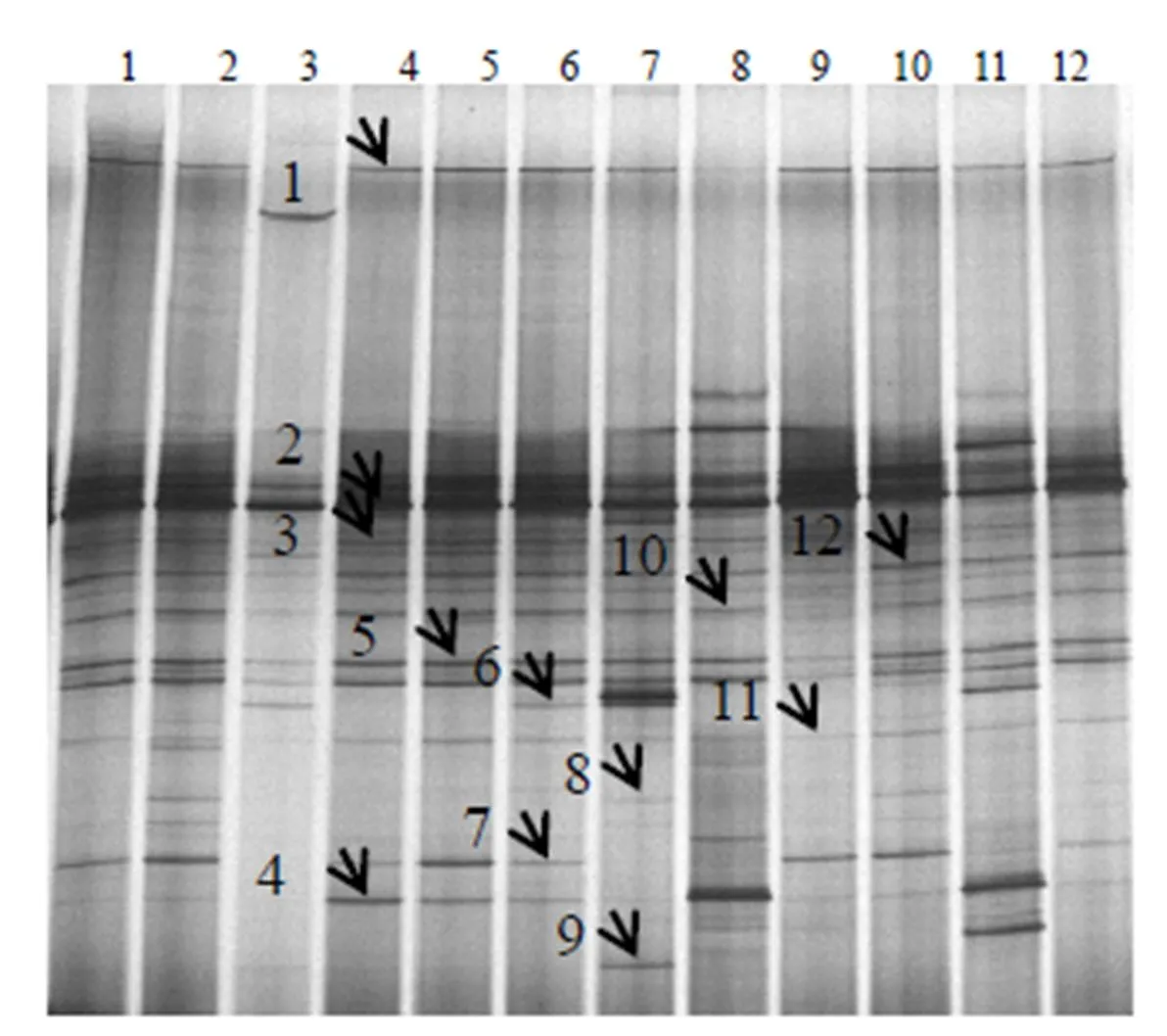
1,2,3,…,12分别对应样品编号Y1,Y2,Y3,…,Y12;图中箭头所指为回收片段。
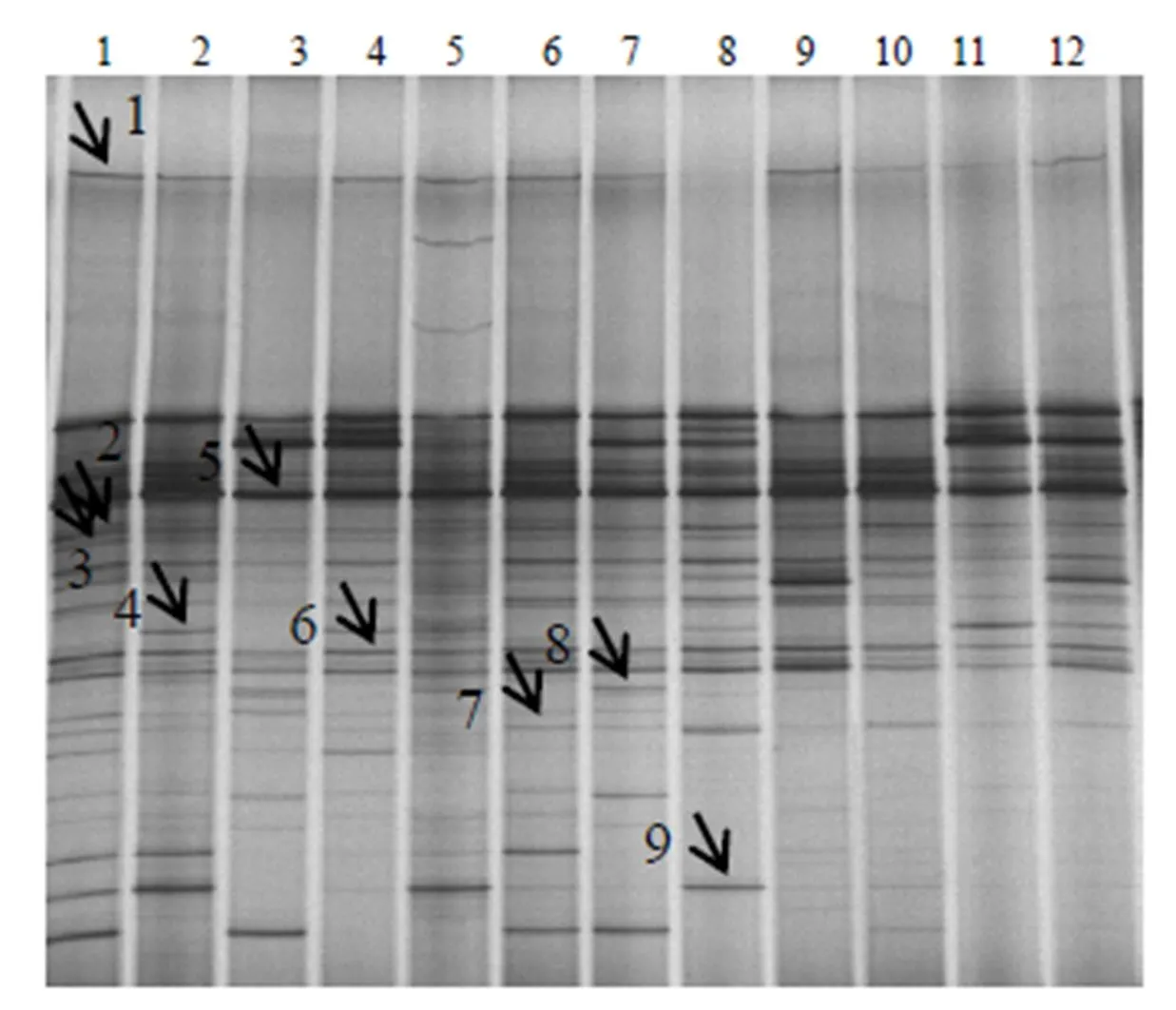
1,2,3,…,12分别对应样品编号F1,F2,F3,…,F12;图中箭头所指为回收片段。
2.2PCR–DGGE图谱的多样性分析
对各样品条带的数量、亮度及分布位置进行分析的结果(表1)表明,摘除子宫后1 d阴道菌群的多样性指数、均匀度、丰富度均高于摘除子宫前1 d的和摘除子宫后第2天的,表明摘除子宫后第1天的阴道样品菌群结构的多样性、均匀度及丰富度均较摘除子宫前1 d和摘除子宫后第2天的高,且均呈先增加后降低的趋势;粪便菌群的丰富度也有相似变化趋势,但变化程度较小,且其余指标值在摘除子宫前后变化不明显。
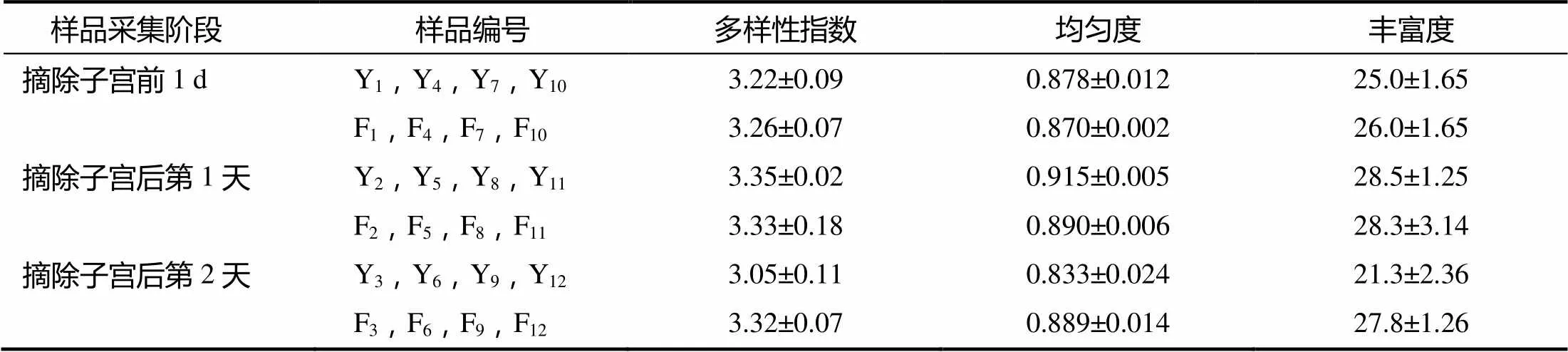
表1 不同样品采集阶段阴道和粪便样品的多样性指数和均匀度及丰富度
2.3PCR–DGGE图谱条带的聚类分析
图3结果显示,除阴道样品Y7外,11个阴道样品和12个粪便样品各聚集成一类,不同患犬阴道及粪便菌群的相似性系数均高于0.63,表明动物个体的差异对其阴道及粪便菌群结构的影响较小。在阴道样品中,摘除子宫前Y1、Y4、Y10的相似性系数为0.88,而与Y7的差异显著;摘除子宫后第2天,Y6、Y9、Y12的相似性系数高达0.95;同一只患犬不同阶段的相似性系数不同,如Y10、Y11、Y12的相似性系数为0.70,而Y1、Y2、Y3的相似性系数低至0.65。可见,同一个体摘除子宫前后阶段的相似性较低,随着摘除子宫后治疗时间的增加,不同患犬间阴道菌群的相似性增大。在粪便样品中,同一阶段的样品,如F1、F4、F7的相似性系数为0.74,与F10差异显著,摘除子宫后第1天、第2天样品的相似性系数分别为0.66、0.69,同一只患犬的不同阶段如Y4、Y5、Y6的相似性系数为0.70,Y10、Y11、Y12的相似性系数低至0.66,可见,摘除子宫前后同一个体及不同个体间粪便菌群结构的相似性均低于阴道菌群结构的,表明摘除子宫对阴道菌群的影响较大。
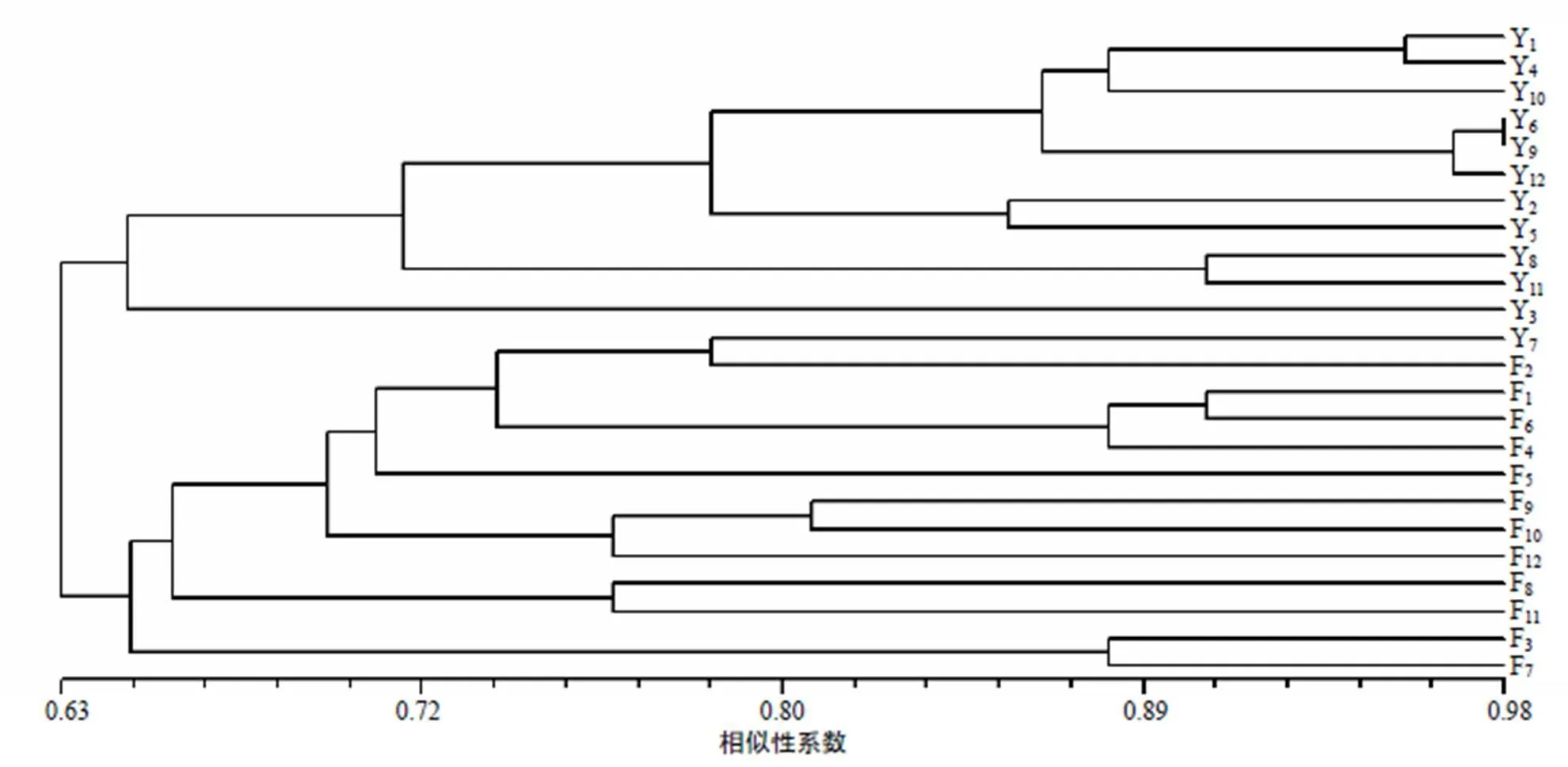
图3 PCR–DGGE图谱的聚类分析结果
2.4 PCR–DGGE图谱条带的主成分分析
主成分因子1(PCA1)的贡献率为18.301%,主成分因子2(PCA2)的贡献率为14.674%;PCA1明显地将样品分成2个部分,阴道样品主要分布在图的左边,粪便样品主要分布在图的右边。PCA2将摘除子宫前1 d和摘除子宫后第1天的阴道样品同摘除子宫后第2天的阴道样品区别开来,摘除子宫前1 d及摘除子宫后第1天的样品主要分布在图的上边,摘除子宫后第2天的样品主要分布在图的下边,而粪便样品呈无规律性分布(图4)。
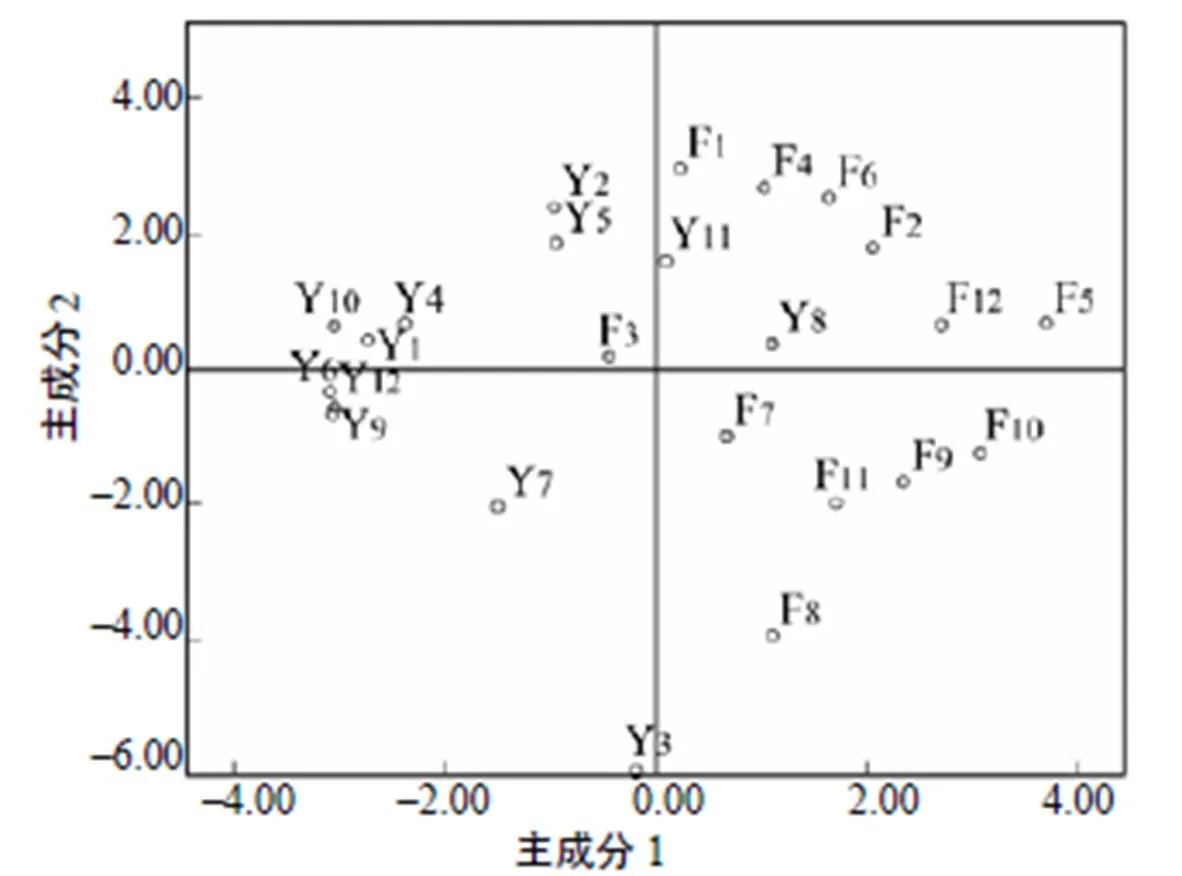
图4 PCR–DGGE图谱条带的主成分分析结果
2.5条带测序结果
PCR–DGGE图谱显示,粪便样品回收了9条带,阴道样品回收了12条带,共回收了21条带(图1和图2中的箭头所指)。由克隆测序后在GenBank数据库中进行序列比对分析的结果(表2、表3)可见,假单胞菌()、大肠杆菌()是阴道和粪便中共同存在的优势菌群,红球菌()是阴道和粪便中均存在的特异性菌群,而葡萄球菌()、嗜水气单胞菌()源自阴道,不动杆菌()源自粪便。21个测序结果与GenBank数据库中细菌的同源性绝大多数都达到了100%,说明试验中所得序列与已鉴定微生物的亲缘性高。
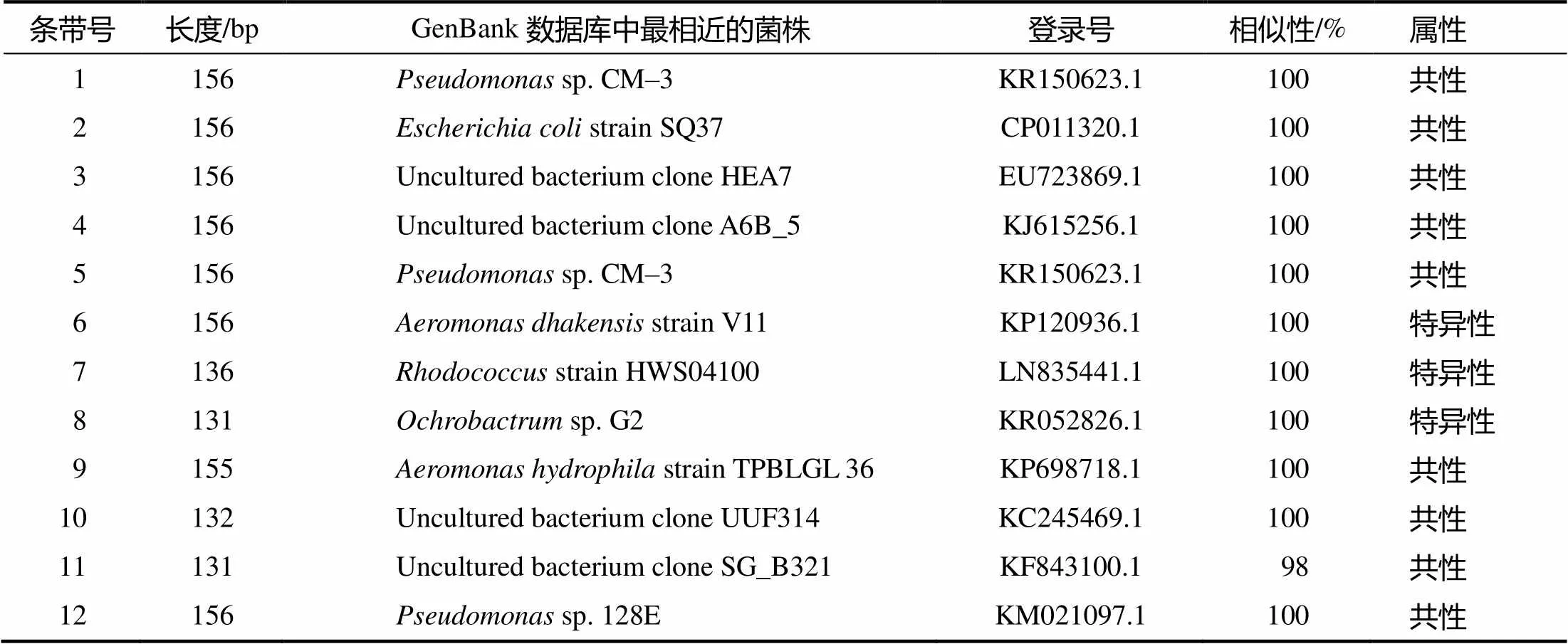
表2 阴道样品PCR–DGGE图谱的共性和特异性条带的Blast分析结果
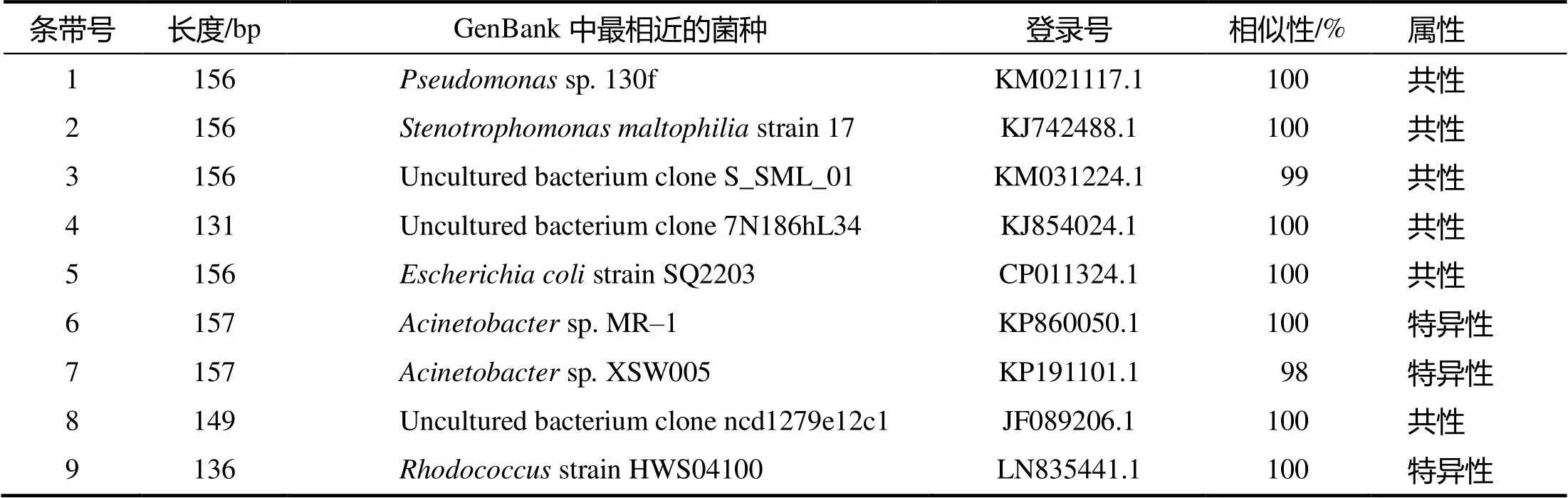
表3 粪便样品PCR–DGGE图谱的共性和特异性条带的Blast分析结果
3 结论与讨论
采用PCR–DGGE技术分析摘除蓄脓子宫对小型犬阴道及粪便菌群的影响,揭示患犬阴道及粪便细菌群落的结构特征,结果显示,患犬阴道和粪便菌群都有较高的丰富度,阴道样品平均有25条带,粪便样品平均有27条带,患犬阴道菌群的丰富度与粪样的相当;主成分分析结果显示,不同患犬摘除子宫前后3个时间点的阴道样品各自聚为一类,且各类之间分界明显,而粪便样品呈不规则分布,表明不同犬只个体的阴道菌群患子宫蓄脓后表现出一定的相似性,在摘除子宫用相同药物治疗后,相似性程度进一步增加,呈现先增加后降低的趋势,而粪便菌群只有丰富度呈现相同的变化趋势,其余指标均在摘除子宫后增加。该现象可能是因为患犬抵抗力下降,腹腔切除子宫导致手术刺激或感染,使阴道及粪便中菌群的丰富度均增加,但经2 d治疗后阴道菌群受到抑制,多样性指数减少;粪样菌群受药物的影响较小,菌群多样性稍有增加,但变化不明显。本研究结果与文献[10]报道的结果基本一致(当受到药物或病理因素影响时,肠道移行肌电复合波会出现紊乱,导致肠道清除运动受到破坏,此时肠道细菌繁殖速度大于清除速度,细菌数量增加)。
本试验结果显示:犬类在患子宫蓄脓的情况下,其阴道微生物的丰度有显著提高,与粪便微生物的丰度相当。本研究结果与文献[11]报道结果基本一致(阴道疾病患者阴道微生物群落的丰度和相对丰度均显著提高[11])。
本试验结果显示:大肠杆菌、假单胞菌是患犬阴道和粪便中共同的优势菌群,红球菌是共有的特异性细菌,而葡萄球菌、嗜水气单胞菌是阴道的特有细菌;不动杆菌是粪便的特有细菌。本研究结果与文献[12–15]报道的结果基本一致(子宫蓄脓的主要致病菌为大肠杆菌,细菌主要来源是阴道弯窿内的常在菌,另外还有尿道感染或肠道细菌移行等其他来源[12];尿道致病性大肠杆菌是导致子宫蓄脓和泌尿道感染的主要细菌,其作用机理是因其具有特殊的尿道感染致病因子(uropathogenic virulence factors,UVFs),UVFs帮助细菌吸附、定植于尿道和子宫黏膜,为细菌的生长繁殖提供必要的营养物质,尿道中的细菌在发情期的某个易感染阶段进入并感染子宫[13];从子宫样品中可分离出链球菌、克雷伯菌、葡萄球菌、巴斯德菌、变形杆菌和假单胞菌等常见菌[14])。
本试验中检测到的阴道优势菌群是大肠杆菌和假单胞菌,二者均为革兰氏阴性菌,表明子宫蓄脓对阴道菌群的影响较大。正常情况下,阴道菌群主要为阴道杆菌及革兰氏阳性球菌等[15],只有当机体免疫力低下或阴道内环境改变时,阴道内酸碱度才发生变化,导致病原菌大量繁殖。
在阴道和粪便PCR–DGGE图谱中,大肠杆菌、假单胞菌电泳条带的强度和迁移率均相似。阴道和粪便中大肠杆菌、假单胞菌的DNA序列通过BLAST比对和同源性分析,可得大肠杆菌的值为9e–82,假单胞菌的值为2e–68,二者都接近于0,表明阴道和粪便中的大肠杆菌和假单胞菌有很高的相似性。这是因为犬发情后子宫内膜脱落,出血,生殖道抵抗力降低,此时如果犬坐于地面往往会因为阴部被地面微生物污染而引发子宫蓄脓[16](犬坐于附有自身粪便的地面时会通过细菌移行感染粪便中的大肠杆菌和假单胞菌)。
综合分析结果表明,子宫蓄脓对阴道菌群影响较大;随着摘除子宫后时间的增加,阴道菌群的多样性呈先增加后降低的趋势;阴道内的大肠杆菌及假单胞菌可能来源于粪便。
参考文献:
[1] 万圣.犬子宫蓄脓4种细菌多重PCR检测方法的建立及溶菌酶抑菌效果观察[D].济南:山东农业大学,2013.10.7666/d.Y2303814.
[2] Fukuda S.Incidence of pyometra in colony-raised beagle dogs[J].Exp Anim,2001,50(4):325–329.DOI:10.1538/ expanim.50.325.
[3] 钱存忠.96例犬子宫蓄脓的诊断、临床病理及其发病机理研究[D].南京:南京农业大学,2004.10.7666/d. Y679918.
[4] Arora N,Sandford J,Browning G F,et al.A model for cystic endometrial hyperplasia/pyometra complex in the bitch[J].Theriogenology,2006,66(6/7):1530–1536. DOI:10.1016/j.theriogenology.2006.02.019.
[5] 钱存忠,侯加法.犬子宫蓄脓的病因学及病理变化特征[J].畜牧与兽医,2005,37(9):49–52.DOI:10.3969/j. issn.0529–5130.2005.09.024.
[6] 张志强,薛琴,吕艳丽,等.犬子宫积脓的需氧菌调查及药物敏感试验[J].中国兽医杂志,2005,41(3):40–42.DOI:10.3969/j.issn.0529–6005.2005.03.020.
[7] 田晓娟,张志红,黄江丽,等.体外培养瘤胃微生物总DNA的提取与纯化[J].江西科学,2012,30(1):44–46,102.DOI:10.3969/j.issn.1001–3679.2012.01.013.
[8] Walter J,Hertel C,Tannock G W,et al.Detection of,,andspecies in human feces by using group-specific pcr primers and denaturing gradient gel electrophoresis[J]. Applied and Environmental Microbiology,2001,67(6):2578–2585.DOI:10.1128/aem.67.6.2578–2585.2001.
[9] 倪学勤,Gong Joshua,Yu Hai,等.PCR–DGGE技术分析蛋鸡MHC基因对肠道细菌种群结构的影响[J].中国农业科学,2009,42(7):2564–2571.
[10] 金艺鹏.犬肠道抗菌药物相关性菌群失调的微生物学与组织病理学研究[D].北京:中国农业大学,2006.10. 7666/d.y940181.
[11] 凌宗欣.女性生殖道微生物群落菌群多样性变化与生殖道感染的相关性研究[D].杭州:浙江大学,2012.
[12] 杨百亮,姚迪.犬子宫蓄脓需氧菌的分离鉴定及药敏试验[J].畜牧与兽医,2008,40(1):74–76.
[13] Siqueira A K,Ribeiro M G,Leite Dda S,et al.Virulence factors instrains isolated from urinary tract infection and pyometra cases and from feces of healthy dogs[J].Res Vet Sci,2009,86(2):206–210.DOI:10.1016/j.rvsc.2008.07.018.
[14] Wadås B,Kühn I,Lagerstedt A S,et al.Biochemical phenotypes ofin dogs:comparison of isolates isolated from bitches suffering from pyometra and urinary tract infection with isolates from faeces of healthy dogs[J].Vet Microbiol,1996,52(3/4):293–300.DOI:10.1016/s0378–1135(96)00067–3.
[15] 史跃杰.99例阴道细菌的检验方法比较分析[J].现代预防医学,2011,38(14):2815–2817.
[16] 卢德章,张建涛,胡魁,等.犬猫腹腔镜技术的研究进展[J].中国畜牧兽医,2008,35(12):148–149.
Effects of purulent uterus extirpation on the microflora in vagina and feces of small canine
Zeng Dong1,2,Feng Fan1,Qing Xiaodan1,Ni Xueqin1,2*,Sun Hao1,Qiu Xianmeng3,Zou Fuqin1,Yang Mingyue1,Zhu Xingxing1,Zhang Ziyuan1,Luo Xianjin1
(1.Institute of Animal Microecology College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, China; 2. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Chengdu 611130, China; 3.Sichuan Chengdu Bo’ai Animal Hospital, Chengdu 611100, China)
Four small canines, suffered from pyometra, were employed to test the effects of uterus extirpation on the microbial community structure in their vagina and feces. The recycled common and specific bands derived from samples in vagina and feces were sequenced and cloned by adopting polymerase chain reaction and denaturing gradient gel electrophoresis (PCR–DGGE) technologies. The results showed that the diversity index, evenness and richness of flora in vagina were 3.22, 3.35 and 3.05, respectively before the extirpation; they were 0.88, 0.92, and 0.83 respectively after the first extirpation day and 25.0, 28.50, and 21.25 respectively after the second extirpation day, which showed an decrease at first, and then increase at the second day. To the flora that in feces, on the contrast, only the richness showed the same tendency.andwere the dominant flora both in vagina and feces,presented in specific both in vagina and feces, whileandpresented specific only in vagina, andwere specific in feces. All the results indicated that uterus extirpation exerted a great impact on microbial community structure in vagina,andin vagina might be derived from feces.
small canine; pyometra; vaginal flora; intestinal flora
S858.292
A
1007-1032(2016)05-0528-06
2015–09–17
2016–09–08
四川省科学技术厅科技支撑项目(2013NZ0042)
曾东(1961—),男,四川丹棱人,博士,教授,主要从事动物微生态研究,zend@sicau.edu.cn;#共同第一作者,冯帆,主要从事微生态研究,931540340@qq.com;*通信作者,倪学勤,博士,教授,主要从事动物微生态研究,xueqinni@foxmail.com
投稿网址:http://xb.ijournal.cn
责任编辑:王赛群
英文编辑:王库

