明亮发光杆菌连续培养条件的优化
蒋媛媛, 孟 芹, 苏嘉缘, 李 佩, 郭美锦, 冯耀宇(华东理工大学 .资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室;.生物工程学院,上海 0037)
明亮发光杆菌连续培养条件的优化
蒋媛媛1, 孟 芹1, 苏嘉缘1, 李 佩1, 郭美锦2, 冯耀宇1
(华东理工大学 1.资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室;2.生物工程学院,上海 200237)
为克服市售冻干粉批次间活性差异较大、检测前需复苏等缺点,对明亮发光杆菌从摇瓶到发酵罐进行逐级放大培养,探索其在发酵罐上的最适连续培养条件,获得连续稳定的发光细菌检测液。在摇瓶条件下得到的最适培养条件为:温度18℃,初始p H=7.0,转速200 r/min,接种量2%。在此条件下,菌体最大比发光度可达2 500 m V。在5 L发酵罐中的最适培养条件为:转速200 r/min,通气量0.5 vvm,稀释率0.10 h-1。在此条件下,对明亮发光杆菌进行多批连续培养,菌体比发光度可稳定在500~1 000 m V,可连续培养10 d左右。
发光杆菌;摇瓶培养;连续培养;最适条件
面对水环境中种类繁多、结构复杂、毒理和环境健康阈值均不明确的污染物,传统的水质理化指标检测已难以满足水环境安全管理的需要。另一方面,生物毒性检测法因其能够直观反映水体中所有污染物的综合毒性效应及其对人体和其他生物体系的危害程度,已成为水质安全评价的重要补充。
生物毒性检测实验主要有鱼类急、慢性[1]、蚤类毒性[2]、藻类毒性[3]及微生物毒性实验[4](如发光细菌对污染物毒性的发光抑制)等。这些方法在有毒物质对水环境的危害和风险评估方面有较大优势,不少学者对这些快速、灵敏的生物检测方法进行过研究。Farre等[5]利用有机毒物对鱼类、鼠类、水蚤类的生长抑制作用检测其生物毒性大小。研究发现,虽然鱼类、水蚤类实验的灵敏度较高,但所需实验周期长,花费大[6]。相比以上毒性检测法,基于发光菌为指示物的生物毒性检测法[7]利用有毒物质抑制发光菌的正常发光且被抑制程度与有毒物质浓度线性相关的原理,直接、有效地反映水质综合毒性[8]。该方法以其快速、简便、灵敏度高、成本低、可实时检测等优点受到检测人员的青睐,得到广泛应用。
近年来,将发光菌毒性检测技术和现代光电检测技术有机结合,在细胞固定化技术、生物传感技术的基础上,连续地进行在线水质毒性检测是目前研究的热点之一[9-11]。然而市售发光菌冻干粉价格较高,且测量之前需进行冻干粉的复苏及复苏效果不稳定等问题限制了其在现场连续原位自动化监测方面的应用。为了探索发光菌在水质连续监测应用上的可行性,少数学者对发光菌进行连续培养,并取得一定成果。Sedky等[12]在250 m L摇瓶,初始p H为7.0,温度为20℃的条件下对明亮发光杆菌进行连续培养,发现菌体在发光稳定的状态下可维持120 h以上;Pooley等[13]在20 m L微型装置中对明亮发光杆菌进行培养,发现菌体发光度在5%的误差范围内可保持稳定1周以上。
本文首次对明亮发光杆菌从摇瓶到发酵罐进行逐级放大培养来探索其最适培养条件,以期提供稳定、连续的测量菌液,从而克服传统检测多为批式反应、结果容易浮动等缺点,为连续原位监测提供理论基础。
1 材料与方法
1.1材料与试剂
明亮发光杆菌T3小种冻干粉(中科院南京土壤研究所);胰蛋白胨;酵母粉;Na2HPO4、KH2PO4、NaCl及甘油均为分析纯。
1.2培养基
胰蛋白胨5.0 g,酵母粉5.0 g,Na2HPO45.0 g,KH2PO41.0 g,NaCl 30.0 g,甘油3.0 g,去离子水溶解定容至1 000 m L,调节p H至7.0[14]。发光细菌所需营养物质与常见的异养微生物相似,由于明亮发光杆菌为海洋菌,故需提供质量分数为3% 的NaCl溶液,此配方能使明亮发光杆菌发光最佳,故采取此培养基配方。摇瓶培养、发酵罐培养以及补料均采用此培养基配方。
1.3实验方法
1.3.1明亮发光杆菌摇瓶培养条件的优化
(1)培养基。根据明亮发光杆菌培养基配方,在碳源和盐分的基础上逐步添加营养成分,于最佳接种量、温度、转速和p H下培养,测量发光强度和OD600,确定最佳培养基配方。
(2)接种量。分别接种0.5、1.0、1.5、2.0、2.5、5.0 m L的新鲜菌液于50 m L培养基中,在转速180 r/min下摇床培养24 h,测定发光强度及OD600值,确定最佳接种量。
(3)摇床转速。采用最佳接种量,将菌液分别在100、150、200 r/min的转速下培养24 h,测定发光强度及OD600值,以确定最佳转速。
(4)温度。采用最佳接种量和转速,将菌液分别在12、15、18、22、25℃下摇床培养24 h,测定发光强度及OD600值,确定最佳温度。
(5)p H。在最佳接种量、温度、转速下,用0.1 mol/L的HCl和NaOH缓冲液调节培养基p H至5.5、6.5、7、7.5、8,摇床培养24 h,测定发光强度及OD600值,确定最佳p H。
1.3.2明亮发光杆菌发酵罐上的批式培养
(1)在温度18℃,初始p H 7.0,接种量2%下,在100、200、300、400 r/min转速下,培养24 h,测定发光强度和OD600值,确定最佳搅拌转速。
(2)在最佳转速下,通过调节通气量为0.2、0.4 和0.5 vvm,探索通气量对发光菌生长和发光的影响,确定最佳通气量。
1.3.3明亮发光杆菌发酵罐上的连续培养 将明亮发光杆菌在5 L发酵罐中培养到16~18 h,在稀释率0.05~0.4 h-1范围内,以搅拌速率200 r/min、通气量0.5 vvm、18℃对发光菌进行连续培养,确定最佳稀释率;接通过程质谱仪MAX300-LG,同步监测各发酵参数。对明亮发光杆菌进行3个批次连续培养,测定发光强度和OD600值,考察不同批次稳定性情况。
1.3.4检测方法 明亮发光杆菌发光强度的检测参照DXY-3生物毒性检测仪说明书;菌体浓度的检测采用OD600分光光度计法。
2 结果与讨论
2.1明亮发光杆菌在摇瓶中的培养
2.1.1培养基的选择 在发酵培养过程中,培养基中有一种或几种必需的营养物,微生物可始终处在对这些营养物所需的最低质量浓度状态下生长。根据明亮发光杆菌培养基配方,在满足其生长所需的碳源和盐分的基础上逐步添加营养成分,每隔6 h倒出部分料液,同时补加相应的新鲜料液,观察其生长发光变化。表1示出了4种培养基配方(“+”表示含有此成分,“-”表示不含此成分)。实验结果见表2。由表2可知,第4种培养基的效果最佳,菌体比发光度(发光度/菌体浓度)高于其他3种情况。可见,明亮发光杆菌的生长除了需要碳源和盐分之外,氮源、无机盐离子对发光菌的生长和发光也是必须的,所以在后期的补料过程中亦选择补全料。
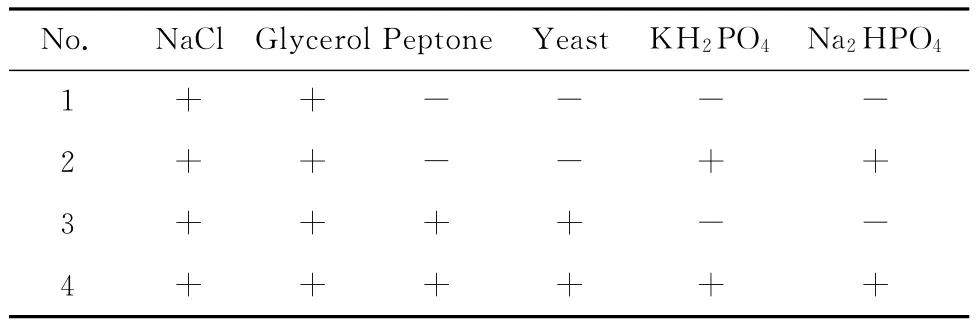
表1 不同批次的培养基Table 1 Different fed-batch mediums
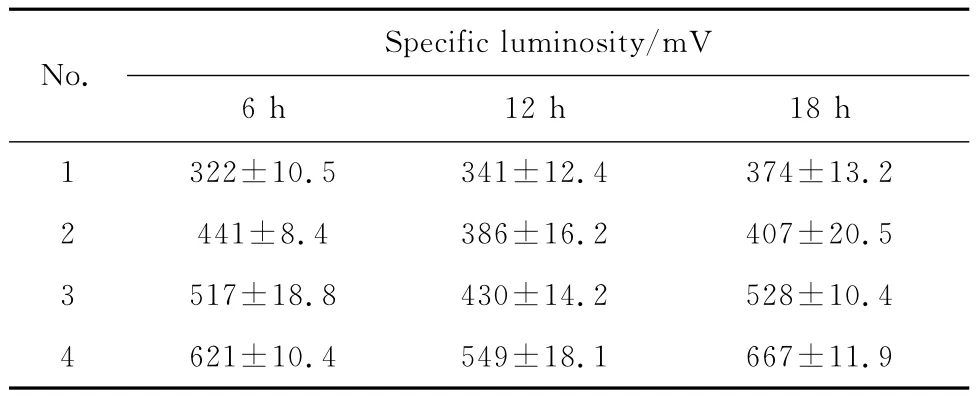
表2 不同批次培养基下的比发光度Table 2 Specific luminosity of different fed-batch mediums
2.1.2接种量的影响 以时间为横坐标,菌体比发光度为纵坐标作图,考察不同接种量对发光菌发光以及生长的影响,结果如图1所示。可以明显看出,在2%~10%接种范围内,菌体比发光度随着接种量的增大而减小。在2%的接种量时,菌体比发光度可达到1 000 m V。1%接种量的整体比发光度水平略低于2%的接种量。以上结果表明,接种量过大、过小均不利于菌体的发光,2%的接种量对发光菌的摇瓶培养最适宜。增大接种量会缩短菌体生长过程中的延滞期,也会带入过多的代谢物质。在生长初期,过多菌的生长、分裂会导致底物提前大量消耗,同时,由于菌体过多会导致发酵黏液的增多及氧的缺乏,最终影响发光菌的生长和发光。
2.1.3转速的影响 搅拌可以增加气液接触面积,提高气液界面传质速率。从图2可见,菌体在200 r/min下生长速度最快,整体比发光度值最大,最高可达2 300 m V。100、150 r/min低转速下,摇瓶供氧不足,生长速率较慢;250 r/min高转速下,菌体提前进入衰亡期,不利于发光菌的生长发光。所以就摇瓶培养而言,转速200 r/min对菌体的生长和发光比较适宜。
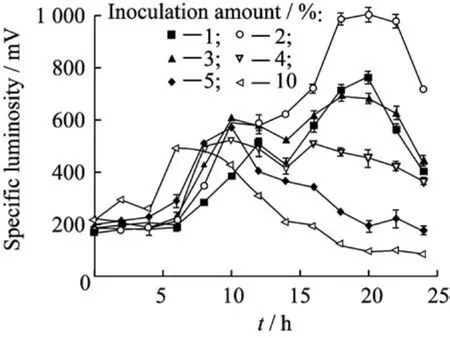
图1 接种量对菌体比发光度的影响Fig.1 Effect of inoculation amount on specific luminosity
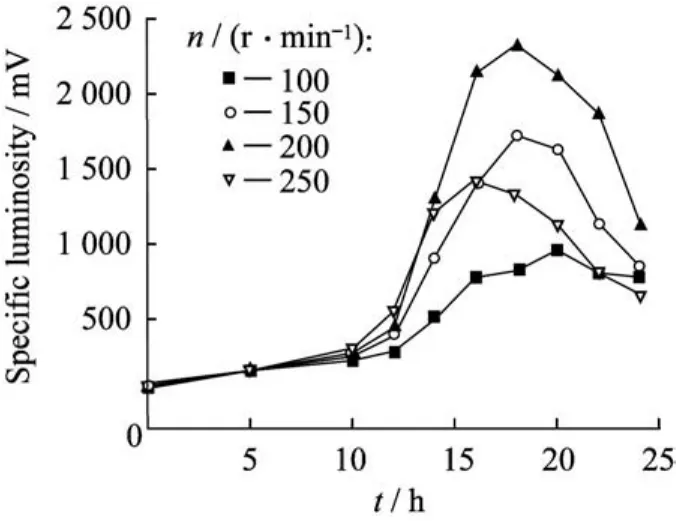
图2 转速对菌体比发光度影响Fig.2 Effect of rotation speed on specific luminosity
2.1.4温度的影响 温度是微生物生长的关键因素之一,本实验所采用的明亮发光杆菌源自海洋中,分布在水深250~1 000 m的较冷的中层区,属于低温性微生物,故本实验选择在12~25℃范围内确定发光杆菌的最适生长和发光温度。由图3可看出,18℃时的发光杆菌整体比发光度水平最高,最高值可达2 400 m V。22℃时的菌体生长发光水平略低于18℃,其次是15℃和25℃,12℃最弱,最高只达800 m V。低温下,菌体代谢缓慢,高温会影响酶的活性,因此明亮发光杆菌的最适生长温度为18℃左右,这与Sedky[12]在250 m L锥形瓶中对发光菌连续培养得出的最适培养温度20℃相接近。
2.1.5p H的影响 p H会影响菌体细胞膜的电荷状况及细胞膜的稳定性,进而影响菌体对营养物质的吸收能力和代谢产物的分泌,最终影响菌体的生长和繁殖。它是评价发酵体系状态变化和实施生产工艺控制的重要依据。将培养基的初始p H分别调至5.5、6.5、7.0、7.5、8.0,培养24 h,考察不同p H对菌体生长和发光的影响,如图4所示。由图4可知,p H在7.0时,菌体比发光度最高,可达2 500 m V,其次是p H 7.5、p H 6.5、p H 8.0;p H在5.5时的菌体比发光度水平最低。实验结果表明,p H 7.0对菌体的生长和发光最有利。
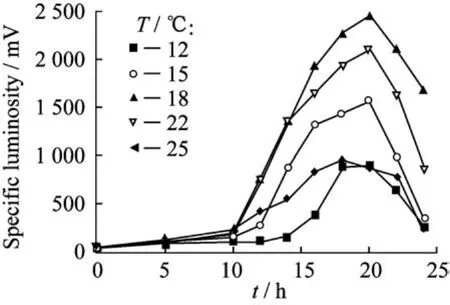
图3 温度对菌体比发光度的影响Fig.3 Effect of temperature on specific luminosity
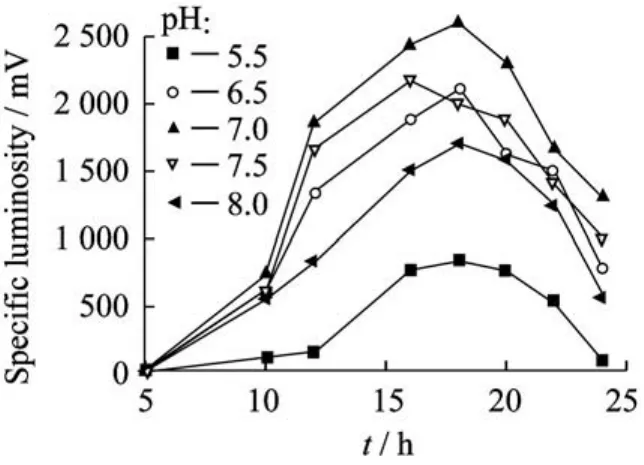
图4 p H对菌体比发光度影响Fig.4 Effect of p H on specific luminosity
2.2发光杆菌在发酵罐中的分批培养
2.2.1转速的影响 机械搅拌可打碎空气气泡,增加气液接触面积,能提高气液界面的传质速率,同时使发酵液充分混合。另一方面,搅拌影响罐内供氧状况,转速越大,供氧越充分。在温度18℃,通气量0.5 vvm,接种量2%的条件下,分别在转速为100、200、300、400 r/min下对发光杆菌进行培养(图5)。由图5可知,在200 r/min的转速下,菌体比发光度值可达最大,活力持续时间最长,最适合发光杆菌的生长和发光所需。高转速(300、400 r/ min)下,菌体会较快进入对数生长期,同时也提前进入衰亡期。低转速(100 r/min)下,菌体生长较缓慢,比发光度水平低。究其原因,低转速会导致罐内溶氧不足,不能满足菌体的生长和发光。转速过高,罐内体系的剪切应力增大,对菌体会造成一定伤害,且高溶氧下,细胞生长过快会导致过早自溶、后期活性衰弱、菌体活力维持时间短的现象[15]。此外,过高的溶氧不一定能激发菌体内荧光酶的最佳状态,甚至会限制荧光酶的活性。可见,转速的选择应以发光菌的实际生长发光状况来确定,不是越高越好。由实验结果可确定,在5 L发酵罐中培养发光菌的最佳转速为200 r/min,此结果与Stefanie等[16]在500 m L小型发酵罐中对费氏弧菌进行培养得出的最佳搅拌转速有所差异,这可能与装置的大小以及菌种的差异有关。
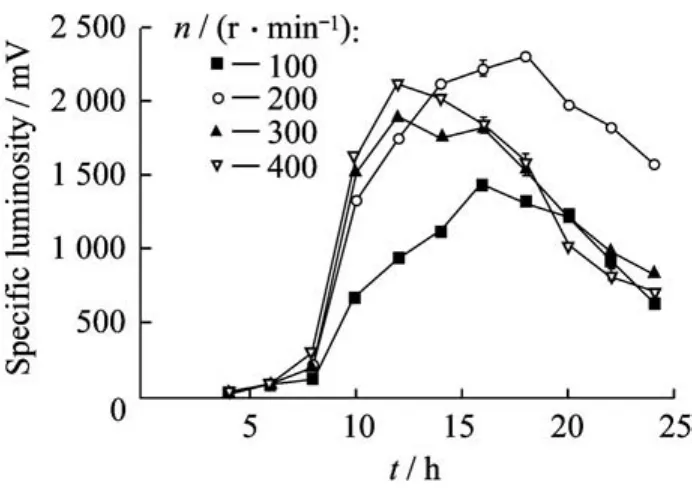
图5 不同转速对菌体比发光度的影响Fig.5 Effect of different agitation rates on specific luminosity
2.2.2通气量的影响 在18℃,搅拌速度为200 r/min时,分别以通气量0.5、0.4、0.2 vvm对发光杆菌进行培养(即空气流量分别为1、800、400 mL/min),考察通气量对菌体生长和发光的影响,结果如图6。当通气量为0.5 vvm时,菌体比发光度水平最高,最高可达2 200 mV;通气量为0.4、0.2 vvm时的菌体发光度皆低于0.5 vvm时的水平。由实验结果可见,通气量0.5 vvm最适合菌体的生长发光。
2.3明亮发光杆菌在发酵罐中的连续培养
在明亮发光杆菌连续培养的过程中探索最适稀释率(D),补料在菌体培养到18 h开始加入。图7显示了不同稀释率下,菌体比发光度的情况。由图7可知,当D为0.27 h-1时,菌体比发光度水平较低,达到稳定培养时比发光度不到80 m V;当D= 0.10 h-1时,菌体生长发光状况最好,稳定时比发光度可达到500 m V;当D=0.18 h-1时,菌体比发光度为380 m V;当D=0.36、0.40 h-1时,比发光度分别为180、100 m V左右。
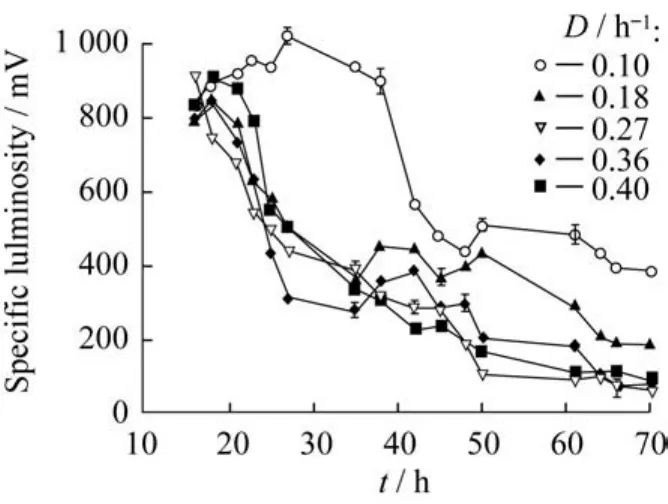
图7 不同稀释率对菌体比发光度的影响Fig.7 Effect of dilution rate on specific luminosity
以上结果表明,比较适宜的稀释率在D=0.10 h-1左右,此时菌体在稳定状态时活性较好。若稀释率过低,则残留基质浓度不断减小,基质低到无法维持菌的生长代谢,而残留的发酵代谢废液也不能及时流出,菌体会逐渐老化失活;稀释率也不宜过高,因为稀释率越大越容易出现菌体被“冲洗”的现象,菌体浓度减小,其发光效果也将受到影响。由实验可得,稀释率为0.10 h-1为最佳稀释率,这与Stefanie等[16]得出的费氏弧菌连续培养的最佳稀释率为0.08~0.09 h-1的结果相近。
图8所示为连续培养过程中参数动态响应图,CER、OUR分别为发酵过程中的摄氧率和CO2释放率。一般情况下,若OUR、CER增大,表明细胞代谢速率增强;若OUR、CER下降,表明菌体代谢受到影响。
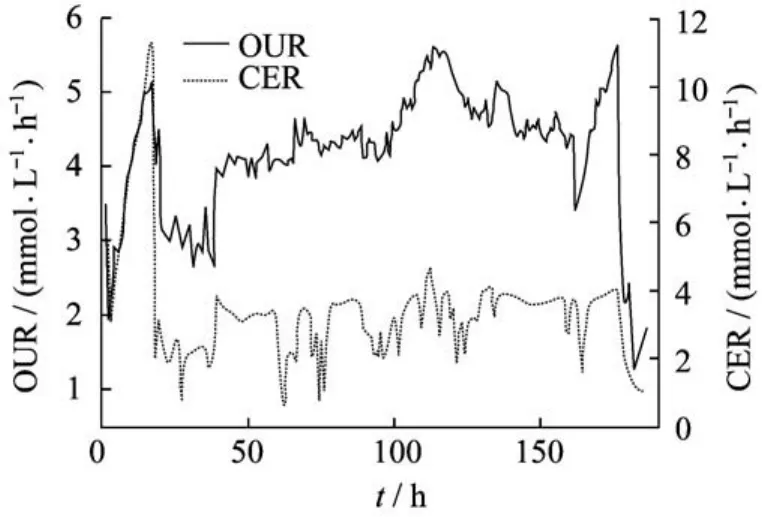
图8 连续培养中参数动态响应图Fig.8 Dynamic response of different parameters during chemostae cultivation
由图8可知,在发酵过程中,前10 h内,随着菌体的不断生长,OUR、CER不断上升,溶氧迅速下降;当溶氧处于较低水平时,菌体生长得到控制,OUR、CER增长减缓。约20 h后,菌体达到稳定期,CER、OUR、尾碳达到最高值,之后迅速下降,此时,罐内溶氧成为菌体生长的限制性因素,这时可通过微调转速来提高溶氧水平,保证罐内供氧能够满足代谢需要,此后,CER、OUR及尾碳、尾氧也处于稳定状态,变化幅度很小。在发酵稳定期间,需要进行补料,补料在短时间之内会导致OUR、CER的急剧变化,但补料之后,OUR、CER又趋于稳定,菌体代谢恢复正常。由图可见,连续培养过程中,主要参数变化相对稳定,明亮发光杆菌生长状态良好。
在前期优化的培养条件上,选择稀释率0.10 h-1,转速200 r/min、温度18℃、通气量0.5 vvm、p H=7.0的条件下进行3个批次连续培养,实验结果如表3所示。由表3可知,3次连续培养过程中菌体比发光度可稳定在700 m V以上,稳定性良好。其中持续时间最短8 d,最长可达12 d。

表3 不同批次连续培养中菌体比发光度Table 3 Luminosity variation during different batches
图9所示为明亮发光杆菌其中一次成功培养的菌体生长和发光情况。由图可见,成功培养过程中菌体浓度及发光度变化较为稳定,OD600在1.5~3.0之间,比发光度在700~1 500 m V范围,整体比发光度水平较高,随着时间的延长,二者皆呈现下降的趋势,符合微生物生长规律。
在连续培养期间,菌种会面临着老化以及活性降低的问题,时间越久活性越低。在补料期间每天需更换补料瓶,这亦会加大染菌的几率。相比Sedky[12]、Pooley[13]、Stefanie[16]等对发光菌进行的连续培养持续时间,本实验连续培养时间可长达12 d,结果较为理想,能够满足水质连续检测的需要,为发光杆菌在日后水质原位、连续、在线监测的应用奠定基础。
3 结 论
(1)在摇瓶培养中,采用含有不同营养物的培养基对明亮发光杆菌进行培养,结果显示全料下的菌体生长发光状态最好;分别探索了温度、接种量、转速及p H对明亮发光杆菌生长和发光的影响,得到最适培养条件为:温度18℃,初始p H 7.0,转速200 r/min,接种量2%,在此条件下,菌体最大比发光度可达2 500 m V。
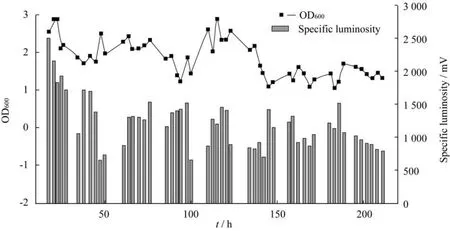
图9 连续培养中菌体比发光度变化Fig.9 Luminosity variation during chemostat cultivation
(2)在5 L发酵罐中对明亮发光杆菌进行批式培养,探索转速和通气量对菌体生长和发光的影响。得到最适转速为200 r/min。此转速下,菌体最大比发光度可达2 200 m V且可持续4 h。在最适转速200 r/min下,考察不同通气量对发光菌生长和发光的影响。结果显示,通气量为0.5 vvm时的菌体生长发光水平最佳,最高可达2 000 m V,高于通气量分别为0.2 vvm和0.4 vvm时的比发光度值。
(3)进一步在5 L发酵罐中探索稀释率对明亮发光杆菌连续培养的影响。得到最适稀释率为0.10 h-1,此条件下菌体比发光度可达到1 000 m V。在最佳培养条件:稀释率0.10 h-1,转速200 r/min、温度18℃、通气量0.5 vvm、p H 7.0时对发光杆菌进行3次连续培养。在培养过程中,主要参数变化相对稳定,菌体生长发光状况良好,菌体比发光度可维持在700 m V以上,培养时间最短为8 d,最长可达12 d,能够满足水质连续监测的需要,可进一步用于实践之中。
[1] ZENG Yang,FU Xiu’e,REN Zongming.The effects of
residual chlorine on the behavioral responses of daphnia magna in the early warning of drinking water accidental events[J].Procedia Environmental Sciences,2012,13:71-79.
[2] JOANA R A,CARLOS G,LUCIA G.Challenges in assessing the toxic effects of polycyclic aromatic hydrocarbons to marine organisms:A case study on the acute toxicity of pyrene to the european seabass(Dicentrarchus labrax L.)[J].Chemosphere,2012,86(9):926-937.
[3] MAGER E M,ESBAUGH A J,BRIX K V,et al.Influences of water chemistry on the acute toxicity of lead to Pimephales promelas and Ceriodaphnia dubia[J].Comparative Biochemistry and Physiology:Part C.Toxicology& Pharmacology,2011,153(1):82-90.
[4] TON S S,CHANG S H,HSU L Y,et al.Evaluation of acute toxicity and teratogenic effects of disinfectants by Daphnia magna embryo assay[J].Environmental Pollution,2012,168:54-61.
[5] FARRE M,BARCELO D.Toxicity testing of wastewater and sewage sludge by biosensors,bioassays and chemical analysis [J].Trends in Analytical Chemistry,2003,22(5):299-310.
[6] 彭强辉,陈明强,蔡强,等.水质生物毒性在线监测技术研究进展[J].环境监测管理与技术,2009,21(4):12-16.
[7] KIM B,GUM B.A multi-channel continuous water toxicity monitoring system:Its evaluation and application to water discharged from a power plant[J].Environmental Monitoring and Assessment,2005,109(3):156-164.
[8] CHOS S H,GU M B.A portable toxicity biosensor using freeze-dried recombinant bioluminescent bacteria[J]. Biosensors and Bioelectronics,2002,17(5):433-440.
[9] HORSBURGHA M,MARSLIN D P,TURNER N L,et al. On-line microbial biosensing and fingerprinting of water pollutants[J].Biosensors and Bioelectronics,2002,17(6-7):495-501.
[10] WONG K Y,ZHANG Minquan,LI Xiangming,et al.A luminescence-based scanning respirometer for heavy metal toxicity monitoring[J].Biosensors and Bioelectronics,1997,12(2):125-133.[11] CHO J C,PARK K J,IH M H S,et al.A novel continuous toxicity test system using a luminously modified freshwater bacterium[J].Biosensors and Bioelectronics,2004,20(2):338-344.
[12] SEDKY H A,SANG E O.Improved detection of toxic chemicals by Photobacterium phosphoreum using modified Boss medium[J].Journal of Photochemistry and Photobiology B:Biology,2010,101(1):16-21.
[13] POOLEY D T,LARSSON J,JONES G,et al.Continuous culture of photobacterium[J].Biosensors and Bioelectronics, 2004,19(11):1457-1463.
[14] 朱文杰,郑天凌,李伟民.发光细菌与环境毒性检测[M].北京:中国轻工业出版社,2009:118-119.
[15] 刘咏梅,王仲石,王焕章,等.溶解氧控制与发酵过程摄氧率及鸟苷积累的关系[J].华东理工大学学报(自然科学版),2002,28(3):245-248.
[16] STEFANIE S,FRANCISCO G,DAVID L.Bioluminescence of Vibrio fischeri in continuous culture:Optimal conditions for stability and intensity of photoemission[J].Journal of Microbiological Methods,2006,67(2):321-329.
Optimization of Continuous Cultivation for Photobacterium Phosphoreum
JIANG Yuan-yuan1, MENG Qin1, SU Jia-yuan1, LI Pei1,
GUO Mei-jin2, FENG Yao-yu1
(1.State Environmental Protection Key Laboratory of Environmental Risk Assessment and Control on Chemical Process,School of Resources and Environmental Engineering;
2.School of Biotechnology,East China University of Science and Technology,Shanghai 200237,China)
The detection of water toxicity by bioluminescent bacterium was restricted because the stability of commercially available lyophilized powder varied among different batches and long resuscitation time.The cultivation of Photobacterium phosporeum was scaled up from shake flask to 5 L fermenter in order to obtain bacteria with stable luminosity.The optimum culture conditions in shake flask were as follows:18℃,p H 7.0,rotation speed 200 r/min and inoculation amount 2%,under which the specific luminosity can reach 2 500 m V.In 5 L fermenter,the optimum conditions were as follows:rotation speed 200 r/min,aeration rate 0.5 vvm and dilution rate 0.10 h-1,under which the specific luminosity during the continuous cultivation ranged from 500 m V to 1 000 m V in several batches,and the continuous cultivation was maintained for about 10 d.
uminescent bacteria;shake-flask culture;continuous culture;optimum conditions
X172
A
1006-3080(2016)01-0048-06 DOI:10.14135/j.cnki.1006-3080.2016.01.008
2015-05-08
国家科技部水污染控制与治理科技重大专项(2014ZX07104006);生物反应器国家重点实验室“十二五”自主研究课题(2060204)
蒋媛媛(1990-),女,安徽芜湖人,硕士生,从事环境微生物研究。E-mail:jiangyuanyuan415@foxmail.com
冯耀宇,E-mail:yyfeng@ecust.edu.cn

