一类具有高水合常数的钆类核磁共振成像造影剂的研究
郝士婧, 熊儒琳, 程丽坤, 胡爱国(华东理工大学材料科学与工程学院,上海市先进聚合物材料重点实验室,上海 200237)
一类具有高水合常数的钆类核磁共振成像造影剂的研究
郝士婧, 熊儒琳, 程丽坤, 胡爱国(华东理工大学材料科学与工程学院,上海市先进聚合物材料重点实验室,上海 200237)
合成了一类具有高水合常数(q)的钆类造影剂,该类配合物由金属钆与含有2个氮氧化基团和4个羧酸基团的有机配体组成,具有高水合常数的特点。通过核磁氢谱、碳谱以及高分辨质谱对配体及配合物的结构进行了表征。通过荧光寿命分析检测配合物的q值在3左右。该类配合物的纵向弛豫率(r1)为8.5~10.1(m M)-1·s-1,约为商用造影剂二乙三胺五乙酸合钆(Gd-DTPA)的3倍。细胞实验证实该类造影剂具有很低的细胞毒性,这在临床应用中是非常关键的。该类配合物具有合成简便、弛豫率高以及毒性低等特点,为制备更低成本、更高性能的造影剂打下基础。
氮氧化合物;钆(Ⅲ)配合物;核磁共振成像造影剂;纵向弛豫率;水合常数
核磁共振成像技术(Magnetic Resonance Imaging,MRI)具有强大的成像能力和对人体无害的特性,是一种非常重要的医学诊断工具[1]。人体中有很多可用于MRI的磁性核,如1H、13C、19F、23Na、31P、27Al等。因为氢质子有比较高的磁旋比,而且人体内含有大量的氢质子(水),因此用于医学诊断的人体成像通常选用氢质子的核磁共振。不过MRI的敏感性和组织分辨率并不高,在多数情况下需要在被检测对象中注射入一类能改变氢质子弛豫时间的物质,这种物质被称为MRI造影剂(Contrast Agent,CA)。当前的造影剂多为钆类造影剂,是一类由金属钆(Ⅲ)离子与有机配体形成的配合物。
科学界对钆类造影剂的进一步开发研究主要针对以下3个方面:提高造影剂弛豫率(r1)[2-4];改善造影剂分子的水溶性[5-6];提高造影剂的器官或肿瘤特异性[7-9]。目前提高造影剂弛豫率的方法是MRI造影剂研究的主流方向。根据SBM(Solomon-Bloembergen-Morgan)理论[10],增大钆(Ⅲ)配合物的旋转相关时间τR、减小结合水分子的停留时间τM以及增加造影剂的水合常数q,都是提高造影剂弛豫率的有效方法。金属钆(Ⅲ)离子拥有8~9个配位点。在目前的商用造影剂如二乙三胺五乙酸合钆(Gd-DTPA)中,配体分子占据钆(Ⅲ)离子的8个配位点,留下一个配位点与水分子形成配位,所以水合常数q值为1。人们可以通过设计合成新结构的有机配体,使得配体分子只占据钆(Ⅲ)离子少量的配位点,留出足够的空间以容纳更多的配位水分子,从而提高水合常数q。
Tóth等[11]研究合成的化合物[Gd(do3a)(H2O)2]是对q值为2的钆类造影剂的第一次尝试。Tóth和Merbach等[12-14]后来又研制出配体为DTTA的一类配合物,Aime等[15]设计合成了配体为AAZTA的一类配合物,Raymond等[16-17]设计合成了一类配体为HOPO的配合物,他们所设计合成的钆类配合物的水合常数均为2,这些配合物的r1值介于7~10(mM)-1·s-1,约是商用造影剂弛豫率的2倍。
本文设计合成一类具有桥联氮氧基团和羧基基团的小分子配体,该配体与金属钆离子形成6个配位键,理论上为钆(Ⅲ)离子留下2~3个配位点与水分子形成配位,得到一类水合常数q>1的小分子配合物。
氮氧基团是一种两性离子(zwitterion),具有很好的亲水性和对无机离子的配位能力。如果分子内同时还具有亲油基团就可以形成一种非离子型表面活性剂。Zinner和Vicentini等[18-22]报道了大量的镧系金属与氮氧化合物的配合物,Feng[23-24]、Bayot[25]以及Zhou等[26]也相继报道了氮氧化合物与镧系金属形成配合物的结构,其中金属离子和氮氧基团中的氧原子形成配位的配位方式得到证实。
本文设计合成的配合物是金属钆离子与配体分子通过4个羧基基团和2个氮氧基团形成配位,其理想结构在1.2节示出。所设计合成的氮氧化乙二胺四乙酸(EDTAO2)、氮氧化丙二胺四乙酸(PDTAO2)、氮氧化丁二胺四乙酸(BDTAO2)和氮氧化间苯二甲胺四乙酸(BDATAO2)为配体的钆(Ⅲ)配合物,有高的水合常数和弛豫率。
1 实验部分
1.1主要试剂和仪器
乙二胺四乙酸:国药集团化学试剂有限公司;1,3-丙二胺、1,4-丁二胺、氢氧化钠、溴乙酸叔丁酯、三氟乙酸(TFA):国药集团化学试剂有限公司;乙腈、碳酸钾、无水乙醚、冰醋酸、中性氧化铝(200~300目,即75~48μm):上海凌峰化学试剂有限公司;乙醇、间苯二甲胺,苏州晶协高新电子材料有限公司;氘代二甲基亚砜(DMSO-d6)、氘代水(D2O)、氘代氯仿(CDCl3):J&K化学试剂公司;六水合氯化钆、六水合氯化铕:Alfa Aesar化学试剂公司。
Ultra Shield 400 spectrometer型核磁共振仪(NMR):美国Bruker公司;LCT Premier XE spectro-meter型质谱:Waters公司;IRIS 1000、Varian 710ES组合型等离子吸收光谱(ICP-AES):美国热电公司;GE SIGNA EXCITE 1.5T型GE MRI仪:美国通用电气医疗集团。MRI的纵向驰豫时间T1,测试条件:在室温下,采用反转恢复序列进行测试;具体参数为:重复间隔时间(TR)为1 600 ms,回波时间(TE)为9 ms,反转时间(TI)为50、100、200、300、400、600、700、900、1 200、1 500 ms,视场(FOV)为150 mm×150 mm,Matrix为128× 128,层厚为2 mm,最后采用MISTAR软件(Apollo Medical Imaging Technology Pty Ltd.,Australian)进行数据分析。
1.2钆(Ⅲ)配合物的合成
本文设计合成的化合物的合成步骤如图1所示。
化合物1a[25]:称取乙二胺四乙酸(5.8 g,0.02 mol)溶解于乙酸(30 m L)中,加入质量分数为30%的过氧化氢水溶液(50 m L),室温下搅拌反应72 h。停止反应后于55℃下减压蒸馏以除去溶剂和水,用超纯水(10 m L)溶解粗产物,加热至60℃滴加乙醇,至溶液稍有浑浊时停止滴加,将溶液冷却至室温并置入冰箱,有白色粉末状固体析出,得到产物氮氧化乙二胺四乙酸(5.49 g),产率为86%。1HNMR(400 MHz,D2O,δ):4.54(s,4H),4.35(d,J=16.1 Hz,8 H);13C-NMR(100 MHz,D2O,δ):168.5,64.8,57.5;HRMS(ESI-):m/z calcd.for C10H11N2O10-(M-H)-,323.073 2,found:323.073 3。
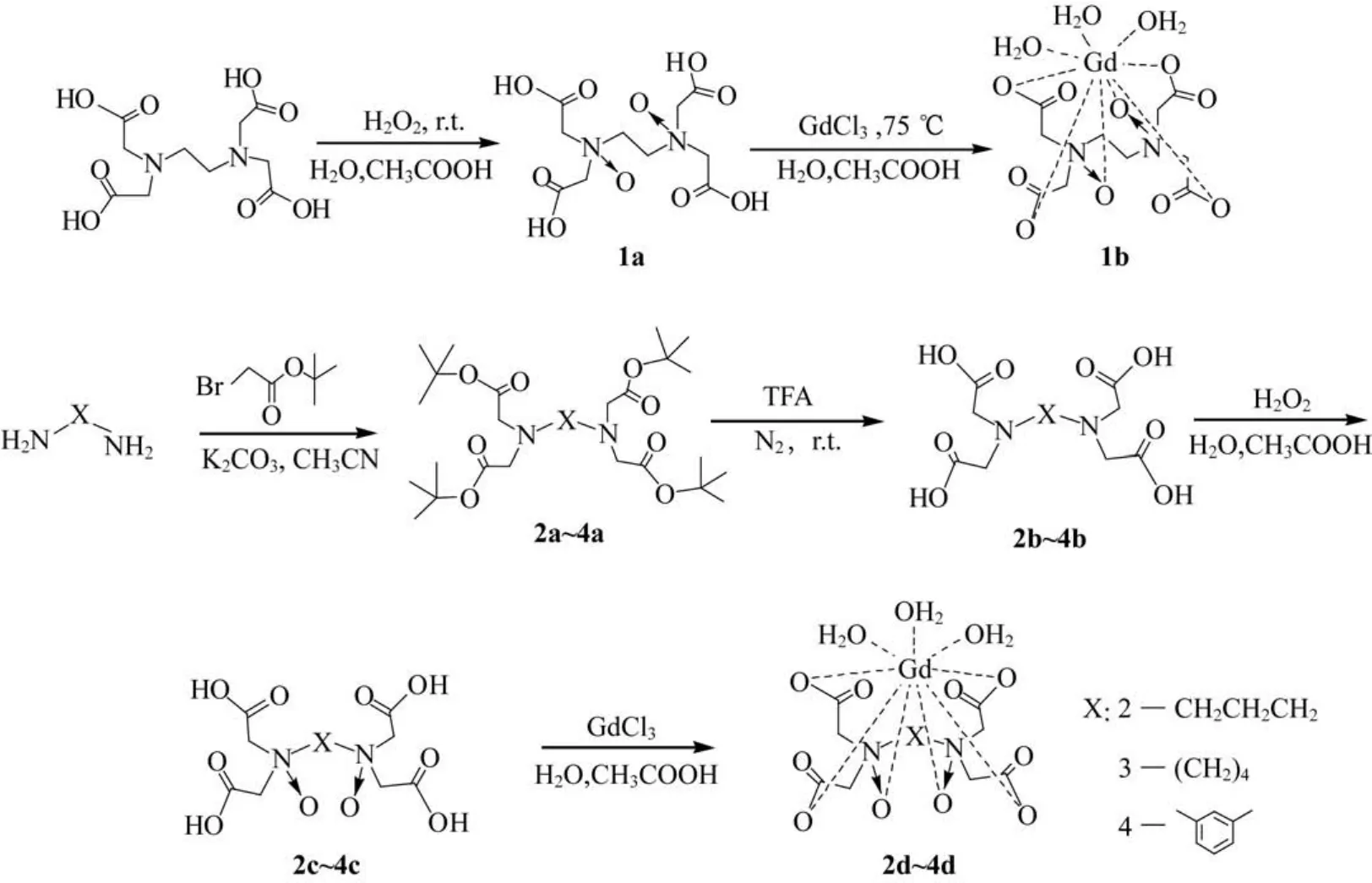
图1 钆(Ⅲ)配合物的合成路线Fig.1 Synthesis routes of Gd(Ⅲ)complexes
化合物2a:用乙腈(20 mL)溶解1,3-丙二胺(1 g,0.014 mol),加入研细的碳酸钾(24 g),并升温至40℃。逐滴加入溴乙酸叔丁酯(11.5 g,0.059 mol),滴加完毕后于40℃下反应3 d。反应完毕后过滤除去碳酸钾,旋蒸除去溶剂,得到黄色油状物。用二氯甲烷(20 mL)溶解油状物后再次过滤除去残余的碳酸钾,旋蒸去除溶剂后得到棕黄色油状物1,3-丙二胺四乙酸叔丁酯(6.11 g),产率为85%。1H-NMR(400 MHz,CDCl3,δ):3.36(s,8H),2.68(t,4H),1.41(s,2H),1.38(s,36H);13C-NMR(100 MHz,CDCl3,δ):168.7,78.9,53.8,50.1,26.3,25.9;HRMS(ESI+):m/z calcd.for C27H51N2O8+(M+H)+,531.362 2,found:531.365 7。
化合物3a、4a的合成方法与化合物2a相同,初始原料分别为1,4-丁二胺和间苯二甲胺。
化合物3a:黄色油状物,产率为79%。1H-NMR(400 MHz,CDCl3,δ):3.42(s,8H),2.69 (t,4H),1.46(s,36H),1.49(m,4 H);13C-NMR (100 MHz,CDCl3,δ):170.2,72.9,56.7,51.1,28.2,27.9;HRMS(ESI+):m/z calcd.for C27H51N2O8+(M+H)+,545.382 3,found:545.386 2。
化合物4a:黄色油状物,产率为81%。1H-NMR(400 MHz,CDCl3,δ):7.2~7.3(m,4H),3.87(s,4H),3.40(s,8H),1.45(s,36H);13C-NMR(100 MHz CDCl3,δ):168.7,136.9,128. 1,126.7,79.1,55.8,26.5;HRMS(ESI+):m/z calcd.for C32H53N2O8+(M+H)+,593.382 3,found:593.386 2。
化合物2b:取上步反应产物1,3-丙二胺四乙酸叔丁酯(4.56 g,8.6 mmol),将其转入50 mL shlenk瓶并抽真空换氮气3次后,用注射器加入三氟乙酸(15 m L),在常温下搅拌,溶液呈橙黄色。反应12 h后旋蒸除去三氟乙酸,用40 mL乙醚洗涤粗产物,过滤得到白色固体1,3-丙二胺四乙酸(2.02 g),产率为77%。
化合物3b、4b的合成方法与2b相同,分别使用化合物3a,4a为反应物,产率分别为65%,84%。
化合物2c:称取1,3-丙二胺四乙酸(3.26 g,11 mmol)溶解于乙酸中(30 m L),加入质量分数为30%的过氧化氢水溶液(50 m L),室温下搅拌反应72 h。停止反应后于55℃下减压蒸馏除去溶剂和水,用超纯水(10 m L)溶解粗产物,加热至60℃,滴加乙醇至溶液稍有浑浊后停止滴加,将溶液冷却至室温并置入冰箱,析出白色粉末状固体,得到产物氮氧化-1,3-丙二胺四乙酸(2.27 g),产率为63%。1H-NMR(400 MHz,DMSO-d6,δ):4.25(d,J=15.8 Hz,8 H),3.82(t,4H),2.29(m,2 H);13C-NMR(100 MHz,DMSO-d6,δ):165.8,62.9,38.6,16.4;HRMS(ESI-):m/z calcd.forC11H17N2O-10(M-H)-,337.088 9,found:337.089 3。
化合物3c、4c的合成方法与2c相同,分别使用化合物3b、4b为反应物。
化合物3c:白色固体,产率为71%。1H-NMR (400 MHz,DMSO-d6,δ):4.25(d,J=15.7 Hz,8H),3.70(t,4 H),1.78(m,4 H);13C-NMR(100 MHz,DMSO-d6,δ):165.6,64.8,62.6,18.7;HRMS(ESI-):m/z calcd.for C12H19N2O-10(M-H)-,351.104 5,found:351.103 7。
化合物4c:白色固体,产率为81%。1H-NMR (400 MHz,NaOD,D2O,δ):7.20~7.31(m,4 H),4.50(s,4 H),3.85(d,J=15.6 Hz,8 H);13C-NMR (100 MHz,NaOD,D2O,δ):171.2,137.4,133.7,129.5,128.3,69.4,66.3;HRMS(ESI+):m/z calcd.for C16H21N2O+10(M+H)+,401.120 0,found:401.120 0。
化合物2d:称取上步反应产物氮氧化-1,3-丙二胺四乙酸(0.338 g,1 mmol),用超纯水(10 m L)和乙酸(0.5 m L)溶解,升温至75℃搅拌。称取六水合氯化钆(0.409 g,1.1 mmol)溶于超纯水(2 m L)中,用注射器缓慢逐滴加入体系。75℃下搅拌反应72 h,反应结束后于55℃下减压蒸馏除去溶剂,得到白色固体,再次用超纯水溶解并于55℃下减压蒸馏除去溶剂,反复两次操作。用超纯水(8 m L)溶解粗产物,再用1 mol/L氢氧化钠溶液调节p H至8左右,过滤除去不溶物,滤液加热至50℃,滴加乙醇至溶液稍有浑浊,将溶液冷却至室温并置入冰箱,有白色粉末状固体析出,为氮氧化-1,3-丙二胺四乙酸的钆配合物,产率为93%。
化合物1b、3d、4d的合成方法与2d相同,分别使用化合物1a、3c、4c为反应物,合成产物均为白色固体,产率分别为92%、94%、93%。配合物1b、2d、3d、4d的钆离子质量分数依次为23%、22%、22%和22%。
1.3水合常数q值的测定
将等质量的氮氧化二胺四乙酸铕(Ⅲ)配合物分别溶解在氘代水和水的混合溶剂(氘代水与水的质量比分别为2∶8,4∶6,5∶5,6∶4,8∶2)以及纯水中(配合物浓度为5 mmol/L),采用Bio Tek SynergyTMHT多功能酶标仪,在395 nm的激发波长下激发不同溶剂中的铕(Ⅲ)配合物,并以50μs为间隔检测发射波长为616 nm处的衰变荧光强度,得到配合物在不同溶剂中的荧光衰减曲线,拟合得出其荧光寿命。
1.4细胞毒性实验
1.4.1细胞计数传代实验 把培养液和胰酶放入传递窗中预热,同时将废液缸和磷酸缓冲盐溶液(PBS)置入超净台,用紫外灭菌20~30 min(始终保持台面干净)。将细胞从培养箱中取出置入传递窗中。把培养瓶中的液体倒去,用PBS冲洗培养瓶2~3次。取适量胰酶,加入培养瓶中,平行轻摇培养瓶,使得胰酶可以摇晃到整个瓶壁,然后小心倒去胰酶(瓶口需要过火处理)。
培养培养瓶中余下的胰酶消化细胞,当观察到瓶壁上的细胞将要脱落或已经脱落时,就加入培养液以终止消化。用10 m L移液管吸取培养瓶中的液体,并小心吹打瓶壁,吹打干净后将培养液移入10 m L离心管中,离心,倒掉上清液。然后再次加入新鲜的培养液重悬。量取30μL细胞悬液,滴入之前洗净除菌过的细胞计数板,盖上盖玻片,在显微镜下观察计数。
1.4.2贴壁细胞MTT(噻唑蓝)实验 将正处于对数生长期的MGC80-3细胞以每孔3 000个细胞的密度接种到96孔板中,置于Thermo Fisher CO2培养箱中进行贴壁培养。
将氮氧化乙二胺四乙酸、氮氧化-1,3-丙二胺四乙酸、氮氧化-1,4-丁二胺四乙酸和氮氧化间苯二甲胺四乙酸为配体的钆(Ⅲ)配合物配制成一定浓度的溶液,过滤消毒,然后用培养液稀释样品至相应的浓度梯度,每种配合物浓度梯度均为200、150、100、80、60、40μmol/L。
待细胞贴壁24 h后,将孔板中的培养液除去,把按浓度稀释好的钆(Ⅲ)配合物溶液加入孔板中。同样将参照空白在CO2培养箱中孵育相同的时间。每一种样品需要分别培养12、24、48 h,孵育完后孔板中每孔加入MTT试剂,继续培养4 h,MTT与细胞完全反应后取出孔板,小心移除培养液,再在每孔中加入二甲基亚砜(DMSO)溶液,室温下静置10 min,将孔板放在酶标仪中振荡30 s。检测492 nm波长处每孔的吸光度值。
细胞活力以实验组与对照组吸光度的相对分数表示。使用Nikon TS100倒置光学显微镜进行细胞计数。
2 结果与讨论
2.1造影剂分子水合常数(q值)
水合常数的测定通常使用与钆相邻的稀土元素铕的配合物,由于二者有几乎相同的荷质比,离子半径也相差无几,可以认为所形成的配合物的结构也非常相似。铕(Ⅲ)配合物有较长的荧光寿命,并且发射波长在可见光范围内。科学家常用铕(Ⅲ)配合物对化合物的荧光性质进行分析[27-28]。通过测试铕(Ⅲ)配合物在不同溶剂中的荧光寿命可以拟合出其水合常数。在本工作中,我们采用与2d相同的合成方法,使用六水合氯化铕代替六水合氯化钆,合成了所有的金属铕(Ⅲ)配合物类似物。以化合物在不同质量比溶剂中的荧光寿命的倒数对溶剂质量比作图,外推法得到化合物在纯氘代水中的荧光寿命,带入公式(1)[28],即得到铕(Ⅲ)配合物的水合常数q。
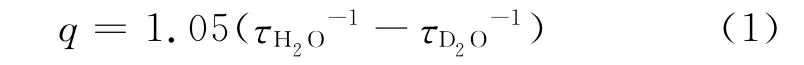
式中τH2O-1和τD2O-1分别为铕(Ⅲ)配合物在纯水和纯氘代水环境下荧光寿命的倒数。
图2显示了氮氧化乙二胺四乙酸铕配合物在不同质量比溶剂中的荧光衰减曲线,通过软件分别拟合得出其对应的荧光寿命,并用外推法得到配合物在纯氘代水中的荧光寿命,代入公式(1)得到配合物水合常数q。几种配合物的荧光寿命和水合常数列于表1。实验结果显示这4种配合物的q值为2.92~3.22,符合实验设计(图1)。
2.2造影剂分子弛豫率的研究
核磁共振成像实验后,将得到的图像通过像素与信号的指数关系进行分析,通过平均每个样品中心的至少45个像素计算出纵向弛豫时间(t1),对1/t1与钆浓度作图(图3),并对这些散点图进行线性拟合,所得的斜率即为弛豫率r1。
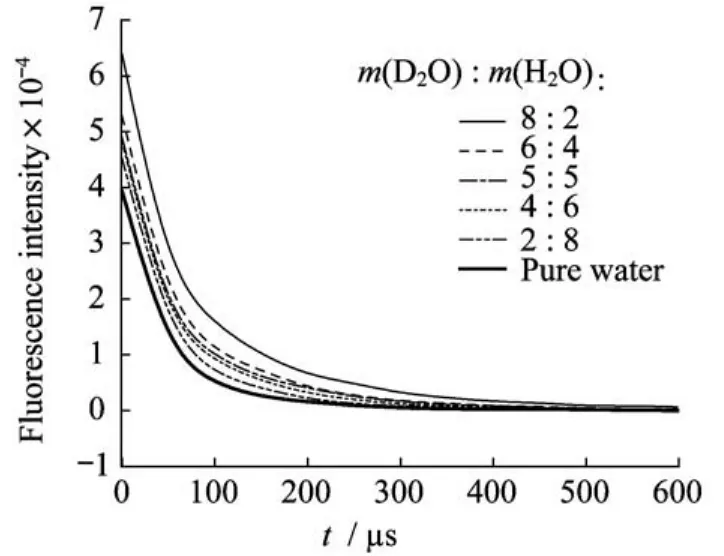
图2 氮氧化乙二胺四乙酸铕配合物在不同溶剂中的荧光衰减曲线Fig.2 Fluorescence decay curves of Eu-EDTAO2in different solvents
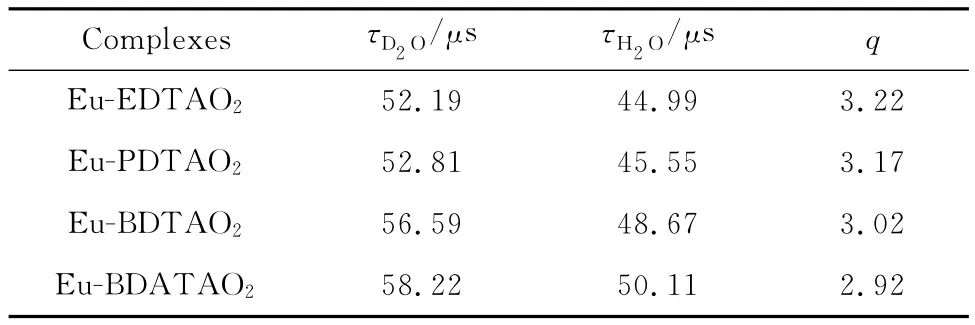
表1 铕配合物的荧光寿命和水合常数Table 1 Luminescence lifetimes and hydration numbers of the Eu-complexes
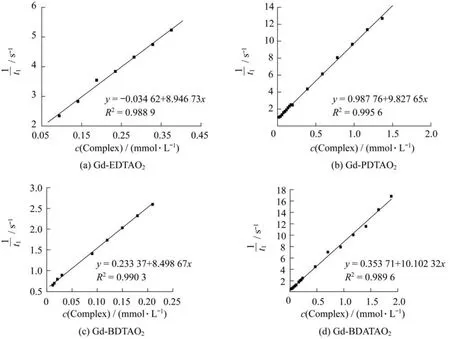
图3 Gd-EDTAO2,Gd-PDTAO2,Gd-BDTAO2,Gd-BDATAO2纵向弛豫率曲线Fig.3 r1curves of Gd-EDTAO2,Gd-PDTAO2,Gd-BDTAO2and Gd-BDATAO2
如图3所示,由线性拟合得到配合物弛豫率r1,4种钆(Ⅲ)配合物的弛豫率依次为8.9,9.8,8.5,10.1(m M)-1·s-1。在同样的配位和成像条件下商用造影剂Gd-DTPA的弛豫率为3.2(m M)-1· s-1。4种新的钆(Ⅲ)配合物的弛豫率是商用造影剂的2~3倍,实现了提高造影剂弛豫率的目的。此外,结合弛豫率结果和SBM理论,我们所设计合成的小分子造影剂的水合常数q为2~3,与2.1节荧光寿命测试结果相吻合。
2.3配合物的细胞毒性
经过细胞计数传代实验和贴壁细胞MTT实验后,细胞活力以实验组与对照组吸光度的相对分数表示。图4显示了4种钆(Ⅲ)的细胞毒性检测结果。从细胞毒性图可以看出,这4种钆(Ⅲ)配合物即使当浓度达到200μmol/L时,MGC80-3细胞的存活率仍然超过了85%。由此可见,本工作中合成的4种小分子造影剂的确具有很低的细胞毒性,为今后其在生物体中的应用奠定了基础。
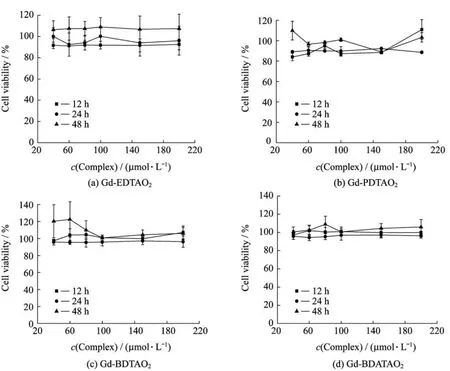
图4 不同浓度的Gd-EDTAO2,Gd-PDTAO2,Gd-BDTAO2和Gd-BDATAO2配合物存在下MGC80-3细胞的细胞活力Fig.4 Relative cell viability of MGC80-3 cells obtained in the presence of Gd-EDTAO2,Gd-PDTAO2,Gd-BDTAO2and Gd-BDATAO2complexes
3 结 论
本文设计合成了4种氮氧化小分子配体,并形成相应的钆(Ⅲ)配合物,包括氮氧化乙二胺四乙酸钆配合物(Gd-EDTAO2)、氮氧化丙二胺四乙酸钆配合物(Gd-PDTAO2)、氮氧化丁二胺四乙酸钆配合物(Gd-BDTAO2)和氮氧化间苯二甲胺四乙酸钆配合物(Gd-BDATAO2)。它们均有较高的水合常数(q≈3)和比商用造影剂更高的弛豫率(r1为8.5~10.1(m M)-1·s-1)。通过细胞实验说明了我们设计合成的这类化合物的细胞毒性低。此类造影剂的合成过程相对简单,有利于未来的产业化。本文的工作为未来更优质的造影剂的研究提供了新的思路。
[1] HERMANN P,KOTEK J,KUBICEK V,et al.Gadolinium(Ⅲ)complexes as MRI contrast agents:Ligand design and properties of the complexes[J].Dalton Transactions,2008,21 (23):3027-3047.
[2] MOULA KARIMDJY M,TALLEC G,FRIES P H,et al. Confinement of a tris-aqua Gd(Ⅲ)complex in silica nanoparticles leads to high stability and high relaxivity andsupresses anion binding[J].Chemical Communications,2015,51(31):6836-6838.
[3] CHEN Yingying,ZHU Qiu,TIAN Yu,et al.Supramolecular aggregates from polyacrylates and Gd(Ⅲ)-containing cationic surfactants as high-relaxivity MRI contrast agents[J]. Polymer Chemistry,2015,6(9):1521-1526.
[4] CHEN Yingying,ZHU Qiu,CUI Xinghui,et al.Preparation of highly efficient MRI contrast agents through complexation of cationic Gd(Ⅲ)-containing metallosurfactant with biocompatible polyelectrolytes[J].Chemistry,2014,20(39):12477-12482.
[5] ANDOLINA C M,KLEMM P J,FLOYD W C,et al.Analysis of lanthanide complex dendrimer conjugates for bimodal NIR and MRI imaging[J].Macromolecules,2012,45(22):8982-8990.
[6] GLOGARD C,HOVLAND R,FOSSHEIM S L,et al. Synthesis and physicochemical characterisation of new amphiphilic gadolinium DO3A complexes as contrast agents for MRI[J].Journal of the Chemical Society,Perkin Transactions 2,2000,2(5):1047-1052.
[7] LIU Qiuming,CHEN Shuai,CHEN Jing,et al.An asymmetrical polymer vesicle strategy for significantly improving T1 MRI sensitivity and cancer-targeted drug delivery[J].Macromolecules,2015,48(3):739-749.
[8] MA Xuehua,GONG An,XIANG Lingchao,et al. Biocompatible composite nanoparticles with large longitudinal relaxivity for targeted imaging and early diagnosis of cancer [J].Journal of Materials Chemistry B,2013,1(27):3419-3428.
[9] BRYSON J M,REINEKE J W,REINEKE T M. Macromolecular imaging agents containing lanthanides:Can conceptual promise lead to clinical potential?[J]. Macromolecules,2012,45(22):8939-8952.
[10] LAUFFER R B.Paramagnetic metal complexes as water proton relaxation agents for NMR imaging:Theory and design [J].Chemical Reviews,1987,87(5):901-927.
[11] TóTHÉ,DHUBHGHAILL O M N,BESSON G,et al. Coordination equilibrium——A clue for fast water exchange on potential magnetic resonance imaging contrast agents?[J].Magnetic Resonance in Chemistry,1999,37(10):701-708.
[12] LIVRAMENTO J B,TOTH E,SOUR A,et al.High relaxivity confined to a small molecular space:A metallostarbased,potential MRI contrast agent[J].Angewandte Chemie-International Edition,2005,44(10):1480-1484.
[13] RULOFF R,VAN KOTEN G,MERBACH A E.Novel heteroditopic chelate for self-assembled gadolinium(Ⅲ)complex with high relaxivity[J].Chemical Communications,2004(7):842-843.
[14] LIVRAMENTO J B,SOUR A,BOREL A,et al.A starburstshaped heterometallic compound incorporating six densely packed Gd3+ions[J].Chemistry,2006,12(4):989-1003.
[15] GIANOLIO E,GIOVENZANA G B,LONGO D,et al. Relaxometric and modelling studies of the binding of a lipophilic Gd-AAZTA complex to fatted and defatted human serum albumin[J].Chemistry,2007,13(20):5785-5797.
[16] RAYMOND K N,FLOYD W C,KLEMM P J,et al. Conjugation effects of various linkers on Gd(Ⅲ)MRI contrast agents with dendrimers:Optimizing the hydroxypyridinonate(HOPO)ligands with nontoxic,degradable esteramide(EA)dendrimers for high relaxivity [J].Journal of the American Chemical Society,2011,133(8):2390-2393.
[17] PIERRE V C,BOTTA M,AIME S,et al.Substituent effects on Gd(Ⅲ)-based MRI contrast agents:Optimizing the stability and selectivity of the complex and the number of coordinated water molecules[J].Inorganic Chemistry,2006,45(20):8355-8364.
[18] BEZERRA R F,MELO D M A,VICENTINI G,et al. Addition compounds between 4-methylmorpholine-N-oxide (MMNO)and some lanthanides(Ⅲ)and yttrium(Ⅲ)nitrates[J].Journal of Alloys and Compounds,2002,344(1/ 2):120-122.
[19] FERNANDES L C,MATOS J R,ZINNER L B,et al.Crystal structures,spectroscopic,TG and DSC studies of lanthanide picrate complexes with 4-methylmorpholine N-oxide(MMNO)[J].Polyhedron,2000,19(22/23):2313-2318.
[20] MARINHO E P,MELO D M A,ZINNER L B,et al. Hydrated neodymium(Ⅲ)and europium(Ⅲ)picrate complexes with pyrazine-N-oxide[J].Journal of Alloys and Compounds,2000,303/304:116-120.
[21] FANTIN C A,ALVARENGA M G,ZINNER L B,et al. Synthesis,characterization,and thermal behavior of the addition compounds of rare earths dichloracetates and quinoline-N-oxide(QNO)[J].Journal of Alloys and Compounds,2004,374(1/2):362-365.
[22] ALVARENGA M G,ZINNER L B,FANTIN C A,et al. Preparation and characterization of uranyl complexes with three isomeric methyl-pyridine-N-oxide ligands[J].Journal of Alloys and Compounds,2004,374(1/2):258-260.
[23] LIU Xiaohua,LIN Lili,FENG Xiaoming.Chiral N,N’-dioxides:New ligands and organocatalysts for catalytic asymmetric reactions[J].Accounts of Chemical Research,2011,44(8):574-587.
[24] FENG Juhua,FU Xuan,CHEN Zhenling,et al.Efficient enantioselective synthesis of dihydropyrans using a chiral N,N’-dioxide as organocatalyst[J].Organic Letters,2013,15(11):2640-2643.
[25] BAYOT D,TINANT B,DEVILLERS M.Spectroscopic and structural characterizations of novel water-soluble tetraperoxo and diperoxo[polyaminocarboxylato bis(N-oxido)]tantalate (V)complexes[J].Inorganic Chemistry,2004,43(19):5999-6005.[26] JIANG Xue,CHEN Maolong,YANG Yuchen,et al. Formation and catalytic activity of novel water soluble di[ethylenediaminetetraacetato bis(N-oxido)]lanthanides [J].Inorganic Chemistry Communications,2013,35:9-12.
[27] CURMAN D,ZIVEC P,LEBAN I,et al.Spectral properties of Eu(Ⅲ)compound with antibacterial agent ciprofloxacin (cfq H).Crystal structure of[Eu(cfq H)(cfq)(H2O)(4)]Cl-2 center dot 4.55H2O[J].Polyhedron,2008,27(5):1489-1496.
[28] BEEBY A,CLARKSON I M,DICKINS R S,et al.Nonradiative deactivation of the excited states of europium,terbium and ytterbium complexes by proximate energymatched OH,NH and CH oscillators:An improved luminescence method for establishing solution hydration states[J].Journal of the Chemical Society,Perkin Transactions,1999,2(3):493-503.
A New Type of Magnetic Resonance Imaging Contrast Agents with High Hydration Numbers
HAO Shi-jing, XIONG Ru-lin, CHENG Li-kun, HU Ai-guo
(Shanghai Key Laboratory of Advanced Polymeric Materials,School of Materials Science and Engineering,East China University of Science and Technology,Shanghai 200237,China)
A series of Gd(Ⅲ)complexes were synthesized and evaluated as potential magnetic resonance imaging(MRI)contrast agents.The ligands of these complexes are featured with two hyphenated amine-N-oxide and four carboxyl groups,providing the complexes with high hydration numbers (q,the number of inner-sphere water molecules).The structures of the ligands and complexes were characterized with1H-NMR,13C-NMR and ESI-MS.Preliminary results on 1.5T MRI measurement of the complexes showed high r1values(longitudinal relaxivity)of 8.5-10.1(m M)-1·s-1.The q value of the complexes was determined as up to 3 with fluorescence lifetime analysis with their Eu(Ⅲ)analogues.Cell tests revealed low cytotoxicity of the complexes,which is essential for clinical applications.The structural simplicity,the high relaxivity and the low toxicity of the complexes provide a new solution for the development of highly efficient MRI contrast agents.
N-oxides;gadolinium complexes;MRI contrast agents;longitudinal relaxivity;hydration numbers
O621.3
A
1006-3080(2016)01-0028-07 DOI:10.14135/j.cnki.1006-3080.2016.01.005
2015-05-05
国家自然科学基金(21274042)
郝士婧(1989-),女,硕士生,主要从事高分子合成研究。E-mail:kimberly1989@163.com
胡爱国,E-mail:hagmhsn@ecust.edu.cn

