落新妇苷对高糖刺激的血管内皮细胞SDF-1α表达的影响*
王可可, 邓雅妍, 赖建鸿, 张帮艳, 黄 琛, 申志华, 姜汉国, 2, 揭 伟,2△
(1广东医学院病理学系,广东 湛江 524023; 2广东医学院附属医院病理诊断与研究中心,广东 湛江 524001;3广东医学院基础医学院病理生理教研室,广东 湛江 524023; 4肇庆市第一人民医院儿科,广东 肇庆 526021)
落新妇苷对高糖刺激的血管内皮细胞SDF-1α表达的影响*
王可可1,2▲, 邓雅妍1,4▲,赖建鸿1,张帮艳1,黄琛1,申志华3,姜汉国1, 2,揭伟1,2△
(1广东医学院病理学系,广东 湛江 524023;2广东医学院附属医院病理诊断与研究中心,广东 湛江 524001;3广东医学院基础医学院病理生理教研室,广东 湛江 524023;4肇庆市第一人民医院儿科,广东 肇庆 526021)
目的: 分析落新妇苷对高糖刺激的血管内皮细胞间质细胞衍生因子1α(SDF-1α)表达的影响。方法: SD大鼠腹腔注射链脲佐菌素后诱导成急性糖尿病模型,采用硫代巴比妥酸法测量血浆丙二醛(MDA)浓度,采用紫外分光光度法检测血浆H2O2浓度,采用免疫荧光检测大鼠胸主动脉内皮细胞中SDF-1α的表达。人脐静脉内皮细胞(HUVECs)经高糖刺激后,用real-time PCR、ELISA和免疫荧光检测SDF-1α的表达,流式细胞术观察细胞周期分布情况,免疫荧光检测p65的表达和细胞内定位。结果: 糖尿病大鼠血浆MDA和H2O2水平均高于正常对照组,其胸主动脉内皮细胞SDF-1α的表达较正常组减弱;落新妇苷能降低糖尿病大鼠血浆MDA及H2O2的水平并增加胸主动脉内皮细胞SDF-1α的表达。体外高糖刺激呈浓度和时间依赖性减少HUVECs中SDF-1α表达,落新妇苷能一定程度地恢复SDF-1α表达。高糖刺激增加HUVECs S期比例,而落新妇苷减少其S期分布。高糖刺激HUVECs中p65蛋白核转位,落新妇苷抑制高糖诱导的p65核转位。结论: 落新妇苷能增加高糖刺激下内皮细胞表达SDF-1α,减少高糖状态下的氧化应激和NF-κB的活化。
高糖; 落新妇苷; 间质细胞衍生因子1α; 人脐静脉内皮细胞
糖尿病是危害人群健康的常见病、多发病。广东省是中国的高发区之一,发病率超过全国平均水平,且年轻化趋势明显[1-2]。糖尿病的一个主要特征就是高血糖症。在长期的高糖刺激下,血管内皮细胞容易受到损伤。而血管内皮细胞内有关信号的活化,进而导致内皮细胞出现分泌细胞因子功能紊乱是糖尿病血管并发症最早期的变化之一。
间质细胞衍生因子1α(stromal cell-derived factor-1α,SDF-1α)主要是由内皮细胞、血管平滑肌细胞等分泌的一种小分子蛋白质。作为一种配体,在具有CXCR4或CCR7受体的细胞迁移及归巢中发挥重要的作用[3]。研究表明,循环SDF-1α表达的减少是糖尿病的重要分子事件[4]。SDF-1α表达减少,将不能保护内皮细胞抗损伤因子,因而内皮细胞易出现凋亡;同时低水平的SDF-1α对循环内皮祖细胞的趋化作用减弱,不能及时修复损伤的内皮细胞。因此,如能改善糖尿病时SDF-1α水平,理论上对糖尿病血管并发症将起到延缓作用。
高糖刺激容易在体液中形成大量活性氧簇(reactive oxygen species,ROS),继而诱导细胞内重要炎症信号通路如p38 MAPK和NF-κB的激活。落新妇苷(astilbin,Ast)是从土茯苓中分离得到的二氢黄酮醇,具有利尿、镇痛、抗炎、抑制免疫排斥、减轻缺血再灌注损伤及抑制动脉粥样硬化发生发展等方面的作用,口服效果好且无明显毒副作用[5-7]。在糖尿病肾病及缺血再灌注肝损伤中起到明显的治疗作用[8-10]。目前国内外均未见有关Ast对SDF-1α表达影响的报道。本项目旨在分析Ast对高糖刺激的血管内皮细胞中SDF-1α表达的影响,为临床糖尿病血管病并发症的防治提供新的科学依据。
材 料 和 方 法
1主要抗体及试剂
羊抗鼠SDF-1α及p65的Ⅰ抗(Santa Cruz);荧光标记Ⅱ抗(武汉三鹰);落新妇苷(成都曼斯特公司);链脲佐菌素(streptozotocin,STZ)购自Sigma;SDF-1α ELISA试剂盒(R&D);RNA抽提试剂盒、RT试剂盒及定量PCR试剂盒(TOYOBO);PCR引物由上海生工公司合成;DMEM培养基、胎牛血清(fetal bovine serum,FBS)购自HyClone;青霉素及链霉素双抗(北京博奥森);H2O2及丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物公司);D-葡萄糖及D-甘露醇(mannitol)为国产分析纯试剂。
2实验动物
雄性SD大鼠22只,体重180~210 g。由广东医学院实验动物中心提供,动物使用许可证号为SYXK(粤)2008-0007。
3主要方法
3.1急性糖尿病大鼠模型复制及处理大鼠分组如下:(1)正常血糖(normoglycemia,NG)组:腹腔一次性注射柠檬酸盐水后正常饮食饮水(n=7);(2)高糖血症(hyperglycemia,HG)组:腹腔一次性注射STZ(pH 4.5,0.1%枸橼酸缓冲液新鲜配制,50 mg/kg)后正常饮食饮水,2周后腹腔注射生理盐水(n=10);(3) Ast干预组:55 mg/kg腹腔一次性注射STZ,2周后再每天腹腔给予Ast(20 mg·kg-1·d-1,生理盐水溶解),正常饮食饮水(n=5)。各组大鼠在给予STZ 72 h后采用断尾取血测血糖值,连续测3 d,以血糖水平≥16.7为糖尿病建模成功。4周时处死大鼠,抽取心室血,分离血浆,分别用硫代巴比妥酸法测量MDA和紫外分光光度法检测H2O2浓度, 具体参考试剂盒说明书进行。胸主动脉冰冻切片后用于免疫荧光检测内皮细胞中SDF-1α的表达。
3.2细胞培养及分组人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自中科院上海细胞所。HUVECs以DMEM培养基(含10% FBS、1×105U/L青霉素和100 mg/L链霉素)常规培养,经免疫组化检测细胞CD31表达以鉴定,细胞汇合后经0.25%胰酶消化,1∶3传代培养,取对数生长期细胞用于相关实验。分组:正常糖浓度(normal glucose,NG)组,DMEM基础培养液含10% FBS,5.5 mmol/L D-葡萄糖;高糖(high glucose,HG)组,DMEM基础培养液含10% FBS,12.5、25或50 mmol/L D-葡萄糖;渗透压对照(Mtol)组,DMEM基础培养液含10% FBS,25 mmol/L D-甘露醇;高糖+落新妇苷(HG+Ast)组,DMEM基础培养液含10% FBS,25 mmol/L D-葡萄糖及25 μmol/L落新妇苷。HUVECs以0.5% FBS的DMEM培养基培养12 h同步化后再进行上述分组处理,于预订时点分别收获细胞与上清用于相关实验。
3.3Real-time PCR检测细胞SDF-1α的mRNA表达TRIzol试剂提取各组细胞总RNA,取1 μg RNA反转录为cDNA,采用real-time PCR检测SDF-1α的mRNA表达。PCR引物序列如下:SDF-1α正义链为5’-GAT TCT TCG AAA GCC ATG TTG-3’,SDF-1反义链为5’-CAC TTT AGC TTC GGG TCA ATG-3’;β-actin正义链为5’-TGA CGT GGA CAT CCG CAA AG-3’,β-actin反义链为5’-CTG GAA GGT GGA CAG CGA GG-3’。采用LightCycler 480 循环仪(Roche)进行PCR循环,总反应体系20 μL,包括10 μL SYBR Green I PCR Master Mix, 0.4 μL 正义链引物 (10 μmol/L), 0.4 μL 反义链引物 (10 μmol/L), 2 μL cDNA 和 7.2 μL dH2O。PCR 扩增条件为95 °C 5 min;95 °C 15 s,60 °C 60 s,共45个循环。目标基因的表达量用2-ΔΔCt法计算。
3.4ELISA检测细胞培养液上清中SDF-1α蛋白的表达各组细胞培养液上清经4 ℃离心后弃去沉渣,取上清用于ELISA测定,具体过程参照试剂盒说明书进行。各组测定A值经标准曲线换算得到浓度值,根据各样本收集的细胞数值进行标准化,结果以μg/L(每104细胞)表示。每组重复3孔。
3.5免疫荧光检测SDF-1α及p65的表达及细胞内定位间接免疫荧光法检测大鼠主动脉冰冻切片内 SDF-1α蛋白的表达,检测HUVECs中SDF-1α及p65蛋白的表达及细胞内定位。细胞爬片及主动脉冰冻切片经0.5% BSA-PBS 37 ℃孵育30 min,PBS洗涤,滴加相应 I 抗,4 ℃冰箱过夜孵育,PBS洗涤,滴加荧光Ⅱ抗后37 ℃避光孵育30 min,DAPI复染细胞核,PBS洗涤后甘油明胶封片,激光共聚焦显微镜(Leica)下观察并拍照。计数6个典型中倍视野,统计p65核表达细胞的百分率。
3.6细胞周期分析上述各组细胞经0.25%胰酶消化,PBS洗涤,75%冷乙醇过夜固定,PBS洗涤后重悬,加入PI和 RNaseA,37 ℃ 温浴30 min,流式细胞仪(BD)测定细胞周期分布。
4统计学处理
数据以均数±标准误(Mean±SEM)表示,用GraphPad Prism 5软件行单因素方差(one-way ANOVA)分析,两两比较采用Student-Newman-Keuls检验。以P<0.05为差异有统计学意义。
结 果
1Ast降低糖尿病大鼠氧化应激并增加血管内皮细胞中SDF-1α的表达
用STZ诱导的急性糖尿病大鼠血浆中H2O2和MAD均高于正常对照组,而Ast治疗组中H2O2和MAD浓度较糖尿病组下降,差异有统计学显著性。同时,免疫荧光结果显示糖尿病组其胸主动脉内皮细胞中SDF-1α表达的荧光信号较正常对照组弱,而Ast治疗组荧光信号得到增强,见图1。
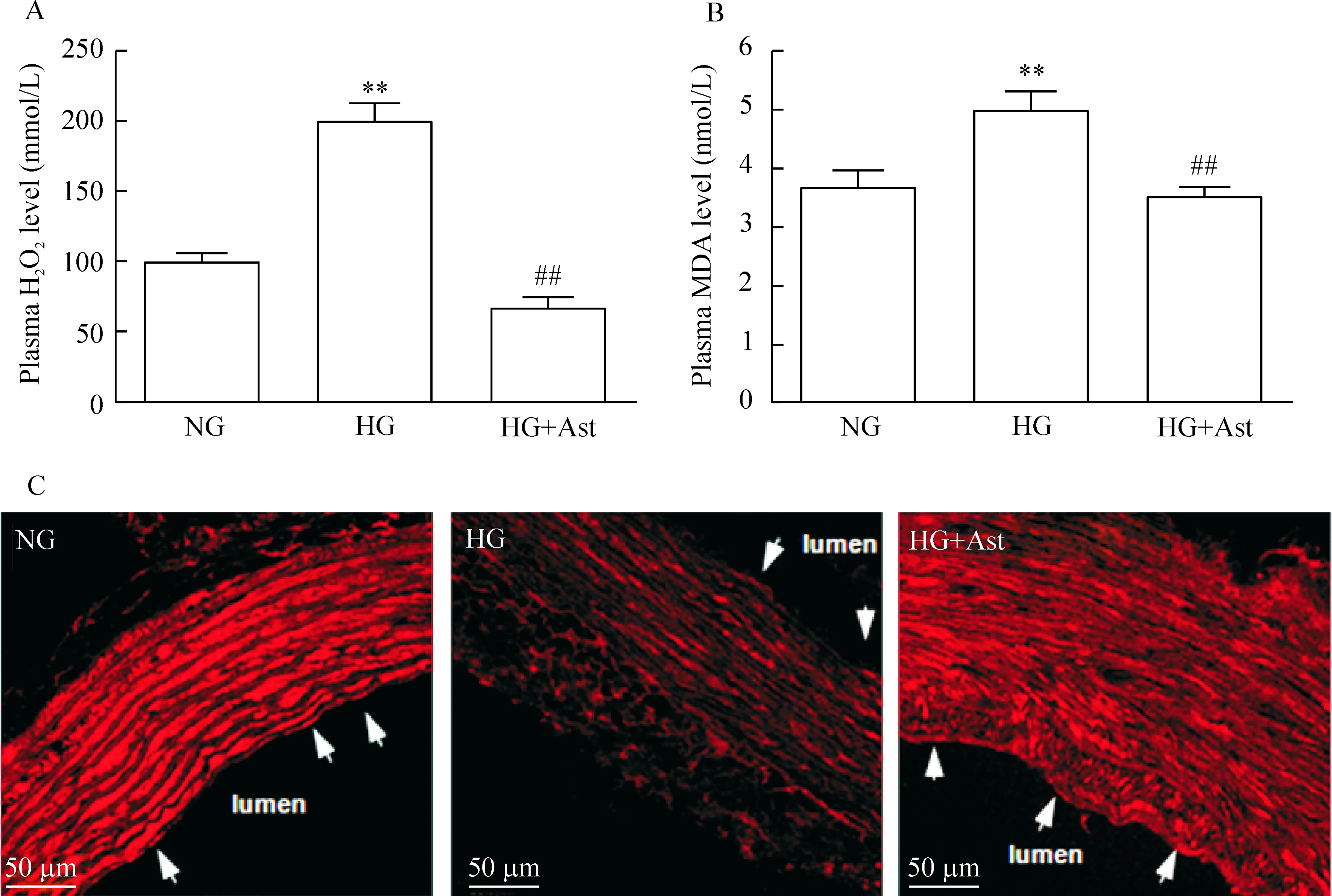
Figure 1.Astilbin (Ast) decreased plasma H2O2and MDA levels and increased SDF-1α expression in diabetic rats. NG: normoglycemia; HG: hyperglycemia. Mean±SEM.n=5~10.**P<0.01vsNG;##P<0.01vsHG.
图1落新妇苷降低糖尿病大鼠血浆ROS,增加主动脉内皮细胞SDF-1α表达
2高糖刺激呈时间及浓度依赖方式下调内皮细胞中SDF-1α mRNA水平
体外用25 mmol/L HG刺激HUEVCs 48 h后其SDF-1α的mRNA水平明显较正常组显著下降,而渗透性对照组中SDF-1α的mRNA水平相对NG组亦有一定程度下降,初步提示HG刺激下调SDF-1α的mRNA不仅与高渗透压有关,又与高糖刺激有关。进一步发现,这种下降呈现葡萄糖浓度依赖和刺激时间依赖的方式,见图2。
3Ast逆转高糖刺激抑制的HUEVCs中SDF-1α的表达
体外实验证实,Ast能上调HG导致的SDF-1α mRNA水平的抑制,见图2;其次,ELISA结果显示,Ast能升高HG组细胞培养上清中分泌的SDF-1α蛋白;最后,免疫荧光结果证实Ast增加HG组内皮细胞胞浆中SDF-1α蛋白的荧光信号强度,见图3。
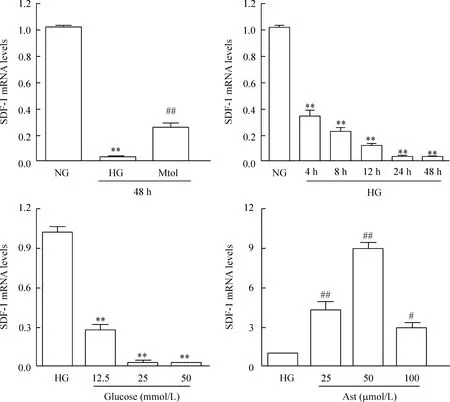
Figure 2.The changes of SDF-1α mRNA levels in HUVECs assessed by real-time RT-PCR. NG: normal glucose (5.5 mmol/L); HG: high glucose (25 mmol/L); Mtol: mannitol (25 mmol/L; osmotic control); Ast: astilbin. Mean±SEM.n=3.**P<0.01vsNG;#P<0.05,##P<0.01vsHG.
图2Real-time PCR检测HUVECs中SDF-1α的mRNA水平
4Ast对高糖条件下HUVECs细胞周期的影响
与NG组比较,HG刺激显著下调HUVECs细胞周期中G1期比值(P<0.01)和上调S期比值(P<0.01),而Ast刺激减少了HG组的S期分布(P<0.05),而G2/M期在NG、HG及Ast组之间差异不明显。与NG组比较,Mtol刺激轻度增加了G1期并轻度减少了S期分布,见图4。
5Ast抑制HUVECs中高糖介导的NF-κB活化
在NG条件下,HUVECs胞质中有少量p65蛋白表达,未见明显p65核定位;单纯高渗透压刺激仅见少许细胞存在p65核定位信号,而高糖刺激48 h后p65核定位信号显著增加;在应用Ast后减少了高糖诱导的p65核定位,见图5、6。
讨 论
血管内皮细胞功能受损是糖尿病血管并发症的早期分子事件,而引起血管内皮功能紊乱与高糖条件下产生的ROS有关。ROS是机体氧化反应中产生的有害化合物,具有强氧化性。高血糖时ROS的大量生成导致血液中的氧化应激反应的概率急剧上升,进而使各类型的功能蛋白质变性,形成大量的晚期糖基化终末产物。同时ROS是细胞炎症基因如p38、NF-κB等激活的重要诱因。因此,逆转内皮的功能障碍能有效降低患糖尿病心血管并发症的风险。本研究表明,体内给予落新妇苷能缓解糖尿病大鼠氧化应激因子如H2O2和MDA的产生,同时落新妇苷还可以促进高糖条件下血管内皮细胞重要细胞因子SDF-1α的产生,研究结果初步提示落新妇苷在糖尿病血管内皮功能紊乱的修复中具有一定的作用。
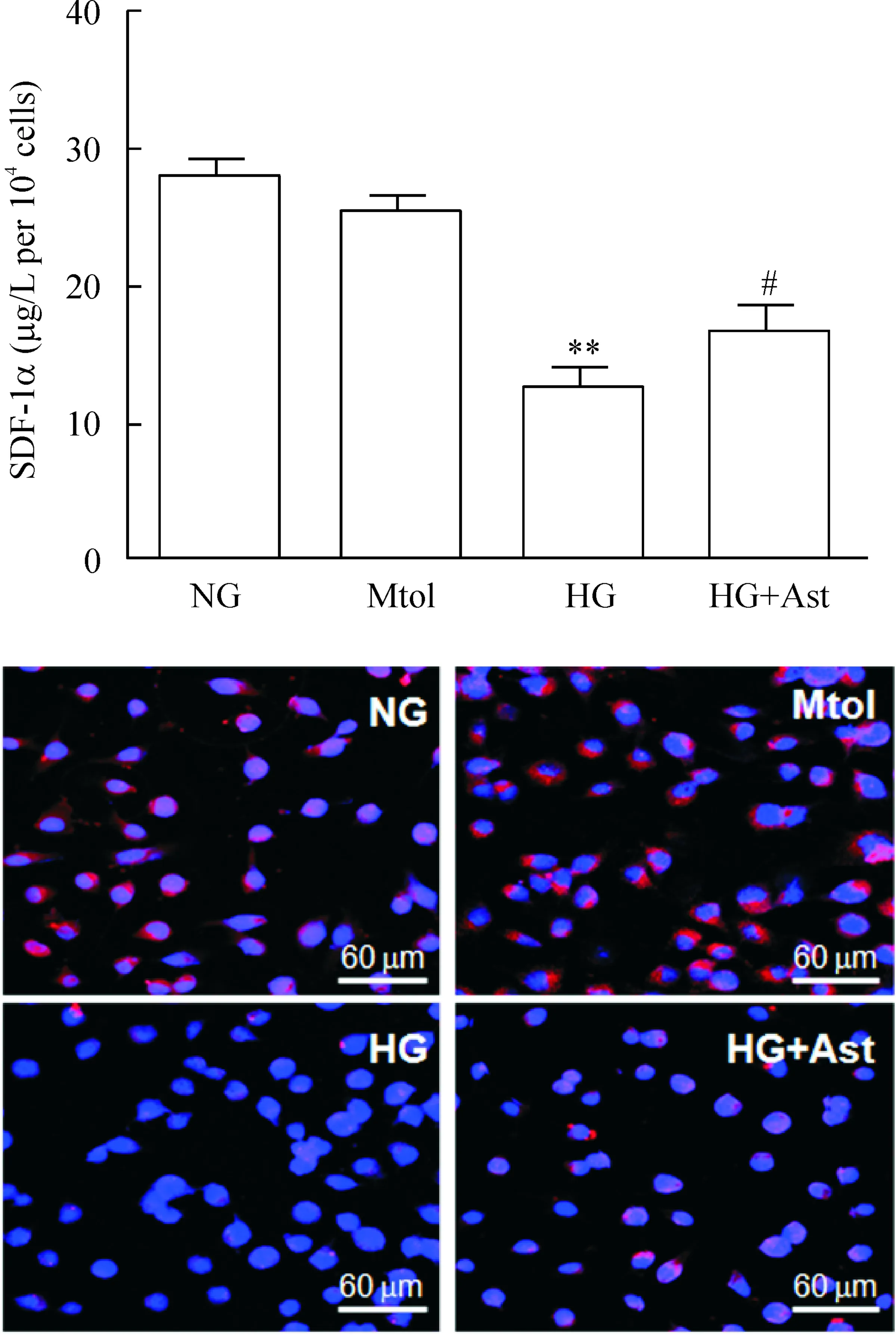
Figure 3.SDF-1α protein in HUVECs and their supernatants. NG: normal glucose; HG: high glucose; Mtol: mannitol (osmotic control); Ast: astilbin. Mean±SEM.n=3.**P<0.01vsNG and Mtol;#P<0.05vsHG.
图3HUVECs及其培养液上清中SDF-1α蛋白的表达情况

Figure 4.The cell cycle distribution in HUVECs. NG: normal glucose (5.5 mmol/L); HG: high glucose (25 mmol/L); Mtol: mannitol (25 mmol/L; osmotic control); Ast: astilbin (25 μmol/L). Mean±SEM.n=3.**P<0.01vsNG and Mtol;#P<0.05,##P<0.01vsHG.
图4HUVECs细胞周期的变化
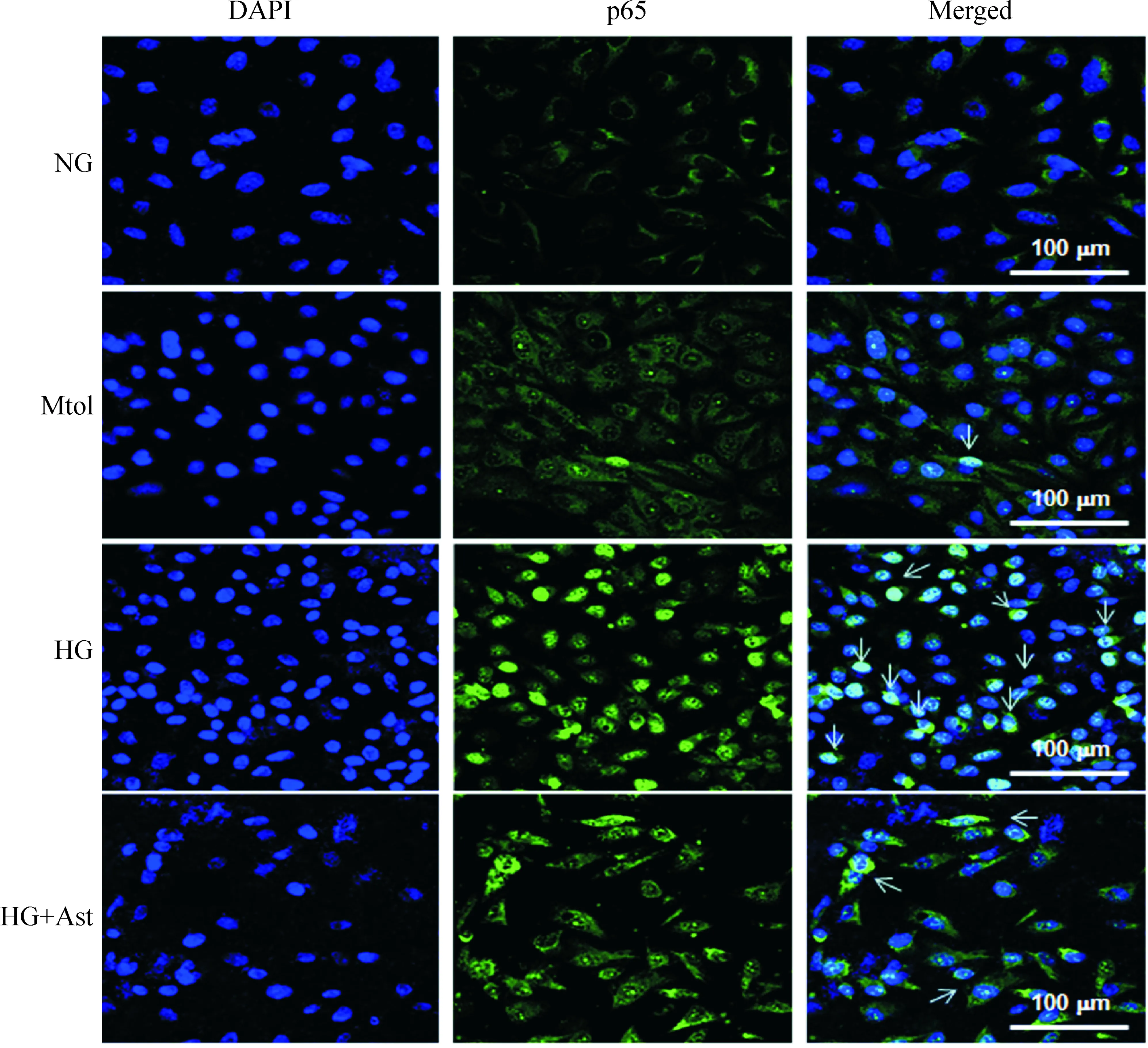
Figure 5.The expression and cellular location of p65 in HUVECs. Arrows indicate nuclear location. NG: normal glucose (5.5 mmol/L); HG: high glucose (25 mmol/L); Mtol: mannitol (25 mmol/L; osmotic control); Ast: astilbin (25 μmol/L).
图5免疫荧光检测HUVECs中p65蛋白的表达及细胞内定位

Figure 6.The percentage of nuclear localization of p65 in HUVECs. NG: normal glucose; HG: high glucose; Mtol: mannitol (osmotic control); Ast: astilbin. Mean±SEM.n=6.**P<0.01vsNG and Mtol;#P<0.05vsHG.
图6HUVECs中p65蛋白核定位细胞百分比
SDF-1α是一种强烈的趋化因子,循环血液中SDF-1α水平与内皮祖细胞数量呈正相关[4]。糖尿病患者SDF-1α与HbA1c、低密度脂蛋白负相关,提示改善血糖、血脂状况可能升高外周血中SDF-1α水平,进而改善内皮功能。动脉粥样化发生的始动环节是因为诸多危险因素造成动脉内皮损伤,而这些环节受趋化因子和黏附因子的调控。糖尿病早期,由于内皮细胞功能紊乱,血液中SDF-1α水平下降,对内皮祖细胞的趋化能力不足因而不能及时修复受损的内皮。因此,早期提高血液中SDF-1α水平对糖尿病血管并发症的防治具有积极意义。当糖尿病发展至合并动脉粥样硬化的时期,外周血中SDF-1α水平下降,血管壁上的SDF-1α的浓度表达却增加,这势必提高了血管壁与血中SDF-1α的浓度梯度,很可能因此而提高了SDF-1α趋化单核细胞侵入内皮下和诱导平滑肌细胞的迁移,从而加速动脉粥样硬化进展[11]。因此,糖尿病晚期应恢复血管壁与血液中SDF-1α水平的正常比值。本研究发现,急性糖尿病大鼠胸主动脉内皮细胞SDF-1α较正常对照组下降,但我们未进一步分析胸主动脉壁与循环血液中SDF-1α水平比值的改变。SDF-1α在糖尿病性动脉粥样硬化并发症的发生发展中到底是起保护还是加速作用,在不同时期所扮演的角色与作用机制尚待进一步研究。
落新妇苷是一种二氢黄酮醇。黄酮类药物能通过诱导下游基因表达,以达到影响细胞生物学功能,抑制或杀灭细菌菌株,抑制重要的病毒酶、逆转录酶和蛋白酶等[12]。落新妇苷可通过调节IL-1β、IL-6、IFN-γ、TNF-α、MCP-1 和 COX-2等炎症因子而发挥抗炎作用[13-14]。另有研究显示,落新妇苷可通过抑制葡萄糖-6-磷酸酶活性而调节葡萄糖的合成[15]。我们早期的研究显示落新妇苷具有抗平滑肌细胞增殖的作用[16]。此外,落新妇苷通过抗氧化应激在糖尿病肾病及缺血再灌注肝损伤中起到明显的恢复作用[8-10]。在本实验显示落新妇苷能明显降低高血糖条件下的血浆中的自由基数量,显示了很好的抗氧化作用,与Petacci等[17]的报道相一致。此外,我们的研究首次发现落新妇苷可拮抗糖尿病高糖对血管内皮细胞SDF-1α因子的损伤。
NF-κB是重要的转录因子,在炎症损伤、氧化应激、缺血再灌注损伤等反应中具有关键性作用。p65作为其活性亚基,其核定位的增加是判断NF-κB信号活化的重要证据。本研究显示,与正常对照相比,高糖刺激显著活化了HUVECs中NF-κB信号,表现为p65蛋白核定位信号的显著增加,而落新妇苷明显减低了高糖刺激导致的p65蛋白的核定位,提示落新妇苷具有抑制高糖诱导的NF-κB信号活化作用。这与我们早期研究发现落新妇苷能抑制血管紧张素Ⅱ活化平滑肌细胞中NF-κB信号结果相似[16],也一定程度上支持了Diao等[18]发现落新妇苷能通过阻断高迁移率族蛋白B1而抑制糖尿病大鼠心肌组织中NF-κB磷酸化的结果的报道。
NF-κB信号的活化可以通过经典途径和非经典途径来实现。糖尿病或高糖可通过产生ROS而活化NF-κB信号[19],但NF-κB信号与SDF-1α的关系较为复杂。一方面外源性SDF-1α可以活化NF-κB信号[20],提示SDF-1α是NF-κB信号的上游;另一方面,非经典途径活化的NF-κB信号可以调节包括SDF-1α基因在内的少部分靶基因的表达[21-22],提示SDF-1α是NF-κB下游靶基因。非常有趣的是,经典途径活化的NF-κB信号可以抑制非经典途径活化NF-κB信号介导的SDF-1α的表达[23]。因此,很可能糖尿病时血管内皮细胞中存在高糖→ROS→非经典NF-κB信号→SDF-1α→经典NF-κB信号→抑制非经典NF-κB的信号反馈环路,而落新妇苷可能通过抗氧化应激减弱糖尿病时经典NF-κB信号的活化而弱化了对非经典NF-κB信号活化介导的SDF-1α表达的负性调控,因而最终表现为SDF-1α表达的增加,但这一假设仍需要进一步的探讨。
总之,本研究结果显示在高糖应激的条件下,机体会产生大量的ROS并抑制血管内皮细胞中SDF-1α的表达,落新妇苷可以增加高糖条件下血管内皮细胞表达SDF-1α,减少ROS释放和抑制NF-κB信号活化。落新妇苷在糖尿病血管并发症防治上的确切的药用价值及其作用机制仍需更多的深入研究。
[1]广东省糖尿病流行病学调查协作组. 广东省糖尿病患病现况调查分析[J]. 广东医学, 2001, 22 (6):455-458.
[2]翁建平. 广东省糖尿病研究现状与对策[J]. 新医学, 2010, 41(3):141-142.
[4]韦玉和,罗春媛,周斌,等. 2型糖尿病患者外周血中SDF-1水平和内皮祖细胞CXCR4表达率的变化[J]. 江苏大学学报:医学版, 2009,19(5):413-416.
[5]Lu CL, Zhu YF, Hu MM, et al. Optimization of astilbin extraction from the rhizome ofSmilaxglabra, and evaluation of its anti-inflammatory effect and probable underlying mechanism in lipopolysaccharide-induced RAW264.7 macrophages[J]. Molecules, 2015, 20(1):625-644.
[6]张白嘉,刘亚欧,刘榴,等. 土茯苓及落新妇苷抗炎、镇痛、利尿作用研究[J]. 中药药理与临床, 2004, 20(1):11-12.
[7]宋少华,沈筱芸,丁国善,等. 落新妇苷对小鼠骨髓来源树突状细胞成熟及免疫功能的抑制作用[J]. 中西医结合学报, 2010, 8 (2):145-151.
[8]Chen L, Lan Z, Zhou Y, et al. Astilbin attenuates hyperuricemia and ameliorates nephropathy in fructose-induced hyperuricemic rats[J]. Planta Med, 2011, 77(16):1769-1773.
[9]Li GS, Jiang WL, Yue XD, et al. Effect of astilbin on experimental diabetic nephropathyinvivoandinvitro[J]. Planta Med, 2009, 75(14):1470-1475.
[10]慕宁,王海梁,傅宏,等. 落新妇苷通过促进IL-10表达保护小鼠缺血再灌注损伤肝脏[J]. 第二军医大学学报, 2008, 29(12):1729-1432.
[11]姚峰,周军媚,王佐,等. SDF-1对单核细胞的黏附作用[J]. 中国比较医学杂志, 2009, 19(3):35-38.
[12]Havsteen BH. The biochemistry and medical significance of the flavonoids[J]. Pharmacol Ther, 2002, 96(2-3):67-202.
[13]Xin W, Huang H, Yu L, et al. Three new flavanonol glycosides from leaves ofEngelhardtiaroxburghiana, and their anti-inflammation, antiproliferative and antioxidant properties [J]. Food Chem, 2012, 132(2):788-798.
[14]Guo L, Liu W, Lu T, et al. Decrease of functional activated T and B cells and treatment of glomerulonephitis in lupus-prone mice using a natural flavonoid astilbin[J]. PLoS One, 2015, 10(4):e0124002.
[15]Estrada O, Hasegawa M, Gonzalez-Mujíca F, et al. Evaluation of flavonoids from Bauhinia megalandra leaves as inhibitors of glucose-6-phosphatase system [J]. Phytother Res, 2005, 19(10):859-863.
[16]Li P, Gao S, Jie W, et al. Astilbin inhibits proliferation of rat aortic smooth muscle cells induced by angiotensin Ⅱ and down-regulates expression of protooncogene [J]. J Huazhong Univ Sci Technolog Med Sci, 2012, 32(2):181-185.
[17]Petacci F, Freitas SS, Brunetti IL, et al. Inhibition of peroxidase activity and scavenging of reactive oxygen species by astilbin isolated fromDimorphandramollis(Fabaceae, Caesalpinioideae) [J]. Biol Res, 2010, 43(1):63-74.
[18]Diao H, Kang Z, Han F, et al. Astilbin protects diabetic rat heart against ischemia-reperfusion injury via blockade of HMGB1-dependent NF-κB signaling pathway [J]. Food Chem Toxicol, 2014, 63:104-110.
[19]Wei M, Li Z, Xiao L, et al. Effects of ROS-relative NF-κB signaling on high glucose-induced TLR4 and MCP-1 expression in podocyte injury[J]. Mol Immunol, 2015, 68(2 Pt A):261-271.
[20]Li LX, Zhang XF, Bai X, et al. SDF-1 promotes ox-LDL induced vascular smooth muscle cell proliferation[J]. Cell Biol Int, 2013, 37(9):988-994.
[21]Dejardin E, Droin NM, Delhase M, et al. The lymphotoxin-beta receptor induces different patterns of gene expression via two NF-κB pathways[J]. Immunity, 2002, 17(4):525-535.
[22]McCorkell KA, May MJ. Noncanonical NF-κB activation and SDF-1 expression in human endothelial cells[J]. Methods Mol Biol, 2015,1280:155-180.
[23]Madge LA, May MJ. Classical NF-κB activation negatively regulates noncanonical NF-κB-dependent CXCL12 expression[J]. J Biol Chem, 2010, 285(49):38069-38077.
(责任编辑: 陈妙玲, 罗森)
Effects of astilbin on expression of SDF-1α in high glucose-treated vascular endothelial cells
WANG Ke-ke1, 2, DENG Ya-yan1, 4, LAI Jian-hong1, ZHANG Bang-yan1, HUANG Chen1, SHEN Zhi-hua3, JIANG Han-guo1, 2, JIE Wei1, 2
(1DepartmentofPathology,GuangdongMedicalUniversity,Zhanjiang524023,China;2PathologicalDiagnosisandResearchCentre,AffiliatedHospitalofGuangdongMedicalUniversity,Zhanjiang524001,China;3DepartmentofPathophy-siology,SchoolofBasicMedicalScience,GuangdongMedicalUniversity,Zhanjiang524023,China;4DepartmentofPediatrics,FirstPeople’sHospitalofZhaoqingCity,Zhaoqing526021,China.E-mail:wei.jie@gdmc.edu.cn)
AIM: To explore the effects of astilbin on high glucose-induced stromal cell-derived factor-1α (SDF-1α) expression in vascular endothelial cells.METHODS: The acute diabetic SD rats were established by intraperitoneally injection of streptozotocin. The plasma malondialdehyde (MDA) and H2O2levels were measured by thiobarbituric acid method and UV spectrophotometry, respectively. The SDF-1α expression in the endothelial cells of thoracic aorta was assessed by immunofluorescent staining. Human umbilical vein endothelial cells (HUVECs) were treated with high glucose. The expression of SDF-1α in HUVECs was detected by real-time PCR, ELISA and immunofluorescence. Flow cytometry was adopted to analyze the cell cycle distribution. The expression and intracellular localization of p65 was assessed by immunofluorescent staining.RESULTS: The plasma levels of MDA and H2O2in diabetic rats were higher than those in the normal controls. The expression of SDF-1α in the aortic endothelial cells of diabetic rats was decreased as compared with the normal controls. Astilbin alleviated plasma MDA and H2O2levels in the diabetic rats and increased SDF-1α in the thoracic aorta endothelial cells.Invitrostimulation with high glucose significantly reduced the expression of SDF-1α in the HUVECs, which was restored by astilbin. High glucose stimulation increased the proportion of S phase in the HUVECs, and astilbin reduced S phase proportion. High glucose increased p65 nuclear translocation in the HUVECs, which was attenuated by astilbin treatment. CONCLUSION: Astilbin increases the expression of SDF-1α and reduces oxidative stress and NF-κB activation in high glucose-stimulated vascular endothelial cells.
High glucose; Astilbin; Stromal cell-derived factor-1α; Human umbilical vein endothelial cells
1000- 4718(2016)04- 0610- 08
2015- 10- 13
2015- 12- 14
广东省大学生创新训练项目(No. 1057112014);广东医学院大学生创新实验项目(No. 2011ZZZF002);国家自然科学基金资助项目(No. 81170121)
Tel: 0759-2388584; E-mail: wei.jie@gdmc.edu.cn
R363; R587.1
A
10.3969/j.issn.1000- 4718.2016.04.006
杂志网址: http://www.cjpp.net
▲并列第1作者

