miR146通过靶向Notch 1促进骨髓间充质干细胞向髓核样细胞分化
岳宗进,刘汝银,于 露,冯仲锴,王新立
(河南中医药大学第二附属医院,河南郑州 450002)
◇基础研究◇
miR146通过靶向Notch1促进骨髓间充质干细胞向髓核样细胞分化
岳宗进,刘汝银,于露,冯仲锴,王新立
(河南中医药大学第二附属医院,河南郑州450002)
目的探讨miR146在骨髓间充质干细胞(BMSC)向髓核样细胞分化中的作用及其机制。方法从SD大鼠中分离培养BMSC,传至第3代用于本实验。以TGFβ1(转化生长因子-β1)诱导BMSC向髓核样细胞分化为模型。检测TGFβ1诱导BMSC后蛋白多糖(ACAN)、Ⅱ型胶原蛋白(COLⅡ)和SOX9的蛋白及mRNA表达水平;RT-PCR检测miR146的表达水平。随后通过上调或下调miR146水平,检测ACAN、COLⅡ和SOX9的蛋白及mRNA表达水平;双荧光素酶报告系统验证miR146的靶基因,并上调或下调miR146水平后检测靶基因的蛋白表达水平;过表达靶基因并检测其与miR146mimic共转染对ACAN、COLⅡ和SOX9表达的影响。最后,上调或下调靶基因后,检测miR146表达水平的变化。结果TGFβ1诱导BMSC向髓核样细胞分化后ACAN、COLⅡ、SOX9和miR146高表达。上调miR146后,ACAN、COLⅡ和SOX9的表达升高;下调miR146后ACAN、COLⅡ和SOX9的表达降低。双荧光素酶报告系统证实,Notch 1是miR146的靶基因,miR146通过抑制Notch 1的表达上调ACAN、COLⅡ和SOX9的表达水平。上调Notch 1后miR146表达下调,下调Notch 1后miR146表达上调。结论miR146通过靶向Notch 1促进骨髓间充质干细胞向髓核样细胞分化,Notch 1对miR146亦具有负向调控作用。
骨髓间充质干细胞;髓核样细胞;miR146;Notch 1
椎间盘退变(intervertebraldiscdegeneration,IDD)是中老年人的常见病及多发病,其病因主要是因为纤维环和髓核的含水量、蛋白多糖和胶原等逐渐减少、弹性和韧性降低、张力下降、椎间隙变窄等[1]。常见的治疗方法是手术治疗和非手术治疗,然而都不能从根本上修复椎间盘退变的病理状态[2]。将骨髓间充质干细胞(BMSC)注入到山羊髓核中,发现BMSC可以阻止椎间盘退化[3],其可能的机制是BMSC分化成为髓核样细胞而增加了髓核细胞的数量[4]。研究显示,BMSC用于治疗IDD具有很大的临床应用潜力[5]。
我们在前期研究中发现,TGFβ1(转化生长因子-β1)诱导的BMSC向髓核样细胞分化过程中miR146高表达。本研究旨在探讨miR146在BMSC向髓核样细胞分化中的作用及其机制。
1 材料与方法
1.1实验动物清洁级1月龄SD大鼠15只,雄性,体质量88~100g,由郑州大学提供。大鼠饲养与实验过程严格按照河南省中医院动物伦理学委员会要求。
1.2主要试剂DMEM培养基(赛默飞世尔科技有限公司),Trizol裂解液(赛默飞世尔科技有限公司),PrimeScriptTMRTReagentKit(TaKaRa),双荧光素酶检测试剂盒(碧云天生物技术),TGFβ1(Amresco),兔抗大鼠Ⅱ型胶原多克隆抗体,兔抗大鼠蛋白多糖多克隆抗体,SOX9兔抗大鼠多克隆抗体,辣根过氧化物酶标记的山羊抗兔IgG,β-actin兔抗大鼠单克隆抗体。所有的抗体均购于Abcam公司。
1.3方法
1.3.1BMSC的分离培养将1月龄SD大鼠用35mL/L水醛进行腹腔麻醉。在无菌条件下,分离出大鼠双下肢胫、股骨,剪断两端暴露髓腔。用5mL注射器吸取含100mL/LFBS的低糖DMEM培养基,反复冲洗骨髓腔,冲洗3次收集冲洗液。轻轻吹打制成单细胞悬液。1 000r/min离心20min,去上清。用含100mL/LFBS的低糖DMEM重悬,按细胞密度1×106/cm2接种于培养皿中,350mL/LCO2、37 ℃孵育箱中培养,待细胞生长达到90%以上,用胰酶消化传代,培养至第3代便可进行下列实验。
1.3.2TGFβ1处理BMSC将第3代BMSC以1×104/cm2的密度接种于12孔板的2孔中,待细胞生长至80%时,加入10μg/LTGFβ1诱导14d[6],对照组正常培养14d,用于后续实验。
1.3.3细胞转染将细胞分为4组(n=6):miR146mimic、miR146inhibitor、miR146mimicNC(阴性对照)和miR146inhibitorNC(阴性对照)。采用LipofectamineTM2000将每组转染入TGFβ1诱导的BMSC细胞或转染入BMSC细胞,用于后续实验。
1.3.4Westernblotting采用RIPAlysisbuffer将BMSC裂解,离心后吸出上清液体,采用BCA蛋白试剂盒进行蛋白浓度测定。将蛋白样品进行100g/LSDS-PAGE电泳,后转至PVDF膜上,牛奶封闭1h。加一抗4 ℃孵育过夜,后经TBST冲洗3次,每次10min。加二抗室温孵育1h,经TBST冲洗3次,每次10min。后经在暗室中曝光。以β-actin作为内参。结果采用软件imageJ计算统计。
1.3.5双荧光素酶报告基因检测将BMSC按照1×105/cm2接种于6孔板中,待细胞生长至80%,采用LipofectamineTM2000将扩增的Notch 1-3′UTR-WT和Notch 1-3′UTR-MUT分别转入重组质粒psicheck-2中,成功构建重组质粒psicheck-2-Notch 1-3′UTR-WT和psicheck-2-Notch 1-3′UTR-MUT。分别与miR146共转入BMSC中形成miR146+Notch 1-3′UTR-WT组与miR146+Notch 1-3′UTR-MUT组。结果采用发光化学仪检测萤火虫和海肾荧光比值。
1.3.6Notch 1基因过表达载体的构建及转染根据GenBank中Notch 1基因序列,采用Oligo6.0软件设计引物,并交由上海生工(生工生物工程股份有限公司,中国)合成(F:5′-AGTCGCTAGCATGGTGCTGCTGTCCCGCAAGCGCA-3′;R:5′-GTACCGGTGGCTTAAATGCCTCTGGAATGTGGGTG-3′)。将测序正确的Notch 1基因克隆到pEGFP-N1载体中,构建pEGFP-N1-Notch 1表达载体。采用LipofectamineTM2000将pEGFP-N1-Notch 1转入BMSC;以空载pEGFP-N1作为对照。
1.3.7si-RNA介导的Notch 1基因沉默根据GenBank中Notch 1基因序列,应用网站siDESIEN设计3对siRNA,BLAST对比序列同源性。靶向Notch 1基因的siRNA序列由上海生工合成,其序列如下:F:5′-GCAACCUGCAGUGUAAUAATT-3′;R:5′-UUAUUACACUGCAGGUUGCTT-3′。无关序列(scramble):F:5′-UUCUCCGAACGUGUCACGUTT-3′;R:5′-ACGUGACACGUUCGGAG-
AATT-3′。利用LipofectamineTM2000分别将siRNA-Notch 1和scramble转染到BMSC中。
1.3.8实时定量RT-PCRTrizol法提取BMSC中总RNA。采用PrimeScriptTMRTReagentKit(TaKaRa,日本)进行逆转录和实时定量PCR过程。实时定量RT-PCR引物由上海生工合成,序列如下:Notch 1F:5′-AGCAGGTGCCATAGTCCAC-3′;R:5′-GGTTGATGCTGACGAGATGAG-3′;SOX9:F5′-GACTTCCGCGACGTGGAC-3′;R5′-CAGTA-CCTGCCGCCCAAC-3′;COLⅡ:F5′-GGCAATAGCAGGTTCACGTACA-3′;R5′-CGATAACAGTC-TTGCCCCACTT-3′;ACAN:F5′-TCTACCGCTGCGAGGTGAT-3′;5′-TGTAATGGAACACGATGCCTTT-3′;β-actinF:5′-TGTTACCAACTGGGACGACA-3′;R:5′-GGGGTGTTGAAGGTCTCAAA-3′。通过实时定量PCR检测不同基因的mRNA表达情况。miR146逆转录引物(5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACT-GGATACGACAACCCA-3′)和实时定量PCR引物(F:5′-CGGCGGTGAGAACTGAATTCCA-3′;R:5′-GTGCAGGGTCCGAGGT-3′)均由生工合成。实时定量采用miRNA荧光定量PCR试剂盒(生工生物工程股份有限公司)。2-△△Ct方法分析mRNA相对表达量,进行统计学分析。
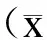
2 结 果
2.1miR146在TGFβ1诱导BMSC向髓核样细胞分化中高表达研究显示,髓核细胞具有ACAN、COLⅡ的表性特征,且SOX9基因被认为能促进ACAN和COLⅡ合成。因此,ACAN、COLⅡ和SOX9在BMSC向髓核样细胞分化中被认为是髓核样细胞的标志[7]。在本研究中,BMSC细胞经TGFβ1诱导后,ACAN、COLⅡ和SOX9的蛋白表达量增加,与对照组比较差异具有统计学意义(图1A、1B,P=0.042)。RT-PCR结果显示,经TGFβ1诱导后,BMSC中ACAN、COLⅡ和SOX9的mRNA表达升高,与对照组比较差异具有统计学意义(图1C,P=0.028)。另外,TGFβ1诱导BMSC向髓核样细胞分化过程中,miR146表达水平升高,与对照组比较具有统计学意义(图1D,P=0.039)。

图1miR146在TGFβ1诱导BMSC向髓核样细胞分化中高表达
Fig.1HighexpressionofmiR146intheprocessofthedifferentiationofBMSCsintopulposus-likecellsinducedbyTGFβ1
A:Westernblotting检测TGFβ1诱导BMSC向髓核样细胞分化后ACAN、COLⅡ和SOX9的蛋白表达;B:图A的量化图;C:RT-PCR检测TGFβ1诱导BMSC向髓核样细胞分化后ACAN、COLⅡ和SOX9的mRNA表达;D:RT-PCR检测TGFβ1诱导BMSC向髓核样细胞分化后miR146的表达水平。Control组:细胞不做处理;TGFβ1组:细胞中加入10μg/LTGFβ1。与对照组比较,*P<0.05(n=6)。
2.2miR146促进BMSC向髓核样细胞分化以向BMSC中加入TGFβ1作为对照。转染miR146mimic后,ACAN、COLⅡ和SOX9的表达水平升高,与对照组比较差异具有统计学意义(P=0.021)。相反,转染miR146inhibitor后,ACAN、COLⅡ和SOX9表达水平下降,与对照组比较差异具有统计学意义(图2A、2B,P=0.044)。
2.3Notch 1是miR146的靶基因Targetscan软件预测及文献查阅发现,Notch 1的3′UTR区250~268bp是miR146的潜在结合位点(图3A)。双荧光素酶报告系统显示(图3B),与Emptyvector组比较,miR146与野生型Notch 1-3′UTR共转染后,检测到双荧光素酶活性的下降具有统计学意义(P=0.016)。miR146与突变型Notch 1-3′UTR共转染后,检测到双荧光素酶活性与Emptyvector组比较差异无统计学意义。说明miR146与Notch 1-3′UTR结合抑制Notch 1基因表达。为了进一步确认miR146对Notch 1基因表达的影响,分别转染miR146mimic和inhibitor至BMSC中,Westernblotting检测Notch 1蛋白表达水平。结果显示,转染mimicNC和inhibitorNC的Notch 1蛋白表达水平与未处理组相比差异无统计学意义。转染miR146mimic后,Notch 1表达水平低于未处理组,且差异具有统计学意义(P=0.033);转染miR146inhibitor后,Notch 1表达水平高于未处理组,且差异具有统计学意义(图3C,P=0.046)。
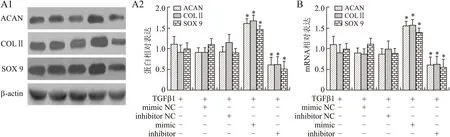
图2miR146促进BMSC向髓核样细胞分化
Fig.2miR146promotedthedifferentiationofBMSCintonucleuspulposus-likecells
A:Westernblotting检测miR146mimic或inhibitor及其对应NC转染TGFβ1诱导的BMSC后ACAN、COLⅡ和SOX9的蛋白表达水平;B:RT-PCR检测miR146mimic或inhibitor及其对应NC转染TGFβ1诱导的BMSC后ACAN、COLⅡ和SOX9的mRNA表达水平。与对照组比较,*P<0.05(n=6)。
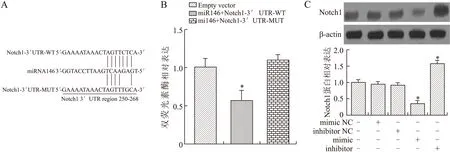
图3Notch 1是miR146的靶基因
Fig.3ThetargetgeneofmiR146wasNotch 1
A:miR146与Notch1的3′UTR区野生型和突变型位点的序列对比图;B:双荧光素酶报告系统显示Notch 1是miR146的靶基因(与Emptyvector组比较,*P<0.05);C:miR146mimic或inhibitor转染对Notch1蛋白表达水平的影响(与对照组比较,*P<0.05,n=6)。
2.4miR146通过靶向Notch 1促进骨髓间充质干细胞向髓核样细胞的分化Si-RNA介导Notch 1基因沉默后,Notch 1蛋白表达水平的下调具统计学意义(图4A,P=0.031);过表达Notch 1后,Notch 1蛋白表达水平的上调具有统计学意义(图4A,P=0.012)。图4B和C显示,转染miR146mimic后,ACAN、COLⅡ和SOX9的蛋白表达水平与对照组相比升高,且差异具有统计学意义(P=0.023)。转染Notch 1过表达载体后,ACAN、COLⅡ和SOX9的蛋白表达水平下调,且具有统计学意义(P=0.033)。当miR146mimic与Notch 1过表达载体共转细胞后,ACAN、COLⅡ、SOX9的蛋白表达水平与对照组相比差异无统计学意义,但低于miR146mimic单独转染组,且差异具有统计学意义(图4B、4C,P=0.025)。RT-PCR检测结果显示,ACAN、COLⅡ、SOX9的mRNA表达水平与蛋白表达水平变化趋势一致(图4D)。

图4miR146通过靶向Notch 1促进骨髓间充质干细胞向髓核样细胞分化
Fig.4miR146promotedthedifferentiationofBMSCintonucleuspulposus-likecellsbytargetingNotch 1
A:Westernblotting验证Notch 1的沉默与过表达载体构建成功;B:Notch 1过表达减少了miR146mimic转染对ACAN、COLⅡ、SOX9的蛋白表达的影响;C:图B的量化图;D:Notch 1过表达减少了miR146mimic转染对ACAN、COLⅡ、SOX9的mRNA表达的影响。与对照组比较,*P<0.05;与Mimic组比较,#P<0.05(n=6)。
2.5Notch 1负向调控miR146的表达与对照组相比,Scramble组和Emptyvector组miR146的表达差异无统计学意义。si-RNA介导Notch 1沉默后,miR146的表达水平与对照组比较上调,且差异具有统计学意义(P=0.033);相反,过表达Notch 1后,与对照组相比,miR146的表达水平的下调具有统计学意义(图5,P=0.042)。

图5Notch 1负向调控miR146的表达
Fig.5 Notch 1negativelyregulatedtheexpressionofmiR146
与对照组比较,*P<0.05(n=6)。
3 讨 论
IDD是骨科常见病,也是腰痛产生的源头。髓核组织失水纤维化、蛋白多糖和胶原逐渐减少是IDD的主要原因[1]。目前认为髓核细胞移植为椎间盘治疗提供了前景[8]。然而,研究显示髓核细胞生长缓慢[9],不好培养。BMSC因其可多向分化、增殖能力强及可在一定条件下(如TGFβ1)被诱导成为髓核样细胞成为研究热点[10]。
有研究显示在斑马鱼的胚胎发育中,miR146特异性的表达在软骨细胞中[11]。因髓核细胞具有软骨细胞的表性特征(ACAN、COLⅡ)[8],又被称为类软骨细胞。SOX9基因被认为能促进ACAN和COLⅡ合成,延缓IDD发展[12]。在本研究中,TGFβ1诱导BMSC向髓核样细胞分化过程中,miR146的表达量升高。我们推测miR146的表达可能与ACAN、COLⅡ和SOX9的增加相关。因此,在TGFβ1诱导BMSC向髓核样细胞分化过程中,我们检测了上调或下调miR146对ACAN、COLⅡ和SOX9表达水平的影响。结果证实,在TGFβ1诱导的BMSC中转染miR146增加了ACAN、COLⅡ和SOX9的表达水平。与本研究相似,在软骨细胞中转染miR146a抑制了IL-1介导的ACAN和COLⅡ表达的减少[13]。并且有研究显示,髓核细胞中转染miR146a可以减少IL-1诱导的椎间盘退变和炎症的形成,当在患有椎间盘小鼠体内敲除miR146a后,IL-1诱导的蛋白多糖的退化加剧[14]。因此,miR146促进BMSC向髓核样细胞分化。
我们进一步检测了miR146的靶基因,发现Notch 1是miR146的靶基因,并且miR146抑制Notch 1的表达。MORIGELE等[15]发现Notch 1沉默促进了BMSC向髓核样细胞分化。并且Notch 1的过表达显著地抑制了miR146mimic转染引起的ACAN、COLⅡ和SOX9表达的增加。实验结果证明,miR146通过靶向Notch 1促进骨髓间充质干细胞向髓核样细胞分化。
另外,本研究观察到Notch 1的过表达抑制miR146的表达,而si-RNA介导Notch 1沉默促进了miR146的表达。说明Notch 1负向调控miR146的表达。但Notch 1通过何种机制调控miR146的表达有待进一步研究。
综上所述,本研究证实了miR146与Notch 1形成反馈环路促进TGFβ1诱导BMSC向髓核样细胞分化。
[1] 鲁玉来. 腰椎间盘突出症 [J]. 中国矫形外科杂志, 2005, 12(23): 1901-1904.
[2]SAKAID,ANDERSSONGB.Stemcelltherapyforintervertebraldiscregeneration:obstaclesandsolutions[J].NatRevRheumatol, 2015, 11(4):43-256.
[3]GHOSHP,MOORER,VERNONROBERTSB,etal.ImmunoselectedSTRO-3+mesenchymalprecursorcellsandrestorationoftheextracellularmatrixofdegenerateintervertebraldiscs[J].JNeurosurgSpine, 2012, 16(5):479-488.
[4] 王锋,王运涛,吴小涛. 髓核细胞修复椎间盘退行性变的研究进展[J]. 中国修复重建外科杂志, 2009, 23(7):864-867.
[5] 王春生,张维斌. 髓核细胞移植抑制椎间盘退变[J]. 中国组织工程研究, 2013, 17(53):9239-9244.
[6] 呼和,韩成龙,姜超,等. 转化生长因子β1对骨髓干细胞分化类髓核细胞的影响[J]. 中国组织工程研究, 2011, 15(36):6722-6726.
[7]NIL,LIUX,SOCHACKIKR,etal.Effectsofhypoxiaondifferentiationfromhumanplacenta-derivedmesenchymalstemcellstonucleuspulposus-likecells[J].SpineJ, 2014, 14(10):2451-2458.
[8]CHOIH,JOHNSONZI,RISBUDMV.Understandingnucleuspulposuscellphenotype:aprerequisiteforstemcellbasedtherapiestotreatintervertebraldiscdegeneration[J].CurrStemCellResTher, 2015, 10(4):307-316.
[9]HEB,WANDYH,YANGJ,etal.Normalanddegeneratedrabbitnucleuspulposuscellsinin vitrocultures:Abiologicalcomparison[J].JHuazhongUSci-Med, 2013, 33(2):228-233.
[10]HANC,JIANGC,YUC,etal.Differentiationoftransforminggrowthfactorbeta1-inducedmesenchymalstemcellsintonucleuspulposus-likecellsundersimulatedmicrogravityconditions[J].CellMolBiol, 2015, 61(2):50-55.
[11]WIENHOLDSE,KLOOSTERMANlWP,MISKAE,etal.MicroRNAexpressioninzebrafishembryonicdevelopment[J].Science, 2005, 309(5732):310-311.
[12]GRUBERHE,NORTONHJ,INGRAMJA,etal.TheSOX9transcriptionfactorinthehumandisc:decreasedimmunolocalizationwithageanddiscdegeneration[J].Spine, 2005, 30(6):625-630.
[13]LIX,GIBSONG,KIMJS,etal.MicroRNA-146aislinkedtopain-relatedpathophysiologyofosteoarthritis[J].Gene, 2011, 480(1):34-41.
[14]GUSX,LIX,HAMILTONJL,etal.MicroRNA-146areducesIL-1dependentinflammatoryresponsesintheintervertebraldisc[J].Gene, 2015, 555(2):80-87.
[15]MORIGELEM,SHAOZ,ZHANGZ,etal.TGF-β1inducesanucleuspulposus-likephenotypeinNotch1knockdownrabbitbonemarrowmesenchymalstemcells[J].CellBiolInt, 2013, 37(8):820-825.
(编辑卓选鹏)
miR146promotesthedifferentiationofbonemesenchymalstemcellsintonucleuspulposus-likecellsbytargetingNotch1
YUEZong-jin,LIURu-yin,YULu,FENGZhong-kai,WANGXin-li
(DepartmentofSpine,theSecondAffiliatedHospitalofHenanUniversityofTraditionalChineseMedicine,Zhengzhou450002,China)
ObjectiveToexploretheeffectofmiR146onthedifferentiationofbonemesenchymalstemcells(BMSCs)intonucleuspulposus-likecellsandtheunderlyingmechanism.MethodsTheBMSCswereisolatedfromSDmice.The3passagesofBMSCswereusedinthepresentstudy.ThedifferentiationofBMSCsintopulposus-likecellswasinducedbyTGFβ1.TheproteinandmRNAexpressionlevelsofaggrecan(ACAN),typeⅡcollagen(COLⅡ)andSOX9weredetectedinTGFβ1-inducedBMSCs.TheexpressionlevelofmiR146wasdeterminedbyRT-PCR.Byup-regulatingordown-regulatingtheexpressionlevelsofmiR146inTGFβ1-inducedBMSCs,wefurtherdetectedtheproteinandmRNAexpressionlevelsofACAN,COLⅡandSOX9.ThetargetgeneofmiR146wasverifiedbydual-luciferasereporterassaysystem.ThemiR146wasup-regulatedordown-regulatedinBMSCsandtheproteinexpressionlevelsoftargetgeneweredetected.ThetargetgenewasoverexpressedandtheexpressionlevelsofACAN,COLⅡandSOX9weredetectedinBMSCstransfectedbytargetgeneandmiR146mimic.Atlast,theexpressionlevelofmiR146wasdetectedbysilencingoroverexpressingthetargetgene.ResultsTheexpressionlevelsofACAN,COLⅡ,SOX9andmiR146wereincreasedduringthedifferentiationofBMSCsintopulposus-likecellsinducedbyTGFβ1.AftermiR146up-regulation,theexpressionlevelsofACAN,COLⅡandSOX9wereelevated.AftermiR146down-regulation,theexpressionlevelsofACAN,COLⅡandSOX9werereduced.Dual-luciferasereporterassaysystemshowedthatthetargetgeneofmiR146wasNotch 1.miR146enhancedtheexpressionlevelsofACAN,COLⅡandSOX9throughinhibitingtheexpressionofNotch 1.Afterup-regulatingNotch 1,theexpressionofmiR146wasreduced.Afterdown-regulatingNotch 1,theexpressionofmiR146wasincreased.ConclusionmiR146promotesthedifferentiationofBMSCsintonucleuspulposus-likecellsbytargetingNotch 1. Notch 1,whichnegativelyregulatestheexpressionofmiR146.
bonemesenchymalstemcell;nucleuspulposus-likecell;miR146; Notch 1
2016-02-23
2016-05-03
河南省科技攻关计划项目(No.102102310277)
刘汝银.E-mail:qujining@yeah.net
R274.34
A
10.7652/jdyxb201605010
SupportedbyScienceandTechnologyProjectsofHenanProvince(No.102102310277)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160803.1139.012.html(2016-08-03)

