基于核酸适配体的荧光法检测水胺硫磷和丙溴磷
王丽 叶华 桑宏庆 王丹丹


摘要:建立了基于适配体的农药水胺硫磷和丙溴磷的荧光检测方法。采用可特异性识别水胺硫磷和丙溴磷、且5′ 端标记荧光基团FAM的核酸适配体(FssDNA),与3′ 末端标记猝灭基团DABCYL的短链序列(QssDNA)互补杂交形成双链结构,荧光基团的荧光被淬灭,荧光信号很弱;此时加入靶分子,特异性结合核酸适配体,引起互补短链序列从双链结构中解离,使适配体荧光信号增强,基于此可实现水胺硫磷、丙溴磷的定量检测。优化后的检测条件为:将终浓度为25 nmol/L FssDNA与50 nmol/L QssDNA在25℃孵育20 min,使二者杂交形成双链适配体探针复合物,加入等体积的农药样品孵育60 min,然后检测体系的荧光信号变化值ΔI。在最佳条件下,ΔI与水胺硫磷和丙溴磷的浓度均在50~500 μmol/L范围内呈线性关系。水胺硫磷的检出限(LOD,3σ)为11.4 μmol/L,相对标准偏差 (RSD)为5.8%(n=10);丙溴磷的检出限为14.0 μmol/L,RSD为4.9%(n=10)。用于实际水样中两种农药的检测,加标回收率为85.8%~95.3%
关键词 :核酸适配体; 荧光; 水胺硫磷; 丙溴磷
1 引 言
水胺硫磷(Isocarbophos)是一种速效广谱的有机磷杀虫剂,主要用于防治果树、水稻和棉花害虫,禁止用于果、茶、烟、菜、中草药植物,属于高毒农药,对人畜的危害很大,主要通过食道、皮肤和呼吸道引起中毒[1,2]。丙溴磷(Profenofos)是一种中等毒性的非内吸性广谱有机磷杀虫剂,具有触杀和胃毒作用,对棉花、果树、水稻、蔬菜等作物上的害虫有很好的防治效果[3,4]。我国规定在谷物中水胺硫磷最大残留限量为0.1 mg/kg,丙溴磷在柑橘和结球甘蓝中最大残留限量分别为0.2和0.5 mg/kg[5]。目前,水胺硫磷和丙溴磷的准确定量分析主要采用色谱法和色谱质谱联用法,这些方法灵敏度和准确度较好,但前处理复杂,需要昂贵的仪器以及专业人员操作,不适合基层分析实验室的推广应用。因此,开发新的农药残留检测技术十分必要。
核酸适配体(Aptamer)[6,7]是通过指数富集配体系统进化技术(SELEX)从体外合成的寡核苷酸库中筛选得到的,能与靶分子特异性结合寡核苷酸序列,具有灵敏度高、亲和力强、识别靶分子范围广、特异性好、易合成等优点,在药物筛选、药物检测、疾病诊断、食品分析等方面得到了广泛应用[8,9]。目前,在食品安全领域,通过与纳米材料、电化学、荧光技术等结合,适配体已成功应用于抗生素、生物毒素、重金属等的检测分析[10~17]。在前期的研究中,本课题组利用SELEX技术成功筛选了两条识别甲拌磷、丙溴磷、水胺硫磷、氧化乐果的核酸适配体[18],并对两条核酸适配体的进行了改造,改造后的SS24PJ35 适配体对水胺硫磷和丙溴磷表现出了较高的活性[19]。本研究利用前期改造的SS24PJ35 适配体,采用高灵敏的荧光检测技术,初步建立了检测水胺硫磷和丙溴磷的方法。本方法简单、快速、成本低、需样量少,对水胺硫磷和丙溴磷具有较高的特异性,适用于水胺硫磷和丙溴磷农药制剂及高含量农药多残留的快速检测。2 实验部分
2.1 仪器与试剂
Filter Max F3多功能酶标仪(美国Molecular Devices公司);Costar黑色96孔板(美国Costar公司);LX100手掌性离心机(江苏海门市其林贝尔仪器制造有限公司);WH2微型漩涡混合仪(上海沪西分析仪器厂有限公司);PHS3B精密pH计(上海虹益仪器有限公司);TGL16台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
水胺硫磷、丙溴磷、甲拌磷、氧化乐果、马拉硫磷、辛硫磷、甲基对硫磷标准品(上海市农药研究所);核酸适配体序列:5′FAMAGCTTGCTGCAGCGATTCTTGATCGCCACAGAGCT3′(FssDNA),互补杂交序列:5′CAAGAATCGCTGCAGDABCYL3′(QssDNA1),5′GAATCGCTGCAGCAADABCYL3′(QssDNA2),5′TCGCTGCAGCAAGCTDABCYL3′(QssDNA3)(上海生工生物工程股份有限公司);三羟甲基氨基甲烷(Tris,纯度≥99.9%,美国Sigma公司);其它试剂均为国产分析纯;实验用水为超纯水。缓冲溶液1×Buffer:300 mmol/L NaCl,50 mmol/L KCl,10 mmol/L MgCl2,50 mmol/L Tris,pH 8.3。
2.2 实验方法
2.2.1 QssDNA的选择 针对FssDNA序列设计了3条不同杂交部位的互补序列QssDNA1、QssDNA2、QssDNA3,在100 μL含0.5%丙酮的1×Buffer缓冲体系中,分别测定 FssDNA、FssDNA+QssDNA、FssDNA+QssDNA+水胺硫磷、FssDNA+QssDNA+丙溴磷的荧光强度,实验采用黑色96孔板,在Filter Max F3多功能酶标仪上测定荧光信号,激发波长485 nm,发射波长535 nm。其中, FssDNA、QssDNA的终浓度均为25 nmol/L,水胺硫磷、丙溴磷的终浓度均为0.5 mmol/L,25℃下,FssDNA和QssDNA先避光孵育20 min,然后再与农药孵育40 min,进行3组平行实验。
2.2.2 FssDNA与最适QssDNA雜交条件的优化 实验对FssDNA与2.2.1小节筛选的最适QssDNA杂交的添加比例、孵育时间、孵育温度进行了优化。具体操作步骤:取若干1.5 mL离心管,加入26 μL 100 nmol/L FssDNA,再分别加入26 μL一定浓度的最适QssDNA,振荡混匀,在一定温度下避光孵育一段时间,制备适配体探针复合物。然后加入52 μL 1 mmol/L 农药(含1%丙酮的1×Buffer缓冲溶液),常温下避光孵育40 min,同时以52 μL含有 1%丙酮的1×Buffer缓冲溶液作为对照,进行3组平行实验。取100 μL反应液于黑色96孔板中测定荧光强度,对照组的荧光强度为I0,农药组的荧光强度为I,荧光强度变化ΔI=I-I0。
2.2.3 样品的测定 采集安徽科技学院人工湖水,经0.22 μm滤膜过滤后,配制成含有一定浓度农药(含1%丙酮的1×Buffer缓冲体系)的水样,在优化的实验条件下进行测定,计算回收率。
3 结果与讨论
3.1 实验原理
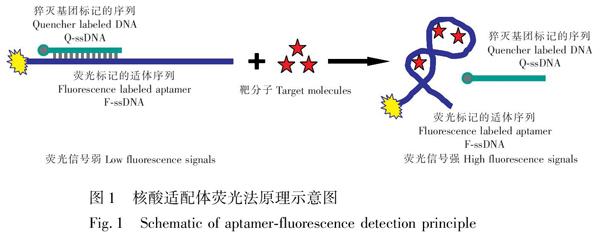
检测原理见图1。在适配体5′ 末端标记FAM荧光基团,设计了一段与适配体互补杂交的序列,并在3′ 末端标记淬灭基团DABCYL。当适配体与互补序列杂交形成双链时,荧光基团与淬灭基团在空间上接近,发生荧光能量共振转移,体系荧光信号很弱。当水胺硫磷、丙溴磷特异性识别结合适配体,形成特定的空间结构时,适配体与互补序列解离,导致荧光信号增强。因此可利用荧光强度的变化检测靶分子。
3.2 不同QssDNA序列的影响
本实验针对FssDNA序列,设计了3条与适配体不同部位杂交的互补序列QssDNA1、QssDNA2、QssDNA3,考察了不同序列对测定结果的影响, 如图2所示。3条QssDNA序列与FssDNA结合后,体系荧光强度均发生不同程度的降低,当加入水胺硫磷、丙溴磷农药时,荧光强度又有不同程度的回升。其中QssDNA2对FssDNA的荧光淬灭效果最好,且加入农药后,QssDNA2组的荧光强度变化最大。原因可能是QssDNA1的杂交位点从FssDNA 5′末端第7个碱基开始,淬灭基团与荧光基团离的相对较远;QssDNA3的杂交位点从第1个碱基开始,理论上淬灭基团与荧光基团离得最近,但可能由于标记基团本身的空间位阻效应,杂交效果并不理想,荧光强度下降最小;QssDNA2的杂交位点从第4个碱基开始,淬灭基团与荧光基团距离适中,荧光强度下降最大。因此选择QssDNA2作为杂交序列。
3.3 FssDNA与QssDNA2的比例的优化
固定 FssDNA终浓度为25 nmol/L,按照1∶1.0, 1∶1.5, 1∶2.0, 1∶2.5和1∶3.0的浓度比例添加QssDNA2,考察对体系荧光强度的影响。实验发现, 对于两种农药,随着QssDNA2添加比例的增加,ΔI都逐渐增加,当比例达到1∶2之后ΔI开始降低,尤其丙溴磷组的ΔI下降明显。可能是当QssDNA2的浓度过大时,影响了农药与FssDNA的识别结合。因此确定FssDNA与QssDNA2最佳添加比为1∶2,即FssDNA终浓度为25 nmol/L,QssDNA2终浓度为50 nmol/L。
3.4 FssDNA与QssDNA2的孵育时间和温度
固定FssDNA终浓度为25 nmol/L,QssDNA2终浓度为50 nmol/L,在25℃避光孵育10, 20, 30, 40和50 min后进行实验,结果表明,对于两种农药,孵育10 min时ΔI较低,可能是孵育时间若太短时FssDNA与QssDNA2不能充分杂交结合,随着孵育时间延长,ΔI逐渐升高,但20 min后ΔI趋于稳定,因此确定孵育时间为20 min。
在优化的实验条件下, 分别在4℃, 25℃, 35℃制备适配体探针复合物,加入农药进测定荧光信号。对于两种农药,当FssDNA与QssDNA2的孵育温度为35℃时,ΔI均偏低;孵育温度为4℃和25℃时,ΔI较高。在25℃条件下,水胺硫磷的ΔI比4℃时略有降低,丙溴磷的ΔI比4℃有较大增加,综合考虑,选择孵育温度为25℃。
3.5 农药与适配体探针复合物的反应时间
在优化的条件下,制备适配体探针复合物,按照2.2.2节的操作加入52 μL 1 mmol/L 农药后,取100 μL反应溶液于黑色96孔板中,每隔20 min测定一次荧光强度,计算ΔI,进行3次平行实验。实验结果表明,随着反应时间延长,ΔI逐渐升高;当反应时间达到60 min后,ΔI趋于稳定。因此,农药的反应时间选择60 min。
3.6 特异性
在优化条件下,考察1 mmol/L水胺硫磷、丙溴磷以及其它5种类似物甲拌磷、氧化乐果、马拉硫磷、辛硫磷、甲基对硫磷对适配体探针复合物荧光强度的影响,发现马拉硫磷、辛硫磷、甲基对硫磷的ΔI很小,可以忽略;甲拌磷、氧化乐果的ΔI稍高,约为水胺硫磷、丙溴磷的ΔI 的10%,是因为本研究使用的FssDNA是由前期工作[18,19]中筛选的识别水胺硫磷、丙溴磷、甲拌磷、氧化乐果的广谱性适配体改造而来。
3.7 标准曲线、检出限和精密度
终浓度为25~700 μmol/L的不同浓度的水胺硫磷、丙溴磷对检测体系体系荧光响应(ΔI)的影响如图3和图4所示,可见随着两种农药浓度增大,ΔI也逐渐增大,两种农药均在50~500 μmol/L浓度范围内与ΔI呈良好的线性关系,水胺硫磷检测的相关系数为0.9917,检出限(LOD,3σ)为11.4 μmol/L;丙溴磷检测的相关系数为0.9908,检出限为14.0 μmol/L。对终浓度250 μmol/L的农药平行测定10次,水胺硫磷的相对标准偏差(RSD)为5.8%,丙溴磷的RSD为4.9%,表明本方法具有良好的精密度。
3.8 样品分析
采用本方法,进行了水样中的加标回收实验,结果见表1,水胺硫磷的加标回收率为86.6%~95.3%,丙溴磷检测加标的回收率為85.8%~92.6%。
4 结 论
本实验将核酸适配体与高灵敏的荧光检测技术有机结合,初步建立了一种水胺硫磷和丙溴磷的荧光检测方法。与气相色谱法[20]相比,本方法的检出限偏高,仍需进一步优化,如对适配体进行修饰等。但本方法对水胺硫磷和丙溴磷有一定的特异性和灵敏度,操作简单、成本低,可用于农药制剂及高含量农药多残留的快速筛查检测。
References
1 YANG ShuJuan, GUO JianHui, CAI EnXing, CHEN LiPing. Subtropical Plant Science, 2011, 40(4): 59-62
杨淑娟, 郭建辉, 蔡恩兴, 陈丽萍. 亚热带植物科学, 2011, 40(4): 59-62
2 ZHANG GuoWen, ZHAO DeZhi, QUE QingMin, PAN JunHui, LIU KaiHua. Journal of Nanchang University (Natural Science), 2008, (4): 374-381
张国文, 赵德智, 阙青民, 潘军辉, 刘开花. 南昌大学学报(理科版), 2008, (4): 374-381
3 NIE Ting, HUA RiMao, TANG Feng, WU XiangWei, TANG Jun. J. Anhui Agri. Sci., 2009, 37(29): 14323-1432
聂 婷, 花日茂, 汤 锋, 吴祥为, 唐 俊. 安徽农业科学, 2009, 37(29): 14323-1432
4 LUO Jing, JIA Na, SHI HaiYan, WANG MingHua. Environmental Science & Technology, 2011, 34(6): 16-19
罗 婧, 贾 娜, 施海燕, 王鸣华. 环境科学与技术, 2011, 34(6): 16-19
5 GB/T 2763212, Maximum Resude Limits for Pesticides in Food. National Standards of the Peoples Republic of China
食品中农药残留最大限量. 中华人民共和国国家标准.GB/T 27632012
6 Gopinath S. Anal. Bioanal. Chem., 2007, 387(1): 171-182
7 Stoltenburg R, Reinemann C, Strehlitz B. Biomol. Eng., 2007, 24(4): 381-403
8 Kim Y S, Hyun C J, Kim I A, Gu M B. Bioorgan. Med. Chem., 2010, 18(10): 3467-3473
9 Peyrin E. J. Sep. Sci., 2009, 32(10): 1531-1536
10 DUAN Nuo, WU ShiJia, WANG ZhouPing. Chinese J. Anal. Chem., 2011, 39(3): 300-304
段 诺, 吴世嘉, 王周平. 分析化学, 2011, 39(3): 300-304
11 Chen J H, Fang Z Y, Liu J, Zeng LW. Food Control, 2012, 25(2): 555-560
12 LEI ZhaoJing, ZHANG CunZheng, HU QiuHui, LIU Yuan, ZHANG Qiang, LIU XianJin. Chinese J. Anal. Chem., 2012, 40(12): 1827-1831
雷兆靜, 张存政, 胡秋辉, 刘 媛, 张 强, 刘贤金. 分析化学, 2012, 40(12): 1827-1831
13 Song K M, Cho M, Jo H, Min K, Kim T, Han M S, Ku J K, Ban C. Anal. Biochem., 2011, 415(2): 175-181
14 Barthelmebs L, Jonca J, PrietoSimon B, Marty J L. Food Control, 2011, 22(5): 737-743
15 Jiang Y X, Tian J N, Hu K, Zhao Y C, Zhao S L. Microchim. Acta, 2014, 181(1112): 1423-1430
16 Bonel L, Vidal J C, Duato P, Castillo J R. Biosens. Bioelectron., 2011, 26(7): 3254-3259
17 Lu C X, Tang Z G, Liu C B, Kang L C, Sun F X. Anal. Bioanal. Chem., 2015, 407(19): 5859
18 Wang L, Liu X J, Zhang Q, Zhang C Z, Liu,Tu K, Tu J. Biotechnol. Lett., 2012, 34(5): 869-874
19 WANG Li, ZHANG CunZheng, LIU Yuan, TU Kang, SANG HongQing, LIU XianJin. Chinese J. Anal. Chem., 2012, 40(6): 940-944
王 丽, 张存政, 刘 媛, 屠 康, 桑宏庆, 刘贤金. 分析化学, 2012, 40(6): 940-944
20 GB/T5009.2072008, Determination of 50 Organophosphorus Pesticides in Unpolished Rice. National Standards of the Peoples Republic of China
糙米中50种有机磷农药残留量的测定. 中华人民共和国国家标准.GB/T 5009.2072008
Abstract A fluorescence method for detection of isocarbophos and profenofos was established based on the specific recognition of aptamer. The aptamer recognizing isocarbophos and profenofos was labeled with fluorescent label FAM at 5′ end (FssDNA). When it bound to complementary DNA chain labeled with quenching group DABCYL at 3′ end (QssDNA), the doublestranded structure would be formed and the fluorescence signals became very weak due to the effect of fluorescence resonance energy transfer. While the QssDNA would be released from the doublestranded structure when the aptamer specifically recognized and bound the targets, and the fluorescence signals of the system would recover. Based on this, isocarbophos and profenofos could be quantitatively detected. The optimized experimental conditions were as follows: firstly, 25 nmol/L FssDNA and 50 nmol/L QssDNA2 were incubated for 20 min at 25℃, then an equal volume of pesticide was added and incubated for another 60 min, then the fluorescence intensity of the system was determined. Under the optimal conditions, the change of the fluorescence intensity of the system (ΔI) showed a linear relationship with the isocarbophos or profenofos concentration in the range of 50 to 500 μmol/L. The limit of detection (LOD, σ) was 11.4 μmol/L for isocarbophos with the relative standard deviation (RSD) of 5.8% (n=10). The LOD was 14.0 μmol/L for profenofos with RSD of 4.9% (n=10). The recovery ranged from 85.8% to 95.3% when this method was applied to detect isocarbophos and profenofos in real water samples.
Keywords Aptamer; Fluorescence; Isocarbophos; Profenofos

