聚合物/磷酸盐双水相分离乳清分离蛋白中α—乳白蛋白和β—乳球蛋白条件的优化
张鹤 姜彬 冯志彪 屈玉霄 李璇
摘要:建立了基于聚(乙二醇ran丙二醇)单丁基醚(聚合物)与磷酸盐、氯化钠的双水相体系对乳清分离蛋白(WPI)中的α乳白蛋白(αLA)和β乳球蛋白(βLG)进行分离,并对其分离条件进行了优化。系統地研究了双水相体系pH值、聚合物与KH2PO4溶液体积比、NaCl添加量和WPI浓度对αLA和βLG的分离效果的影响, 采用液相色谱法对αLA和βLG的分离效果进行评价。结果表明,聚合物/KH2PO4双水相体系pH=4.0, 40%(m/m)聚合物与15.5%(m/m)KH2PO4的体积比为4 mL∶4 mL,NaCl添加量为0.40 g/10 mL, WPI浓度为1 mg/mL时,αLA和βLG分离效果最好,上相中αLA的萃取率为98.2%,下相中βLG的萃取率为96.6%。
关键词 :双水相; 乳清分离蛋白; 聚(乙二醇ran丙二醇)单丁基醚; 分离
1 引 言
乳清分离蛋白(WPI)是蛋白质混合物,在乳清分离蛋白中,α乳白蛋白(αLA)和β乳球蛋白(βLG)的含量占总WPI含量的80%以上[1],并被广泛应用于食品、医药、精细化工等领域,因此具有很高的商业价值[2,3]。现已发现αLA具有多种生理功能,人αLA可以被转化成一种可以诱导肿瘤细胞凋亡的蛋白质,牛αLA也可以被转化成这种对肿瘤细胞有相似活性的物质。在αLA中发现有血管紧张素转移酶(ACE)抑制活性,含有ACE抑制肽的水解产物已经用于高血压患者的血压控制。βLG具有优异的热与冷凝胶特性以及良好的氨基酸谱。然而,儿童对βLG有过敏效应,因此在水解或脱除这种蛋白质后再应用于婴儿或低敏人群[4]。
近年来,双水相体系(ATPS)常应用于分离乳蛋白中各种单体蛋白质。2011年,Jara等[5]采用乳清分离蛋白浓缩物(WPC)/羟丙基甲基纤维素作为双水相体系, 分离WPC中的αLA和βLG,结果表明,分子量低的蛋白质αLA和βLG均被保留在上相,分配比例高达90%,但两种蛋白未能分开。Alcntara等[4,6]利用响应面分析法优化WPI在PEG/磷酸盐双水相和PEG/NaPA双水相体系中的分配情况,实验结果表明,PEG相只含有αLA,但盐相中除含有βLG外,还含有部分αLA。Sivakumar等[7]利用PEG1000/柠檬酸钠双水相体系分离乳清蛋白中的αLA和βLG,在最适条件下,αLA在上相分配系数为16.67,βLG在下相分配系数为0.27。Kalaivani等[8]利用PEG1000/柠檬酸钠双水相体系分离乳清蛋白中的αLA和βLG,通过响应面协同节线长度、pH值、体积比和乳清蛋白浓度等变量的相互作用,优化出最佳提取条件,使上相中αLA的提取率为89%,纯化率为96%,下相中βLG的提取率为96%,纯化率为76%,但此体系对αLA的提取率偏低。
聚(乙二醇ran丙二醇)单丁基醚(聚合物)是一种水溶性聚合物, 可与合适的盐溶液混合, 构成双水相体系。 Chen等[9]利用Poly (ethylene glycolranpropylene glycol)(EOPOL31)/磷酸盐双水相体系结合高效液相色谱法成功分离、富集和测定了牛奶、鸡蛋和虾产品中的环丙沙星(CIP),CIP的萃取率最高可达97.7%。Dembczyński等[10]利用环氧乙烷环氧丙烷共聚物(EO50PO50)/磷酸盐双水相体系分离溶菌酶,并利用响应面模型计算分配系数K和上相中酶的产率,实验结果与响应面模型计算结果一致。本研究采用聚(乙二醇ran丙二醇)单丁基醚(分子量3900)与磷酸盐形成双水相体系, 分离WPI中αLA和βLG, 通过液相色谱监测,系统地研究了双水相体系的pH值、WPI浓度、NaCl添加量和聚合物与磷酸盐体积比对分离效果的影响,优化出最佳提取条件。
2 实验部分
2.1 仪器与试剂
1260半制备液相色谱仪, 配紫外可见检测器 和ChemStation工作站(美国Agilent公司); SC3610型低速离心机(安徽中科中佳科学仪器有限公司);A150011型涡流混匀器(南京佳俊生物有限公司);FE201EL20型pH计,AL04电子分析天平(梅特勒托利多仪器(上海)有限公司)。
WPI(上海诺申食品贸易有限公司,蛋白质含量88%±4.5%);αLA和βLG标准品(美国Sigma公司);聚(乙二醇ran丙二醇)单丁基醚(Poly(ethylene glycolranpropylene glycol) monobutyl ether, Mn~3900,美国Sigma公司);乙腈、三氟乙酸(色谱纯,美国Dikma公司);其它试剂均为分析纯。
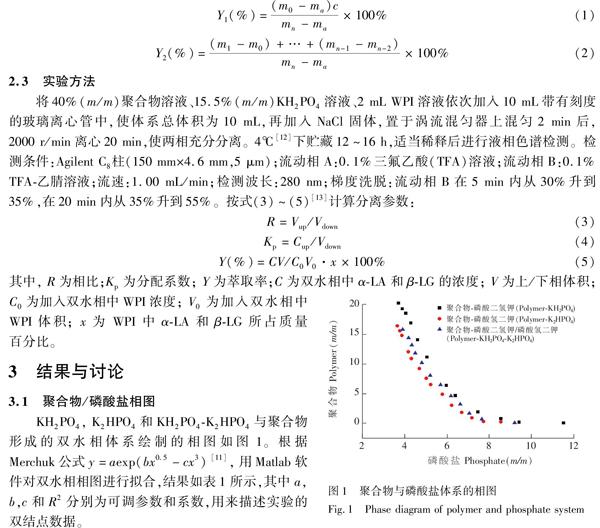
2.2 相图测定
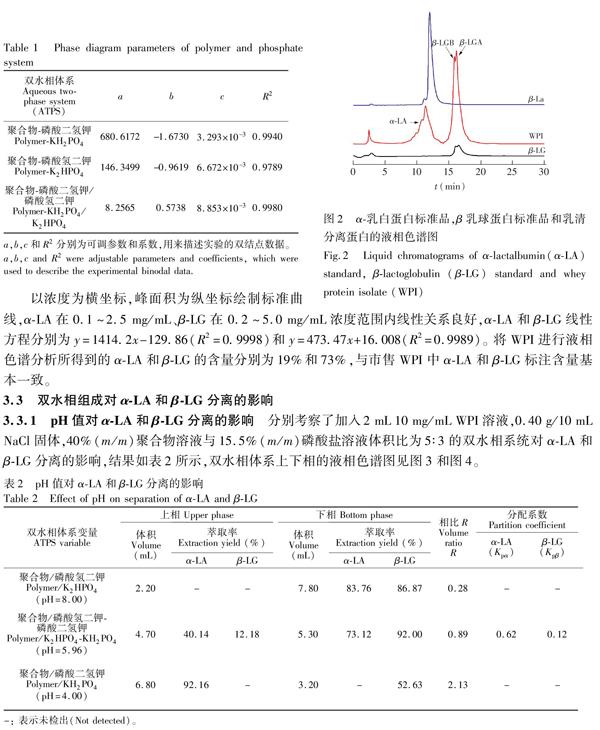
以浓度为横坐标,峰面积为纵坐标绘制标准曲线,αLA在 0.1~2.5 mg/mL、βLG在 0.2~5.0 mg/mL浓度范围内线性关系良好,αLA和βLG线性方程分别为y=1414.2x-129.86(R2=0.9998)和y=473.47x+16.008(R2=0.9989)。 将WPI进行液相色谱分析所得到的αLA和βLG的含量分别为19%和73%,与市售WPI中αLA和βLG标注含量基本一致。
3.3 双水相组成对αLA和βLG分离的影响
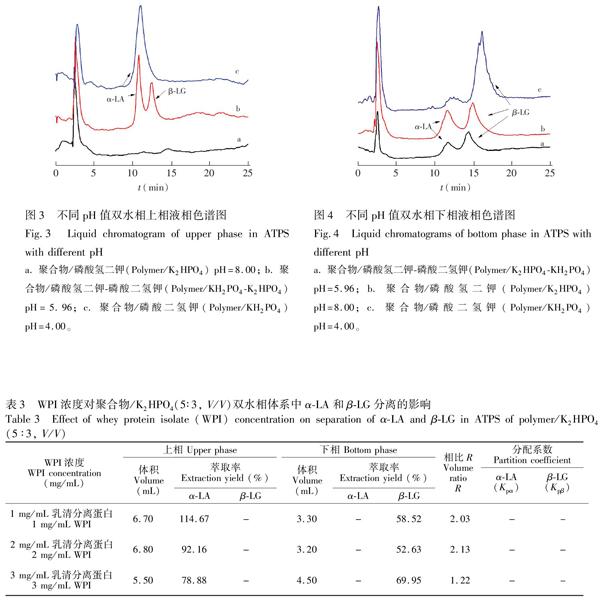
3.3.1 pH值对αLA和βLG分离的影响 分别考察了加入2 mL 10 mg/mL WPI溶液,0.40 g/10 mL NaCl固体,40%(m/m)聚合物溶液与15.5%(m/m)磷酸盐溶液体积比为5∶3的双水相系统对αLA和βLG分离的影响,结果如表2所示,双水相体系上下相的液相色谱图见图3和图4。
WPI浓度不影响聚合物/KH2PO4双水相体系对αLA和βLG分离,但从表3可见,随着WPI浓度增大,αLA萃取率反而下降,WPI浓度大于3 mg/mL时,双水相分界层会有白色沉淀析出,下相体积变大,导致相比变小,同时βLG萃取率变大。当WPI浓度较低时,相比基本相等。而αLA是疏水性蛋白,βLG是亲水性蛋白[16],富含聚合物相比富含盐相具有更大的疏水性,聚合物相中可用于相互作用和溶解的自由水很少,所以加入高浓度WPI的双水相中间层会出现αLA沉淀,导致萃取率显著降低。1 mg/mL WPI对聚合物/KH2PO4双水相体系分离αLA和βLG较为有利。
3.3.3 NaCl添加量對αLA和βLG分离的影响 在聚合物/K2HPO4(5∶3, V/V)双水相体系中分别加入0.30 g/10 mL、0.35 g/10 mL、0.40 g/10 mL NaCl,考察体系对1 mg/mL WPI的萃取效果,如表4。
聚合物/KH2PO4的体积比分别为5 mL∶3 mL和4 mL∶4 mL时,双水相体系能将WPI中αLA和βLG分离,但体积比为5 mL∶3 mL的双水相体系上下相中αLA和βLG萃取率比较低,体积比为3 mL∶5 mL的双水相体系上相中还有部分βLG。从表5可见,聚合物与KH2PO4体积比为4∶4时的双水相体系对αLA和βLG的萃取率更高一些,分离效果也更好。这是因为随着聚合物含量的增加,界面张力增大,同时聚合物相体积增大,相比增大,从而促进其与疏水性蛋白质的相互作用[18]。综合考虑,选取聚合物和磷酸盐的体积比为4 mL∶4 mL, 即相比为1.0时, 为WPI中αLA和βLG的最佳条件。
4 结 论
考察了聚合物(聚(乙二醇ran丙二醇)单丁基醚)/磷酸盐双水相体系分离WPI中αLA和βLG的条件。研究结果表明,在加入40%(m/m)聚合物溶液与15.5%(m/m)KH2PO4溶液体积比为4 mL∶4 mL,加入WPI浓度为1 mg/mL及NaCl固体添加量为0.40 g/10 mL时,构成的双水相系统对αLA和βLG分离效果最佳,αLA和βLG萃取率分别为98.23%和96.56%。αLA和βLG分别进入上下相,有利于后续的进一步分离纯化。与传统的PEG/盐形成的双水相[7,8]萃取αLA和βLG相比,聚合物/KH2PO4双水相分离效果更好,单一变量变化图更直观可见,萃取率更高,聚合物在室温下稳定,萃取过程中无有害物质生成,且聚合物相在较低温度与水溶液形成分层,利用工业化回收进行二次使用,达到了绿色环保的效果。
References
1 Boutin C, Giroux H J, Paquin P, Britten M. Int. Dairy J., 2007, 17(6): 696-703
2 Chatterton D E W, Smithers G, Roupas P, Brodkorb A. Int. Dairy J., 2006, 16(11): 1229-1240
3 Siso M I G. Bioresource Technol., 2006, 57(1): 1-11
4 Alcntara L A P, Minima L A,Minima V P R,Bonomo R C F, Da Silva L H M, Da Silve M C H. J. Chromatogr. B, 2011, 879(21) : 1881-1885
5 Jara F, Pilosof AM R. Food Hydrocoll., 2011, 25(3): 374-380
6 Alcntara L A P, Amaral I V, Bonomo R C F, Da Silva L H M, Da Silva M C H, Minim V P R, Minim L A. Food Bioprod. Process, 2014, 92(4) : 409-415
7 Kalaivani S, Regupathi I. J. Sep. Sci. Technol., 2015, 50(6): 833-840
8 Kalaivani S, Regupathi I. Sep. Purif. Technol., 2015, 146(26): 301-310
9 Chen B, Han J, Wang Y, Sheng C Z, Liu Y, Zhang G C, Yan Y S. Food Chem., 2014, 148(1): 105-111
10 Dembczyński R, Biaas W, Jankowski T . Food Bioprod. Process, 2013, 91(3): 292-302
11 Souza R L, Lima R A, Coutinho J A P, Soares C M F, Lima S. Process Biochem., 2015, 50(9): 1459-1467
12 Dembczyński R, Biaas W, Regulski K, Jankowski T. Process Biochem., 2010, 45(3): 369-374
13 Nandini K E, Rastogi N K. Appl. Biochem. Biotechnol., 2011, 163(1): 173-185
14 Lü H K, Guo D, Jing Z X, Li Y H, REN B Z. Fluid Phase Equilib., 2013, 341(15): 23-29
15 Mokhtarani B, Mortaheb H R, Mafi M, Amini M H. J. Chromatogr. B, 2011, 879(1112): 721-726
16 De Oliveira M C, De Abreu Filho M A N, Pessa Filho P A. Biochem. Eng. J., 2007, 37(3) : 311-318
17 Berggren K, Johansson H O, Tjerneld F. J. Chromatogr. A, 1995, 718(1): 67-79
18 Kalaivani S, Regupathi. J. Bioprocess Biosyst. Eng., 2013, 36(10): 1475-1483
Abstract Poly (ethylene glycolranpropylene glycol) monobutyl ether/phosphate aqueous twophase system (ATPS) coupled with high performance liquid chromatography (HPLC) was developed for the separation of αlactalbumin (αLA) and βlactoglobulin (βLG) in whey protein isolate (WPI). The main parameters relating to this method were investigated and optimized. The effects of pH value, volume ratio of polymer and KH2PO4 solutions, concentration of NaCl and WPI on the partition of αLA and βLG in WPI were investigated. The results showed that efficient separation of both proteins in WPI could be achieved by using the ATPS with 4 mL poly (ethylene glycolranpropylene glycol) monobutyl ether solution (40%, m/m) and 4 mL KH2PO4 solution (15.5%, m/m), 0.40 g/10 mL NaCl, while the concentration of WPI was 1 mg/mL, at pH 4.0. Under the optimized conditions, αLA was separated to the upper phase while βLG to the bottom phase with the yield of 98.2% and 96.6% respectively.
Keywords Aqueous twophase system; Whey protein isolate; Poly (ethylene glycolranpropylene glycol) monobutyl ether; Separation

