两阶段温度控制策略以及助剂促进淀粉分支酶的胞外表达
王驰,李柱,李才明,2,3,顾正彪,2,3*,洪雁,2,3,程力,2,3,李兆丰,2,3*
1(江南大学 食品学院,江苏 无锡,214122) 2(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122) 3(江南大学,食品安全与质量控制协同创新中心,江苏 无锡,214122)
两阶段温度控制策略以及助剂促进淀粉分支酶的胞外表达
王驰1,李柱1,李才明1,2,3,顾正彪1,2,3*,洪雁1,2,3,程力1,2,3,李兆丰1,2,3*
1(江南大学 食品学院,江苏 无锡,214122)2(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)3(江南大学,食品安全与质量控制协同创新中心,江苏 无锡,214122)
为了促进重组淀粉分支酶在枯草芽孢杆菌(BacillussubtilisWB600)中的胞外表达,对重组淀粉分支酶在摇瓶水平上进行了发酵优化。首先,以胞外酶活力为指标,先后考察了初始培养基、pH、培养温度和培养时间4种因素对胞外表达的影响;然后,通过两阶段温度策略和助剂的添加进一步提高胞外表达水平。结果表明,当发酵培养基为TB、pH为7.5时,25 ℃培养24 h后胞外酶活力达到19.9 U/mL;同时,菌体生长最适温度和酶分泌的最适温度是不一致的,通过两阶段温度控制策略(即0~12 h控制温度30 ℃,12 h后温度调至25 ℃),胞外酶活力与单一温度条件下的最高水平(25 ℃)相比提高了1.4倍,达到了47.1 U/mL;在此基础上,进一步添加0.05%的吐温-80,将胞外酶活进一步提高40%,达到65.8 U/mL。
淀粉分支酶;胞外表达;两阶段温度控制策略;发酵优化
近年来,改性淀粉研究成为热点[1-3],而且更加侧重其构效关系的研究[4-6]。通常人们采用物理、化学和酶法对淀粉进行改性,其中酶法改性较物理、化学法更加温和。
淀粉分支酶(Starch Branching Enzyme,SBE)是一种糖基转移酶,通过切开α-1,4-糖苷键连接的葡聚糖链,把切下的非还原末端通过α-1,6-糖苷键连接于受体链上,使得淀粉产生更多分支[7],可以对天然淀粉进行高支化修饰,使得淀粉拥有更好的抗回生性和更好的抗消化性[ 6,8-9]。因此,利用淀粉分支酶制备高支化淀粉是一种新型的改性手段。然而,淀粉分支酶主要来源于植物,而微生物来源的淀粉分支酶又通常是胞内酶,天然菌产酶能力低下,严重制约了该酶的发展应用。为了克服这一缺陷,通过构建基因工程菌实现酶的胞外过量表达是行之有效的途径之一。目前,采用Escherichiacoli过量表达淀粉分支酶已有研究报道[10],本实验室前期研究中已实现了来源于GeobacillusthermoglucosidansSTB02的SBE酶在E.coliBL21(DE3)中的表达,但仅实现了胞内表达[11],而且E.coli表达系统的安全性相对较低,限制了重组淀粉分支酶的应用,尤其是应用于食品领域。相比于E.coli表达系统,枯草芽孢杆菌表达系统是基因工程安全的宿主菌,是良好的分泌型宿主,可以将异源蛋白分泌至胞外而不会形成包涵体。因此,淀粉分支酶在枯草芽孢杆菌中的胞外表达将会为该酶的应用奠定良好基础,也将为该酶的进一步研究提供保障。
本实验室的前期研究已将来源于GeobacillusthermoglucosidansSTB02的SBE酶基因插入质粒pST中,构建了分泌性表达载体sbe/pST,实现了在B.subtilisWB600中的胞外表达,但是初始酶活不高,因此,本研究着重对其发酵条件进行优化,提高其胞外酶活力。
1 材料与方法
1.1材料与仪器
基因工程菌B.subtilisWB600(sbe/pST)保藏于本实验室。
马铃薯支链淀粉标准品购自Sigma-Aldrich(上海)公司;SDS-PAGE凝胶电泳试剂盒购自碧云天生物技术研究所;5种典型的培养基(LB、LB+1%葡萄糖、SOB、SOC和TB)参照文献[12]中方法配置。
ZQZY-70BF振荡培养箱,上海知楚仪器有限公司;G136TR立式压力蒸气灭菌器,致微仪器有限公司;SW-CJ-G 单人净化工作台,苏州净化设备有限公司;3K15型高速冷冻离心机,Sigma-Aldrich(上海)公司;可见光分光光度计(T6-v),南京菲勒仪器有限公司。
1.2实验方法
1.2.1种子培养
将保藏的重组菌B.subtilisWB600(sbe/pST)接100 μL至装有50 mL LB培养基的250 mL三角瓶中,摇床转速为200 r/min,37 ℃,培养8 h。接种前添加终浓度为5 μg/mL的硫酸卡那霉素。
1.2.2摇瓶发酵
将活化好的种子培养液按4%(v/v)的接种量接入50 mL特定发酵培养基的250 mL三角瓶中,转速200 r/min。需要优化的参数是发酵初始培养基,发酵初始pH,发酵温度和时间。各培养基使用前添加5 μg/mL的硫酸卡那霉素。
1.2.3菌体浓度测定
采用OD600值表示。
1.2.4酶活测定方法
参照文献[11]中方法进行,略有改动。将0.9 mL马铃薯支链淀粉溶液[0.25%(w/v)]在50 ℃保温10 min,加入0.1 mL酶液在50 ℃下反应15 min。反应结束后沸水浴灭酶15 min终止反应,10 000 r/min离心2 min待显色用;显色体系为0.3 mL反应液与4.0 mL显色液[0.05%(w/v) KI, 0.005%(w/v) I2, pH 6.0]于7 mL离心管中混合,显色20 min后530 nm处测定吸光值。酶活单位定义:在上述条件下,吸光值每分钟降低1%为1个酶活单位。
1.2.5数据处理
实验结果为3次平行实验的平均值,用平均值和标准偏差表示。采用软件Excel2010(Microsoft公司)分析数据和作图;显著性分析(P< 0.05)采用SPSS软件进行,通过单因素方差分析(ANOVA)、Student-Newman-Keuls (SNK)程序来实现。
2 结果与讨论
2.1初始培养基
将B.subtilisWB600(sbe/pST)分别置于5种较典型的适合B.subtilis生长的培养基(LB、LB+1%葡萄糖、TB、SOB和SOC)中进行发酵,结果如图1所示。在这些培养基中,TB培养基最有利于重组SBE酶的胞外生产,SOC培养基次之。30 ℃下,B.subtlis在TB培养基中培养24 h,胞外酶活达到12.1 U/mL,是在LB培养基中的约8倍。
原因主要包括:(1) TB培养基中磷酸盐缓冲液提供缓冲环境,有利于菌体的生长和重组SBE酶的稳定;(2)相对其他培养基,TB培养基营养丰富,更适合B.subtilis生长,能有更多的菌体生产重组SBE酶。因此,选择TB培养基作为初始培养基。

图1 发酵培养基对重组枯草芽孢杆菌产淀粉>分支酶的影响Fig.1 Effect of culture media on production of starch branching enzyme in the recombinant B.subtilis(每个值为3个单独测定值的平均值,相对偏差小于5%)
2.2发酵初始pH值
在菌体发酵过程中,pH对菌体新陈代谢速度和代谢方式均有影响[13]。因此,有必要对发酵初始pH进行控制。如图2所示,初始pH为6.5~8有利于产酶;在pH5.5~7.5范围内,酶活随着pH值的升高而增大,在pH7.5时达到最大,为13.0 U/mL;随着pH的继续升高,酶活呈现下降趋势,可能是因为碱性条件抑制了菌体生长,同时碱性环境抑制了淀粉分支酶的酶活。

图2 初始pH重组枯草芽孢杆菌产淀粉分支酶的影响Fig.2 Effect of initial pH on production of starch branching enzyme in the recombinant B.subtilis(每个值为3个单独测定值的平均值,相对偏差小于5%)
2.3培养温度和时间
培养温度影响菌体生长和代谢速度,因此有必要控制好培养温度。4种不同培养温度对菌体生长和产酶的影响如图3所示。从图3A可以看出,当发酵时间为12 h时,30 ℃下的酶活最大;进一步发酵至24 h时,25 ℃下的酶活最大,而20 ℃和37 ℃均不利于酶的分泌。从图3B可以看出,发酵前期,随着温度的升高,菌体生长速率加快。可能原因是:(1)温度太低时,菌体代谢速度太慢,限制了重组SBE的胞外表达;(2)温度较高时质粒丢失率较大,稳定性大大降低,从而影响产酶;(3)温度较高时SBE前体蛋白合成速率太快,导致部分在跨膜之前就自发折叠,不能成为正确的构象;(4)温度越高,菌体利用营养的速度加快,当养分利用完全,菌体开始发生自溶。综合考虑,选择25 ℃,发酵24 h为较优条件,酶活达到19.9 U/mL。

A:发酵温度对胞外酶活力的影响;B:发酵温度对菌体生长的影响图3 发酵温度对重组枯草芽孢杆菌产淀粉分支酶的影响Fig.3 Effect of temperature on production of starch branching enzyme in the recombinant B.subtilis(每个值为3次独立实验的平均值,相对偏差小于5%)
2.4两阶段温度控制策略提高酶的胞外表达
温度对微生物的菌体生长和酶的分泌有重大影响,国内外已有学者采用了温度调控策略进行发酵,并取得了一定的效果。李兆丰等[14]采用先25 ℃后30 ℃的策略生产α-CGT酶,酶活相比恒定25 ℃时提高了45%。ZHU等[15]采用先37 ℃后35 ℃的策略生产1,3-丙二醇,产量比恒定35 ℃时提高了11%。从前面实验结果可以看出,在发酵前期0~12 h,30 ℃最有利于重组淀粉分支酶的分泌,从12 h至发酵结束,25 ℃最有利于重组酶的表达。而菌体的生长最适温度37 ℃与酶的最适分泌温度25 ℃是不一致。基于此,尝试两阶段温度控制策略,先利用较高的温度促进菌体生长,再利用较低温度促进其分泌。当在37 ℃或者30 ℃下发酵12 h,然后变温到25 ℃继续发酵12 h,酶活分别为30.3 U/mL和47.1 U/mL,比恒定25 ℃条件下的酶活分别提高了50%和140%。
进一步分析了不同变温时间对胞外酶活的影响。图4A为先37 ℃培养,后变温至25 ℃,发现在前12个小时内变温的酶活均比恒定25 ℃的要高,当变温时间9 h时,酶活最高,达到37.6 U/mL。图4B为先30 ℃培养,后变温至25 ℃。当变温时间为12 h时,酶活最高,达到47.1 U/mL。总发酵时间为24 h。因此,选择较优发酵条件为:以TB为发酵培养基,初始pH为7.5,先在30 ℃下发酵12 h,变温到25 ℃继续发酵12 h。得到的胞外分支酶酶活是单一温度发酵模式最高水平(恒温25 ℃)的2.4倍,达到47.1 U/mL。

A:温度由37 ℃变至25 ℃;B:温度由30 ℃变至25 ℃图4 变温时间对重组枯草芽孢杆菌产淀粉分支酶的影响Fig.4 Effect of temperature-changing time on production of starch branching enzyme in the recombinant B.subtilis(每个值为3次独立实验的平均值,相对偏差小于5%)
2.5助剂的添加对重组淀粉分支酶的胞外表达的影响
有研究表明,在培养基中添加某些助剂,如金属离子、表面活性剂等,对重组酶在B.subtilis中的分泌有一定的促进作用[16-17],李才明等[18]研究发现,0.5 mmol/L 的Fe3+能明显促进β-CGT酶在B.subtilis中的分泌表达;RAO等[19]研究发现SDS、吐温-80对α-淀粉酶的分泌有促进。
在最优发酵条件的基础上,本文进一步尝试了添加几种金属离子和几种表面活性剂,研究其对重组SBE酶在B.subtilis中的分泌表达的影响。
2.5.1添加金属离子对重组SBE酶胞外表达的影响
不同金属离子对重组SBE酶胞外表达的影响如表1所示,在培养基中添加Co3+、Ba2+显著抑制SBE酶的胞外分泌,可能是分泌在培养基中的重组SBE酶的活性中心遭到破坏,从而丧失了分支酶的活性;添加Mg2+、Ca2+和K+对酶活几乎没有影响;添加Na+使得酶活下降5.3%,原因可能是Na+含量增大,改变了细胞膜内外Na+的浓度梯度,影响了蛋白的主动运输;而在培养基中添加0.2 mmol/L Fe3+能够将发酵液中SBE的酶活提高7.2%,有必要对其添加量进一步研究。

表1 金属离子对重组枯草芽孢杆菌产淀粉分支酶的影响
注:1)不加助剂。每个值为3次独立实验的平均值,不同字母表示显著性差异(P< 0.05)。
进一步研究了不同添加量的Fe3+对重组SBE分泌的影响,如表2所示,添加0.3 mmol/L 的Fe3+时胞外酶活最高,比不添加Fe3+提高了8.5%。继续增加Fe3+的浓度,反而会导致酶活下降。

表2 不同浓度Fe3+对重组枯草芽孢杆菌产淀粉分支酶的影响
注:1)不加助剂。每个值为3次独立实验的平均值,字母a表示没有显著性差异(P> 0.05)。
2.5.2添加表面活性剂对重组SBE酶胞外表达的影响
分析了3种不同浓度添加量的吐温-80、SDS、PEG 4000和曲拉通-100对重组酶在B.subtilis中分泌表达的影响。如表3所示,与对照相比,添加0.05%的吐温-80能够将酶活提高40.0%;添加0.10%的SDS能够将酶活提高17.7%;添加0.05%的PEG 4000能够将酶活提高6.4%;而添加曲拉通-100酶活反而使得酶活下降。
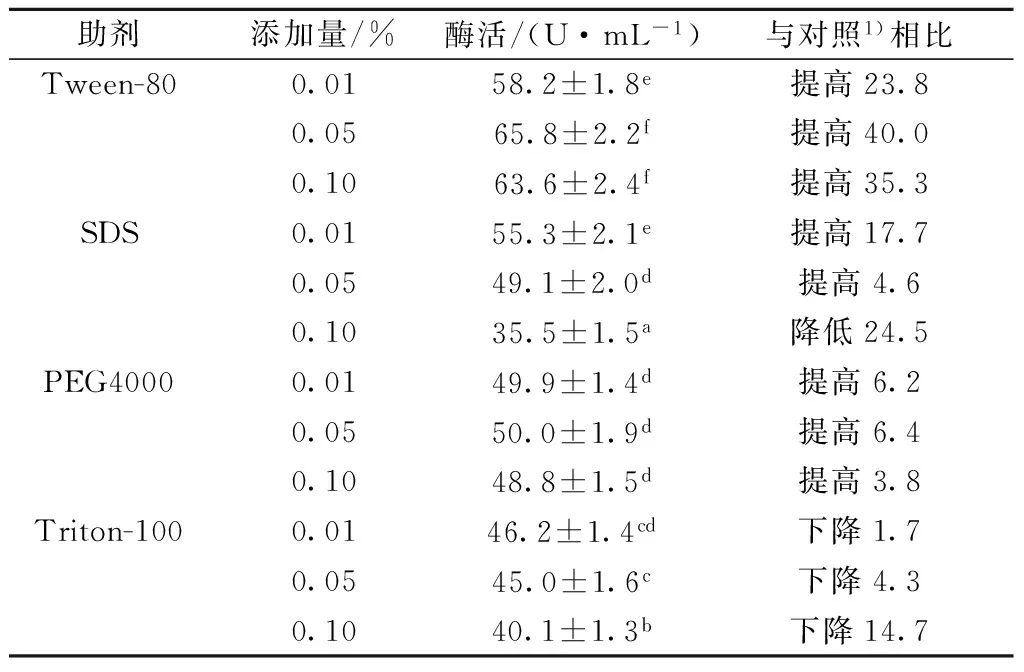
表3 不同表面活性剂对重组枯草芽孢杆菌产淀粉分支酶的影响
注:1)不加助剂。每个值为3次独立实验的平均值,不同字母表示显著性差异(P< 0.05)。
吐温-80是非离子表面活性剂,SDS是阴离子表面活性剂,二者对细胞膜的通透性均有一定的改善作用[20-21];PEG 4000是一种乳化剂,也能改善细胞膜的通透性[22];细胞膜通透性的改善有利于更多的重组SBE酶分泌到胞外[20-22]。随着三者的浓度增加,酶活都出现先增大后降低的趋势,这是因为三者均使得培养基的稠度增大,减少了菌体对氧气的利用率,稠度过高,抑制了菌体的生长[21],不利于酶的分泌表达。曲拉通-100也是一种非离子表面活性剂,当其添加浓度为0.10%时,显著抑制了SBE酶的胞外表达,可能是因为曲拉通-100中的羟基容易与蛋白质分子形成氢键,改变了蛋白质分子的构象,降低蛋白质的活性[23-24]。
2.5.3复合添加Fe3+以及吐温-80对重组SBE酶胞外表达的影响
在培养基中添加0.3 mmol/L 的Fe3+和0.05%的吐温-80,检测出胞外酶活66.0 U/mL,与单独添加0.05%的吐温-80酶活水平接近,说明二种助剂未显示出协同作用。
3 结论
本文对淀粉分支酶的胞外表达体系B.subtilisWB600(sbe/pST)进行了摇瓶优化。在摇瓶发酵优化的基础上,利用两阶段温度控制策略,进一步提高了酶活,达到47.1 U/mL。在此基础上添加微量吐温-80,进一步提高分泌水平达到65.8 U/mL,这是目前国内首次报道对淀粉分支酶在B.subtilis中的胞外表达。虽然在发酵水平上,此胞外表达体系的酶活依然低于其在胞内表达的酶活[11],但是从下游工艺来说,减少了破壁的步骤,大大降低了经济成本;另一方面,B.subtilis的表达体系较大肠杆菌的胞内表达体系,更安全,不易形成包涵体和基本无内毒素[25-26]。
[1]ZHANG Yan-jun,LIU Wei,LIU Cheng-mei,et al.Retrogradation behaviour of high-amylose rice starch prepared by improved extrusion cooking technology[J].Food Chemistry,2014,158:255-261.
[2]JIANG Huan-huan,ZHANG Ya-yuan,HONG Yan,et al.Digestibility and changes to structural characteristics of green banana starch duringinvitrodigestion[J].Food Hydrocolloids,2015,49:192-199.
[3]LEE C K,LE Q T,KIM Y H,et al. Enzymatic synthesis and properties of highly branched rice starch amylose and amylopectin cluster[J].Journal of Agricultural and Food Chemistry,2007,56(1):126-131.
[4]LI Wen-wen,LI Cai-ming,GU Zheng-biao,et al.Relationship between structure and retrogradation properties of corn starch treated with 1,4-α-glucan branching enzyme[J].Food Hydrocolloids,2016,52:868-875.
[5]HOOVER R,HUGHES T,CHUNG H J,et al.Composition,molecular structure,properties,and modification of pulse starches:A review[J].Food Research International,2010,43(2):399-413.
[6]DEMIATE I M,DUPUY N,HUVENNE J P,et al.Relationship between baking behavior of modified cassava starches and starch chemical structure determined by FTIR spectroscopy[J].Carbohydrate Polymers,2000,42(2):149-158.
[7]TETLO I J,EMES M J.A review of starch-branching enzymes and their role in amylopectin biosynthesis[J].IUBMB Life,2014,66(8):546-558.
[8]LE Q T,LEE C K,KIM Y W,et al.Amylolytically-resistant tapioca starch modified by combined treatment of branching enzyme and maltogenic amylase[J].Carbohydrate Polymers,2009,75(1):9-14.
[9]LEE B H,YAN L,PHILLIPS R J,et al.Enzyme-synthesized highly branched maltodextrins have slow glucose generation at the mucosal α-glucosidase level and are slowly digestibleinvivo[J].PloS One,2013,8(4):1-10.
[10]SUZUKI R,KOIDE K,HAYASHI M,et al.Functional characterization of three (GH13) branching enzymes involved in cyanobacterial starch biosynthesis fromCyanobacteriumsp. NBRC 102756[J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics,2015,1 854(5):476-484.
[11]鲍春辉,顾正彪,李才明,等.重组大肠杆菌产淀粉分支酶的发酵条件探索[J].食品工业科技,2014,35(15):155-158.
[12]张佳瑜.软化芽孢杆菌α-环糊精葡萄糖基转移酶在毕赤酵母和枯草杆菌中的表达[D].无锡:江南大学,2010.
[13]ZHANG Xian,BAO Teng,RAO Zhi-ming,et al.Two-stage pH control strategy based on the pH preference of acetoin reductase regulates acetoin and 2, 3-butanediol distribution inBacillussubtilis[J].PloS One,2013,9(3):1 187.
[14]李兆丰.软化类芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中的表达及其产物特异性分析[D].无锡:江南大学,2009.
[15]ZHU Chun-jie,FANG Bai-shan.Application of a two-stage temperature control strategy to enhance 1,3-propanediol productivity byClostridiumbutyricum[J].Journal of Chemical Technology and Biotechnology,2013,88(5):853-857.
[16]GAWANDE B N,SINGH R K,CHAUHAN A K,et al.Optimization of cyclomaltodextrin glucanotransferase production fromBacillusfirmus[J].Enzyme and Microbial Technology,1998,22(4):288-291.
[17]GAWANDE B N,PATKAR A Y.Application of factorial designs for optimization of cyclodextrin glycosyltransferase production fromKlebsiellapneumoniaeAS-22[J].Biotechnology and Bioengineering,1999,64(2):168-173.
[18]李才明.β-环糊精葡萄糖基转移酶在枯草杆菌中的分泌表达及其热稳定性研究[D].无锡:江南大学,2014.
[19]UMA MAHESWAR RAO J L,SATYANARAYANA T.Enhanced secretion and low temperature stabilization of a hyperthermostable and Ca2+-independent α-amylase ofGeobacillusthermoleovoransby surfactants[J].Letters in Applied Microbiology,2003,36(4):191-196.
[20]NE'EMAN Z,KAHANE I,RAZIN S.Characterization of the mycoplasma membrane proteins II.Solubilization and enzymic activities ofAcholeplasmalaidlawiimembrane proteins[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,1971,249(1):169-176.
[21]TANGNU S K,BLANCH H W,Wilke C R.Enhanced production of cellulase,hemicellulase,and β-glucosidase byTrichodermareesei(Rut C-30)[J].Biotechnology and Bioengineering,1981,23(8):1 837-1 849.
[22]ANDERSSON E,Hahn-Hägerdal B.High concentrations of PEG as a possible uncoupler of the proton motive force:α-amylase production withBacillusamyloliquefaciensin aqueous two-phase systems and PEG solutions[J].Applied Microbiology and Biotechnology,1988,29(4):329-336.
[23]SRIVASTAVA R A K, Baruah J N.Culture conditions for production of thermostable amylase byBacillusstearothermophilus[J].Applied and Environmental Microbiology,1986,52(1):179-184.
[24]张剑,田辉,张开诚.环境介质对β-淀粉酶活性的影响[J].中国调味品,2008(7):50-53.
[25]SIETSKE A,DIDERICHSEN B.On the safety ofBacillussubtilisandB.amyloliquefaciens:a review[J].Applied Microbiology and Biotechnology 1991,36(1):1-4.
[26]夏雨.枯草芽孢杆菌食品级表达系统的构建和分泌表达研究[D].无锡:江南大学,2007.
Higher extracellular expression of starch branching enzyme by two-staged temperature strategy and additives
WANG Chi1,LI Zhu1,LI Cai-ming1,2,3,GU Zheng-biao1,2,3*,HONG Yan1,2,3,CHENG Li1,2,3,LI Zhao-feng1,2,3*
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)2(The Start Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China)3(Collaborative Innovation Center for Food Safety and Quality Control, Jiangnan University, Wuxi 214122, China)
The fermentation conditions were optimized in the shake flask in order to further enhance the extracellular expression of recombinant Starch Branching Enzyme (SBE) byBacillussubtilisWB600. Effects of four factors including culture media, initial pH, temperature and culture time were firstly investigated in succession on extracellular expression with extracellular enzyme activity as an index. The level of extracellular expression was further improved by a two-staged temperature strategy. The results showed that the extracellular SBE activity was 19.9 U/mL while the culture was performed in TB medium, pH7.5, at 25 ℃ for 24 h. Meanwhile the optimum temperature for cell growth is inconsistent with that for secretion. By the two-staged temperature strategy (temperature was controlled at 30 ℃ for the first 12 h and then switched to 25 ℃ till the end of the fermentation), the extracellular activity reached 47.1 U/mL, increased by 140% compared to the constant temperature operation at 25 ℃. It was further increased by 40% to 65.8 U/mL after addition of Tween-80(0.05%,w/v).
starch branching enzyme (SBE); extracellular expression; two-staged temperature strategy; optimization of fermentation
10.13995/j.cnki.11-1802/ts.201608004
硕士研究生(顾正彪教授和李兆丰副教授为共同通讯作者,E-mail: zhengbiaogu@jiangnan.edu.cn; zfli@jiangnan.edu.cn)。
高校博士点基金专项课题优先发展领域课题(20130093130001);中国博士后科学基金-面上资助(2014M560394);江苏省博士后科研资助计划(1401100C);江苏省科技支撑计划-农业部分(BE2014305)。
2016-02-07,改回日期:2015-03-18

