冬虫夏草西洋参复合物增强免疫力功能实验研究
邱涵 吕晓君 张鹏
[摘要] 目的 研究冬蟲夏草西洋参复合物对小鼠免疫功能的影响。 方法 将SPF级昆明种雌性小鼠200只随机分为5个实验组,每个实验组动物分为阴性对照组和冬虫夏草西洋参复合物高、中、低剂量组(0.9、0.6、0.3 g/kg)。阴性对照组给予蒸馏水,连续灌胃30 d,每日1次。检测冬虫夏草西洋参复合物对ConA诱导的小鼠脾淋巴细胞转化能力、迟发型变态反应、血清溶血素水平、抗体生成细胞数、小鼠碳廓清能力、小鼠腹腔巨噬细胞吞噬鸡红细胞能力及NK细胞活性等免疫指标的影响。 结果 与阴性对照组比较,冬虫夏草西洋参复合物高、中、低剂量组能明显促进小鼠迟发型变态反应(P < 0.01),升高血清溶血素水平(P < 0.05或P < 0.01);冬虫夏草西洋参复合物中、低剂量组可显著提高碳廓清能力(P < 0.05或P < 0.01),高、中剂量组可显著增强NK细胞活性(P < 0.05);但冬虫夏草西洋参复合物各剂量组对小鼠体重、胸腺/体重比值、脾脏/体重比值、脾淋巴细胞增值转化能力、抗体生成细胞数及巨噬细胞吞噬鸡红细胞作用无明显影响(P > 0.05)。 结论 冬虫夏草西洋参复合物具有增强小鼠免疫力的功能。
[关键词] 冬虫夏草;西洋参;免疫功能;小鼠
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2016)03(c)-0018-05
[Abstract] Objective To study the impact of Cordyceps and Panacis Quinquefolii Radix Compound on immunity function in mice. Methods A total of 200 SPF Kunming female mice were randomly divided into 5 batches, each of which consisted of negative control group and high, medium and low dosage (0.9, 0.6, 0.3 g/kg) of Cordyceps and Panacis Quinquefolii Radix Compound group. The negative control group was given distilled water, each mouse was orally administered once a day, for 30 days. The immune indexes including ConA-induced lymphocyte transformation ability, delayed type hypersensitivity, serum hemolysin level, antibody producing cell count, carbon clearance ability, macrophage phagocytosis of chicken erythrocytes capacity and NK cell activity were detected. Results Compared with the negative control group, high, medium and low dosage of Cordyceps and Panacis Quinquefolii Radix Compound group could significantly strengthen the delayed type hypersensitivity of mice (P < 0.01), increase the level of serum hemolysin (P < 0.05 or P < 0.01). The medium and low dosage of Cordyceps and Panacis Quinquefolii Radix Compound group could significantly strengthen carbon clearance ability of mice (P < 0.05 or P < 0.01), the high and medium dosage of Cordyceps and Panacis Quinquefolii Radix Compound group could significantly strengthen NK cells activity of mice (P < 0.05). However, Cordyceps and Panacis Quinquefolii Radix Compound had no significant effects on body weight increase, ratio of spleen weight to body weight, ratio of thymus weight to body weight, lymphocyte transformation ability of mice induced by ConA and macrophage phagocytosis of chicken erythrocytes capacity (P > 0.05). Conclusion Cordyceps and Panacis Quinquefolii Radix Compound can enhance immunity function in mice.
[Key words] Cordyceps; Panacis Quinquefolii Radix; Immunity function; Mice
冬虫夏草,又名虫草,是我国特有的珍稀名贵药材,其主要化学成分中的腺苷和多糖是冬虫夏草生理活性最显著的物质,研究提示冬虫夏草多糖和腺苷具有增强免疫力的作用[1-2]。西洋参,又名西洋人参、洋参、花旗参、广东人参,其主要化学成分中的西洋参皂苷是生理活性最显著的物质,研究提示,西洋参皂苷和多糖等成分具有增强免疫力的作用[3-5]。传统中医理论认为,免疫力低下属于中医正气不足的范畴,是由于正气不足,身体各种功能下降,从而出现不能抵御外邪等一系列正虚的症状,其病机为正气虚弱,多采用扶助正气、固本培元法进行治疗[6-7]。《本草纲目拾遗》中记载冬虫夏草具有滋补强身、补精益气之功效,西洋参具有生津止渴、补血养阴、健脾益气之功效。本研究依照《保健食品检验与评价技术规范》[8]中有关增强免疫力功能的检测方法,研究冬虫夏草西洋参复合物是否具有增强免疫力的作用。
1 材料与方法
1.1 受试物
冬虫夏草西洋参复合物购自北京海德润制药有限公司(批号20141210),性状为黄白色至浅灰色粉末。保存条件:密闭置于常温干燥处,保质期:24个月。
1.2 实验动物
SPF级昆明小鼠,200只,雌性,3周龄,体重18~22 g,由武汉生物制品研究所提供,实验动物生产许可证号:SCXK(鄂)2012-0003。饲养条件:实验动物饲养于湖北省食品药品监督检验研究院,实验动物使用许可证号:SYXK(鄂)2014-0009。光照为12 h明暗交替,温度20~26℃,相对湿度40%~70%。
1.3 仪器与试剂
AB204-S电子分析天平(梅特勒-托利多仪器有限公司);JM5102电子秤(余姚市纪铭称重校验设备有限公司);3K15台式冷冻离心机(Sigma公司);二氧化碳培养箱(SHEL-LAB公司);ELX800酶标仪(BIOTEK公司);BX53显微镜(日本OLYMPUS公司);AU400全自动生化仪(日本OLYMPUS公司)。RPMI 1640培养基、刀豆蛋白A(ConA)、CCK-8、Hank液、二硝基氟苯(DNFB)、绵羊红细胞(SRBC)、印度墨汁、Na2CO3、鸡红细胞、YAC-1细胞、乳酸脱氢酶(LDH)检测试剂盒。
1.4 方法
1.4.1 实验分组及受试物给予方式 小鼠按体重随机分为20组,每组10只。将20组小鼠分成5个实验组,每个实验组的40只动物分为4组(冬虫夏草西洋参复合物高、中、低剂量组及阴性对照组)。第1实验组:ConA诱导的小鼠淋巴细胞转化实验和NK细胞活性测定;第2实验组:迟发型变态反应(DTH)实验;第3实验组:血清溶血素测定和抗体生成细胞检测;第4实验组:小鼠碳廓清实验、胸腺和脾脏脏/体比值;第5实验组:小鼠腹腔巨噬细胞吞噬鸡红细胞实验。设冬虫夏草西洋参复合物高、中、低剂量分别为0.9、0.6、0.3 g/kg,相当于人体推荐量的30、20、10倍剂量。临用前用蒸馏水配制浓度为0.045、0.030、0.015 g/mL。各组小鼠灌胃体积为20 mL/kg。阴性对照组给予等体积蒸馏水。每天灌胃1次,连续30 d。
1.4.2 体重及淋巴器官脏器/体重比值测定 每周称量所有动物体重,结束时处死小鼠。取出第4实验组小鼠的胸腺和脾脏,称重并计算脏/体比值。脏/体(%)=脏器重量/动物体重×100%。
1.4.3 ConA诱导的小鼠淋巴细胞转化实验(CCK-8法)及NK细胞活性测定(LDH测定法) 末次给予受试样品后,处死小鼠,无菌操作下取脾,研磨制成单个脾细胞悬液后分成两份(1号和2号),过200目筛网后Hank液洗2次,用RPMI 1640培养液调整细胞浓度至3×106个/mL(1号悬液)和2×107个/mL(2号悬液)。1号悬液用CCK-8法检测经ConA诱导的小鼠淋巴细胞的增殖能力;以2号悬液为效应细胞,取对数生长期的YAC-1细胞,调整细胞终浓度至4×105个/mL作为靶细胞,依照LDH测定法进行检测,全自动生化分析仪检测LDH含量,计算NK细胞活性。
1.4.4 二硝基氟苯诱导的小鼠DTH实验(耳肿胀法) 用1% DNFB致敏小鼠5 d后,再用1% DNFB刺激右耳,24 h后处死动物剪下左右耳壳。用打孔器取下直径8 mm的耳片后分别称重,以左右耳的重量之差来反映DTH的程度。
1.4.5 血清溶血素测定(血凝法)及抗体生成细胞检测(Jerne改良玻片法) 将脱纤维处理后的羊血用生理盐水洗涤3次,1500 r/min离心10 min。每只鼠经腹腔注射2%(V/V)SRBC 0.2 mL进行免疫。第5天按“血凝法”标准观察血球凝集程度进行血清溶血素的测定,计算抗体水平。随后处死小鼠,制备脾细胞悬液,调整细胞浓度为5×106个/mL。按“Jerne改良玻片法”标准进行检测,计数溶血空斑数,以空斑数/106脾细胞表示抗体生成细胞数。
1.4.6 小鼠碳廓清实验 末次给予受试物后,称体重,从小鼠尾静脉10 mL/kg注入稀释4倍的印度墨汁,注入后2、10 min,分别从内眦静脉丛取血20 μL,并立即加到2 mL 0.1% Na2CO3溶液中。以0.1% Na2CO3溶液作空白对照,酶标仪检测600 nm波长处的OD值。将小鼠处死,取肝脏和脾脏,称重,计算吞噬指数。
1.4.7 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(滴片法) 每只小鼠腹腔注射2%(V/V)SRBC 0.2 mL。96 h后颈椎脱臼处死小鼠,按“滴片法”检测,计算吞噬率和吞噬指数。
1.5 统计学方法
采用SPSS 17.0软件进行统计分析,计量资料采用均数±标准差(x±s)表示,采用单因素方差分析(One-way ANOVA,方差齐性采用Dunnett检验,方差不齊采用Dunnett T3检验)和非参数检验统计学处理。以P < 0.05为差异有统计学意义。
2 结果
2.1 冬虫夏草西洋参复合物对小鼠体重的影响
冬虫夏草西洋参复合物各剂量组小鼠整个试验过程中体重与阴性对照组比较,差异无统计学意义(P > 0.05)。见表1。
2.2 冬虫夏草西洋参复合物对小鼠淋巴器官脏器/体重比值的影响
冬虫夏草西洋参复合物各剂量组小鼠胸腺/体重比值和脾脏/体重比值与阴性对照组比较,差异无统计学意义(P > 0.05)。见表2。
2.3 冬虫夏草西洋参复合物对ConA诱导小鼠淋巴细胞转化的影响
冬虫夏草西洋参复合物各剂量组小鼠加ConA孔与不加ConA孔OD的差值,与阴性对照组比较差异无统计学意义(P > 0.05),说明其不能增强ConA诱导的小鼠脾淋巴细胞增殖能力,判定该实验结果阴性。见表3。
2.4 冬虫夏草西洋参复合物对DNFB诱导小鼠DTH反应的影响
冬虫夏草西洋参复合物各剂量组均能促进小鼠对DNFB诱发的DTH反应,与阴性对照组比较差异有高度统计学意义(P < 0.01),判定该实验结果阳性。见表4。
2.5 冬虫夏草西洋参复合物对小鼠抗体生成细胞的影响
冬虫夏草西洋参复合物各剂量组的溶血空斑数与阴性对照组比较,差异无统计学意义(P > 0.05),说明其不能增强抗体生成细胞能力,判定该实验结果阴性。见表5。
2.6 冬虫夏草西洋参复合物对小鼠血清溶血素抗体水平的影响
冬虫夏草西洋参复合物各剂量组均能升高血清溶血素水平,与阴性对照组比较差异有统计学意义(P < 0.05或P < 0.01),判定该实验结果阳性。见表6。
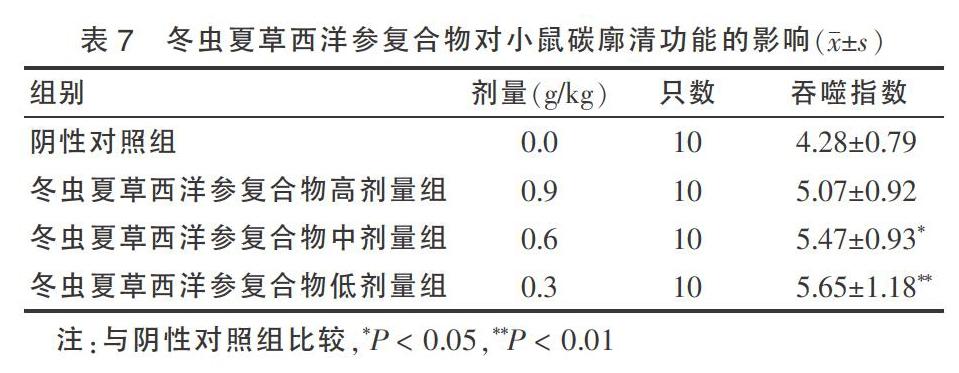
2.7 冬虫夏草西洋参复合物对小鼠碳廓清功能的影响
冬虫夏草西洋参复合物中、低剂量组可提高小鼠碳廓清吞噬指数,与阴性对照组比较差异有统计学意义(P < 0.05或P < 0.01),判定该实验结果阳性。见表7。
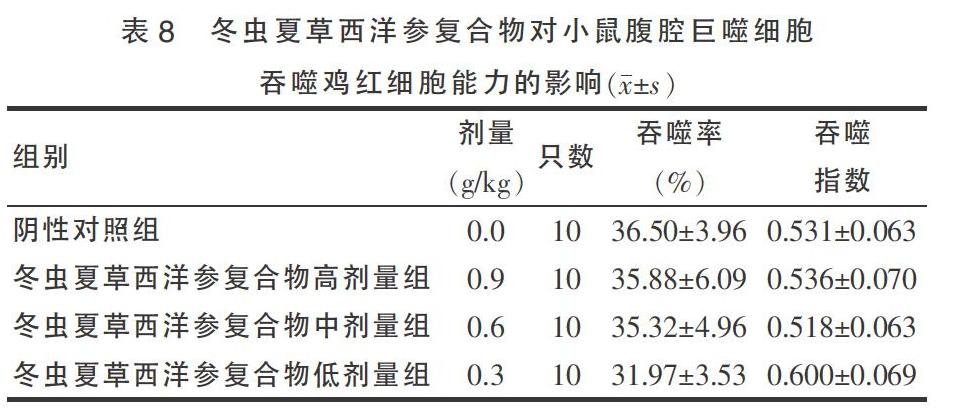
2.8 冬虫夏草西洋参复合物对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
冬虫夏草西洋参复合物各剂量组均不能提高吞噬率和吞噬指数,与阴性对照组比较差异无统计学意义(P > 0.05)。见表8。
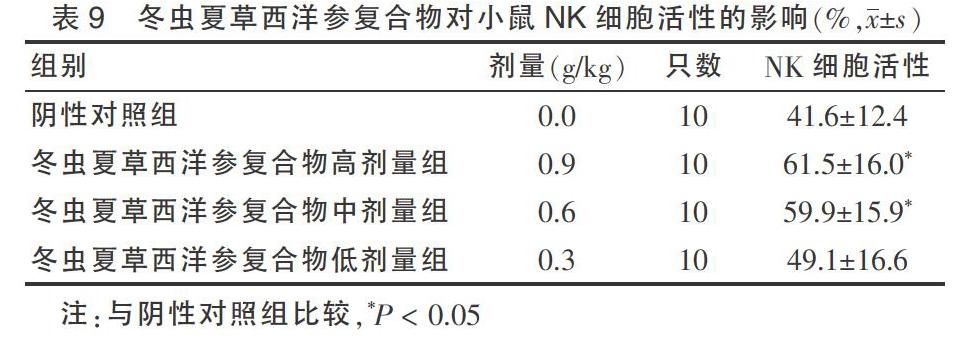
2.9 冬虫夏草西洋参复合物对小鼠NK细胞活性的影响
冬虫夏草西洋参复合物高、中剂量组能增强小鼠NK细胞活性,与阴性对照组比较差异有统计学意义(P < 0.05),判定该实验结果阳性。见表9。
3 讨论
免疫是机体对一切异物或抗原性物质进行非特异或特异性识别和排斥清除的一种生理学功能[9],主要包括细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞功能四大方面[10-11]。大量研究提示,冬虫夏草能够活化NK细胞[12],T、B细胞[13-14]以及单核-巨噬细胞[15-16]等特异性或者非特异性淋巴细胞,从而起到对机体的免疫保护作用[17]。国内外学者也提示了西洋参多糖具有明显的提高免疫力的作用[18-20],为验证两者合用对机体是否具有免疫调节功能,本研究从细胞免疫、体液免疫、吞噬功能、NK细胞功能检测冬虫夏草西洋参复合物对小鼠免疫功能的影响,并观察其对动物体重和免疫器官的影响,结果显示:DNFB诱导小鼠DTH实验中,冬虫夏草西洋参复合物各剂量组左右耳片重量差值与阴性对照组比较有显著性差异,可促进小鼠DTH;血清溶血素测定实验中,冬虫夏草西洋参复合物各剂量组抗体水平与阴性对照组比较差异有显著性意义,可提高血清溶血素水平;碳廓清实验中,冬虫夏草西洋参复合物中、低剂量组吞噬指数与阴性对照組比较差异有显著性意义,可提高小鼠巨噬细胞吞噬能力;NK细胞活性测定实验中,冬虫夏草西洋参复合物高、中剂量组LDH含量与阴性对照组比较差异有显著性意义,可增强小鼠NK细胞活性。
机体的免疫作用主要通过激活巨噬细胞、促进T细胞转化、提高B淋巴细胞和NK细胞的活性,同时激活网状内皮系统和补体系统等来完成[20]。DTH是T细胞介导的一种超敏反应,用变应原(DNFB)刺激小鼠时T淋巴细胞会增殖成致敏淋巴细胞,部分还会分化成记忆细胞,当再次用同种变应原刺激时,记忆细胞会迅速增殖,发生以单核细胞浸润为主的炎性反应,属于细胞免疫应答功能;血清溶血素测定是B淋巴细胞产生抗SRBC抗体使致敏红细胞溶解的溶血反应,属于体液免疫应答功能;巨噬细胞可通过直接吞噬外来异物或自身衰老的细胞来发挥提高机体免疫力的作用,当墨汁被注入到小鼠尾静脉血液中,血液中的外周血单核巨噬细胞会吞噬异物颗粒,可用巨噬细胞的吞噬指数反映其吞噬能力;活细胞的胞浆内含有LDH,NK细胞具有自然杀伤活性及抗肿瘤作用,当YAC-1细胞(小鼠淋巴瘤细胞)受到NK细胞杀伤后,LDH释放到细胞外,因此通过检测细胞上清液的LDH含量来反映NK细胞的活性。因此,本研究结果提示,冬虫夏草西洋参复合物对小鼠细胞免疫功能、体液免疫功能、吞噬功能和NK细胞活性均有增强作用,促进了小鼠的特异性免疫和非特异性免疫。根据《保健食品功能学评价程序和检验方法》中增强免疫力实验结果判定标准,认为冬虫夏草西洋参复合物具有增强免疫力的作用。
[参考文献]
[1] 俞丽霞,张冰冰,阮叶萍,等.虫草多糖不同组分的免疫活性研究[J].浙江中医学院学报,2004,28(1):49-50.
[2] 蔡溱,陈方剑,陆松伟,等.冬虫夏草胶囊对免疫抑制小鼠免疫功能的影响[J].解放军药学学报,2014,30(2):118-121.
[3] 舒思洁.西洋参及其活性成分的药理学研究进展[J].时珍国医国药,2006,17(12):2603-2604.
[4] 赵云利,吴华彰,杨晶.西洋参皂甙对免疫抑制小鼠免疫功能的影响[J].中国生物制品学杂志,2011,24(3):305-308.
[5] 于永超,张佳丽,林兵,等.西洋参多糖对钴-60辐照小鼠的免疫调节作用[J].现代预防医学,2012,11(39):2685-2687.
[6] 温文,蒋筱.中医非药物疗法对癌症患者免疫力的影响[J].大众科技,2014,16(182):121-123.
[7] 李正本,于明鹤,王国辉.中草药对免疫功能的影响[J].广东畜牧兽医科技,2006,31(3):18-19.
[8] 中华人民共和国卫生部.保健食品检验与评价技术规范[S].北京:中华人民共和国卫生部,2003:22-34.
[9] 钟建春,张艳,丁振涛,等.人工冬虫夏草多糖提取物对小鼠免疫功能的影响[J].中山大学学报,2011,50(6):99-102.
[10] 高旭,李丽芬,刘斌钰.黄芪多糖对小鼠免疫功能影响的实验研究[J].山西大同大学学报,2010,26(4):42-44.
[11] 张擎,胡质毅,王荃,等.灵芝菌丝体碱提多糖对小鼠细胞免疫的作用[J].中山大学学报,2005,44(5):79-82.
[12] 申玲玲,杜光.冬虫夏草在免疫疾病方面应用进展[J].医药导报,2009,28(10):1316-1318.
[13] Zhang J,Yu Y,Zhang Z,et al. Effect of polysaccharide from cultured Cordyceps sinensis on immune function and anti-oxidation activity of mice exposed to 60Co [J]. Int Immunopharmacol,2011,11(12):2251-2257.
[14] 陈露,安利国.虫草多糖的免疫调节作用及其抗肿瘤活性的研究[J].山东师范大学学报,2009,24(4):109.
[15] 闫文娟,李泰辉,谢意珍.冬虫夏草固体发酵物水提液对免疫功能低下小鼠的影响[J].食用菌学报,2013,20(1):75-79.
[16] 葉小弟,郑高利.冬虫夏草及其菌丝体多糖免疫药理学研究进展[J].中国中医药科技,2014,21(1):107-109.
[17] Wang M,Guilbert LJ,Li J,et al. A proprietary extract from North American ginseng(Panax quinquefolium)enhances IL-2 and IFN-gamma productions in murine spleen cells induced by Con-A [J]. Int Immunopharmacol,2004,4(2):311-315.
[18] 杨修仕,周闲容,王丽君,等.西洋参多糖的超滤分离及其免疫增强活性研究[J].山东师范大学学报,2014,35(5):49-52.
[19] 杜宏举,马玲,郑珊,等.黄芪配伍西洋参对小鼠免疫功能的影响[J].首都公共卫生,2013,7(6):248-251.
[20] 张小梅.黄芪多糖的免疫调节作用及抗肿瘤研究进展[J].大连大学学报,2003,24(6):101-104.
(收稿日期:2015-12-23 本文编辑:张瑜杰)

