参芍口服液对糖尿病肾病大鼠肾脏NLRP3炎症复合体相关蛋白表达的影响
李海鸥,张红利,贾春新,周洪霞,张春来
(1唐山工人医院,唐山063000;2华北理工大学)
参芍口服液对糖尿病肾病大鼠肾脏NLRP3炎症复合体相关蛋白表达的影响
李海鸥1,张红利1,贾春新1,周洪霞2,张春来1
(1唐山工人医院,唐山063000;2华北理工大学)
目的探讨参芍口服液对糖尿病肾病(DN)模型大鼠肾脏核苷酸结合寡聚化结构域样受体3炎症性复合体(以下简称NLRP3炎症体)表达的影响及对肾脏的保护作用。方法 选择健康雄性Wistar大鼠45只,随机分为模型组、治疗组、对照组各15只。模型组、治疗组予一次性腹腔注射STZ制备DN模型,对照组腹腔注射等剂量的生理盐水。造模成功后,治疗组给予参芍口服液250 mg/(kg·d)灌胃,对照组和模型组给予等量生理盐水灌胃,均干预12周。各组大鼠干预12周后,以代谢笼收集24 h尿液,检测24 h尿量及尿蛋白定量(PRO),断尾取血测定血糖、血清Scr、血BUN。采用Masson染色法观察肾脏组织病理改变。采用免疫组化法检测肾脏组织NLRP3炎症体成分核苷酸结合寡聚化结构域样受体3(NLRP3)、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)、IL-1β蛋白定性表达,采用Western blot法检测肾脏组织NLRP3、Caspase-1、IL-1β蛋白表达量。结果 治疗组、对照组血糖、24 h尿量、PRO、血Scr、血BUN均低于模型组(P均<0.05)。模型组肾小球中重度纤维化,系膜基质重度增生,基底膜明显增厚;治疗组病理改变较模型组明显减轻。模型组肾脏组织中NLRP3、Caspase-1及IL-1β的定性及定量表达均高于对照组及治疗组(P均<0.05)。结论 参芍口服液可降低DN大鼠血糖水平、减轻肾脏纤维化、保护肾功能,其机制可能与降低肾脏组织中NLRP3炎症体相关蛋白NLRP3、Caspase-1、IL-1β 的表达有关。
参芍口服液;糖尿病肾病;核苷酸结合寡聚化结构域样受体3;半胱氨酸天冬氨酸蛋白酶1;白细胞介素-1β
糖尿病肾病(DN)是糖尿病最重要的微血管并发症之一,是导致终末期肾衰竭及糖尿病患者死亡的重要原因之一。肾小管间质纤维化是各种慢性肾脏疾病进行性发展的共同病理生理过程。炎症及免疫反应是参与肾小管间质病变的重要驱动力[1,2]。核苷酸结合寡聚化结构域样受体3炎症性复合体(以下简称NLRP3炎症体)是以核苷酸结合寡聚化结构域样受体3(NLRP3)为基础骨架,凋亡相关斑点样蛋白(ASC)、半胱氨酸天冬氨酸蛋白酶前体(Pro-Caspase-1)衔接组成的蛋白炎症复合体,作用于IL-1β前体使其剪切为有活性的IL-1β,从而发挥生物学作用[4]。NLRP3炎症体在2型糖尿病[5]、痛风[6]、阿尔兹海默病[7]、动脉粥样硬化[8]和肿瘤等非细菌性炎症疾病的发病中均有一定作用,但在DN发病中的作用尚不完全明确。参芍口服液是以丹参、黄芪及赤芍等精制而成的中药复方制剂。以往研究证实,参芍口服液可以阻断糖尿病心肌病变组织中的炎症反应,抑制心肌纤维化[9,10]。2014年7~10月,我们对DN模型大鼠予参芍口服液灌胃干预,观察其对NLRP3炎症体相关蛋白NLRP3、Caspase-1及 IL-1β表达的影响,探讨参芍口服液治疗DN的作用机制,为其临床应用提供实验依据。
1 材料与方法
1.1动物及试剂健康雄性Wistar大鼠45只,体质量(160±20)g,SPF级,由河北联合大学实验动物中心提供。参芍口服液(唐山工人医院制剂室制备)药物组成:丹参250 g,黄芪250 g,赤芍150 g,当归150 g,川芎75 g,桃仁125 g,红花75 g,水蛭187.5 g,地龙250 g,清半夏125 g。链脲佐菌素(STZ)购于美国 Sigma公司;兔抗鼠NLRP3、IL-1β多克隆抗体购于美国Novus公司;Caspase-1购于美国Abcam公司;免疫组化试剂盒购于福州迈新生物技术开发公司;封闭用正常山羊血清工作液、Masson试剂盒、显色试剂盒均购于北京中杉金桥生物技术公司。
1.2分组及模型制备将大鼠按随机数字表法分为模型组、治疗组、对照组各15只,以标准饮食喂养。模型组、治疗组禁食、禁饮12 h后,予一次性腹腔注射STZ 25 mg/kg制备DN模型。第3天时监测空腹血糖、尿糖、尿量、24 h尿微量白蛋白排泄率的变化,若连续3次空腹血糖>16.7 mmol/L、尿糖强阳性、尿量>对照组的150%、24 h尿微量白蛋白排泄率>30 mg/24 h,则为造模成功。对照组腹腔注射等剂量的生理盐水。
1.3干预方法造模成功后,治疗组给予参芍口服液250 mg/(kg·d)灌胃,对照组和模型组给予等量生理盐水灌胃,均干预12周。
1.4血糖及肾功能指标检测各组大鼠饲养12周后,以代谢笼收集24 h尿液,检测24 h尿量及尿蛋白定量(PRO)。然后断尾取血,测定血糖、血清Scr、血BUN水平。
1.5肾脏组织病理观察采用Masson染色法。各组大鼠取血后,麻醉状态下迅速取出肾脏,制作石蜡切片,常规脱蜡,经丽春红染色液染色,依次用乙酸溶液、磷钼酸溶液、乙酸溶液冲洗后,苯胺蓝染色液染色,苏木素染色复染。光镜下观察肾脏胶原纤维的染色情况。
1.6肾脏组织NLRP3、Caspase-1、IL-1β蛋白定性表达检测采用免疫组化法。肾组织石蜡切片脱蜡,行微波抗原修复,分别滴加兔抗鼠多克隆抗体NLRP3、IL-1β及兔抗鼠单克隆抗体Caspase-1,4 ℃过夜,PBS冲洗后加入二抗工作液,DAB溶液染色,苏木素复染。阴性对照以PBS代替一抗。采用光学显微镜观察采集图像。NLRP3、Caspase-1和IL-1β主要表达于细胞质,以细胞质出现棕黄色颗粒为阳性,用PBS代替一抗作阴性对照。用DAB染色,采用免疫组化图像软件分析结果。每个切片随机测定3个视野,应用Image Pro Plus图像分析软件,测量每一视野中阳性染色区域的积分光密度值(IOD)与测量区域的面积,计算平均光密度值。
1.7肾脏组织NLRP3、Caspase-1、IL-1β蛋白定量表达检测采用Western blot法。将样品蛋白加上样缓冲液以120 g/L,目的条带电转印法转印至PVDF 膜上,TBST缓冲液封闭,检测NLRP3、Caspase-1、IL-1β蛋白表达量。特异性抗体孵育,曝光、显影、定影。图像分析系统扫描并定量分析胶片条带的光密度值,以目的蛋白与GAPDH的比值代表目的条带的相对表达量。每个蛋白重复3次实验。

2 结果
2.1三组血糖、肾功能指标结果比较治疗组、对照组血糖、24 h尿量、PRO、血Scr、血BUN均低于模型组(P均<0.05)。见表1。

表1 各组血糖及肾功能指标结果比较±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
2.2肾脏组织病理表现对照组肾小球及肾小管形态正常,结构清晰。模型组肾小球中重度纤维化,系膜基质重度增生,基底膜明显增厚,毛细血管壁增厚明显,结构不清,球囊壁增厚,间质纤维化。治疗组肾小球轻度纤维化,肾小球系膜基质轻度增生,基底膜轻度增厚,球囊壁无明显增厚,病理改变较模型组明显减轻。见插页Ⅱ图4。
2.3肾脏组织NLRP3、Caspase-1、IL-1β蛋白定性表达比较对照组肾脏组织中NLRP3有少量表达,Caspase-1、IL-1β不表达。模型组肾脏组织中NLRP3、Caspase-1及IL-1β的表达均高于对照组及治疗组(P均<0.05)。见表2。
2.4肾脏组织NLRP3、Caspase-1、IL-1β蛋白定量表达比较模型组肾脏组织NLRP3、Caspase-1和IL-1β表达水平均高于对照组及治疗组(P均<0.05)。见表3、图1。

表2 各组肾脏组织NLRP3、Caspase-1、IL-1β蛋白定性表达比较±s)
注:与对照组比较,*P<0.05;与模型组比较,﹟P<0.05。

表3 各组肾脏组织NLRP3、Caspase-1、IL-1β蛋白定量表达比较±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨论
DN是目前我国慢性肾衰竭的主要原因之一,探讨DN发病机制及有效防治措施对DN的治疗具有重要意义。近年来,中药在防治DN方面显现出较大优势。参芍口服液是以活血化瘀为法研究的中药复方制剂,主要含有丹参、黄芪、川芎、赤芍等成分,具有活血化瘀、抑制炎症反应、抑制纤维化的作用。现代药理学实验证实,川芎对血管内皮不仅起到保护作用[10],而且具有抑制心肌重构和细胞凋亡等作用。研究证实,参芍口服液具有改善血管内皮损伤、促进血管再生、逆转心室重构、抗炎等作用[17,18]。但参芍口服液对DN的作用尚无研究。本研究发现,治疗组血糖、24 h尿量、PRO、血Scr、血BUN均低于模型组,肾脏组织病理改变较模型组明显减轻,提示参芍口服液可有效降低DN大鼠血糖水平、改善肾功能、减轻肾脏纤维化,对DN大鼠具有降糖及肾功能保护作用。
炎症反应是DN的重要病理生理基础。IL-1β是一种前炎性因子,在炎症反应、引发胰岛素抵抗[11]和纤维化过程中均起重要作用。Caspase-1是IL-1β前体分子——IL-1的转化酶,是激活IL-1家族细胞因子前体分子的关键因子。IL-1家族细胞因子前体分子必须有赖于IL-1转化酶Caspase-1的剪切作用,活化后才能演变为成熟的炎症因子而发挥生物作用[12]。而Caspase-1的活化需要NLRP3的激活,进而触发炎症瀑布反应[14]。Caspase-1活化后,可使细胞膜完整性破坏,形成微小孔径,使细胞内的离子平衡丧失,水分内流,细胞肿胀继而膜破裂,引起细胞凋亡[15],使炎症介质释放到胞外,募集、激活免疫细胞,诱发微环境炎症大爆发,这一病理生理的过程会加快DN的进程。NLRP3在炎症反应中的另一作用是通过影响NF-κB调控IL-1β的转录[13]。Zhou等[6]研究发现,高血糖可使小鼠NLRP3炎症体介导的IL-1β分泌显著增加。
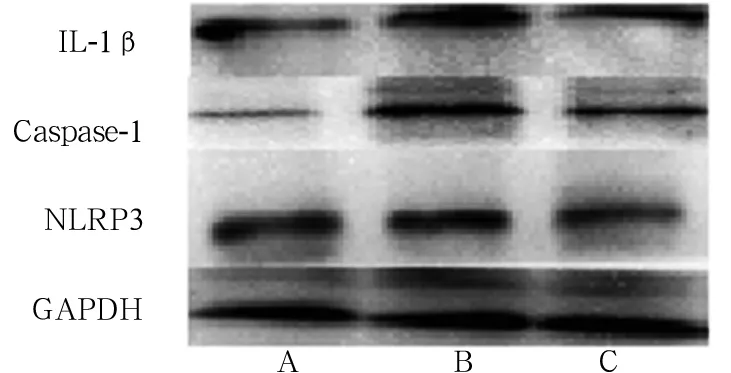
注:A为对照组,B为模型组,C为治疗组。
图1各组肾脏组织NLRP3、Caspase-1、IL-1β蛋白表达(Western blot法)
NLRP3炎症体属于固有免疫NLRs家族,可募集多种蛋白形成一种复合体,称为NLRP3炎症体,包括NLRP3、Caspase-1、ACS、IL-1β等。NLRP3炎症体各成分在激发和调节免疫应答及炎症反应中起着重要的调控作用,其作为固有免疫的重要组成部分,不仅在炎症反应中能够识别内源性和外源性的危险信号,对炎症反应也起到调节作用,进而促进炎症反应的发生[16]。目前,对NLRP3炎症体是否参与了DN发病过程中的炎症反应尚不明确。本研究发现,模型组肾脏组织中NLRP3、Caspase-1及IL-1β蛋白表达均高于对照组,提示NLRP3炎症体NLRP3、Caspase-1及IL-1β蛋白在DN大鼠肾脏组织中表达均增高,均参与了DN的病变过程,可能是DN发生发展的重要环节;治疗组肾脏组织NLRP3、Caspase-1及IL-1β蛋白表达均低于模型组,病理表现较模型组明显减轻,肾小球纤维化减轻,提示参芍口服液可抑制NLRP3炎症体NLRP3、Caspase-1及IL-1β蛋白的表达、减轻肾脏组织纤维化,从而发挥对肾脏的保护作用,延缓肾纤维化的进程。因而,NLRP3炎症体可以作为新的干预靶点,为未来DN的防治提供了新的方向和思路。
[1] Gluhovschi G, Gluhovschi C, Bob F, et al. Trandafirescu immune compartments of the nephron in relation to the immune system[J].Romanian J Inter Med, 2010,48(1):17-31.
[2] Rodriguez IB, Johson RJ, Herrera AJ. Tubulointerstitial damage and progression of renal failure[J]. Kidn Intern Supp, 2005,(99):82-86.
[3] Martinon F, Burns K, Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing ofpro IL-1β[J].Mol Cell, 2002,10(2):417-426.
[4] Bauernfeind F, Ablasser A, Bartok E, et al. Inflammasomes:current understanding and open questions[J].Cell Mol Life Sci, 2011,68(5):765-783.
[5] Tran TH, Pham JT, Shafeeq H, et al. Role of interleukin-1 inhibitorsin the management of gout[J]. Pharmacotherapy, 2013,33(7):744-753.
[6] Zhou R, Tardivel A, Thorens B, et al. Thioredoxin-interacting protein links oxidative stress to inflammasome activation[J]. Nat Immunol, 2010,11(2):136-140.
[7] Halle A, Hornung V, Petzold GC, et al. The NALP3 inflammasome is involved in the innate immune response to amyloid-β[J]. Nat Immunol, 2008,9(8):857-865.
[8] Li X, Zhang Y, Xia M, et al. Activation of Nlrp3 inflammasomes enhances macrophage lipid-deposition and migration;implication of a novel role of inflammasome in atherogenesis[J]. PLoS One, 2014,9(1):87552.
[9] 李霞,贺博然,纪征,等.宽心合剂对大鼠心脏急性缺血-再灌注损伤后心肌纤维化的影响[J].中国中医基础医学杂志,2010,7(16):599-600.
[10] 许毓申, 王国宏, 边延涛, 等. 糖尿病心肌病早期心肌局部血管紧张素Ⅱ和一氧化氮的变化[J]. 心肺血管病杂志, 2001, 20(4): 241-242.
[11] Larsen CM, Faulenbach M, Vaag A, et al. Interleukin-1-receptor antagonist in type 2 diabetes mellitus[J]. N Engl J Med, 2007,356(15):1517-1526.
[12] Gabay C, Lamacchia C, Palmer G. IL-1 pathways in inflammation and human diseases[J]. Nat Rev Rheumatol, 2010,6(4):232-241.
[13] Franchi L, Eigenbrod T, Munoz-Planillo R, et al. The inflammasome:a caspase-1-activation platform that regulates immune responses and disease pathogenesis[J]. Nat Immunol, 2009,10(3):241-247.
[14] Anders HJ, Muruve DA. The inflammasomes in kidney disease[J]. Am Soc Nephrol, 2011,22(6):1007-1018.
[15] Yazdi AS, Guarda G, D′Ombrain MC, et al. Inflammatory caspases in innate immunity and inflammation[J].J Innate tmmun, 2010,2(3):228-337.
[16] Schertzer JD, Tamrakar AK, Magalhaes JG, et al. NOD1 activators link innate immunity to insulin resistance [J]. Diabetes, 2011,60(9):2206-2215.
[17] 张琦,李映雪,尚小明,等.参芍口服液对冠状动脉介入治疗术后活性物质患者血清血管和细胞因子的影响[J].中国老年学杂志,2015,3(35):1487-1489.
[18] 张琦,李映雪,刘晓堃,等.参芍口服液对动脉粥样硬化大鼠血脂和血管活性物质的影响[J].中国动脉硬化杂志,2014,22(9):922-924.
张春来(E-mail: 120zcl@sina.com)
10.3969/j.issn.1002-266X.2016.30.010
R587.2
A
1002-266X(2016)30-0034-04
2016-04-25)

