异亮氨酸对大鼠空肠形态和抗菌肽表达的影响
任 曼,吕照勇,史 凯,李倩倩,周可柔,吴修磊,李升和
(安徽科技学院 动物科学学院,安徽 凤阳 233100)
异亮氨酸对大鼠空肠形态和抗菌肽表达的影响
任曼,吕照勇,史凯,李倩倩,周可柔,吴修磊,李升和*
(安徽科技学院动物科学学院,安徽凤阳233100)
目的:研究不同浓度的异亮氨酸对大鼠空肠形态和抗菌肽表达的影响;方法:选用40只健康断奶SD大鼠,随机分为四组,分别饲喂含有不同浓度异亮氨酸的饲粮(基础日粮+0%、0.5%、1.0%或1.5%异亮氨酸),试验期为14 d。HE染色观察空肠形态变化,通过荧光定量PCR测定空肠中抗菌肽的表达水平。结果:1)对照组大鼠空肠绒毛整齐,黏膜上皮界限清晰,隐窝较浅,0.5%和1.0%异亮氨酸组大鼠空肠绒毛较对照组排列整齐,绒毛较高,隐窝较浅;与0%、0.5%和1.0%异亮氨酸组相比,1.5%异亮氨酸组大鼠绒毛高度较低,隐窝深度增加。2)与对照组相比,0.5%、1.0%和1.5%异亮氨酸均在不同程度上显著提高了空肠防御素rBD-1的表达,其中0.5%异亮氨酸组大鼠空肠防御素rBD-1表达增加了2.3倍,1.0%异亮氨酸组rBD-1表达量增加了13.1倍,1.5%异亮氨酸组rBD-1表达量增加了14.2倍。结论:添加异亮氨酸可显著增加大鼠空肠防御素基因的表达,适量的异亮氨酸对空肠黏膜形态具有改善作用,过量异亮氨酸可能破坏空肠黏膜形态。
异亮氨酸;SD大鼠;空肠形态结构;抗菌肽
哺乳动物肠道兼具消化吸收营养物质和阻挡病原微生物入侵的双重任务,其黏膜屏障功能情况直接影响机体健康[1]。肠道形态、黏液蛋白分泌、上皮渗透性等均可反映肠道黏膜的完整性,其中绒毛高度和隐窝深度是评价肠道黏膜完整性的常用指标[2]。抗菌肽(antimicrobial peptide,AMP)是一种具有抗菌或抑菌作用的小分子多肽,哺乳动物内源合成的AMP是先天性免疫系统的重要组分,它直接杀死病原微生物的同时还可通过TLRs(Toll-like Receptors,TLRs)调节免疫反应,上皮组织(包括皮肤、肠道、肺等)产生和分泌的AMP参与构成上皮黏膜免疫的第一道屏障[3]。研究发现,多种因素可影响和调控内源AMP表达,包括发育阶段、损伤、营养物质(如维生素D、短链脂肪酸、氨基酸等)、脂多糖(lipopolysaccharide,LPS)等[4]。支链氨基酸(branched-chain amino acids,BCAA)除了作为蛋白质合成的底物,还能够在体外促进抗菌肽的表达,并且对免疫细胞的发育具有至关重要的作用[4],但是有关于支链氨基酸在肠道免疫功能方面的研究较少。本课题组前期研究发现异亮氨酸可促进猪肠上皮表达抗菌肽[5],但有关异亮氨酸的使用剂量和对肠道黏膜屏障的影响尚缺乏研究。本研究以大鼠为动物模型,研究异亮氨酸对空肠抗菌肽表达和肠道形态的影响,旨在为营养素调控内源抗菌肽表达及肠道黏膜屏障功能的提高提供借鉴,也为异亮氨酸在动物人类营养调控中的应用提供理论基础。
1 材料与方法
1.1试验动物与设计
试验选用清洁级健康断奶SD雄性大鼠(SCYK(浙)20140001)40只,平均初始体重50.73 g,购买自浙江实验动物中心。随机分为4组,分别饲喂添加不同浓度异亮氨酸的日粮(0%、0.5%、1%、1.5%),试验期为14 d。试验期间,大鼠自由采食和饮水,保证环境温度和湿度控制在25±2℃和50±5%。
1.2试验试剂
L-异亮氨酸(1001064222),C6H13NO2,纯度≥99%,生物试剂,购自美国Sigma公司,RNAzol®RT试剂盒(RN190)购自美国Molecular Research Center公司,PrimeScript RT Reagent Kit反转录试剂盒(RR037A)和SYBR Premix Ex Taq II荧光定量PCR试剂盒(RR820A)均购自大连TAKARA公司。
1.3试验方法
试验结束时乙醚麻醉,取大鼠空肠两段,一段放入4%多聚甲醛溶液中固定,另一段放入液氮中冷冻。
1.3.1组织切片制作将固定24 h以上的组织修整后梯度酒精脱水,经二甲苯至透明,石蜡包理2 h,修块后切片(6 μm),HE染色,中性树胶封片,Olympns BX5+DP73显微摄影系统显微观察并摄影。
1.3.2提取mRNA和反转录切取1~2cm空肠肠段在研钵中加入液氮研磨,取100 mgL组织用于提取总RNA,提取方法参照RNAzol®RT试剂盒说明。用核酸蛋白浓度测定仪(NanoDrop-2000,Thermo Scientific公司,美国)测定所提总RNA的质量和浓度,当OD260nm/OD280nm在1.8~2.0和OD260nm/OD230nm在1.5~2.2时,说明RNA质量较好,可用于下一步试验。取1μg RNA加入到20 μL反转体系中,按照反转录试剂盒说明将RNA反转为cDNA。
1.3.3引物筛选根据NCBI数据库提供的相关基因序列,使用Primer Premier 5.0生物软件设计防御素和内参基因引物,由生工生物有限公司合成。根据温度梯度PCR筛选特异性高的引物序列。
1.3.4荧光定量PCR首先制备实时荧光定量PCR标准曲线,取普通PCR反应产物1 μL用灭菌超纯水稀释100倍后,再逐级稀释至109倍,根据预实验模版中的所测基因cDNA浓度,选择8个连续的浓度梯度作为标准曲线模板与cDNA模板一起按照试剂盒说明进行实时荧光定量PCR扩增。扩增体系如下:Buffer 5 μL, SYBR Green II 0.2 μL,上下游引物各0.4 μL,cDNA模板1 μL,无RNA酶超纯水3 μL,空白对照组以相同体积超纯水代替cDNA模板。
1.4数据分析
所有测定结果均以平均值和SEM表示,显著性统计采用SAS 8.1软件中单因素方差分析进行,差异显著时用Duncan’s多重比较。当P<0.05为差异显著。
2 结果与分析
2.1大鼠空肠组织形态结构变化
异亮氨酸对大鼠空肠组织形态结构的影响如图1所示,可见对照组(0%异亮氨酸组)大鼠空肠绒毛整齐,黏膜上皮界限清晰,隐窝较浅;0.5%和1.0%异亮氨酸组大鼠空肠绒毛较对照组排列整齐,绒毛较高,隐窝较浅;与0%、0.5%和1.0%异亮氨酸组相比,1.5%异亮氨酸组大鼠绒毛高度较低,隐窝深度增加,说明适量异亮氨酸有益于肠道黏膜上皮的发育,而过量异亮氨酸对肠道黏膜上皮有一定的损伤作用。
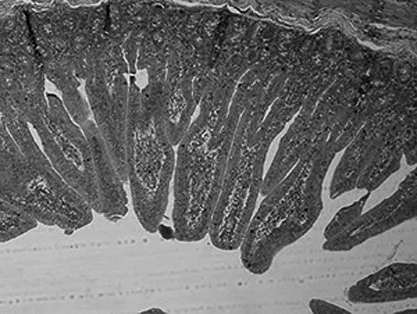



图1 异亮氨酸对SD大鼠空肠形态结构的影响(HE染色,200×)
2.2大鼠空肠防御素表达情况
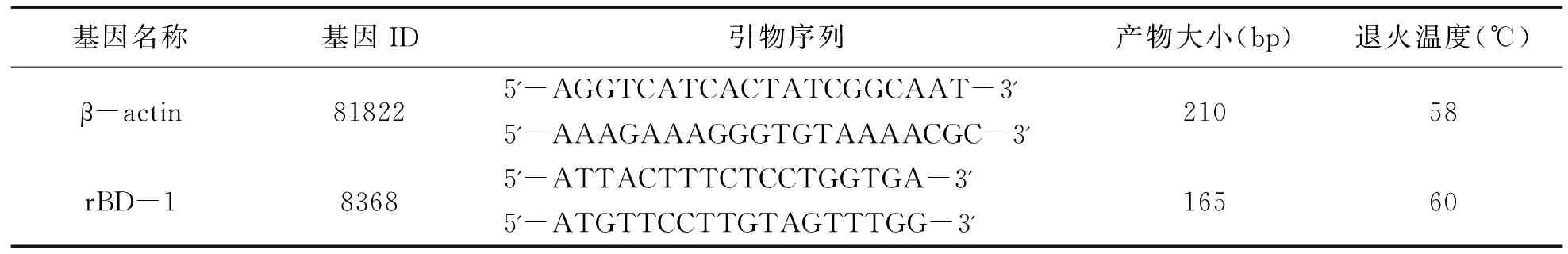
表1 大鼠基因引物序列
内参基因β-actin和大鼠防御素基因rBD-1的引物序列和产物片段如表1和图2所示。荧光定量PCR结果如图3所示,结果表明,与对照组相比,0.5%、1.0%和1.5%异亮氨酸均在不同程度上显著提高了空肠防御素rBD-1的相对表达量,其中0.5%异亮氨酸组大鼠空肠防御素rBD-1表达增加了2.3倍,1.0%异亮氨酸组rBD-1表达量增加了13.1倍,1.5%异亮氨酸组rBD-1表达量增加了14.2倍。说明在饲粮中添加异亮氨酸可显著促进大鼠空肠防御素rBD-1基因的表达。
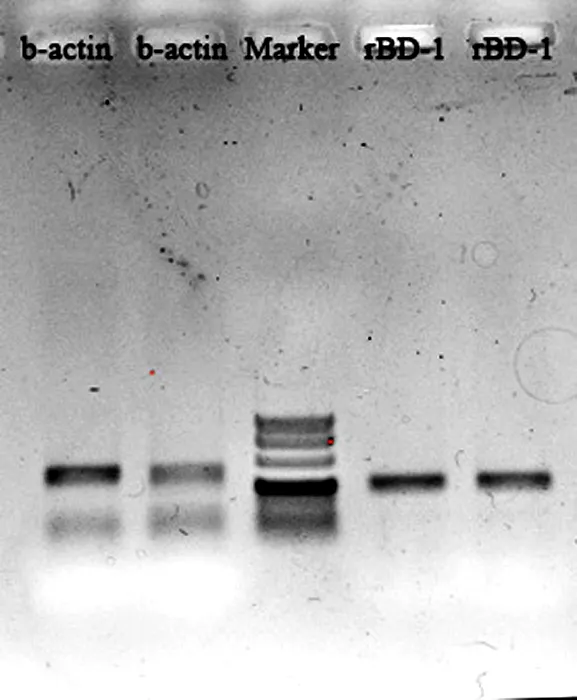
图2 大鼠内参基因β-actin和防御素基因rBD-1引物扩增产物核酸电泳。

图3 大鼠防御素rBD-1在空肠的相对表达量。
3 结论与讨论
近年营养学与免疫学一致认为肠道不仅消化吸收营养物质,还是重要的免疫器官[6]。在正常生理状态下,肠道免疫屏障功能将细菌和内毒素等外源抗原与机体组织隔绝,在创伤、感染、应激等状态下,肠道黏膜会发生损伤、肠道共生菌群失调、免疫功能异常等,进而破坏肠免疫屏障,促使肠道内微生物和内毒素的位移,导致全身性炎症反应,影响幼年机体的生长发育。断奶之后,小肠黏膜受到抗原的过度刺激,绒毛萎缩和隐窝增生,肠免疫系统被激活[7-8]。日粮营养物质直接影响断奶后的早期肠道免疫反应和肠功能紊乱[9],王薇薇[10]发现苏氨酸直接影响小肠粘液蛋白质的合成和分泌、免疫球蛋白分泌及断奶仔猪小肠粘膜屏障功能,张峰瑞[11]发现精氨酸合成底物N-氨甲酰谷氨酸可促进新生仔猪小肠中免疫球蛋白的合成,降低大肠杆菌的感染。岳隆耀[12]的蛋白质组研究结果表明低氮日粮中补充支链氨基酸能够提高断奶仔猪空肠中免疫相关蛋白的表达,并降低热应激蛋白60水平。同样,本研究也发现适量异亮氨酸可提高肠道屏障功能,表现为改善肠道形态和促进抗菌肽的表达。氨基酸作为蛋白合成底物,适量范围内可改善动物健康,过量时不仅造成氨基酸间不平衡和拮抗,还具有毒性,直接损伤机体。研究发现,过量的赖氨酸、蛋氨酸、苏氨酸或色氨酸均可抑制肉仔鸡和断奶仔猪的生长性能[13],周凡[14]报道赖氨酸和精氨酸间拮抗会降低淡水鱼的生长性能,尚晓迪[15]研究表明异亮氨酸浓度超过1.49%时会抑制草鱼的生长。但关于氨基酸过量对肠道黏膜功能影响的研究较为缺乏,仍需进一步的探索。
肠上皮表面的AMP在抵御微生物过程中扮演重要角色,这些“天然抗生素”属于进化古老的先天性免疫效应因子[16]。其中,β防御素是目前研究最为深入和存在最为广泛的AMP之一,它一方面可阻止上皮表面微生物的入侵,另一方面参与机体免疫调节[17]。内源AMP的表达和活性受多种因素调控,如细菌和LPS、营养供给和一些功能性营养物质等。近期研究发现,氨基酸能够促进不同的上皮细胞表达β防御素,Fehlbaum等[18]报道3.12-12.5 μg/mL异亮氨酸可显著促进牛肾上皮细胞中β防御素的表达,但当浓度大于 ≥ 25 μg/mL时这种促进作用明显降低。Konno等[19]报道细胞培养基中添加5-50 μg/mL的异亮氨酸可提高人结肠上皮细胞系Caco-2中人β防御素2的表达。本研究通过体内试验发现,日粮添加异亮氨酸可以促进肠上皮表达β防御素,此结果与前人体外研究一致,表明适宜浓度异亮氨酸可能通过调节肠道形态和AMP表达而改善肠道健康。过量氨基酸可能由于氨基酸拮抗和过量氨基酸毒性而损伤肠道形态结构,但是没有影响AMP的表达。
以上结果说明,在饲粮添加异亮氨酸可显著增加大鼠空肠防御素基因的表达,适量的异亮氨酸对空肠黏膜上皮形态具有改善作用,过量异亮氨酸可能破坏空肠黏膜上皮形态。
[1]吕晓英,张朝审.乳糖不耐受研究动态[J].现代预防医学,2005,32(4):319-321.
[2]MAO Xiangbing, ZENG Xiangfang, QIAO Shiyan, et al. Specific roles of threonine in intestinal mucosal integrity and barrier function[J]. Frontiers in Bioscience (Elite Edition), 2011, 3(4): 1192-1200.
[3]GALLO R L, HOOPER L V. Epithelial antimicrobial defence of the skin and intestine[J]. Nature Reviews Immunology, 2012, 12(7): 503-516.
[4]WINTERGERST E S, MAGGINI S, HORNIG D H. Contribution of selected vitamins and trace elements to immune function[J]. Annals of Nutrition and Metabolism, 2007, 51(4): 301-323.
[5]REN M, ZHANG S-h, ZENG X-f, et al. Branched-chain Amino Acids are Beneficial to Maintain Growth Performance and Intestinal Immune-related Function in Weaned Piglets Fed Protein Restricted Diet[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(12): 1742-1750.
[6]OSWALD I P. Role of intestinal epithelial cells in the innate immune defence of the pig intestine[J]. Veterinary Research, 2006, 37(3): 359-368.
[7]GUY-GRAND D, DISANTO J P, HENCHOZ P, et al. Small bowel enteropathy:role of intraepithelial lymphocytes and of cytokines(IL-12,IFN-gamma,TNF)in the induction of epithelial cell death and renewal[J]. European Journal of Immunology, 1998, 28(2): 730-744.
[9]WU G. Intestinal mucosal amino acid catabolism[J]. The Journal of Nutrition, 1998, 128(8): 1249-1252.
[10]王薇薇.日粮苏氨酸影响断奶仔猪小肠黏膜屏障的研究[D].北京:中国农业大学,2008.
[11]张峰瑞.N-氨甲酰谷氨酸调控新生仔猪肠道粘膜免疫的研究[D].北京:中国农业大学,2013.
[12]岳隆耀.低蛋白平衡氨基酸日粮对断奶仔猪肠道功能的影响[D].北京:中国农业大学,2010.
[13]李彦才.氨基酸过量供给对猪禽性能的影响[J].饲料与畜牧,1996(5):11-12.
[14]周凡.饲料赖氨酸和精氨酸对黑鲷幼鱼生长影响及其拮抗作用机理研究[D].杭州:浙江大学,2011.
[15]尚晓迪.草鱼幼鱼对异亮氨酸需要量的研究[D].重庆:西南大学,2009.
[16]ZASLOFF M. Antimicrobial peptides of multicellular organisms[J]. Nature, 2002, 415(6870): 389-395.
[17]SANTAOLALLA R, FUKATA M, ABREU M T. Innate immunity in the small intestine[J]. Current Opinion in Gastroenterology, 2011, 27(2): 125-131.
[18]FEHLBAUM P, RAO M, ZASLOFF M, et al. An essential amino acid induces epithelial beta-defensin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(23): 12723-12728.
[19]KONNO Y, ASHIDA T, INABA Y, et al. Isoleucine,an essential amino acid,induces the expression of human defensin 2 through the activation of the G-Protein coupled Receptor-ERK pathway in the intestinal epithelia[J]. Haemophilia, 2015, 21(3): 330-337.
(责任编辑:马世堂)
Modulation of Isoleucine on Intestinal Morphology and Antimicrobial Peptide Expression in Rat Jejunum
REN Man,LV Zhao-young,SHI Kai,LI Qian-qian,ZHOU Ke-rou,WU Xiu-lei,LI Sheng-he*
(College of Animal Science ,Anhui Science and Technology University, Fengyang 233100, China)
Objective:To investigate the effect of isoleucine on intestinal morphology and antimicrobial peptide expresion in intestine.Methods: 40 healthy weaned SD rat were randomly divided into 4 groups (n=10) and the experimental diets were contained 0%, 0.5%, 1.0%, 1.5% isoleucine, respectively. After 14 days of experimental period, rat jejunum was collected to test intestinal morphology by HE staining to analyze expression of antimicrobial peptide by qRT-PCR. Results:The microstructure photography showed that rats of the control group (0% isoleucine) had orderly villus and thin crypt, the 0.5% and 1.0% isoleucine groups had higher villus and thinner crypt. Compared with 0%, 0.5% and 1.0% isoleucine groups, 1.5% isoleucine in diet decreased villous height and increased the crypt depth. Compared with the control group, isoleucine supplementation induced expression of rBD-1 in jejunum and the level of rBD-1 expression in 0.5%, 1.0% and 1.5% isoleucine groups was increased by 2.3, 13.1 and 14.2 times, respectively. Conclusion: isoleucine significantly induced epithelial defensin expression and properly concentration of isoleucine improved jejunum morphology, but high isoleucine concentration had harmful effect on jejunum morphology.
Isoleucine; SD rat; Jejunum morphology; Anti-microbial peptides
2016-01-13
安徽省高校自然科学研究项目(KJ2015A296);安徽省自然科学基金(1608085QC72);安徽科技学院自然科学基金(ZRC2014453);安徽省大学生创新创业训练计划项目(AH201410879036,AH201410879037);安徽科技学院第十二批校大学生创新科研基金(15XSZ01)。
任曼(1986-),女,安徽省淮北市人,博士,助教,主要从事动物营养调控研究。*通讯作者:李升和,教授,E-mail:Lish@ahstu.edu.cn。
S816
A
1673-8772(2016)03-0006-05

