舒肝颗粒的质量标准研究
朱 敏 刘 艳
昆明中药厂有限公司,云南 昆明 650228
舒肝颗粒的质量标准研究
朱敏刘艳*
昆明中药厂有限公司,云南昆明650228
目的:建立控制舒肝颗粒的质量标准。方法:对舒肝颗粒中白术、甘草、栀子、芍药进行薄层色谱鉴别;采用高效液相色谱法测定栀子苷的含量。结果:薄层色谱检出白术、甘草、栀子苷、芍药苷;栀子苷在0.2505~2.672μg范围内线性关系良好,r=0.9998,平均回收率为97.98%,RSD为2.26%(n=9)。结论:该方法简便、准确,能有效控制舒肝颗粒的质量。
舒肝颗粒;栀子苷;HPLC
舒肝颗粒是由当归、白芍、柴胡、香附等10味中药组成,具有疏肝理气,散郁调经的功效。临床用于肝气不舒的两胁疼痛,胸腹胀闷,月经不调,头痛目眩,心烦意乱,口苦咽干,以及肝郁气滞所致的面部黧黑斑(黄褐斑)等。该制剂载于卫生部药品标准中药成方制剂第十七册中,标准编号为WS3-B-3343-98,处方合理,疗效确切。原标准中有两项TLC鉴别,无含量测定项,为了有效控制其内在质量,现对其质量标准进行了研究和提高。本研究对制剂中白术、甘草建立了薄层色谱鉴别,结果可靠。用高效液相色谱法测定栀子苷的含量,方法简便,分离度好,结果准确,可作为控制该制剂质量的方法[1]。
1 仪器与材料
1.1仪器B3200S-T超声机(上海必能信超声);高效液相色谱仪(美国Agilent 1100液相色谱仪系统)。1.2材料硅胶G、GF254由青岛海洋化工有限公司提供;白术(批号:120925-201310)、甘草(批号:120904-201117)、栀子苷(批号:110749-201316)、芍药苷(批号:110736-201438)等对照药材/对照品均由中国食品药品检定研究院提供;舒肝颗粒(批号:150821,昆明中药厂有限公司);缺有关药味的阴性对照样品自制。乙腈为色谱纯,其他试剂为分析纯。
2 鉴别
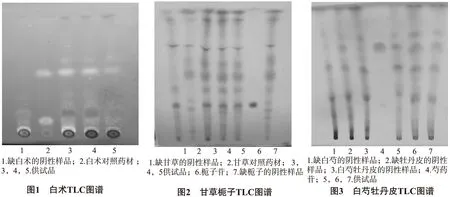
2.1白术的鉴别取本品30g或9g(低糖型),加沸水10mL或3mL(低糖型)使溶解,放冷,加乙酸乙酯30mL,振摇混合,超声处理20min,静置,倾取上清液,残渣续加乙酸乙酯20mL,振摇混合,超声处理10min,静置,倾取上清液,合并上清液,以3%碳酸钠溶液振摇提取2次(20、15mL),合并碱水液,滴加浓盐酸调至pH2~3,以乙酸乙酯振摇提取2次(30mL、20mL),合并乙酸乙酯萃取液,以水20mL洗涤,分取乙酸乙酯液蒸至近干,残渣加甲醇0.5mL使溶解,作为供试品溶液。另取白术对照药材0.5g,加水30mL煎煮,保持微沸30min,煎液滤过,残渣再加水20mL煎煮,保持微沸20min,煎液滤过,合并2次滤液,浓缩至约1mL,放冷,加乙酸乙酯15mL,振摇混合,自“超声处理20min”起,同供试品溶液制备方法制成对照药材溶液0.5mL。照薄层色谱法(中国药典2015年版四部通则0502)试验[2],吸取上述两种溶液各10~20μL,点于同一硅胶G薄层板上,以环己烷-乙酸乙酯(7∶3)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,于105℃的烤箱中烘烤3~5min,置紫外光灯(365nm)下检视,供试品与对照药材色谱相应的位置上,显相同颜色的荧光斑点。见图1。
2.2甘草、栀子的鉴别取本品20g或6g(低糖型),加沸水7mL或2mL(低糖型)使溶解,放冷,加水饱和的正丁醇25mL,振摇混合,超声处理20min,静置,倾取上清液,残留物再加水饱和的正丁醇15mL,振摇混合,超声处理10min,静置,倾取上清液,合并上清液,用正丁醇饱和的水洗涤2次(25mL、15mL),分取正丁醇液蒸至近干,放冷,残渣加甲醇1mL使溶解,作为供试品溶液。另取甘草对照药材0.5g,加水煎煮2次(40mL、30mL),每次保持微沸20min,煎液合并,离心,取上清液,浓缩至约3mL,加水饱和的正丁醇15mL,振摇混合,自“超声处理20min”起,同供试品溶液制备方法制成对照药材溶液0.5mL。再取栀子苷对照品1mg,加甲醇1mL,制成1mg/mL的对照品溶液。照薄层色谱法(中国药典2015年版四部通则0502),吸取上述三种溶液各5~10μL,分别点于同一以含1%氢氧化钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲酸-冰乙酸-水(15∶1∶1∶2)为展开剂,上行展至12cm以上,取出,晾干,喷以10%硫酸乙醇溶液,于105℃加热至斑点显色清晰。供试品与对照药材色谱中,显相同颜色的主斑点;与对照品色谱,显相同颜色的斑点。见图2。
2.3白芍、牡丹皮的鉴别取2.2项下供试品溶液作为供试品溶液。取芍药苷对照品1mg,加甲醇1mL,制成1mg/mL的对照品溶液。照薄层色谱法(中国药典2015年版四部通则0502),吸取上述两种溶液各5μL,分别点于同一硅胶G薄层板上,以二氯甲烷-甲醇-乙酸乙酯(8∶4∶1)为展开剂,在氨蒸汽饱和条件下展开,上行展至12cm,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点清晰。供试品与对照品色谱相应的位置上,显相同颜色的斑点。见图3。
3 含量测定
3.1色谱条件色谱柱:十八烷基硅烷键合硅胶柱(Agilent ZORBAX Eclipse XDB-C18柱,4.6×250mm,5μm)。柱温:30℃;流速:1.0mL/min;流动相:乙腈-水(10∶90);检测波长238nm;进样量:10μL。理论板数按栀子苷计算不低于1500。
3.2对照品溶液的制备取栀子苷对照品适量,精密称定,加甲醇制成50μg/mL的溶液,即得。3.3供试品溶液的制备取本品装量差异项下的内容物,研细,取2g或0.7g(低糖型),精密称定,置具塞锥形瓶中,精密加入甲醇25mL,称定重量,超声处理30min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
3.4阴性对照试验取缺栀子的阴性对照样品,照“3.3项”下方法制成阴性对照样品溶液,将栀子苷对照品溶液、供试品溶液和栀子阴性对照溶液,分别注入液相色谱仪中,进行测定。结果显示供试品与栀子苷在相应位置有对应的峰,阴性对照在相应位置无对应峰。结果见图4。3.5线性关系考察精密称取栀子苷对照品16.7mg,置25mL容量瓶中,加甲醇至刻度,制成668g/mL的溶液。精密取上述对照品溶液分别稀释成25.05、50.1、100.2、133.6、200.4、267.2μg/mL的对照品溶液,注入高效液相色谱仪,按上述色谱条件测定峰面积;以峰面积积分值为纵坐标,以栀子苷进样量(μg)为横坐标作线性回归,绘制标准曲线,得回归方程:Y=1493.52597X+10.24901,结果表明,栀子苷在0.2505~2.672μg之间呈良好线性关系。

3.6稳定性试验取舒肝颗粒同一供试品溶液,在0、2、4、7、9h分别进样10μL,其峰面积值分别为706.675 90、729.119 20、683.207 15、716.021 06、703.533 08,RSD=2.39%,结果表明,在9h内供试品溶液中的栀子苷稳定。3.7精密度试验分别精密吸取对照品溶液(176μg /mL)各5μL,按测定方法重复进样6次,测定峰面积值。各次测得的峰面积值分别是1 543.170 90、1 503.700 20、1 536.676 27、1 535.266 11、1 533.991 33、1 500.863 77,平均值为1 525.611 43,RSD为1.20%。
3.8重复性试验取批号为150821的舒肝颗粒,按正文所列的含量测定方法,分别制备9份供试品溶液,分别测定栀子苷含量,栀子苷平均含量为0.5507mg/g,RSD为1.27%(n=9),说明本方法重复性良好。
3.9回收率试验采取全程加样法。取已知含量的样品(批号:150821,栀子苷含量:0.5507mg/g)9份,精密称定,分成3组,分别精密加入高、中、低三组剂量的栀子苷对照品,按样品测定方法测定栀子苷含量,平均回收率为97.98%,RSD=2.26%。结果见表1。

表1 加样回收率试验结果
3.10耐用性试验取同一批号的样品,照样品含量测定方法,分别变动样品测定的色谱条件,测定栀子苷含量。以考察测定条件有小的变动时,测定结果不受影响的承受程度。分别于不同流动相乙腈-水(9∶91)、(10∶90)、(11∶89)测定样品中栀子苷含量,RSD为2.59%;分别于不同流速(0.9、1.0、1.1mL/min)测定样品中栀子苷含量,RSD为0.05%;分别于不同柱温(20、30、40℃)测定样品中栀子苷含量,RSD为2.31%;分别于不同波长(228、238、248nm)测定样品中栀子苷含量,RSD为2.32%;分别于不同色谱柱测定样品中栀子苷含量,RSD为2.33%。其结果表明耐用性良好。
3.11样品测定结果20批舒肝颗粒的测定结果,样品含量见表2。
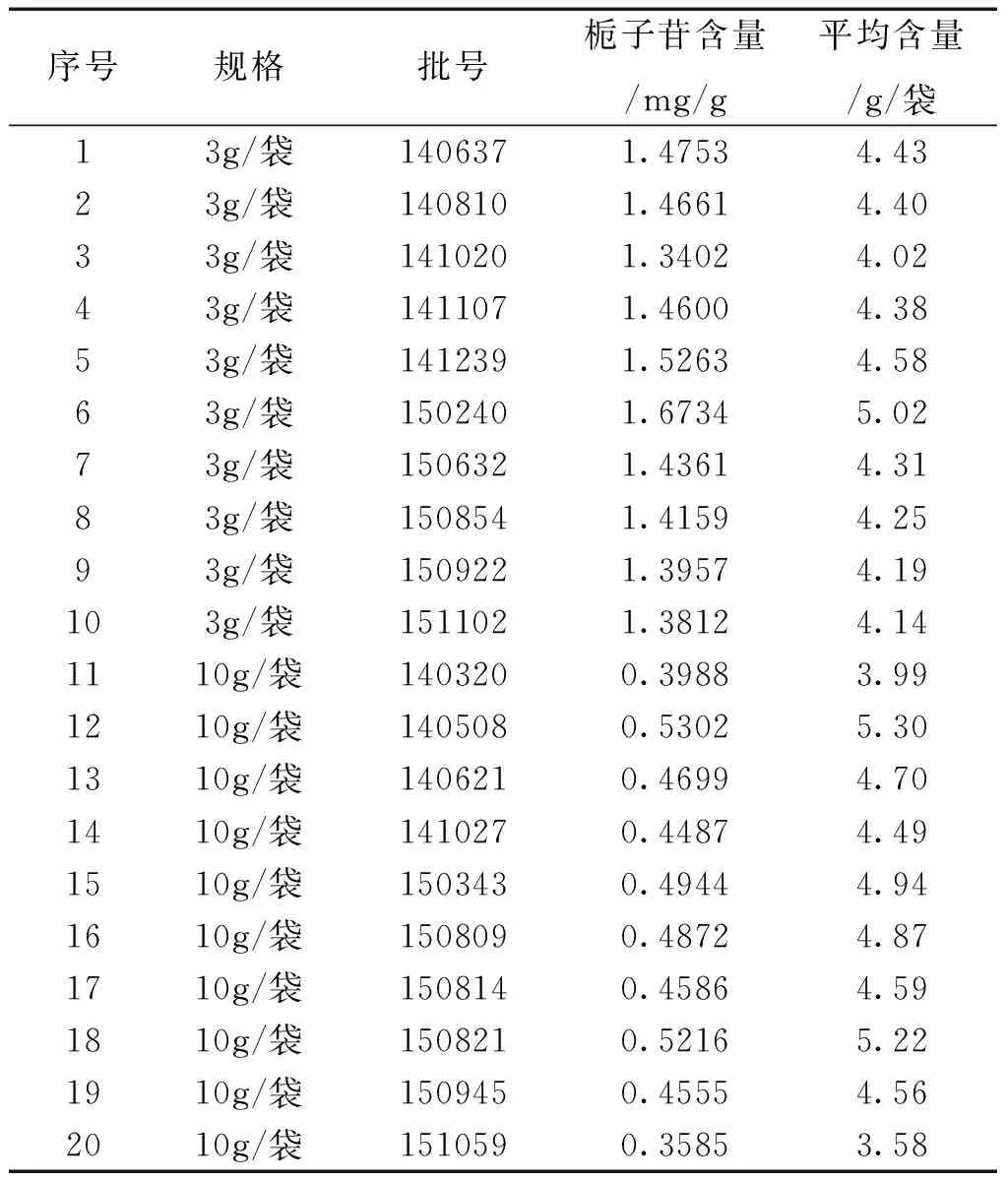
表2 样品含量测定结果
4 讨论
4.1含量测定中,首先进行检测波长的选择:精密称取栀子苷对照品适量,加50%甲醇制成每1mL含17.568μg/mL的溶液,在紫外可见分光光度仪上进行栀子苷的紫外光谱扫描,得到栀子苷的紫外吸收光谱,可见栀子苷在238nm处有最大吸收,故选择238nm作为栀子苷的检测波长。流动相的选择:曾以甲醇-水(20∶80);乙腈-水(9∶91)(10∶90);乙腈-0.1%磷酸(10∶90)分别做流动相试验,试验结果表明:采用乙腈-水(10∶90)作为流动相,栀子苷与其他组分的分离度能达到要求,空白试验也无干扰,故选用。4.2分别对供试品制备中的提取溶剂、提取方法和提取时间、提取溶剂用量进行了考察。分别采用甲醇、乙醇、70%乙醇、50%乙醇进行提取,实验表明甲醇和50%乙醇提取的栀子苷含量相近,但因50%乙醇提取滤过液困难,故选取甲醇作为提取溶剂。考察了超声处理20min、30min、40min、60min,对栀子苷含量的影响,结果表明超声处理30min已提取完全。考察了15mL、25mL、40mL三种不同用量,结果表明提取溶剂加入25mL基本提取完全。故确定供试品的制备方法为:加甲醇25mL超声提取30min。
[1]国家药品监督管理局.中药新药质量标准研究的技术要求[R].
[2]国家药典委员会编.中华人民共和国药典(一部)[S]. 北京:中国医药科技出版社,2015.
(编辑:熊金富)
2016-05-20
朱敏(1979-),男,汉族,本科,工程师;研究方向为中药质量控制研究。E-mail:darkuyzhu@sina.com
刘艳(1969-),女,汉族,本科高级工程师;研究方向为中药工艺及质量控制研究。E-mail:825177465@qq.com
R286.0
A
1007-8517(2016)15-0024-04

