中草药所致DILI患者临床和肝组织病理学特点分析
姚云洁,肖朗,杨才兴,卢林,刘鸿凌
中草药所致DILI患者临床和肝组织病理学特点分析
姚云洁,肖朗,杨才兴,卢林,刘鸿凌
目的分析近年来所收集的中草药所致药物性肝损伤(DILI)患者的临床及肝组织病理学资料的特点。方法收集2010年1月至2015年1月收治的305例中草药所致DILI患者的临床资料,采用ELISA法检测血清抗甲型肝炎病毒IgM、抗戊型肝炎病毒IgM、乙型肝炎病毒表面抗原、抗丙型肝炎病毒抗体、抗EB病毒IgM和抗巨细胞病毒IgM,常规进行肝活检。结果本组DILI患者临床症状和体征主要有纳差(46.6%)、乏力(64.3%)和脾肿大(78.0%);临床分型以肝细胞型(40.0%)为主,87.9%患者发病前用药持续时间大于2周;肝组织病理学表现为中度炎症和纤维化(G2-3S2-3占59.0%);致肝损伤的单一中草药主要为何首乌(11.8%)、雷公藤(10.8%)和黄药子(9.2%),中成药复合制剂主要以治疗银屑病(13.8%)和骨关节类疾病(5.6%)中成药为主;三种单一中草药发病前用药时间均短于中成药复合制剂;停药及对症治疗24 w后284例(93.1%)患者恢复正常。结论中草药致肝损伤发病前用药时间较长,起病较缓慢,需要引起临床重视。
药物性肝损伤;中草药;临床特征;病理学
中草药所导致的药物性肝损伤(drug-induced liver injury,DILI)在我国十分常见。由于广泛的开发,越来越多的中草药制剂或者片剂开始应用于临床实践,中草药所致DILI也有逐年递增的趋势。与成分确定的西药相比,中草药成分相对较为复杂,常见的致肝损伤的中草药有何首乌、雷公藤、黄药子等以及一些中草药复合制剂或片剂,部分中草药的肝损伤具有初期临床反应不明显、潜伏期长,并且易与其它肝脏疾病相混淆,因而这些中草药所致DILI的临床表现和特点还有待进一步探讨和总结。本文通过对305例中草药所致DILI患者的临床特点及相关指标进行分析,以期为中草药的临床应用提供一定参考。
1 资料与方法
1.1病例来源2010年1月至2015年1月解放军第302医院收治的中草药所致DILI患者305例(男性108例,女性197例);年龄12~89岁,平均年龄(43.1±15.0)岁。DILI诊断标准:根据既往用药史、肝脏病理活检及RUCAM评分标准[1-5]等进行。中药所致DILI的分型参考美国药物肝毒性指导委员会(Drughepatotoxicitysteeringcommittee,DHSC)修订的3种分型标准[6]:(1)肝细胞损伤型:谷丙转氨酶(ALT)≥3×正常值上限,且ALT/碱性磷酸酶(ALP)≥5;(2)胆汁淤积型:ALP≥2×正常值上限,且ALP/ALT>2;(3)混合型:ALT>3×正常值上限,ALP>2×正常值上限,且2<ALT/ALP<5。排除有可能引起肝炎的各种病毒感染史及现症感染(包括甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒、巨细胞病毒、EB病毒等),通过询问既往病史及相关检查排除先天性胆红素代谢障碍患者。
1.2检测采用ELISA法检测血清抗甲型肝炎病毒IgM、抗戊型肝炎病毒IgM、乙型肝炎病毒表面抗原、抗丙型肝炎病毒抗体(上海科华生物工程股份有限公司);采用ELISA法检测抗EB病毒IgM和抗巨细胞病毒IgM(深圳市科润达生物工程有限公司);肝功能指标的检测使用全自动生化分析仪(HITACHI 7600)。
1.3肝活检对无肝穿刺禁忌证的患者,在知情同意的前提下,经超声引导下经皮肤穿刺获取肝脏标本10~25 mg,标本经HE染色等处理后于显微镜下镜检。根据Metavir评分确定肝脏的炎症分级(G)和纤维化分期(S)。所有的标本镜检均由2名具有5年以上病理活检经验的病理科医师各自独立完成。1.4统计学方法数据分析应用SPSS17.0软件,对均数±标准差服从正态分布的资料采用t检验。对不符合正态分布的资料以中位数(四分之一分位距,四分之三分位距)表示,当P<0.05时,被认为差异具有显著统计学意义。
2 结果
2.1临床症状及特点在所有符合DILI诊断的305例患者中,其症状及体征主要有:发热11例(3.61%),乏力196例(64.3%),纳差142例(46.6%),腹胀47例,(15.4%),恶心63例(20.7%),瘙痒22例(7.21%),尿黄135例(44.3%),皮疹7例(2.30%),灰白便16例(5.25%),脾肿大238例(78.0%);肝细胞型、淤胆型和混合型分别为122例(40.0%)、93例(30.5%)和90例(29.5%);应用引起肝损伤的相关药物发病前用药持续时间为小于2 周37例(12.1%),2周~8周132例(43.3%),大于8 周136例(44.6%),如图1所示。
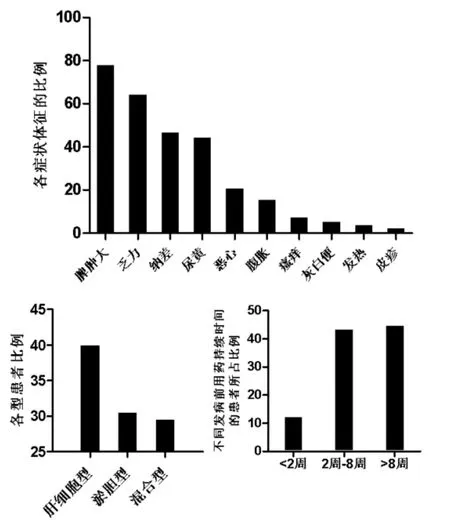
图1 305例患者临床资料
2.2实验室检查305例患者入院时血清ALT水平为181(53.5,527.5)U/L,升高257例(84.3%);AST为141.5(68.5,584)U/L,升高276例(90.5%);TBIL为26.9(14.2,126.8)μmol/L,升高195例(63.9%);DBIL 13.9(4.9,81.7)μmol/L;GGT 45.8(21.6,189.4)U/L;ALP 127.5(86.3,189.6)U/ L;TBA 21.5(6.0,151.0)μmol/L。
2.3应用药物种类具体药物种类及例数如表1所示。治疗银屑病类中成药主要包括消银散、克银丸、消银片、康银灵、银屑灵、复方青黛丸等;治疗骨关节病类中成药主要包括骨康胶囊、骨筋丸胶囊、仙灵骨葆胶囊、迪通胶囊、活络止痛丸、六味壮骨颗粒等;其它种类里包括成分不明的复合制剂和汤剂等。不同药物种类在发病前用药时间、ALT、AST水平上未发现显著统计学差异(P>0.05)。
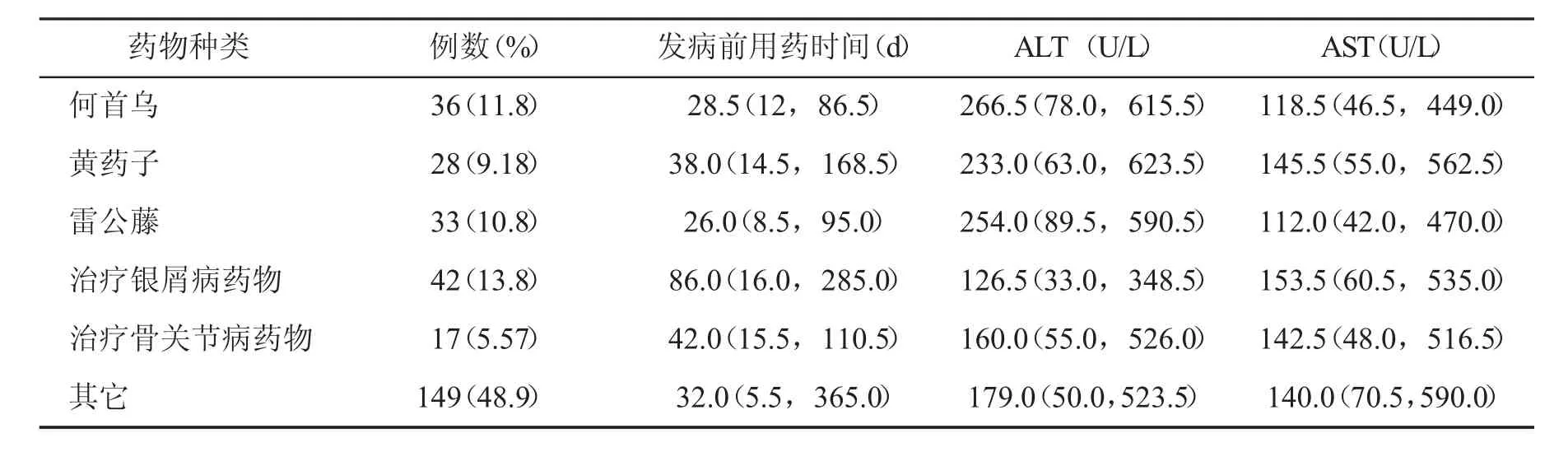
表1 不同中草药致DILI患者临床特点
2.4肝组织病理学表现特点在本研究中,213例患者接受了肝组织活检,部分患者肝活检组织HE染色如图2所示。根据Metavir评分,诊断G2S285例(39.9%)、G2S342例(19.7%)、G3S233例(15.5%)和G3S3期20例(9.4%),其它患者GS分期如下:G1S02例(0.9%)、G1S15例(2.3%)、G1S23例(1.4%)、G1S31例(0.5%)、G2S02例(0.9%)、G2S16例(2.8%)、G3S02例(0.9%)、G3S15例(2.3%)、G4S24例(1.9%)、G4S33例(1.4%)。
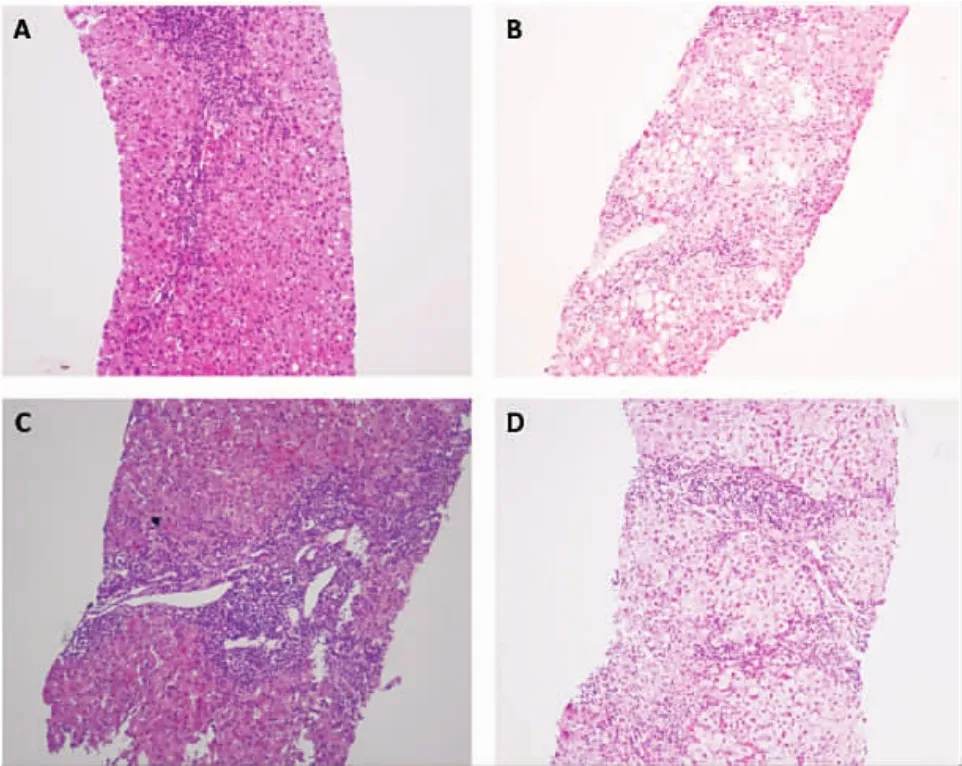
图2 部分患者肝活检组织学表现(HE,100×)
2.5治疗及转归所有患者一经诊断,即停用可疑致肝损伤的中草药,并卧床休息,给予保肝、退黄、降酶等对症治疗。治疗4周后,192例(63.0%)患者血清ALT和TBIL水平恢复正常,8周后267例(87.5%)ALT和TBIL恢复正常。随访24周,284例(93.1%)ALT、TBIL恢复正常,失访13例(4.26%),无效5例(1.64%),死亡3例(0.98%,其中2例为晚期肿瘤,1例为慢性肝衰竭)。
3 讨论
在本研究中,我们发现中草药所致肝损伤患者女性要明显多于男性,这与国内一些研究结果相似[7,8],可能与女性更敏感的求医愿望或者肝肾微粒体药酶活性略低于男性有关[9,10]。另外,患者主要以中老年人为主,主要是由于中老年人是使用中草药的主要人群,且中老年人生理机能减退、肝脏代偿能力下降,部分患者同时合并基础疾病或长期服药。
从本研究结果来看,患者一般在应用中草药4周后发病,症状、体征也主要以乏力、纳差、脾肿大等为主,同时大多数患者AST升高明显,说明中草药所致DILI一般呈慢性累积性进展,即用药时间越长,其发生肝损伤的可能性越大。因此,合理特别是减少中草药应用的持续时间对于有效控制和减少中草药致DILI的发生率十分重要。本组患者肝损伤的临床分型主要以肝细胞型为主,说明其损伤主要累及肝细胞,其机制可能是药物代谢途径受干扰、免疫及非免疫因素等[11,12],由于中草药成分以及比例相对复杂,具体机制还有待进一步研究。
在致肝损伤中草药中,以何首乌、黄药子和雷公藤较为常见。何首乌因具有润肠通便、解毒以及消痈等功效而被广泛应用,然而泡制方法或工艺的不同,都有可能改变何首乌致肝损伤的程度[13]。动物实验发现,何首乌致肝损伤呈现“毒-时-量”效应,即随着时间的延长或剂量增加,其对肝脏的毒性作用增强[14]。进一步研究表明,何首乌中含有的大黄素及鞣质类,可能是引起肝损伤的主要成分[15],且大黄素诱导肝细胞凋亡的作用同样具有时间和空间的累积效应[16]。黄药子则因具有清热解毒、凉血止血以及化痰散结的功效而常见于临床,其致肝损伤的主要成分可能是黄药子萜A、黄药子萜B和黄药子萜C[17]。与何首乌相似,黄药子致肝损伤的程度与给药剂量以及用药时间有关[18]。从中医的角度来看雷公藤具有活血化瘀、清热解毒、消肿散结等功效,而在临床上雷公藤更多的被用于免疫相关的疾病。雷公藤的主要有效成分之一是二萜类内酯醇-雷公藤甲素,该成分也是引起肝损伤的主要成分[19]。雷公藤除了具有肝毒性,还具有消化系统、生殖系统以及血液系统毒性,其不良反应高发,从而影响了其临床应用[20]。在大鼠实验中雷公藤致肝损伤也具有一定的“时-毒”关系。另外,梁伟坤等的临床数据表明雷公藤致肝损伤可能存在剂量的累加效应。总的来说,这三种中草药均与用药时间和剂量相关,如果保持剂量不变,时间越长越容易发生肝损伤,而本研究中应用这三种中草药的大多数患者发病前用药时间并不短,说明本研究的结果与这三种中草药的肝毒性累积效应相一致。在临床上,对于有明确致肝损伤作用的中草药来说,合理的控制每次用药剂量以及用药持续时间十分重要,与此同时,还需要常规监控肝功能变化,并结合病情实际用药,以确定是否继续用药。
治疗银屑病和治疗骨关节病的中草药主要以中草药复合制剂为主,因而这类中成药往往含有多达数十种中草药,生产流程也比较固定,在临床应用之前经过了前期临床试验,肝毒性也理应小于有明确肝毒性的单一中草药。在本研究中,这两类中成药致肝损伤的作用不管从炎症程度还是发病时间都相对轻于何首乌、黄药子或雷公藤,因而中草药复合制剂致肝损伤相较于单一中草药而言更为隐匿,对于临床工作者而言,此类药物的使用所致的肝损伤更应该引起重视。
[1]中华医学会肝病学会D1LI学组.DILI.肝脏,2008,13(2):182.
[2]Danan G,Benichou C.Causality assessment of adverse reactions to drugs-I.A novel method based on the conclusions of internationalconsensusmeetings:applicationtodrug-induced liver injuries.J Clin Epidemiol,1993,46(11):1323-1330.
[3]梁伟坤,邝俊建.雷公藤及其制剂相关肝损害国内文献分析.中国药物应用与检测,2010,8(3):169-172.
[4]王青青,胡晓娜,保志军.药物性肝损伤诊断进展.实用肝脏病杂志,2014,17(4):441-444.
[5]Chalasani NP,Hayashi PH,Bonkovsky HL,et al.ACG Clinical Guideline:thediagnosisandmanagementofidiosyncratic drug-inducedliverinjury.Am JGastroenterol,2014,109(7):950-966.
[6]许建明.急性DILI诊治建议(草案).中华消化杂志,2007,27 (11):765-767.
[7]周桂琴,黎波,曾玲玲,等.80例中草药致DILI临床特征分析.时珍国医国药,2013,24(4):967-968.
[8]鲁大军.40例中药致DILI的分析与探讨.医药前沿,2014,16:324-325.
[9]唐宋琪,杨雪,丁若兰,等.雷公藤多苷致大鼠肝损伤的“时-毒”关系及免疫毒性机制研究.中药药理与临床,2012,28(5):78-81.
[10]Xiong LS,Jia JD,Ou XJ,et a1.Clinical characteristics analysis of 78 patients with drug-induced liver injury.J Gin Hepatol,2011,27(10):1062-1065.
[11]吕敏,刘建军,刘丽萍,等.DILI分析及临床防治.中国现代医药杂志,2015,17(5):104-107.
[12]任东东,邓存良.DILI的研究进展.西南军医,2014,16(6):670-672.
[13]闫二磊,梁生旺.何首乌肝损伤的研究进展.广东药学院学报,2014,30(6):784-786.
[14]黄伟,张亚框,孙蓉.何首乌不同组分单次给药对小鼠肝毒性“量-时-毒”关系研究.中国药物警戒,2011,8(4):193-197.
[15]何岳珍,陈洁,沈世林.何首乌与肝损伤关系的研究进展.医学综述,2013,19(12):2206-2207.
[16]张瑞展,刘斌,孙震晓,等.何首乌提取物对人正常肝细胞L02周期阻滞及其凋亡的影响.中西医结合学报,2010,8(6):554-561.
[17]唐迎雪.黄药子古今临床应用研究.中国中药杂志,1995,20 (7):435-438.
[18]陆霄鹤,武谦虎.黄药子复方制剂致肝损害33例文献分析.四川中医,2014,32(9):162-164.
[19]薛琛,贾晓斌,谭晓斌,等.雷公藤化学成分及其毒性研究.中华中医药杂志,2O10,25(5):730-731.
[20]刘雪梅,刘志宏,张晶,等.雷公藤临床应用及不良反应的研究进展.药学实践杂志,2015,33(2):110-113.
(收稿:2016-02-01)
(本文编辑:陈从新)
ObjectveTo explore the clinical and pathological features of patients with Chinese herbal drug-induced liver injury(DILI)in recent years.Methods305 patients with Chinese herbal drug-induced liver injury betweenJan 2010 and Jan 2015 were enrolled in this study.The serology for exclusion of viral infection were done by ELISA,and liver biopsies were performed routinely.The clinical symptoms,findings of laboratory examinations were analyzed retrospectively.ResultsMajor symptoms and signs in these patients included fatigue (64.3%),anorexia(46.6%)and splenomegaly(78.0%);Hepatocellular type(40.0%)was the major clinical type,and 87.9%of the patients had taken Chinese herbal medicine for more than 2 weeks before the occurrence of liver injury;The main pathological changes in the liver tissues were moderate inflammation and fibrosis(G2-3S2-3 accounted for 59.0%);Liver injury-induced by administration of polygonum multiflorum accounted for 11.8%,thunder god vine for 10.8%,airpotato yam rhizome for 9.2%and compounded herbal medicine for the treatment of psoriasis for 13.8%,and osteoarthrosis for 5.6%;the three above-mentioned herbal medicine took shorter times to induce liver injury;After 24-week management by withdrawal of suspected medicines and supporting treatment,284 patients(93.1%)recovered.ConclusionChinese herbal drug-induced liver injury has slow onset,and it could take long before being noticed.More attentions mustbe paid in clinical practice.
Drug-induced liver injury;Chinese herbal medicine;Clinical features;Pathology
10.3969/j.issn.1672-5069.2016.04.014
401120重庆市渝北区人民医院感染病科(姚云洁,肖朗,杨才兴,卢林);北京解放军第302医院肝移植内科(刘鸿凌)
姚云洁,女,41岁,医学硕士,副主任医师。主要从事慢性肝炎/肝硬化的诊治研究。E-mail:891426884@qq.com
刘鸿凌,E-mail:lhl7125@sina.com
Clinical and pathological features of patients with Chinese herbal drug-induced liver injuryYao Yunjie,Xiao Lang,Yang Caixing,et al.Department of Infectious Diseases,Yubei People's Hospital,Chongqing 401120,China

