慢性丙型肝炎合并2型糖尿病患者临床特征及胰岛素抵抗对抗病毒疗效影响的Meta分析
刘菲菲,张海月,张倩,王鲁文,龚作炯
慢性丙型肝炎合并2型糖尿病患者临床特征及胰岛素抵抗对抗病毒疗效影响的Meta分析
刘菲菲,张海月,张倩,王鲁文,龚作炯
目的分析慢性丙型肝炎(CHC)合并2型糖尿病患者的临床特征及胰岛素抵抗(IR)对干扰素治疗CHC患者临床疗效的影响。方法应用计算机检索PubMed、Ovid、ScienceDirect、Embase、万方、维普数据库1970年至2015年1月发表的关于CHC合并2型糖尿病的临床特征及IR与CHC抗病毒治疗效果关系的文献。应用RevMan 5.2软件进行Meta分析。结果本研究纳入22篇合格文献,全部为英文文献。关于CHC合并2型糖尿病临床特征文献11篇,IR对干扰素治疗CHC病毒学应答产生影响文献11篇;CHC合并2型糖尿病患者的年龄、体质指数(BMI)显著高于单纯CHC或单纯糖尿病患者[P=0.0001,SMD=0.30,95%CI(0.15,0.45),P=0.04,SMD= 0.17,95%CI(0.01,0.34)],CHC合并2型糖尿病患者糖尿病家族史显著多于单纯CHC或单纯糖尿病患者[P=0.01,RR=1.07,95%CI(1.02,1.13)];CHC合并2型糖尿病患者感染HCV基因1型的比例显著低于单纯CHC患者[P=0.01,RR=0.82,95%CI(0.71,0.95)],但两组感染2型或3型比例无显著性差异[P=0.25,RR=1.16,95%CI (0.90,1.50),P=0.92,RR=1.06,95%CI(0.30,3.78)]);干扰素治疗CHC患者获得非持续病毒学应答(NSVR)组HOMA-IR水平和IR发生率显著高于获得持续病毒学应答(SVR)组[P<0.0001,SMD=0.80,95%CI(0.63,0.97),P<0.0001,OR=2.0,95%CI(1.59,2.52)]。结论CHC合并2型糖尿病患者临床特征为高龄、高BMI水平和多伴有糖尿病家族史。感染基因1型CHC患者合并2型糖尿病机会小,而合并IR会降低干扰素抗病毒治疗后SVR发生率,是影响干扰素治疗CHC疗效的重要不利因素之一。
慢性丙型肝炎;2型糖尿病;胰岛素抵抗;基因型;干扰素-α
慢性丙型肝炎(Chronic hepatitis C,CHC)是由丙型肝炎病毒(Hepatitis C virus,HCV)引起的传染性肝脏疾病。CHC的临床表现多样,除了有典型的肝脏损害表现外,还往往合并许多肝外表现,如混合性冷凝球蛋白血症、甲状腺炎、迟发性皮肤卟啉症等[1]。近年来,有些研究表明,CHC与2型糖尿病的发生关系密切[2,3]。2型糖尿病患者存在胰岛素抵抗(Insulin resistance,IR)。研究表明IR会影响α-干扰素治疗CHC患者的病毒学应答。本研究从循证医学的角度对CHC合并2型糖尿病患者的临床特征及IR对α-干扰素抗病毒治疗后发生持续病毒学应答(Sustained virologic response,SVR)的影响进行了Meta分析,以期为临床提供更多的指导。
1 资料与方法
1.1文献检索计算机检索PubMed、Ovid、ScienceDirect、Embase、万方、维普数据库,涵盖1970年至2015年1月1日所有相关文献。同时手工检索纳入文献的参考文献。中文检索词为“慢性丙型肝炎”、“2型糖尿病”、“胰岛素抵抗”、“α-干扰素”、“治疗”。英文检索词为“Chronic hepatitis C”、“Diabetes type 2”、“Diabetes”、“Insulin resistance”、“Interferon-α”、“Therapy”。纳入标准:(1)随机对照试验;(2)经临床诊断为CHC合并2型糖尿病患者;(3)α-干扰素治疗;(4)包括年龄、性别、体质指数(Body mass index,BMI)、有无糖尿病家族史、HOMA-IR、基因型、IR、SVR、非持续病毒学应答(Non sustained viral response,NSVR)等资料。排除标准:(1)仅有摘要;(2)非随机化试验。
1.2纳入文献质量评价根据Cochrane协作网推荐的偏倚风险评估方法对纳入的RCT文献进行评估,①随机分配方案的产生;②隐蔽分组;③对患者或医生实施盲法;④对资料收集和分析人员实施盲法;⑤结果数据是否完整;⑥选择性的结果报告;⑦影响真实性的其他潜在风险。
1.3Meta分析应用Cochrane协作网提供的RevMan 5.2软件。首先采用x2检验和I2检验对同类研究间的异质性进行评价。当P≥0.10,I2<50%时,说明研究间存在异质性的可能性小,使用固定效应模型分析;当P<0.10,I2>50%时,说明研究间具有异质性,则对其异质性的来源进行分析。根据可能出现的异质性因素进行亚组分析(对只有一项亚组的研究仍采用与Meta分析相同的统计量),必要时采用敏感性分析来分析检验结果的稳定性。当异质性过大并不能判断其来源时则放弃Meta分析,改为描述性报告结果。计数资料采用相对危险度(Relative risk,RR)作为分析统计量,对连续性资料,当使用测量工具相同,则采用加权均数差(Weighted mean difference,WMD)进行分析;当相同变量使用不同的测量工具,则采用标准化均数差(Standardized mean difference,SMD)进行分析。所有分析均计算95%可信区间(Credibility interval,CI)。
2 结果
2.1文献检索情况初步检出相关文献241篇,其中英文211篇,中文30篇。经阅读文题和摘要后剔除明显不符合纳入标准的文献176篇。然后,阅读全文和进行质量评价后,进一步剔除重复发表、交叉发表和不符合纳入标准的文献42篇,最终纳入22篇合格文献[4~25],全部为英文文献。关于CHC合并2型糖尿病临床特征文献11篇[4~14],IR对干扰素治疗CHC病毒学应答产生影响文献11篇[15~25]。文献主要特征见表1。
2.2纳入研究的偏倚风险评价对22篇文献的基线资料进行分析,发现它们具有可比性,但存在不同水平的偏倚。可能存在的偏倚主要表现在:(1)发表偏倚:分析CHC合并糖尿病患者的家族史、性别、基因1型、基因2型的漏斗图发现,图形不对称,有一定的差异。比较SVR与NSVR人群HOMA-IR和IR的漏斗图发现,图形不对称,有一定的差异;(2)语种偏倚:本次研究使用中英文检索,但由于中文检索结果未见符合条件的文献,故予以排除,纳入的文献全为英文文献。文献本身的偏倚主要表现在每篇文献的HOMA-IR水平的分界值不同,导致测量偏倚的可能性大。
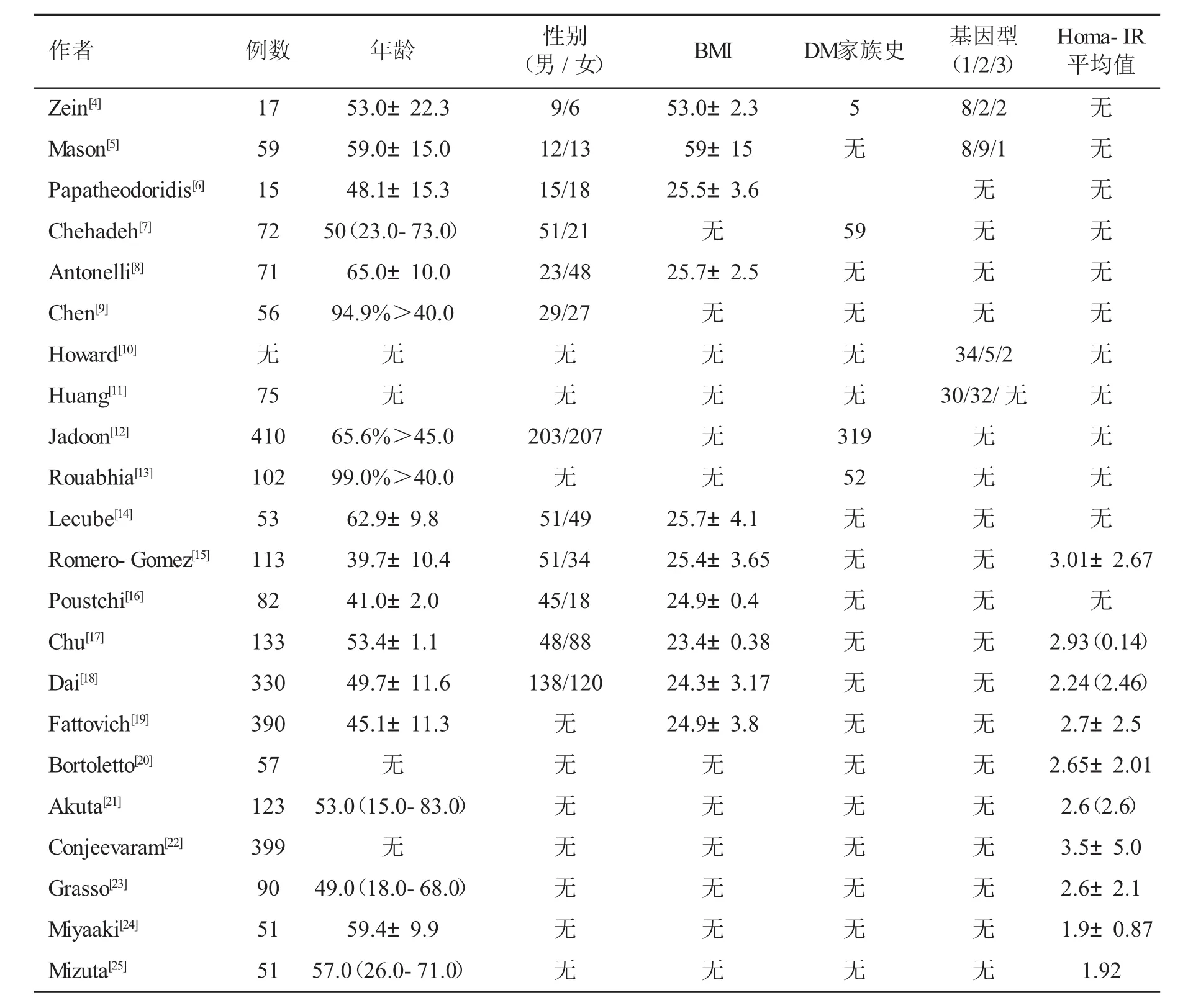
表1 纳入文献的基本特征
2.3CHC合并2型糖尿病患者的年龄特征纳入5篇文献[4~6,8,14]比较了199例CHC合并2型糖尿病患者与1536例CHC或者糖尿病患者的年龄。研究间存在异质性(P=0.008,I2=71%),Meta分析结果显示:两组差异有统计学意义[Z=3.86,P= 0.0001,SMD=0.30,95%CI(0.15,0.45)],表明CHC合并糖尿病患者的年龄比单纯CHC或糖尿病患者大(图1)。
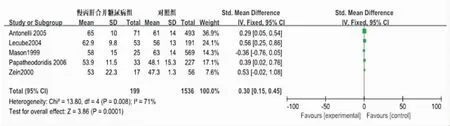
图1 CHC合并糖尿病与CHC或糖尿病患者年龄比较
2.4 CHC合并2型糖尿病的性别特征纳入7篇文献[4~9,12,14]比较了684例CHC合并2型糖尿病患者与4808例CHC或者糖尿病患者的性别。各项研究间不存在异质性(P=0.65,I2=0%),Meta分析结果显示:两组性别差异无统计学意义[Z=1.50,P=0.13,RR=1.07,95%CI(0.98,1.16)],说明性别对CHC合并糖尿病的发病无显著性影响。
2.5CHC合并2型糖尿病患者BMI水平情况共4篇文献[4,6,8,14]比较了174例CHC合并2型糖尿病患者与967例CHC或者糖尿病患者BMI水平。研究间存在异质性(P=0.001,I2=81%)。Meta分析显示:两组差异有统计学意义[Z=2.09,P=0.04,SMD= 0.17,95%CI(0.01,0.34)],表明CHC合并2型糖尿病患者BMI较单纯CHC或糖尿病患者高。
2.6CHC合并2型糖尿病患者糖尿病家族史特征共4篇文献[4,7,12,13]比较了601例CHC合并2型糖尿病患者与2943例CHC或者糖尿病患者糖尿病家族史情况,各项研究间存在异质性(P<0.00001,I2=94%)。Meta分析显示:两组差异有统计学意义[Z=2.54,P= 0.01,RR=1.07,95%CI(1.02,1.13)],表明较多的CHC合并2型糖尿病患者有糖尿病家族史。
2.7CHC合并2型糖尿病患者感染HCV基因型比较共4篇文献[4,5,10,11]比较了150例感染HCV基因1型CHC合并2型糖尿病患者与748例CHC患者感染HCV基因1型情况。各项研究间不存在异质性(P=0.20,I2=35%)。Meta分析显示:两组差异有统计学意义[Z=2.59,P=0.01,RR=0.82,95%CI(0.71,0.95)],说明感染基因1型CHC患者患糖尿病机会小;共4篇文献[4,5,10,11]比较了150例感染基因型2型CHC合并2型糖尿病患者与748例CHC患者感染HCV基因2型的比例。各项研究间存在异质性(P=0.02,I2=69%)。Meta分析结果显示:两组差异无统计学意义[Z=1.15,P=0.25,RR=1.16,95%CI=(0.90,1.50)],说明感染基因2型不是易患2型糖尿病的因素;同样,感染基因3型也不是易患2型糖尿病的因素。
2.8IR对干扰素治疗CHC的影响共有6篇文献[15~18,23,25]比较了干扰素治疗CHC发生SVR 559例和NSVR 286例。各项研究间存在异质性(P<0.00001,I2=98%)。Meta分析结果显示:两组差异有统计学意义[Z=9.36,P<0.0001,SMD=0.80,95%CI (0.63,0.97)],抗病毒治疗后NSVR组HOMR-IR值显著高于SVR组;共11篇文献[15~25]比较了干扰素治疗CHC发生NSVR 708例和SVR 688例伴随IR情况。各项研究间存在异质性(P=0.0005,I2=68%)。Meta分析结果显示:两组差异有统计学意义[Z=5.87,P<0.0001,OR=2.0,95%CI=(1.59,2.52)],提示NSVR组的IR发生率显著高于SVR组。
3 讨论
HCV感染呈全球性分布,威胁到全世界约3%的人口,每年新增300万~400万患者[26]。CHC与其他人群及肝病患者相比更易合并2型糖尿病。肝脏是参与体内糖代谢的重要器官,肝脏通过糖原的合成、降解及通过影响血糖调节激素的水平而影响血糖。因此,肝脏严重受损时易出现血糖异常。本研究综合分析CHC合并2型糖尿病患者的临床特征,发现年龄、BMI值和糖尿病家族史是2型糖尿病发生的危险因素,与其他研究报道一致[27],但性别对CHB合并2型糖尿病发病未表现出明显的关系。因此,在临床上针对高龄、高BMI、有糖尿病家族史的CHC患者应注意监测其血糖水平,必要时及早干预,以降低CHC合并2型糖尿病的发生率。
HCV RNA聚合酶缺乏校对功能,使得病毒复制容易产生错误,导致病毒基因组出现异源性群体。根据病毒分离株核苷酸变异情况可以分成不同的基因型和基因亚型。本文经系统评价得出1型CHC患者合并2型糖尿病机会较小,而2、3型CHC对是否合并2型糖尿病并无明显的影响。
干扰素是CHC患者抗病毒治疗的首选药物,在抗病毒后患者SVR受诸多因素的影响,如感染病毒基因型、治疗前病毒载量、早期病毒学应答、抗干扰素抗体、干扰素敏感决定区、宿主免疫状况、是否有肝硬化等。本研究分析了IR对干扰素治疗CHC患者临床应答率的影响。2型糖尿病存在IR,CHC本身也可以导致IR[28,29]。通过HOMA-IR计算来界定患者是否存在IR,结果在治疗结束时NSVR组与SVR组患者相比有更高的HOMA-IR水平,说明他们存在IR,故对干扰素治疗的病毒学应答较差,说明IR是影响干扰素治疗CHC疗效的重要因素之一。因此,在临床上决定对CHC患者行抗病毒治疗时,是否可通过改善其存在的IR,以期获得更好的临床疗效,值得研究。由于所纳入文献并未全面地描述随机方法、盲法实施、隐蔽分组等情况,可能使得文献质量偏低,上述结论仍需纳入更多高质量、大样本、多中心的随机对照试验来验证。
[1]Moucari R,Asselah T,Cazals-Hatem D,et al.Insulin resistance in chronic hepatitis C:association with genotypes 1 and 4,serum CHC RNA level,and liver fibrosis.Gastroenterology,2008,134 (2):416-423.
[2]Naing C,Mak JW,Ahmed SI,et al.Relationship between hepatitis C virus infection and type 2 diabetes mellitus:meta-analysis. World J Gastroenterol,2012,18(14):1642-1651.
[3]Guo X,Jin M,Liu K,et al.Type 2 diabetes mellitus and the riskof hepatitisC virusinfection:A systematicreview.Sci Rep,2013,3:2981.
[4]ZeinNN,Abdulkarim AS,WiesnerRH,etal.Prevalenceof diabetes mellitus in patients with end-stage liver cirrhosis due to hepatitis C,alcohol,or cholestatic disease.J Hepatol,2000,32 (2):209-217.
[5]Mason AL,Lau JYN,Hoang N,et al.Association of diabetes mellitus and chronic hepatitis C virus infection.Hepatology,1999,29(2):328-333.
[6]Papatheodoridis GV,Chrysanthos N,Savvas S,et al.Diabetes mellitus in chronic hepatitis B and C:prevalence and potential association with the extent of liver fibrosis.J Viral Hepat,2006,13(5):303-310.
[7]Chehadeh W,Abdella N,Ben-Nakhi A,et al.Risk factors for the development of diabetes mellitus in chronic hepatitis C virus genotype 4 infection.J Gastroenterol Hepatol,2009,24(1):42-48.
[8]Antonelli A,Ferri N,Fallahi P,et al.Hepatitis C virus infection:evidence foranassociationwithtype2diabetes.Diabetes Care,2005,28(10):2548-2550.
[9]Chen HF,Li CY,Chen P,et al.Seroprevalence of hepatitis B and C in type 2 diabetic patients.J Chin Med Assoc,2006,69 (4):146-152.
[10]Howard AA,Klein RS,Schoenbaum EE.Association of hepatitis C infection and antiretroviral use with diabetes mellitus in drug users.Clin Infect Dis,2003,36(10):1318-1323.
[11]Huang JF,Dai CY,Hwang SJ,et al.Hepatitis C viremia increases the association with type 2 diabetes mellitus in a hepatitis B and C endemic area:an epidemiological link with virological implication.Am J Gastroenterol,2007,102(6):1237-1243.
[12]Jadoon NA,Shahzad MA,Yaqoob R,et al.Seroprevalence of hepatitisCintype2diabetes:evidenceforapositive association.Virol J,2010,7:304.
[13]Rouabhia S,Malek R,Bounecer H,et al.Prevalence of type 2 diabetes in Algerian patients with hepatitis C virus infection. World J Gastroenterol,2010,16(27):3427-3431.
[14]Lecube A,Hernandez C,Genesca J,et al.Diabetes is the main factor accounting for the high ferritin levels detected in chronic hepatitisCvirusinfection.DiabetesCare,2004,27(11):2669-2675.
[15]Romero-Gómez M,Vilria MDM,Andrade RJ,et al.Insulin resistance impairs sustained response rate to peginterferon plus ribavirin in chronic hepatitis C patients.Gastroenterology,2005, 128(3):636-641.
[16]Poustchi H,Negro F,Hui J,et al.Insulin resistance and response to therapy in patients infected with chronic hepatitis C virus genotypes 2 and 3.J Hepatol,2008,48(1):28-34.
[17]Chu CJ,Lee SD,Hung TH,et al.Insulin resistance is a major determinantof sustainedvirologicalresponseingenotype1 chronic hepatitis C patients receiving peginterferon alpha-2b plus ribavirin.Aliment Pharmacol Ther,2009,29(1):46-54.
[18]Dai CY,Huang JF,Hsieh MY,et al.Insulin resistance predicts response to peginterferon-alpha/ribavirin combination therapy in chronic hepatitis C patients.J Hepatol,2009,50(4):712-718.
[19]Fattovich G,Covolo L,Pasino M,et al.The homeostasis model assessment of the insulin resistance score is not predictive of a sustained virological response in chronic hepatitis C patients. Liver Int,2011,31(1):66-74.
[20]Bortoletto G,Scribano L,Realdon S,et al.Hyperinsulinaemia reduces the 24-h virological response to PEG-interferon therapy in patients with chronic hepatitis C and insulin resistance.J Viral Hepat,2010,17(7):475-480.
[21]Akuta N,Suzuki F,Hirakawa M,et al.Amino acid substitutions in hepatitis C virus core region predict hepatocarcinogenesis following eradication of CHC RNA by antiviral therapy.J Med Virol,2011,83(6):1016-1022.
[22]Conjeevaram HS,Kleiner DE,Everhart JE,et al.Race,insulin resistanceandhepaticsteatosisinchronichepatitisC. Hepatology,2007,45(1):80-87.
[23]Grasso A,Malfatti F,Leo PD,et al.Insulin resistance predicts rapid virological response in non-diabetic,non-cirrhotic genotype 1CHCpatientstreatedwithpeginterferonalpha-2bplus ribavirin.J Hepatol,2009,51(6):984-990.
[24]MiyaakiH,IchikawaT,Nakao K,etal.Predictivevalueof suppressor of cytokine signal 3(SOCS3)in the outcome of interferon therapy in chronic hepatitis C.Hepatol Res,2009,39 (9):850-855.
[25]Mizuta T,Kawaguchi Y,Eguchi Y,et al.Whole-body insulin sensitivity index isahighly specificpredictivemarkerfor virological response to peginterferon plus ribavirin therapy in chronic hepatitis C patients with genotype 1b and high viral load.Dig Dis Sci,2010,55(1):183-189.
[26]Lavanchy D.The global burden of hepatitis C.Liver Int,2009,29(Suppl 1):74-81.
[27]Kissebah AH,Peiris AN.Biology of regional body fat distribution:relationshiptonon-insulin-dependentdiabetesmellitus. Diabetes Metab Rev,1989,5(2):83-109.
[28]Bahtiyar G,Shin JJ,Sower JR,et al.Association of diabetes and hepatitis C infection:epidemiologic evidence and pathophysiologic insights.Curr Diab Rep,2004,4(3):194-198.
[29]Shintani Y,Fujie H,Miyoshi H,et al.Hepatitis C virus infection and diabetes:direct involvement of the virus in the development of insulin resistance.Gastroenterology,2004,126(3):840-848.
(收稿:2015-11-05)
(本文编辑:陈从新)
·药物性肝损伤·
ObjectiveTo investigate the clinical characteristics of patients with chronic hepatitis C(CHC)with concomitant type 2 diabetes and to assess the impact of insulin resistance(IR)on sustained virological response(SVR)in patients with hepatitis C to treatment of interferon-α(IFN-α).MethodsA systematic search of electronic databases for randomized clinical trials in Pubmed,Ovid,Science Direct,Embase,Wanfang database and VIP database from 1970 to January,2015 was done as respect to clinical features of CHC with type 2 diabetes,and the correlation between IR and SVR.The Meta analysis was performed by using the RevMan 5.2 software.ResultTwenty-two papers published in English were retrieved in this study,with eleven on CHC with type two diabetes,and eleven on IR impacting response to IFN-α therapy.Patients with CHC and type 2 diabetes had older age and higher BMI than in patients with CHC or diabetes alone[P=0.0001,SMD=0.30,95%CI (0.15,0.45),P=0.04,SMD=0.17,95%CI(0.01,0.34)];More patients with CHC and type 2 diabetes had family history of diabetis than in patients with CHC or diabetes alone[P=0.01,RR=1.07,95%CI(1.02,1.13)];The incidence of genotype 1 infection in CHC patients with type 2 diabetes was significantly lower than in that of CHC alone[P=0.01,RR=0.82,95%CI(0.71,0.95)],while there was no significant differences as respect of genotypes 2/3infectioninthetwogroups[P=0.25,RR= 1.16,95%CI(0.90,1.50),P=0.92,RR=1.06,95%CI (0.30,3.78)];TheincidenceofIRwashigherin CHC patients with non-sustained virological response (NSVR)to interferon-α therapy than in those who got SVR[P<0.0001,SMD=0.80,95%CI(0.63,0.97),P<0.0001,OR=2.0,95%CI(1.59,2.52)].ConclusionsPatients with CHC and type 2 diabetes tends to be elderly with higher BMI levels and much more family history of diabetes.IR is associated with a lower SVR in CHC patients receiving IFN-α therapy.
Hepatitis C;Type 2 diabetes;Interferon-α;Genotypes;Insulin resistance
10.3969/j.issn.1672-5069.2016.04.013
430060武汉市武汉大学人民医院感染病科
刘菲菲,女,24岁,硕士研究生。主要从事病毒性肝炎防治研究。E-mail:349204481@qq.com
龚作炯,E-mail:zjgong@163.com
Clinical features of patients with chronic hepatitis C with concomitant diabetes type 2 and impact of insulin resistance on efficacy of antiviral therapy:a Meta analysisLiu Feifei,Zhang Haiyue,Zhang Qian,et al.Department of Infectious Diseases,People's Hospital,Wuhan University,Wuhan 430060,Hubei Province,China

