催产素检测方法的研究进展
陈 露, 黄 山, 赵慕华, 赵美萍*, 郑 波
(1.北京分子科学国家实验室,北京大学化学与分子工程学院,北京 100871;2.香港中文大学化学系,香港)
1 引言
催产素(Oxytocin,OXT)是一种由下丘脑的神经细胞合成,经下丘脑-垂体运输至脑垂体后叶分泌的短肽类激素[1],其氨基酸序列为Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH2,化学结构式如图1(A)所示。1953年,由美国生物化学家杜维尼奥首次人工合成[2],并因此获得1955年的诺贝尔化学奖。研究发现,催产素在人类认知和社会行为中发挥了重要的作用,例如母性行为以及配偶间的依恋等[3]。当人体内的催产素水平升高时,人会变得更加慷慨,因此,催产素也被称为是道德分子(the moral molecule)[3,4]。
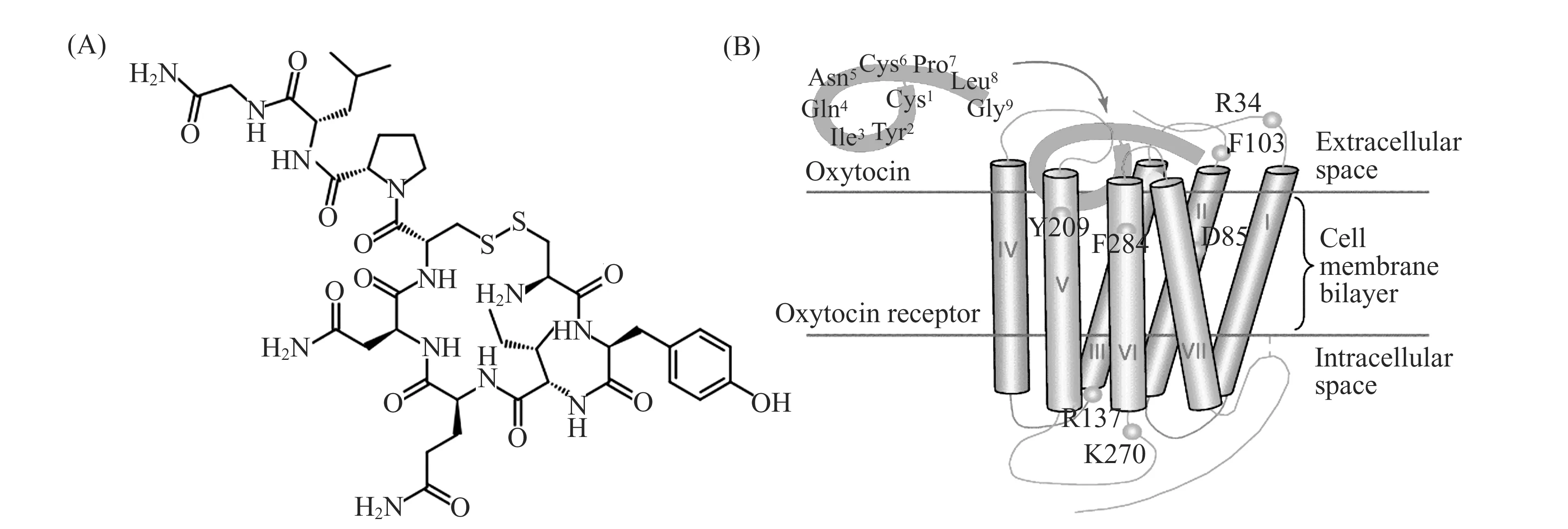
图1 (A)催产素分子结构;(B)催产素(OXT)与催产素受体(OXTR)结合示意图[12]Fig.1 (A)The structure of oxytocin;(B)Schematic model of the structure of the oxytocin receptor(OXTR) and its interaction with oxytocin(OXT)[12]
目前的研究结果表明,催产素以环肽分子形式参与生理过程,并通过与催产素受体(Oxytocin Receptor,OXTR)的结合起到调控作用[5],如图1(B)所示。催产素受体由389个氨基酸残基组成,含有7个α-螺旋的G -蛋白偶联受体(G Protein-coupled Receptors,GPCR)。与受体作用时,催产素分子的环部插入到受体上方由3、4、6号螺旋组成的结合口袋中,羧基端尾部与2、3号螺旋的胞外部分结合[6]。值得注意的是,受体F103残基和催产素分子尾部L8残基的相互作用,是受体区分催产素和其相似物加压素(Vasopressin)的重要依据[7]。同时,二价金属离子(Zn2+、Cu2+等)通过配位作用改变催产素分子环部的构象,增强了催产素和受体的结合能力,是该识别作用发生的必要条件[8]。
2013年,Tsien等[9]发现催产素会选择性地作用于处于被抑制状态的中间神经元(Inhibitory Interneuron),增强信噪比。2015年,Froemke课题组[10,11]对催产素激活小鼠的母性行为进行了详细研究,发现当注射催产素后,鼠脑内原有的不规则的神经脉冲(irregular smattering of neural impulses)信号发展成母性大脑所具备的有序模式。与Tsien等的研究结论类似,作者认为催产素放大了入射信号,使其更易被识别从而指导行为的发生。以上研究结果均表明,催产素通过增强大脑对相关刺激的响应能力从而促进人类的社交行为。由于催产素在体内含量水平的变化对上述神经活动和相关行为的显著影响作用,开发准确、可靠、方便、快捷的催产素定量检测方法对阐明其生物功能、作用机理和探索相关精神疾病的治疗方法都具有非常重要的意义。
迄今已经发展了多种检测生物样品中催产素的方法,其中最先用于检测催产素含量的方法为放射性标记免疫分析法(Radioimmunoassay,RIA)[13,14],之后发展了酶标记免疫分析法(Enzyme Immunoassay,EIA)[15]。近年来,进一步发展了通过二维液相色谱-串联质谱(2D-LC-MS/MS)联用[16]及利用分子印迹传感器检测催产素的方法[17,18]。本文将从原理、发展和应用等方面系统介绍催产素含量的定量检测方法,并对未来的发展需求进行展望。
2 催产素含量的免疫分析方法
免疫分析方法是目前应用最为广泛的检测催产素含量的方法,已用于人体血浆[19,20]、脑脊液[21,22]、唾液[23 - 25]和尿液[26 - 28]等多种生物样品的分析。对样品进行前处理的方法通常是萃取,也有一些研究直接测定了未经处理的新鲜样品。在血浆中检测到的催产素含量为1~300 pg/mL[29],直接测定原始样品中催产素的含量其结果通常高于经过萃取处理后的样品(表1)。萃取方法主要包括固相萃取和液相萃取两类[30]。前者先将1 mL血浆样品与等体积的0.1%三氟乙酸溶液混合后,在14 000 r/min、4 ℃条件下离心20 min。再将上清液在C18柱上进行萃取,洗脱液为3 mL 60%的乙腈溶液。蒸发溶剂后,冻干样品。后者是将1 mL血浆与2 mL冷冻丙酮混合,在1 200 r/min、4 ℃条件下离心20 min,然后用2 mL无水乙醚萃取上清液,在氮气流下干燥。上述处理后的样品复溶后可用于免疫分析。
2.1 催产素的RIA分析方法及其应用
RIA分析方法综合了放射性同位素标记的高灵敏度与抗原-抗体间相互作用的高特异性优势。1970年,Chard等利用RIA法成功测出了人类血浆中催产素的含量[19]。他们选择固相萃取的方法将血浆进行富集,该处理方法对催产素的稳定性影响较小。该方法之后被用于检测未怀孕女性、正常男性,以及处于怀孕不同时期的女性血浆中的催产素含量,结果都处于pg/mL数量级[30,33,39,42,44,49,50,52,53]。1985年,Burd等提出利用RIA的方法同样可以检测未经萃取的生物样品,并且得出了与之前萃取后的样品一致的结果[13],但是方法的重现性较差。
2013年,Kagerbauer等利用RIA的方法检测了41个患者血浆中和脑脊液中的催产素含量[14],发现脑脊液中含量(16.3±1.4 pg/mL)略高于血浆(11.2±2.9 pg/mL),并且二者之间没有相关性。值得注意的是,利用RIA的方法检测血浆样品中催产素的含量时,25个萃取样品中有22个的催产素含量是低于检测限的。对于未经萃取的25个样品,其中有19个的催产素含量是低于检测限的。因此,虽然与萃取技术联用可降低样品中其他物质的干扰,但是多个样品都未测出其中催产素的含量,说明方法的灵敏度还有很大欠缺,这也限制了该方法的应用。
同时,以上基于放射性同位素标记的检测方法还存在操作不便、污染环境、放射性标记稳定性差等缺点,近年来逐渐被新发展的其他非放射性标记免疫分析法和色谱分析法所替代。
2.2 催产素的EIA分析方法及其应用
EIA是一种非放射性标记免疫分析技术,以酶标记抗原或抗体作为示踪物,由高活性的酶催化底物显色或发光,达到定量分析的目的。1998年,Prakash等研究者首次利用EIA的方法在奶牛的血浆中检测到了催产素,并与传统RIA方法进行了比对,二者得到的结果具有较高的相关性(图2),证明了EIA方法的可行性[15]。
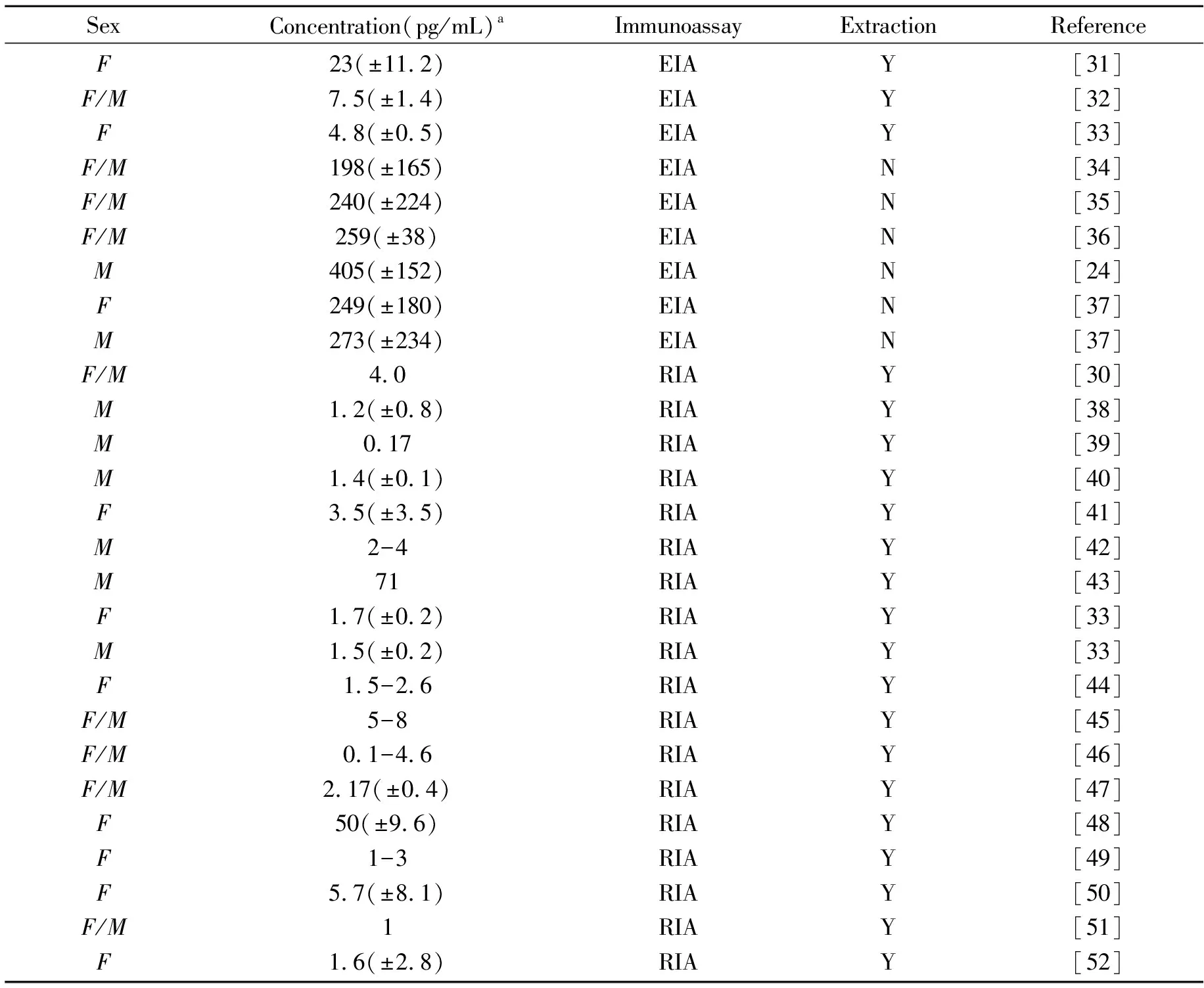
表1 不同方法检测到的人类血浆中催产素的含量水平
aData are presented as the mean (±standard deviation) or the concentration range of oxytocin.

图2 RIA与EIA法检测血浆中催产素浓度间的相关性图[15]Fig.2 Correlation between plasma oxytocin concentrations obtained by RIA and EIA[15]
随后,EIA方法被用于检测多种动物血浆内的催产素含量[54,55]。Péqueux等发展了一种基于新型等离子体萃取的EIA方法[56],通过将样品在centricon YM-3离心超滤管上离心,除去可能会产生干扰的血浆蛋白后,检测到的人血浆中催产素的含量为7 pg/mL。该结果与之前Amico等的RIA方法一致[30]。随后该组又将此方法应用于人类癌细胞样品的检测[57]。2004年,Devarajan等[21]用EIA的试剂盒检测到了大鼠脑脊液中催产素的含量,检测到大鼠脑脊液中的催产素含量为4~12 pg/mL。值得一提的是,采用EIA方法检测到萃取后的样品中催产素的平均含量为1.8±0.4 pg/mL,未萃取样品中的平均含量为358±70 pg/mL,二者结果相差两个数量级,并且不具有相关性。
目前为止,以上两种方法已经研制出了相应的试剂盒。将EIA方法与RIA方法进行对比,有些EIA方法省去了血清样品的萃取过程,得到了与RIA方法类似的结果。然而RIA方法离不开萃取的预处理步骤,因为血清中其他成分会对RIA直接检测产生背景干扰,而这个干扰在EIA方法中并不存在。因此EIA方法相比RIA方法具有较低的检出限。同时,EIA方法也是一个相对安全,低成本,方便快捷的检测方法。故2004年以来,商业化EIA的方法被广泛应用。目前已有一些方法商品化,可用于检测人类血浆和脑脊液中催产素的含量[58]。
2.3 基于色谱/毛细管电泳分离-质谱/电化学/光学检测技术的定量技术及其应用
液相色谱-质谱(LC-MS)联用技术在生物样品定量方面具有高灵敏度、高通量的优点。目前液相色谱-紫外联用技术[59 - 61]、高效液相色谱与库伦电化学检测技术[62]、毛细管区带电泳-紫外联用技术和带有激光诱导荧光毛细管区带电泳技术[63,64]已经被用来检测生物样品或药物制剂中催产素的含量。其中液相色谱与电喷雾离子化质谱联用技术已经被广泛用于生物样品中多肽、蛋白质的检测[65 - 68]。

图3 催产素分子结构可能的碎裂机理[16]Fig.3 Chemical structure of oxytocin with possible fragmentation mechanisms[16]
Karbiwnyk等[16]利用LC-MSn技术检测了静脉盐溶液(intravenous(Ⅳ) saline solutions)中催产素的含量,检出限达到7.00 ng/mL。该工作还给出了质谱中催产素分子可能的碎裂机理(图3)。但该方法用于人血浆中内源性催产素的检测仍不能达到理想的效果。
2011年,Zhang等[69]利用新的具有高灵敏度的2D-LC-MS/MS技术对人血浆中的催产素进行了定量,结合固相萃取实现了血浆中催产素的高灵敏检测。所用人血浆样品为1.4 mL,富集倍数约14倍,该方法的检测限为1.0 pg/mL,检测范围为1.00~250 pg/mL,可以实现人血浆中内源催产素的检测。
然而,最近的研究指出,目前检测到的人血浆中催产素的含量仍有争议,得到的结果需进一步确证。如何准确测定催产素的含量还需建立令人信服的标准[58]。
2.4 分子印迹传感器法检测催产素
Lin等[17]合成了一种新的功能单体N-苄基丙烯酰胺,在金电极表面印迹催产素,通过石英晶体微天平(QCM)实现对催产素的传感检测。如图4所示,N-苄基丙烯酰胺单体通过二硫键固定在金电极表面,丙烯酸和多肽的N端形成离子键,多肽和功能单体的疏水相互作用提供了识别的序列选择性。催产素和MIP的Kd值为1.1×108mol/L,是非特异性吸附物质和非分子印迹聚合物的10~100倍。这一方法可以区分溶液中痕量的催产素和加压素,方法检测灵敏度为ng/mL级。另外,Yola等[18]在表面等离子体共振(SPR)金芯片表面印迹催产素,实现对催产素的传感检测。该方法可以区分催产素(OXT)、精氨酸加压素(AVP)、异亮氨酸催产素(IT)和强啡肽(DYN),并实现了对牛奶样品中的催产素的检测。催产素印迹的SPR芯片对OXT的灵敏度分别是对AVP、IT、DYN的17.99、 18.10和19.48倍,印迹的SPR芯片具有良好的可重复利用性。检测线性范围在0.01~1.0 ng/mL,检出限为0.0030 ng/mL。

图4 多肽印迹过程原理图[17]Fig.4 Schematic representation of the peptide imprinting process[17]
3 总结与展望
生物样品中催产素含量的准确测定,对神经科学和行为科学等研究具有重要意义,是研究催产素参与的生化过程的基础。从整体上看,目前发展的方法各有优劣,放射免疫分析方法不够安全便捷,酶免疫分析方法的适用性存在争议,二维液相色谱-串联质谱联用具有较低的检出限和高的灵敏度,但仍存在特异性的不足。近期的研究中,人们大多还使用酶免疫分析试剂盒的方法。2015年,Emeny等[70]在研究生活压力与催产素的关系时,对催产素的定量方法仍是利用酶免疫分析试剂盒实现的。由于样品环境以及基质效应的影响,人们至今还没有找到一种高效且特异性的检测催产素的标准方法。
由于现有技术尚不能消除活体环境下的各种干扰因素,因此目前发展的检测方法都只能应用于体外样品。为此开发高选择性的识别原件和高效的信号输出平台,将会是下一个阶段的研究重点。若能构建一种均相中高灵敏度、快速定量催产素的方法,并与其它实时、在线平台联用,将为人们进一步深入了解催产素相关的生化过程提供重要的支持。进一步的,催产素生物学功能的研究和临床应用相结合是未来的发展趋势,也将为神经科学等领域带来新的研究思路。

