温度对珠子参种胚生长发育的影响
赵新礼, 张 馨
(陕西中药研究所,陕西咸阳 712000)
温度对珠子参种胚生长发育的影响
赵新礼, 张 馨
(陕西中药研究所,陕西咸阳 712000)
[目的]了解温度对珠子参种胚生长发育的影响,掌握解除种子休眠的方法。[方法]采用不同温度条件下种子沙藏处理,定期取材,以解剖学的方法,对种胚的形态大小及发育情况进行观测。[结果]珠子参种胚属高低温型。在15 ℃下发育最好,约160 d即可达到满胚,后再转入5 ℃低温处理60 d即裂口。裂口种子10 ℃培养5 d就开始萌发。[结论]该研究为珠子参种子催芽育苗提供科学依据。
珠子参;温度条件;种子沙藏处理;种胚发育
珠子参panaxjaponicusvar.major为五加科人参属的濒危药用植物[1],其主要化学成分为皂苷类、糖类、挥发油类等多种类型化合物[2-3]。根状茎入药为珠子参,有补肺、养阴、活络、止血、抗肿瘤、保护心脑血管系统、抗炎镇痛、提高免疫力等功能[4-6];地上部分入药称参叶,有清热、生津、利咽、滋补强壮之效[7]。珠子参种子为胚未成熟的种子,果实成熟时种胚仅为一团很少分化的细胞。若将采收的种子直播,需要经过20~22个月才能完成种胚的发育而解除休眠。因此,掌握种子休眠规律,缩短种胚后熟时间,打破休眠,提高种子发芽率,是珠子参栽培技术研究的关键和重点。学者们对珠子参的化学成分与药理作用已有较多研究[4-7],对其栽培技术方面研究较少[8-11],而有关珠子参种胚后熟的研究未见报道。笔者采用层积沙藏的方法对种胚后熟发育过程进行了研究,为珠子参的规范化栽培提供理论依据。
1 材料与方法
1.1材料8月上中旬采集移栽的珠子参植株的成熟果实,经水浸泡24 h后搓去果皮,取沉于水下的种子作为试验材料。
1.2方法
1.2.1种子的沙藏处理。先将种子用500倍80%多菌灵水溶液浸泡消毒30 min,再将种子与高温灭菌的河沙按1∶10比例拌匀,沙子含水量以手捏成团后自然松散为宜,放入培养皿中,每皿200 粒,每个处理三皿,先放25~32 ℃室温下,约10 d后再分别转入5、10、15、20、25 ℃及实验室(变温5~25 ℃)等6种条件下培养。每隔20 d取种子10粒,采用徒手解剖,在解剖镜下对胚的形态大小及发育情况进行观测。
1.2.2种胚发育观测。对15 ℃培养的种子,每10 d取种子10粒,用FAA固定,石蜡法制永久切片,切片厚度8~12 μm,番红固绿染色。用显微镜对胚的形态大小及发育情况进行观测。
2 结果与分析
2.1种子的形态结构生产上习称的珠子参种子,实质上是包括内果皮的果核,形状为倒卵状肾形,长3~5 mm,宽2.5~3.5 mm,乳白色或米黄色,表面凸凹不平,近果柄处有一小喙,内含种子1粒。种子形状与果核相似,长2.0~3.5 mm,宽2~3 mm,表面凸凹不平,淡黄色,种脐凸出成一小喙,种皮极薄,膜质,胚乳丰富,近种脐处有一长圆形的空腔,长0.3~0.4 mm,宽0.2~0.3 mm;胚位于空腔基部,极小;种子尖端为脐孔,沿脐孔有结合缝,裂口时从结合缝处裂开,胚根由脐孔处萌发。
2.2种胚的后熟发育观测6种不同温度条件下种胚发育情况(表1)发现,在15 ℃下种胚发育最好,培养120 d就有满胚者,约160 d绝大多数种子达到满胚,平均胚率为91.38%。再转入5 ℃低温处理60 d开始裂口。将已裂口种子放10 ℃培养5 d就开始萌发。也就是说,珠子参种子要完成种子的后熟过程必须经历2个阶段,即在15 ℃条件下经过160 d处理可以完成种胚的形态发育,再在5 ℃条件下经过60 d完成其生理后熟,即可打破休眠。
在其他温度条件下培养160 d时,胚的发育情况明显不同。20 ℃有个别种子达满胚,多数种子胚为满胚的2/3,纵切片可见营养叶原基已开始分化小叶原基,胚芽原基亦已出现;5、10、25 ℃及实验室等条件下胚发育更差,仅为满胚的1/5~1/6,仅形成叶原基和凹陷,还处在胚后期发育的初期阶段。
2.3种胚后熟过程的形态结构变化笔者对15 ℃下种胚生长发育情况进行了细致的观察。根据胚各部分的发生,将整个过程分成4个阶段。
2.3.1原胚初分化期(子叶原基的发生期)。果实成熟时,多数种子胚已完成原胚发育阶段,刚刚开始胚胎的后期发育,进入心形胚期,也有少数种子胚呈马蹄形,出现了子叶原基,但尚看不到组织的分化。从正面观纵切片可见,胚为倒心形或马蹄形,长约0.11 mm,宽约0.15 mm,细胞近等圆形,大小一致,排列不整齐,细胞核大,原生质浓厚。侧面切片可见胚呈长圆形,长约0.17 mm,宽约0.11 mm,细胞略呈长方形,纵向排列,在近珠孔端细胞较小。
在25~32 ℃高温下湿沙保藏10 d后,胚体增大,全部为马蹄形,长和宽近相等,约0.25 mm,说明种子成熟后,在适宜的水分、温度条件下胚可立即开始后熟发育。从切片可见,胚顶端中间凹陷,两侧形成2个明显的凸起(子叶原基)。凹陷处是以后胚芽原基的场所,将继续分化出一枚营养叶;子叶原基将增大分化成为成熟胚的子叶;这时,细胞也开始分化,子叶原基中央有2~3列细胞较小,着色较深,排列紧密,为子叶原基内明显的子叶迹,且与下面的组织相连续,是形成维管组织的原始细胞;在子叶迹外围,约有4~6层细胞着色略浅,分化不明显,是以后子叶薄壁组织的原始细胞;在凹陷处,最顶端有3~4层细胞较小,细胞核大,排列紧密,着色亦较深,是以后植物体茎端原始组织,可明显分出原套和原体;在靠近胚柄处也有一些细胞着色略深,但无明显分化,是以后胚根的原始细胞。
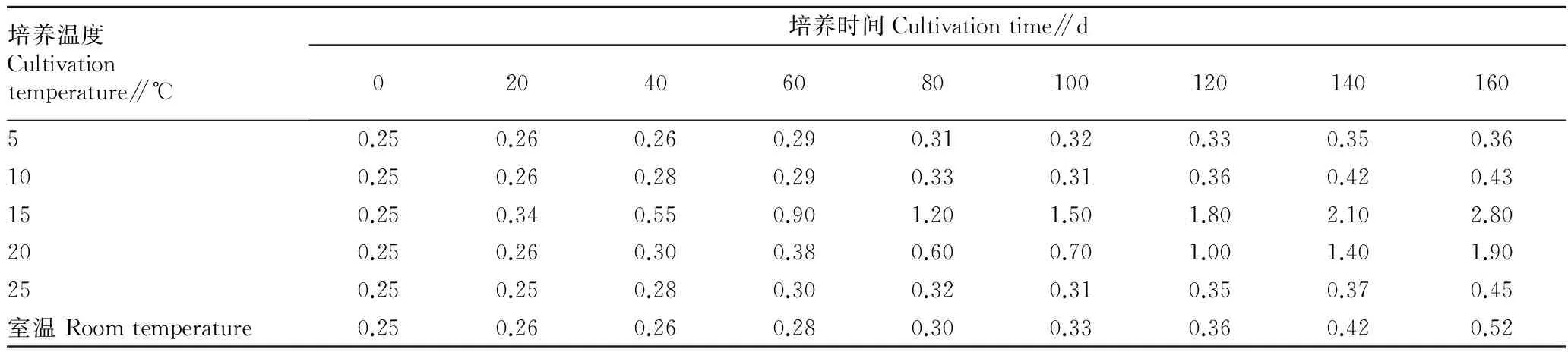
表1 不同培养温度对珠子参种胚生长发育的影响
转入15 ℃条件下培养以后,胚继续发育良好。20 d后胚体开始拉长,长约0.34 mm,宽0.15 mm。由于子叶原基的伸长,中间凹陷处更深,从切片可见顶端原始细胞数目增加,约5~6层,7~8列。
2.3.2营养叶的发生与分化。在15 ℃条件下培养30 d后,胚体呈短棒状,长约0.55 mm,宽约0.25 mm。纵切片可见子叶原基伸长至0.30~0.35 mm,细胞长方形,排列整齐,着色较深。在两枚子叶原基之间凹陷处出现高约0.15 mm的凸起,其顶端略偏斜,有再分化的趋势,这就是第1枚营养叶原基,它从凹陷的一侧发生,但迅速生长很快占据凹陷内空间的大部分,其细胞略呈长方形,排列整齐,原生质浓厚,细胞核大,分裂旺盛,这时,胚根端细胞排列开始层次化,有分化之趋势。
在15 ℃条件下培养50 d后胚体呈棒状,长0.8~1.0 mm,胚根端钝圆。纵切片可见始有组织分化,最顶端是由一层细胞分别构成的根冠原和表皮原,它们有共同的来源;向内是皮层原和中柱原,这时,子叶长约0.55 mm,薄壁组织原始细胞着色变浅;幼叶原基长约0.33 mm,顶端形成偏斜或2个明显的小突起(小叶原基)。
2.3.3胚芽原基的形成。在15 ℃条件下培养80 d后凹陷处中央部位形成圆丘状的胚芽,胚长约1.5 mm,达满胚期的2/3长,以后胚体生长减慢。胚根端各原始细胞群数目增多,分化更为明显。子叶伸长约1 mm,组织分化明显,在着色较深、细胞较小的子叶迹内可见原生韧皮部筛管。营养叶原基伸长0.55~0.60 mm,顶端小叶原基呈棒状。这时,在位于凹陷处正中央出现圆丘状的胚芽原基,其细胞等径形,排列紧密,原生质浓厚,细胞核大;以后细胞数目不断增多,体积增大,并向远离幼叶一侧偏斜,由于肥大幼叶的压迫而成为顶端扁尖状的突起,高0.10~0.20 mm。胚芽生长方向的改变,为萌发时横向伸长发育根状茎打下基础。
2.3.4满胚期。在15 ℃条件下培养120 d时有个别种子已达到满胚期,培养约150 d后胚芽增高并向远离幼叶一侧偏斜,由于肥大幼叶的压迫而呈扁尖状。大多数种子在培养160 d时达到满胚期,完成胚的形态后熟。胚体呈长棒状,长2.1~2.8 mm,宽约1 mm,生长基本停止;胚根端钝圆,子叶基部扁圆,上端扁平,几乎与胚乳等长。胚根、胚轴、子叶、幼叶均已分化完成。连续横切片可见在胚根、胚轴部位已有中轴原和原形成层的分化;子叶的分化程度较高,各组织的分化更进一步,表皮仍为胚性细胞;基本分生组织皮层细胞已明显液泡化,着色较浅;原形成层束外侧可见分泌道,向内可见子叶原生韧皮部筛管和原生木质部导管;幼叶具三枚小叶片,也已分化出原形成层束。
在胚后熟发育的整个过程中,可以看到胚体在增大,胚腔也随着增大,虽未见破毁的胚乳细胞,但胚腔周围的胚乳细胞内贮藏物明显少于远端胚乳细胞,显然胚生长所需营养是来源于胚乳细胞的。
3 结论与讨论
(1)珠子参为阴生植物,果实成熟时种胚由一团很少分化的细胞构成,呈心形或马蹄形,在胚胎发育过程中属于后期分化的开始阶段,这与人参[12]、西洋参[13]等同属植物果熟时胚发育状况相类似。
(2)珠子参种子胚属高低温型,在15 ℃条件下生长发育最好,经过160 d完成种胚的形态后熟,再在5 ℃条件下经过约60 d完成其种胚的生理后熟,在10 ℃下5 d种子开始发芽。而培养160 d时,20 ℃有个别种子达满胚,多数种子胚为满胚的2/3,5、10、25 ℃及实验室等条件下胚生长发育更差。
(3)珠子参种胚在15 ℃条件下经过5个多月时间完成了形态后熟过程,其中前3个月是种胚分化发育最活跃的时期,即由果实成熟时的原胚进一步先后形成心形胚、子叶原基、幼叶原基和胚芽原基,胚长增长也较快;以后2个月只是种胚体积的缓慢增大。因此,若要缩短胚形态后熟的时间,可以在种子采收后立即进行处理,并在后2个月内考虑增加其他处理措施,并进一步试验研究其可行性。
[1] 赵毅,赵仁,宋亮,等.珠子参药材品种概述及资源现状调查[J].中国现代中药, 2011,13(1):11-17.
[2] 赵仁,赵毅,李东明,等.珠子参研究进展[J].中国现代中药,2008,10(7):3-6.
[3] 李利霞,赵厚涛,朱虹,等.珍稀濒危植物珠子参研究进展[J].陕西农业科学, 2015,61(2):59-61.
[4] 陈涛,陈茂华,胡月琴,等.珠子参多糖抗肝癌作用的实验研究[J].时珍国医国药, 2010,21(6):1329-1331.
[5] 王辉,郭天康,胡鹏斌,等.珠子参临床药理研究进展[J].甘肃医药, 2015(2):99-101.
[6] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:254-255.
[7] 江苏新医学院.中药大辞典:上册[M].上海:上海人民出版社,1977:1821.
[8] 刘万里,刘婷,何忠军,等.珠子参规范化栽培技术[J].陕西农业科学,2014,60(8):127-128.
[9] 赵仁,赵毅,何双凌,等.珠子参生产技术标准操作规程(SOP)[J].中国现代中药, 2014,16(7):556-560.
[10] 赵新礼.珠子参生态学和生物学特性的研究[J].现代中药研究与实践,2015,29(6):14-17.
[11] 赵新礼.珠子参生殖生物学特性的研究[J].中国现代中药,2015,17(12):1298-1301.
[12] 陈瑛,韩义,王玉玫,等.人参种子胚后熟的温度条件[J].药学通报,1987,22(7):402-404.
[13] 高镇生,刘俊杰.西洋参种子后熟过程中发育特性的研究[J].中药材科技,1981(3):4-7.
Effects of Temperature on the Embryonic Development ofPanaxjaponicusvar.major
ZHAO Xin-li, ZHANG Xin
(Shaanxi Institute of Traditional Chinese Medicine, Xianyang, Shaanxi 712000)
[Objective] To find the effects of temperature on embryonic development of Panax japonicus var.major, and to grasp the breaking method of seed dormancy.[Method] Seeds sand processing was adopted under different temperatures.After regular sampling, anatomy was used to observe the embryo morphology size and development situation.[Result] Embryo ofP.japonicusbelonged to high and low temperature type.The best development temperature was under 15 ℃.Embryonic development would be finished in condition of 15 ℃ by stratification for within about 160 d, and became crack at 5 ℃ for 60 d.the cracked seeds germinated at 10 ℃ for 5 d.[Conclusion] This research provides scientific basis for the seed emergence ofP.japonicus.
Panaxjaponicusvar.major; Temperature condition; Seed sand stratification; Embryonic development
中医药公共卫生专项(财社[2011]-76号);中医药行业科研专项(201207002)。
赵新礼(1961- ),男,陕西扶风人,高级工程师,从事中药资源与栽培研究。
2016-07-01
S 162.5
A
0517-6611(2016)24-125-02

