三丁酸甘油酯和牛至油对断奶仔猪生长性能、血清生化指标和营养物质表观消化率的影响
张 勇 王 萌 李方方 朱宇旌 黄铁军 何茂龙 王红艳
(1.沈阳农业大学畜牧兽医学院,沈阳110866;2.乐达(广州)香味剂有限公司,广州510530;3.沈阳博阳饲料有限公司,沈阳110128)
三丁酸甘油酯和牛至油对断奶仔猪生长性能、血清生化指标和营养物质表观消化率的影响
张勇1,2王萌1李方方1朱宇旌1黄铁军2何茂龙2王红艳3
(1.沈阳农业大学畜牧兽医学院,沈阳110866;2.乐达(广州)香味剂有限公司,广州510530;3.沈阳博阳饲料有限公司,沈阳110128)
本试验旨在探讨饲粮中添加三丁酸甘油酯(TB)和牛至油(OEO)对断奶仔猪生长性能、血清生化指标、营养物质表观消化率和粪中微生物菌群的影响。试验选用28日龄平均体重为(7.27±0.68) kg的健康大白断奶仔猪128头,随机分成4组,每组4个重复,每个重复8头猪。各组分别饲喂基础饲粮(对照组)、基础饲粮+1 kg/t TB(TB组)、基础饲粮+1 kg/t OEO(OEO组)、基础饲粮+1 kg/t TB+1 kg/t OEO(TB+OEO组)。试验期28 d。结果表明:1)与对照组相比,OEO组显著提高了断奶仔猪平均日增重(P<0.05),极显著降低了腹泻率(P<0.01);TB+OEO组显著降低了断奶仔猪料重比(P<0.05),极显著降低了腹泻率(P<0.01)。2)各组之间血清生化指标无显著差异(P>0.05)。3)与对照组相比,TB+OEO组显著提高了断奶仔猪粗蛋白质表观消化率(P<0.05),极显著提高了粗脂肪表观消化率(P<0.01)。4)与对照组相比,TB组、OEO组和TB+OEO组均极显著降低了粪中大肠杆菌的数量(P<0.01);TB+OEO组显著提高了粪中双歧杆菌的数量(P<0.05)。综上所述,基础饲粮中添加TB+OEO可提高断奶仔猪生长性能,改善营养物质表观消化率,调节肠道菌群平衡。
三丁酸甘油酯;牛至油;断奶仔猪;生长性能;血清生化指标;营养物质表观消化率
断奶是仔猪出生后面临的一大难题,断奶所带来的压力会使仔猪生长受阻,并造成仔猪腹泻以及由此产生的一些列经济损失[1]。三丁酸甘油酯(tributyrin,TB)是一种很好的丁酸来源,与其他丁酸盐相比,具有半衰期长、无臭味、安全无毒副作用等特点,并有益于维护肠黏膜形态,而且能够为消化道提供营养需要从而来预防断奶对仔猪造成的压力[2]。同时,TB作为一种潜在的抗生素替代品得到越来越广泛的关注。牛至油(oregano essential oil,OEO)是由天然植物牛至中提取的挥发油,其主要成分为酚类化合物,主要包括香芹酚(carvacrol,2-甲基-5-异丙基苯酚)占65%~75%,百里酚(thymol,5-甲基-2-异丙基苯酚)占5%~8%,伞花烃(p-cymene,对异丙基苯甲烷)占3%~5%,萜品烯(g-terpinene)占3%~5%。OEO具有明显的抗菌、杀菌和抗氧化作用,并能增强动物免疫功能。OEO预混剂具有抗菌谱广、作用迅速、无残留、不易产生耐药性等特点,是目前理想的抗生素替代品,值得在畜牧业中推广使用。
Hou等[1]对18日龄断奶仔猪的试验研究表明,与对照组相比,添加0.5%的TB能够显著提高断奶仔猪平均日增重,降低料重比和腹泻率。杨玲[3]考察了TB对21日龄断奶仔猪的应用效果,结果显示,添加0.08%和0.15%的TB具有提高断奶仔猪平均日增重、平均日采食量和降低料重比的效果,尤其添加0.15%的TB降低腹泻率效果更为明显。孙鎏国等[4]在断奶仔猪饲粮中添加10%的OEO预混剂0.5 g/kg和5%喹乙醇预混剂1 g/kg,结果表明,饲粮中添加OEO能够提高断奶仔猪的平均日增重,降低料重比和腹泻率,并且可以代替抗生素喹乙醇在饲粮中添加使用。周晓蓉等[5]选用体重在25 kg左右的生长猪所做的试验结果表明,在饲粮中添加100 g/t的OEO能够显著提高干物质(DM)表观消化率1.53%。陈会良等[6]在35日龄的断奶仔猪饲粮中添加了150 mg/kg的OEO,结果表明,OEO能够使断奶仔猪肠道内有益微生物的数量显著提高。TB与OEO是2种绿色无污染的饲料添加剂,同时也都是潜在的抗生素替代品,目前二者在断奶仔猪上应用的研究还较为少见,并且二者的最适添加剂量还未见报道,多数试验都是集中在单一物质的效果研究上。因此,本试验旨在研究饲粮中添加TB和OEO以及二者共同添加对断奶仔猪生长性能、血清生化指标、营养物质表观消化率以及粪中微生物菌群的影响,为二者在断奶仔猪上的应用提供科学依据。
1 材料与方法
1.1试验设计
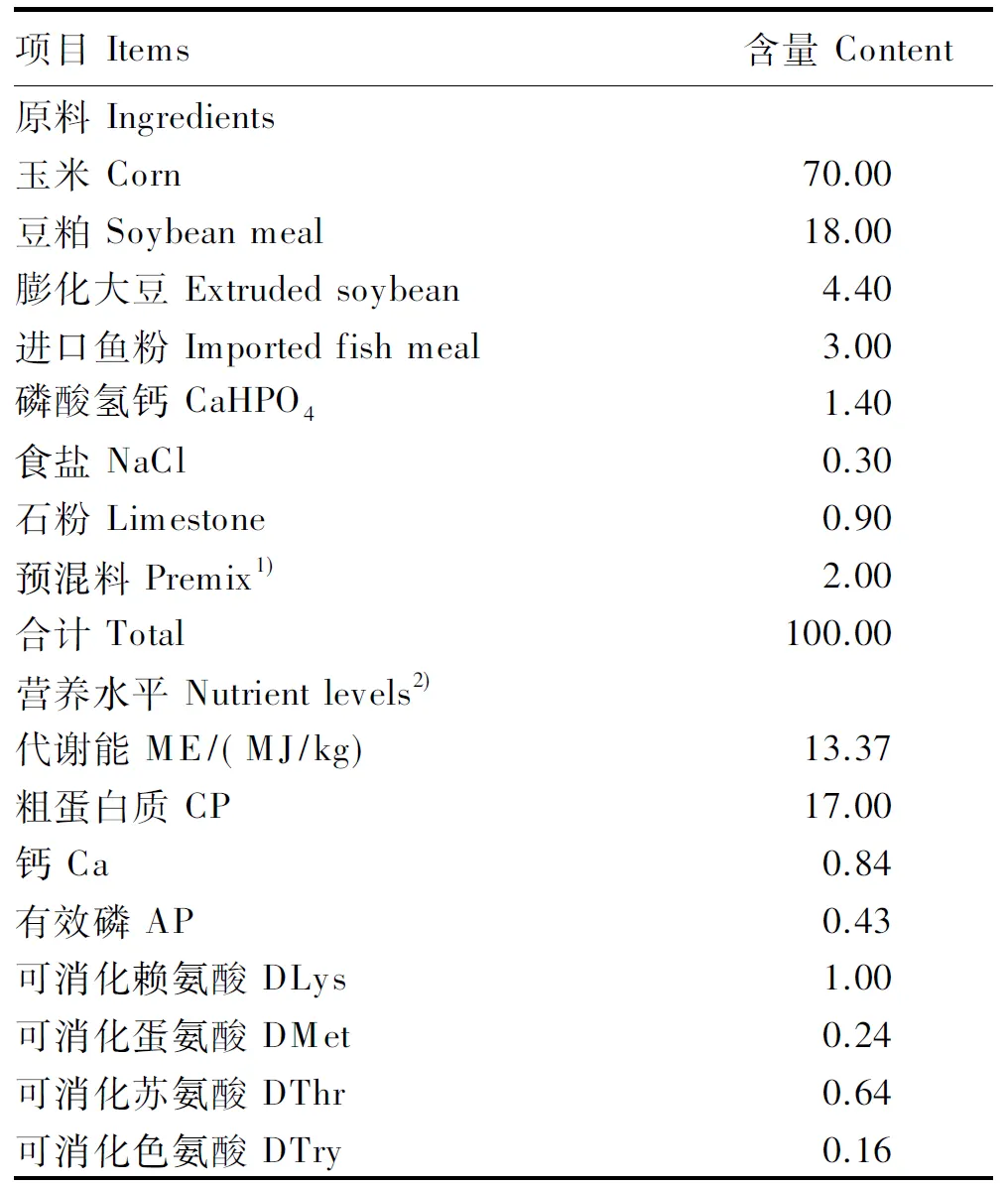
试验在辽宁德宝农牧集团艾德蒙种猪繁育场进行。试验采用2×2因子完全随机化设计,选取128头平均体重为(7.27±0.68) kg的28日龄健康大白断奶仔猪,随机分成4组,每组4个重复,每个重复8头仔猪。4个组间的初始平均体重组差异不显著(P>0.05)。各组分别饲喂基础饲粮(对照组)、基础饲粮+1 kg/t TB(TB组)、基础饲粮+1 kg/t OEO(OEO组)、基础饲粮+1 kg/t TB+1 kg/t OEO(TB+OEO组)。试验期为28 d。试验管理按照常规管理规程及正常免疫程序进行。基础饲粮是参照NRC(1998)早期断奶仔猪营养需要配制的颗粒料,其组成及营养水平见表1。
1.2试验材料
TB和OEO均由广州乐达有限公司提供。TB纯度为50%,OEO纯度为5%。其余部分均为载体,成分为二氧化硅。
1.3检测指标
1.3.1生长性能指标
于试验第1天、第14天、第28天晨饲前逐头称重。在试验期间,每天09:00—10:00、17:00—18:00观察仔猪排粪情况,记录腹泻个体。以个体为单位记录猪只死亡和淘汰情况,发现死淘猪及时结料并称重。根据每日记录的给料量、剩余料、损耗料,以重复为单位记算平均日增重、平均日采食量、料重比及腹泻率。
平均日采食量(g/d)=耗料量/
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:VA 8 000 IU,VD31 228 IU,VE 15 IU,VK 3.0 mg,VB11.3 mg,VB23.1 mg,VB61.2 mg,泛酸钙 calcium pantothenate 13.4 mg,氯化胆碱 choline chloride 500 mg,生物素 biotin 0.11 mg,烟酸 niacin 25 mg,叶酸 folic acid 0.68 mg,VB120.03 mg,Fe 120 mg,Cu 10 mg,Zn 130 mg,Mn 100 mg,I 0.3 mg,Se 0.3 mg,赖氨酸盐酸盐 Lys·HCl (78%) 3 g,L-苏氨酸L-Thr 1.3 g。
2)代谢能与可消化氨基酸为计算值,其余为实测值。ME and digestible amino acids were calculated values, while the others were measured values.
1.3.2血清生化指标
于试验第28天清晨空腹称重后,每组随机选取4头仔猪(每栏1头),进行前腔静脉采血5 mL,放入非抗凝血真空管静置15 min,之后进行离心,3 000 r/min离心15 min分离血清,置于-20 ℃冰箱中保存待测。
通过放射免疫法测定血清中白细胞介素2(IL-2)的含量。试剂盒购自北京华英生物技术研究所,按照试剂盒说明书进行测定,放射免疫仪器为r-911全自动放免计数仪,由中国科技大学实业总公司生产。
采用连续监测法测定血清碱性磷酸酶(ALP)、谷草转氨酶(AST)、谷丙转氨酶(ALT)的活性。测定步骤按照试剂盒的说明书进行,试剂盒购自中生北控生物科技股份有限公司。
采用比色法测定血清免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)含量以及超氧化物歧化酶(SOD)活性。采用日本日立7160全自动生化仪进行测定,试剂盒购自中生北控股份有限公司,操作步骤按照药盒说明书进行。
采用双缩脲法测定血清总蛋白(TP)的含量,采用溴甲酚绿法测定血清白蛋白(ALB)的含量,TP含量和ALB含量之差为血清球蛋白(GLO)含量;采用葡萄糖氧化酶法测定血清葡萄糖(GLU)的含量,采用两点动力法测定血清尿素氮(UN)的含量。所用试剂盒均购自中生北控生物科技股份有限公司,操作步骤按照试剂盒说明书进行。
1.3.3营养物质表观消化率
粪样采集:分别于试验结束前3 d,每天07:00—09:00间按5点法(猪圈四角和中间)收集粪样100 g,按每10 g粪样加10 mL 10%的盐酸进行固氮,防止氨气挥发,并做好记录,将样品置于-20 ℃冰箱冷冻保存用于营养物质分析。实验室测定之前,将所采粪样混合均匀后取样进行测定。
饲料样的采集:采用四分法收集样品各250 g,4 ℃保存待测。
对营养指标的测定参照《动物营养学实验教程》中的具体分析方法进行操作。粗蛋白质(CP)含量的测定采用凯氏定氮法,粗脂肪(EE)含量的测定采用索氏浸提法,钙(Ca)含量的测定采用乙二胺四乙酸(EDTA)络合滴定法,磷(P)含量的测定采用钒钼黄比色法。采用盐酸不溶灰分(AIA)内源指示剂法测定饲料和粪样中粗蛋白质、粗脂肪、钙和磷的表观消化率。营养物质表观消化率计算公式为:
Dd=100-(Id/If)×(Af/Ad)×100。
式中:Dd为营养物质表观消化率(%);Id为试验饲粮中盐酸不溶灰分的含量(%);If为粪中盐酸不溶灰分的含量(%);Af为粪中营养物质含量(%);Ad为试验饲粮中营养物质含量(%)。
1.3.4粪中微生物数量
在试验结束当天07:00—09:00从每个组中挑选出体况接近,生长状况良好的仔猪各3头,每头仔猪采集新鲜粪样5 g,做好记录后置于4 ℃冰箱中保存用于测定粪中微生物数量。采用平板涂布法对粪中微生物的数量进行测定。
1.4数据处理
试验数据采用SPSS 17.0软件的单因素方差分析(one-way ANOVA)程序进行分析,差异显著时采用Duncan氏法进行多重比较,同时采用GLM中的多因素方差分析,分析各因素的主效应以及互作效应。P<0.05为差异显著,P<0.01为差异极显著,结果以“平均值±标准差”表示。
2 结 果
2.1饲粮中添加TB和OEO对断奶仔猪生长性能的影响
由表2可知,单因素分析结果表明,与对照组相比,OEO组能够显著提高断奶仔猪平均日增重(P<0.05),TB组和TB+OEO组对断奶仔猪平均日增重的影响没有达到显著水平(P>0.05);TB+OEO组能够显著降低断奶仔猪料重比(P<0.05),TB组和OEO组对断奶仔猪料重比的影响没有达到显著水平(P>0.05);OEO组和TB+OEO组均能够极显著降低断奶仔猪腹泻率(P<0.01),TB组对断奶仔猪腹泻率的影响没有达到显著水平(P>0.05);TB组、OEO组和TB+OEO组对断奶仔猪平均日采食量的影响没有达到显著水平(P>0.05)。
主效应分析结果表明,饲粮中添加OEO能够极显著降低腹泻率(P<0.01);饲粮中TB和OEO共同添加对断奶仔猪平均日采食量和平均日增重的影响没有显著的交互作用(P>0.05)。
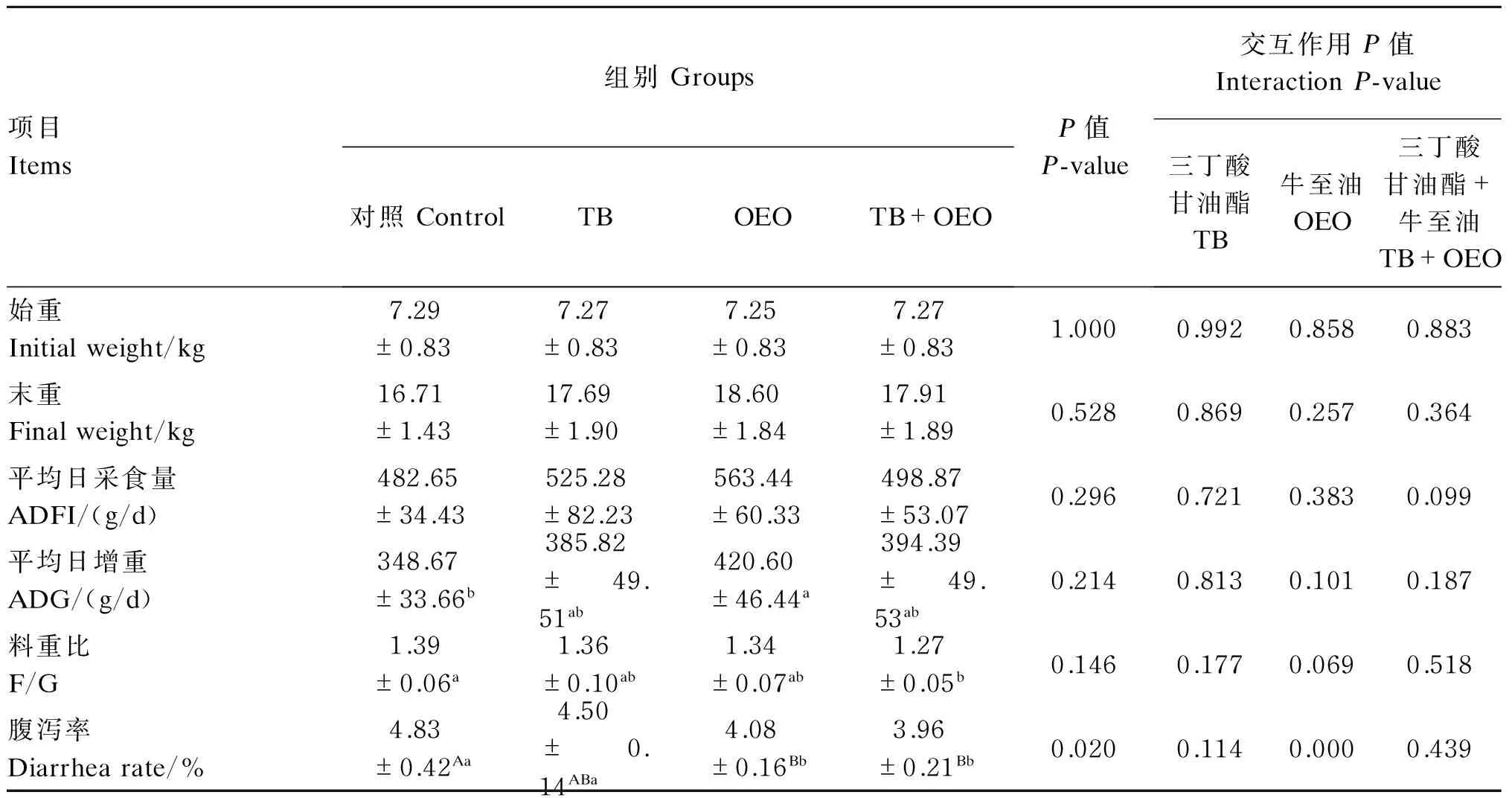
表2 饲粮中添加三丁酸甘油酯和牛至油对断奶仔猪生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2饲粮中添加TB和OEO对断奶仔猪血清生化指标的影响
由表3可知,单因素分析结果表明,与对照组相比,TB组、OEO组和TB+OEO组对断奶仔猪血清中AST、ALT、ALP、SOD活性以及UN、GLU、GLO、TP、IgA、IgG、IgM、IL-2含量的影响均没有达到显著水平(P>0.05)。
主效应分析结果表明,饲粮中单独添加TB或OEO对各血清生化指标的影响均不显著(P>0.05);饲粮中TB和OEO共同添加对断奶仔猪各血清生化指标的影响没有显著的交互作用(P>0.05)。
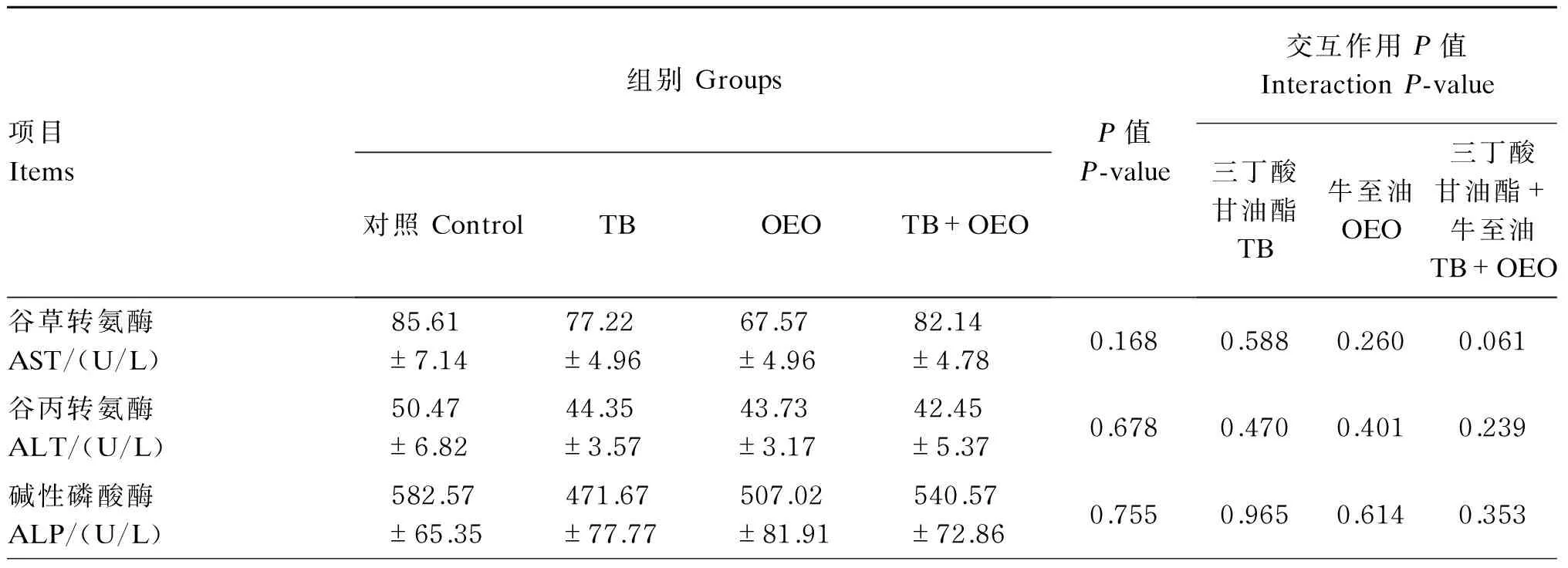
表3 饲粮中添加TB和OEO对断奶仔猪血液生化指标的影响
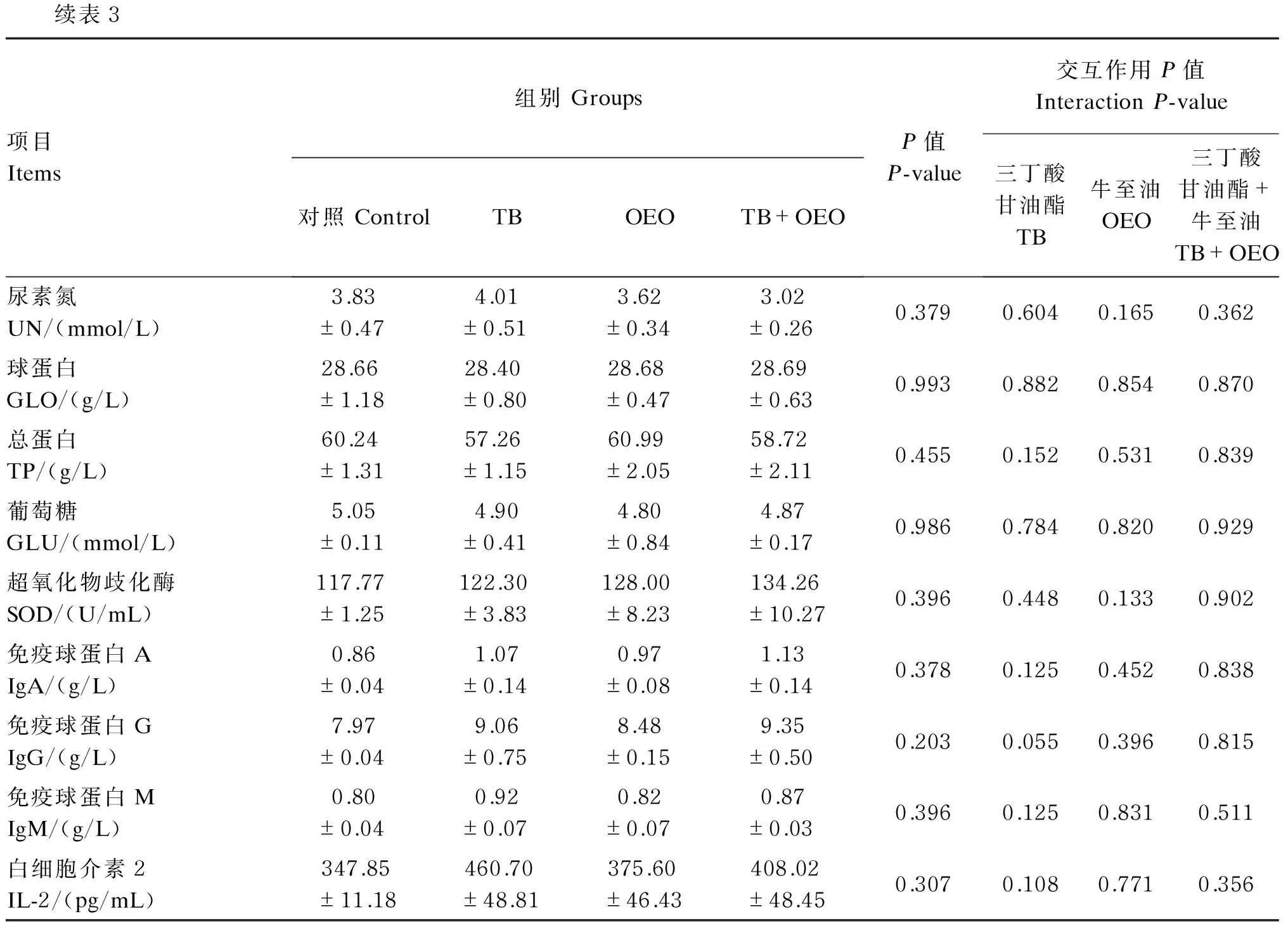
续表3项目Items组别Groups对照ControlTBOEOTB+OEOP值P-value交互作用P值InteractionP-value三丁酸甘油酯TB牛至油OEO三丁酸甘油酯+牛至油TB+OEO尿素氮UN/(mmol/L)3.83±0.474.01±0.513.62±0.343.02±0.260.3790.6040.1650.362球蛋白GLO/(g/L)28.66±1.1828.40±0.8028.68±0.4728.69±0.630.9930.8820.8540.870总蛋白TP/(g/L)60.24±1.3157.26±1.1560.99±2.0558.72±2.110.4550.1520.5310.839葡萄糖GLU/(mmol/L)5.05±0.114.90±0.414.80±0.844.87±0.170.9860.7840.8200.929超氧化物歧化酶SOD/(U/mL)117.77±1.25122.30±3.83128.00±8.23134.26±10.270.3960.4480.1330.902免疫球蛋白AIgA/(g/L)0.86±0.041.07±0.140.97±0.081.13±0.140.3780.1250.4520.838免疫球蛋白GIgG/(g/L)7.97±0.049.06±0.758.48±0.159.35±0.500.2030.0550.3960.815免疫球蛋白MIgM/(g/L)0.80±0.040.92±0.070.82±0.070.87±0.030.3960.1250.8310.511白细胞介素2IL-2/(pg/mL)347.85±11.18460.70±48.81375.60±46.43408.02±48.450.3070.1080.7710.356
2.3饲粮中添加TB和OEO对断奶仔猪营养物质表观消化率的影响
由表4可知,单因素分析结果表明,与对照组相比,TB+OEO组能显著提高断奶仔猪粗蛋白质的表观消化率(P<0.05),TB组和OEO组对断奶仔猪粗蛋白质的表观消化率的影响没有达到显著水平(P>0.05);TB+OEO组能够极显著提高断奶仔猪粗脂肪的表观消化率(P<0.01),TB组和OEO组对断奶仔猪粗脂肪的表观消化率的影响没有达到显著水平(P>0.05)。
主效应分析结果表明,饲粮中添加OEO能够极显著提高粗脂肪的表观消化率(P<0.01),能够显著提高钙的表观消化率(P<0.05)。饲粮中TB和OEO共同添加对断奶仔猪各营养物质的表观消化率的影响没有显著的交互作用(P>0.05)。
2.4饲粮中添加TB和OEO对断奶仔猪粪中微生物数量的影响
由表5可知,单因素分析结果表明,与对照组相比,TB组、OEO组和TB+OEO组均能极显著降低断奶仔猪粪中大肠杆菌数量(P<0.01);TB组、OEO组和TB+OEO组对断奶仔猪粪中乳酸杆菌数量的影响并没有达到显著水平(P>0.05);TB+OEO组能够显著提高断奶仔猪粪中双歧杆菌数量(P<0.05),但TB组和OEO组对断奶仔猪粪中双歧杆菌数量的影响没有达到显著水平(P>0.05)。
主效应分析结果表明,饲粮中添加TB能够显著提高断奶仔猪粪中大肠杆菌的数量(P<0.05);饲粮中添加OEO能极显著提高断奶仔猪粪中大肠杆菌的数量(P<0.01),显著降低粪中双歧杆菌的数量(P<0.05);饲粮中TB和OEO共同添加对断奶仔猪粪中微生物数量的影响没有显著的交互作用(P>0.05)。
3 讨 论
3.1饲粮中添加TB和OEO对断奶仔猪生长性能的影响
侯改凤等[7]和刘统等[8]研究表明,饲粮中添加0.2%的TB能够显著提高断奶仔猪平均日采食量和平均日增重,并降低料重比、腹泻率和发病率。Kulchaiyawat等[9]所做研究结果表明,在断奶仔猪饲粮中添加2%的牛至能够改善断奶仔猪的平均日增重和平均日采食量。Li等[10]研究发现,百里酚与香芹酚等酚类混合物能够提高断奶仔猪的平均日增重和饲料转化率。TB呈中性,化学性质稳定,能够通过胃到达肠道后段,在大肠内被胰脂肪酶迅速分解成甘油和丁酸。丁酸在动物肠道被吸收后,进入到结肠上皮细胞,在此95%的丁酸会被氧化成酮体用来合成ATP,是肠道细胞重要的能量来源[11]。丁酸不仅能够为结肠细胞提供所需的碳水化合物和能量,还能预防渗透性腹泻的发生[12]。丁酸在动物肠道被吸收的同时还能够促进肠道中钠离子(Na+)、钾离子(K+)和水的吸收,从而起到止泻的作用[11]。而OEO具有特殊的芳香气味可刺激动物的食欲,刺激消化道感受器,激活消化酶的活性,从而促进饲粮中营养物质的吸收,促进机体生长。
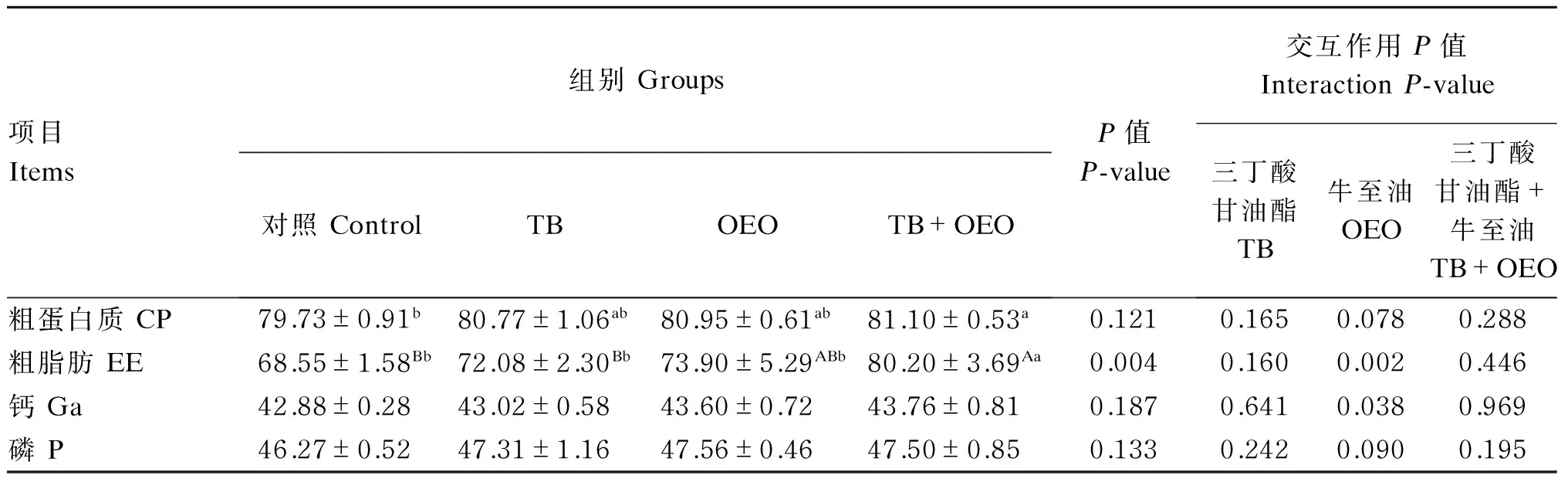
表4 饲粮中添加TB和OEO对断奶仔猪营养物质表观消化率的影响
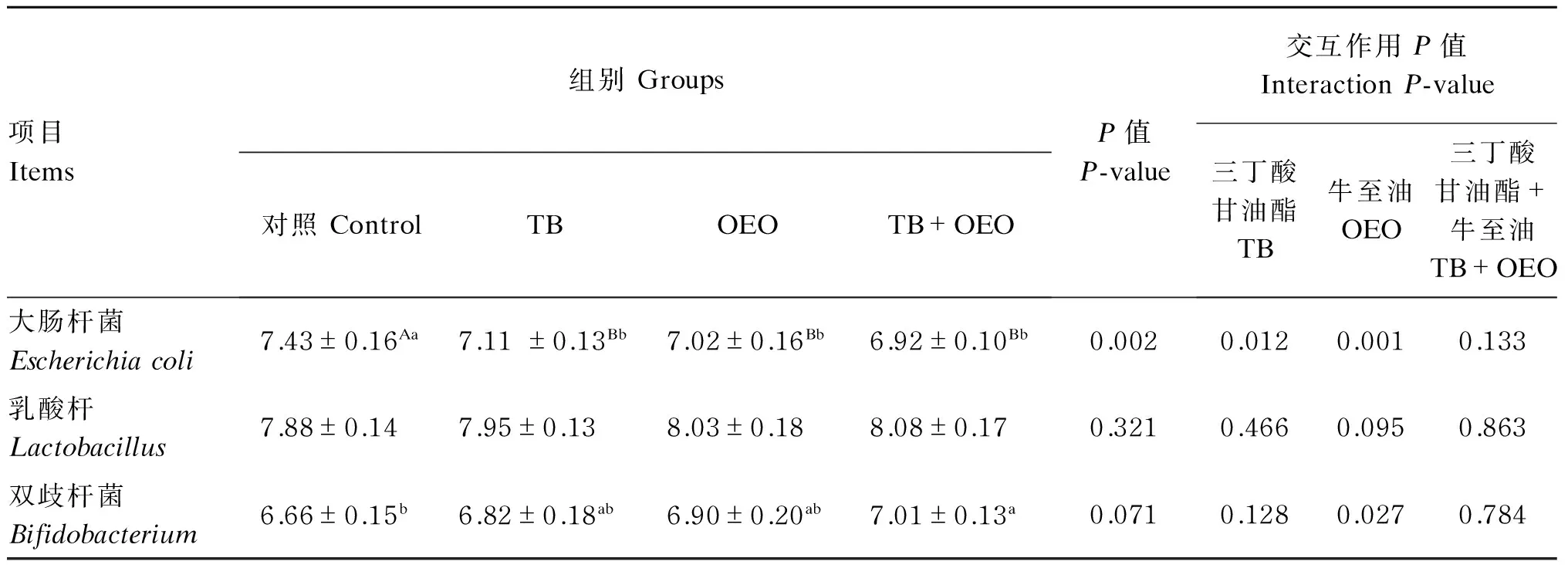
表5 饲粮中添加TB和OEO对断奶仔猪粪中微生物数量的影响
本试验结果表明,在断奶仔猪饲粮中添加TB能够提高断奶仔猪的平均日采食量和平均日增重,但是没有达到显著水平,这可能是因其添加剂量较少的原因。而添加OEO能够显著提高断奶仔猪平均日增重,极显著降低腹泻率;TB和OEO共同添加能显著降低断奶仔猪料重比,极显著降低腹泻率。但是二者之间并没有显著的加性效益。同时,本试验结果与前人的研究结果基本一致。TB与OEO可能产生互作效应的原因是OEO所含的香芹酚及百里酚等化合物能够提高断奶仔猪肠道内微生物发酵所产生的丁酸含量[13],从而使丁酸的效用加强。
3.2饲粮中添加TB和OEO对断奶仔猪血清生化指标的影响
断奶给仔猪带来的应激将会造成实质性器官组织的细胞膜受损、膜内功能膜释放,能够升高相应的酶活性。血清TP是动物体内蛋白质的一个重要来源,能够用来修补组织以及提供能量。TP反映了饲粮中的蛋白质水平及动物对蛋白质吸收代谢程度,TP含量高说明动物的蛋白质合成代谢速度快。GLO是由浆细胞分泌的,其在血清中的含量能够反映出仔猪的抵抗力。IL-2主要由活化T细胞产生,其主要功能是促进淋巴细胞生长、增殖、分化,对机体的免疫应答和抗病毒感染等有重要作用。IgA、IgG、IgM是3种免疫球蛋白,它们由骨髓来源的B淋巴细胞产生,能够参与机体的体液免疫,它们在血清中的含量能够反映出机体免疫力的强弱[14]。TB主要是通过控制炎症反应以及调节抗炎因子的表达从而来改善机体的免疫能力[15]。OEO能够促进机体免疫器官的生长发育,提高巨噬细胞的吞噬能力, 而巨噬细胞是非特异性免疫、体液免疫、细胞免疫及抗感染免疫等方面起重要作用的参与机体免疫应答的重要细胞,对提高机体免疫抵抗力具有重要的作用[16]。杨玲[3]研究表明,饲粮中添加0.20%的TB能够提高TP与GLO含量,降低ALT、天门冬氨酸转氨酶、ALP的活性。Katrin等[17]研究发现,与对照组相比,饲粮中添加OEO能够显著提高淋巴细胞的比例。本试验结果表明,饲粮中添加TB能够使血清IgA、IgG、IgM和IL-2含量增加,说明TB在提高断奶仔猪的免疫性能方面有一定作用。饲粮中添加OEO能够使TP、GLO、IgA、IgG、IgM和IL-2含量增加,说明OEO具有提高断奶仔猪免疫性能的作用。
血清UN含量能够较为准确地反映出机体内蛋白质代谢或者氨基酸间的平衡状况,当氨基酸平衡良好时,血清UN含量就会下降[18]。而在本试验中TB组的血清UN含量较对照组高,可能是由于测定的样本数偏少导致的,而且在仔猪发生应激的时候,血清UN含量的来源与去路也是十分复杂的过程,对于血清UN含量的变化规律还有待进一步的研究和探索。同时,许多学者认为,血清GLU含量的升高也与应激有关。本试验中,TB组、OEO组和TB+OEO组的血清GLU含量均低于对照组,说明TB和OEO在减缓仔猪应激过程中起到了一定的作用。
SOD是机体重要的抗氧化酶,具有特殊的生理活性,是生物体内清除自由基的首要物质。Zhang等[19]研究表明,OEO能够提高血清和肝脏中的SOD活性,降低丙二醛的含量。有研究表明,OEO中所含活性成分的抗氧化性能高于维生素E、维生素C以及类胡萝卜素[20]。本试验结果表明,饲粮中添加TB和OEO能够使断奶仔猪血清SOD活性增加,说明TB和OEO具有一定的抗氧化作用。
3.3饲粮中添加TB和OEO对断奶仔猪粪中微生物数量的影响
Castillo等[21]研究表明,在早期断奶仔猪饲粮中添加了0.3%的丁酸钠,极显著增加了试验组肠道微生物的多样性。陈会良等[6]试验结果表明,OEO可显著提高断奶仔猪空肠、盲肠和结肠中有益微生物的数量,并能有效抑制大肠杆菌的生长繁殖。Li等[10]研究表明,百里酚与香芹酚等的混合物能够降低断奶仔猪粪中大肠杆菌的数量,同时能够增加其粪中乳酸杆菌的数量。
丁酸进入细菌细胞后便会被分解成丁酸根离子和氢离子,氢离子浓度升高便会使大肠杆菌、沙门氏菌等有害菌大量死亡,而乳酸杆菌等有益菌则会因其耐酸性而大量增殖[22]。OEO中的活性成分有较强的表面活性和脂溶性,可以迅速穿透病原微生物的细胞膜,使其内容物流失,并能够有效地阻止线粒体内的呼吸氧化过程,使病原微生物失去能量供应而死亡,从而提高仔猪的抗病能力。本试验结果表明中,饲粮中单独添加TB、OEO或TB与OEO共同添加均能极显著降低断奶仔猪粪中大肠杆菌数量,显著提高断奶仔猪粪中双歧杆菌数量,与前人研究基本一致。
4 结 论
① 饲粮中添加TB能够极显著降低断奶仔猪粪中大肠杆菌的数量。
② 饲粮中添加OEO能显著提高断奶仔猪平均日增重,极显著降低断奶仔猪的腹泻率和粪中大肠杆菌的数量。
③ 饲粮中共同添加TB与OEO能显著降低断奶仔猪的料重比,极显著降低腹泻率,显著提高粗蛋白质的表观消化率,极显著提高粗脂肪的表观消化率,极显著降低粪中大肠杆菌数量,显著增加粪中双歧杆菌数量。
[1]HOU Y Q,LIU Y L,HU J,et al.Effects of lactitol and tributyrin on growth performance,small intestinal morphology and enzyme activity in weaned pigs[J].Asian Australasian Journal of Animal Sciences,2006,19(10):1470-1477.
[2]余东游,孙健栋,麻剑雄,等.三丁酸甘油酯的生物学功能及其在畜牧生产中的应用[J].中国畜牧杂志,2014,50(17):91-95.
[3]杨玲.三丁酸甘油酯对断奶仔猪生长性能、肠道结构和血液生化指标的影响[J].饲料工业,2012(S1):46-49.
[4]孙鎏国,杨海燕,陆玉娟,等.牛至油对断奶仔猪生产性能的影响[J].上海畜牧兽医通讯,2005(3):29,31.
[5]周晓容,刘作华,杨飞云,等.牛至油对生长猪生产性能和养分表观消化率的影响[J].四川畜牧兽医,2010(9):22-23.
[6]陈会良,袁向阳,黄磊,等.牛至油对仔猪肠道微生物菌群的影响[J].中兽医医药杂志,2005(6):32-33.
[7]侯改凤,李瑞,枉侯军,等.三丁酸甘油酯对断奶仔猪生长性能及养分消化率的影响[J].养猪,2014(5):4-6.
[8]刘统,黄兴国,朱广宁.丁酸甘油酯对断奶仔猪生长性能影响的研究[J].饲料工业,2011,32(22):39-41.
[9]KULCHAIYAWAT C,HONEYMAN M S.Effects of oregano supplemented diets on nursery pig performance[R].Animal Industry Report AS 652,2006.
[10]LI S Y,RU Y J,LIU M,et al.The effect of essential oils on performance,immunity and gut microbial population in weaner pigs[J].Livestock Science,2012,145(1/2/3):119-123.
[11]LEONEL A J,ALVAREZ-LEITE J I.Butyrate:implications for intestinal function[J].Current Opinion in Clinical Nutrition and Metabolic Care,2012,15(5):474-479.
[12]CRESCI G,NAGY L E,GANAPATHY V.LactobacillusGG and tributyrin supplementation reduce antibiotic-induced intestinal injury[J].Journal of Parenteral and Enteral Nutrition,2013,37(6):763-774.
[13]CAO P H,LI F D,LI Y F,et al.Effect of essential oils and feed enzymes on performance and nutrient utilization in broilers fed a corn/soy-based diet[J].International Journal of Poultry Science,2010,9(8):749-755.
[14]何颖,赵武,秦毅斌,等.NS复合乳酸菌制剂对断奶仔猪免疫水平的影响[J].动物医学进展,2011,32(12):51-56.
[15]LEONEL A J,TEIXEIRAL L G,OLIVEIRAL R P,et al.Antioxidative and immunomodulatory effects of tributyrin supplementation on experimental colitis[J].British Journal of Nutrition,2013,109(8):1396-1407.
[16]唐瑶,陈洋.牛至油在猪和鸡生产中的应用研究进展[J].湖南饲料,2015(2):29-31.
[17]STELTERA K,FRAHMA J,PAULSENB J,et al.Effects of oregano on performance and immunmodulating factors in weaned piglets[J].Archives of Animal Nutrition,2013,67(6):461-476.
[18]MALMLOF K.Amino acid in farm animal nutrition metabolism,partition and consequences of imbalance[J].Swedish Journal of Agricultural Research,1988,18(4):191-193 .
[19]ZHANG T,ZHOU Y F,ZOU Y,et al.Effects of dietary oregano essential oil supplementation on the stress response,antioxidative capacity,andHSPsmRNA expression of transported pigs[J].Livestock Science,2015,180:143-149.
[20]RICE-EVANS C,MILLER N,PAGANGA G.Antioxidant properties of phenolic compounds[J].Trends in Plant Science,1997,2(4):152-159.
[21]CASTILLO M,MARTE S M,ROCA M,et al.The response of gastrointestinal microbiota to avilamycin,butyrate,and plant extracts in early-weaned pigs[J].Journal of Animal Science,2006,84(10):2725-2734.
[22]GUILLOTEAU P,MARTIN L,EECKHAUT V,et al.From the gut to the peripheral tissues:the multiple effects of butyrate[J].Nutrition Research Reviews,2010,23(2):366-384.
Author, ZHANG Yong, professor, E-mail: syndzhy@126.com
(责任编辑武海龙)
Effects of Tributyrin and Oregano Essential Oil on Growth Performance, Serum Biochemical Indices and Nutrient Apparent Digestibility of Weaning Piglets
ZHANG Yong1,2WANG Meng1LI Fangfang1ZHU Yujing1HUANG Tiejun2HE Maolong2WANG Hongyan3
(1. College of Veterinary and Animal Science, Shenyang Agricultural University, Shenyang 110866, China;2. Lucta (Guangzhou) Flavors Co., Ltd., Guangzhou 510530, China; 3. Shenyang Bo Yang Feed Co., Ltd., Shenyang 110128, China)
This experiment was conducted to investigate the effects of dietary tributyrin (TB) and oregano essential oil (OEO) on growth performances, serum biochemical indices, nutrient apparent digestibility and fecal micro flora of weaning piglets. A total of 128 healthy 28-day-old large white piglets with body weight of (7.27±0.68) kg were randomly allotted to 4 groups with 4 replicates per group and 8 piglets per replicate. The four groups were fed the basal diet (control group), the basal diet+1 kg/t TB (TB group), the basal diet+1 kg/t OEO (OEO group), the basal diet+1 kg/t TB+1 kg/t OEO (TB+OEO group), respectively. The trial lasted for 28 days. The results showed as follows: 1) compared with the control group, the average daily gain of weaning piglets in OEO group was significantly increased (P<0.05), and the diarrhea rate of weaning piglets was significantly decreased (P<0.01); the feed to gain ratio of weaning piglets in TB+OEO group was significantly increased (P<0.05), and the diarrhea rate of weaning piglets was significantly decreased (P<0.01). 2) There were no significant effects on serum biochemical indices among all groups (P>0.05). 3) Compared with the control group, the crude protein apparent digestibility of weaning piglets in TB+OEO group was significantly increased (P<0.05), and the ether extract apparent digestibility of weaning piglets was significantly increased (P<0.01). 4) Compared with the control group, the number ofEscherichiacoliin feces in TB group, OEO group and TB+OEO group was significantly decreased (P<0.01), the number ofBifidobacteriumin feces in TB+OEO group was significantly increased (P<0.05). The results indicate that supplementation of TB and OEO in piglets diet can improve the growth performance of piglets, improve nutrient apparent digestibility and regulate intestinal flora balance.[ChineseJournalofAnimalNutrition, 2016, 28(9):2786-2794]
tributyrin; oregano essential oil; weaning piglets; growth performance; serum biochemical indices; nutrient apparent digestibility
10.3969/j.issn.1006-267x.2016.09.017
2016-03-21
张勇(1972—),男,甘肃武威人,教授,博士,从事猪的营养与饲料资源开发利用的教学和研究工作。E-mail: syndzhy@126.com
S828
A
1006-267X(2016)09-2786-09

