拟南芥AtCIPK23基因对烟草抗旱能力的影响
杨玲珑,李 珂,鲁黎明,2*
(1 四川农业大学 农学院,成都611130;2 植物生理学与生物化学国家重点实验室,北京100094)
拟南芥AtCIPK23基因对烟草抗旱能力的影响
杨玲珑1,李 珂1,鲁黎明1,2*
(1 四川农业大学 农学院,成都611130;2 植物生理学与生物化学国家重点实验室,北京100094)
为了探索拟南芥AtCIPK23基因对烟草耐旱能力的影响,对3个转AtCIPK23基因阳性纯合株系KA13、KA14和KA44与野生型烟草K326(对照)进行了自然干旱处理,测定离体叶片的失水速率、叶绿素含量、相对电导率、脯氨酸和可溶性糖含量,并分析了转基因及野生型材料对活性氧的清除能力,对活性氧清除基因NtSOD、NtCAT和NtAPX及干旱胁迫相关基因NtDREB、NtLEA5和NtCDPK2的表达量进行检测。结果表明:(1)转基因烟草离体叶片的失水速率明显低于K326;自然干旱7 d后,野生型K326出现了明显的干旱胁迫症状;干旱7 d进行复水后,转基因株系的复水存活率明显高于K326。(2)转基因株系中的叶绿素、脯氨酸及可溶性糖含量比K326显著提高,电导率则明显降低。(3)野生型烟草K326中H2O2的积累量明显高于3个转基因株系,转基因株系中ROS清除机制的3个关键基因NtSOD、NtCAT和NtAPX被诱导上调表达。(4)抗旱相关基因NtDREB、NtLEA5和NtCDPK2仅在转基因烟草中受干旱诱导。研究认为,AtCIPK23基因可能具有提高植物抗旱能力的功能。
烟草;转基因;AtCIPK23;钙信号;干旱
干旱是给农业生产造成重大威胁的自然灾害。干旱会导致农作物生长发育受到严重阻碍,给农作物的产量造成巨大的损失[1]。因此,深入了解植物抗旱的生理机制,提高农作物的耐旱性,保证干旱胁迫下农作物的产量,具有十分重要的意义。
在分子层面,植物响应干旱胁迫可以分为两种途径,即依赖ABA途径和不依赖ABA途径。两者的区别在于,在遭受干旱胁迫时,前者会伴随着植物细胞内ABA含量的增加[2]。当ABA含量增加时,会激发胞内的由CDPK、MAPK等蛋白激酶的磷酸化和去磷酸化所导致的信号转导,从而指导下游基因的表达。在此过程中,Ca2+信号转导发挥着极其重要的作用。研究表明,当AtCML9基因被敲除后,atcml9突变体具有更强的抗旱能力[3]。而AtCAMTA1基因却正调控植物的抗旱过程,其敲除后植株的抗旱能力却明显降低[4]。CDPK同样在植物干旱响应中发挥重要作用。cpk3cpk6双突变体中,ABA诱导气孔关闭的功能降低,导致其抗旱能力下降[5]。另外过表达AtCPK4和AtCPK11时,植株抗旱能力增强,而cpk4cpk11双突变体的抗旱能力明显减弱[6-7]。拟南芥cpk8及cpk10突变体对干旱表现出敏感的表型,而CPK8与CPK10的过表达植株的耐旱能力则较野生型大幅度提高[8-9]。CBL(calcineurin B-like proteins)也参与了植物的干旱胁迫响应,如AtCBL5正调控不依赖于ABA抗旱途径,当其过表达时,植株的抗旱能力明显提高[10];AtCBL9的表达受ABA的诱导,同时,其敲除突变体则表现出对渗透胁迫的敏感[11]。
此外,CIPK(CBL-interacting protein kinase)蛋白也参与了植物的干旱胁迫响应。研究发现,AtCIPK6基因的表达受干旱胁迫的强烈诱导[12];在干旱条件下AtCBL1/9与AtCIPK1的互作能力增强,有利于平衡干旱条件下细胞内的渗透压[13-14]。过表达OsCIPK23基因后,水稻中抗旱相关基因被诱导表达,而OsCIPK23基因表达量的降低,则导致水稻植株的抗干旱能力降低[15]。
AtCIPK23基因在拟南芥应答低钾胁迫时起关键作用[16-17],然而,其在干旱胁迫响应中的作用尚不清楚。因此,本文通过将AtCIPK23转入烟草,并研究转基因植株的抗旱性,以为AtCIPK23的抗旱功能研究提供借鉴。
1 材料和方法
1.1 试验材料
普通烟草K326,转AtCIPK23基因烟草株系KA13、KA14和KA44均由植物生理学与生物化学国家重点实验室武维华教授实验室提供。
1.2 烟草的培养及样品采集
烟草种子经表面消毒后,播种于花盆中,并置于温度为25 ℃,相对湿度为60%~80%的大棚中培养。正常供水条件下生长40 d之后,进行自然干旱胁迫处理,即停止浇水12 d,然后复水,并统计复水成活率。
在干旱处理后的第7天,各材料分别采集10株烟草的叶片,进行相关生理指标的测定。
1.3 生理指标的测定方法
1.3.1 叶片失水率 摘取生长30天的烟草同一部位叶片,置于25~35 ℃环境下,自然风干12 h。每小时测1次样品重量,重复3次。叶片失水率=(鲜重-风干后重量)/鲜重×100%
1.3.2 相对电导率 在每片叶片上取10个直径为10 mm的圆形样品,置于10 mL ddH2O中浸泡12 h后用电导仪测定电导率(R1),然后沸水浴孵育30 min后,再次测定电导率(R2), 每个品种重复3次。相对电导率=R1/R2×100%。
1.3.3 叶绿素含量 选取同一部位的叶片,使用叶绿素测量仪SPAD,对叶片的5个不同部位进行叶绿素含量测定,计算平均值。
1.3.4 DAB染色 将叶片置于含有20% PEG 6000的MS营养液中模拟干旱胁迫12 h后,使用DAB(3,3′-diaminobenzidine-HCl)染色。然后,抽真空2 min,而后室温放置2 h,去除染色液,加入适量的脱色液(乙醇∶水∶冰醋酸∶甘油=8∶1∶1∶1)于60 ℃烘箱中进行脱色。
1.3.5 脯氨酸和可溶性糖含量测定 脯氨酸含量的测定用酸性水合茚三酮法进行[18],可溶性糖含量测定用蒽酮比色法进行[19]。
1.4 基因表达量分析
采用Trizol法提取烟草样品的总RNA,用DNase进行纯化处理。然后,取200 ng纯化后的总RNA,使用Reverse TranscriptionM-MLV酶进行反转录,用ddH2O将cDNA稀释10倍用于qRT-PCR实验。最后使用QuantiTect SYBR Green PCR Kit进行相关基因表达量分析。qRT-PCR分析所用引物见表1。qRT-PCR反应体系为:cDNA 1 μL,2x QuantiTect SYBR Green PCR Master Mix 5 μL,Primer F (10 μmol/L) 0.5 μL,Primer R (10 μmol/L) 0.5 μL,ddH2O 3 μL,总体积10 μL。qRT-PCR反应程序为:95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环。

表1 qRT-PCR引物
2 结果与分析
2.1 转基因烟草的分子检测
采用qRT-PCR的方法,对参试的转基因烟草及野生型K326进行了外源基因AtCIPK23的表达检测。结果表明,在野生型K326,没有检测到外源基因AtCIPK23的表达;而在3个转基因株系中,AtCIPK23的表达水平较高,而且,3个株系的表达量并不相同(图1)。由此说明,外源基因AtCIPK23在3个转基因烟草株系中,均得到了表达。
2.2 干旱对转基因烟草生长的影响
为了鉴定AtCIPK23转基因烟草植株的耐旱能力,将3个转基因株系与野生型K326进行了自然干旱处理。在停止浇水7 d后,转基因烟草植株与野生型植株的生长,表现出明显的差异(图2,A)。3个转基因株系植株的生长较为正常,冠部较大,叶色浓绿。而野生型植株的生长受到抑制,多数叶片萎蔫,冠部偏小,表现出干旱胁迫症状。
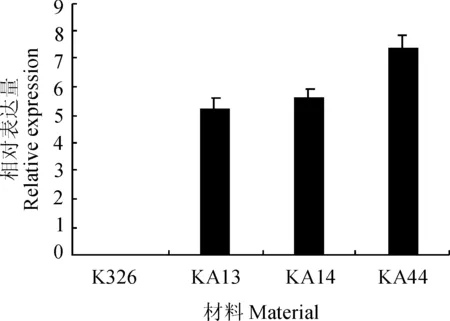
图1 转基因植株AtCIPK23表达量分析Fig.1 Expression analysis of AtCIPK23 in three transgenic lines and K326

A、B. 干旱处理后7 d与复水后5 d烟草的长势;C. DAB染色图2 干旱对转基因烟草生长的影响及DAB染色结果A and B, the phenotype of tobacco after 7 days drought stress treatment and 5 days re-watering. C, DAB stainingFig.2 The effect of drought stress on transgenic tobacco and DAB staining
干旱12 d后,转基因植株也出现黄化和萎蔫现象,但野生型植株的干旱胁迫表现更为严重。此时,进行复水,5 d之后,统计各个参试材料的复水存活率。结果表明,转基因株系KA13、KA14和KA44的复水存活率分别为90%、87%和90%,明显高于野生型K326的70%(图2,B)。干旱表型分析及复水存活率的比较结果,表明了转基因植株具有较强的耐旱能力。
2.3 干旱对烟草叶片失水率及叶绿素含量的影响
为了探究AtCIPK23转基因植株较为抗旱的原因,以正常生长30 d的野生型K326和3个转基因株系叶片为材料,测定了离体叶片的失水率。结果表明,随着时间的延长,4个株系的相对失水率均逐渐增加。其中野生型K326的相对失水率显著高于其余3个转基因株系(图3,A),其相对失水率的高低顺序为K326>KA13>KA14>KA44。此结果说明,叶片的保水能力较强,可能是转基因烟草植株较为耐旱的原因之一。
干旱7 d后,测定了转基因植株及野生型植株的SPAD值。结果表明,转基因株系的SPAD值显著高于野生型K326(图3,B)。SPAD值的高低顺序为KA44>KA14>KA13>K326。由于SPAD值在一定程度上反映了叶绿素含量的高低,因此,本结果也说明,在干旱胁迫下,转基因植株具有较高的叶绿素含量。而叶绿素含量较高,则意味着转基因植株具有较强的光合能力。
2.4 干旱对烟草叶片脯氨酸、可溶性糖含量及相对电导率的影响
脯氨酸及可溶性糖,是植物细胞的渗透调节物质,其含量的高低,在一定程度上反映了植物细胞的耐旱程度。对参试材料的脯氨酸及可溶性糖的测定结果表明,转基因材料这两个物质的含量均明显高于野生型材料(图4)。各材料脯氨酸含量的高低顺序为KA14>KA13>KA44>K326;而可溶性糖含量的高低顺序则为KA44>KA14>KA13>K326。渗透调节物质的测定结果表明,转基因株系具有较强的渗透调节能力,因而,表现较为耐旱。
相对电导率是植物细胞质膜完整性的标志指标之一,也是植物抗逆程度的反应。本研究在停止浇水7 d后,测定了参试材料的相对电导率,结果表明,野生型材料的相对电导率(45%),显著高于转基因株系KA14(28%),极显著高于KA13(18%) 和KA44(18%)。相对电导率测定的结果进一步说明,细胞质膜较为完整,也是转基因株系耐旱能力较强的原因之一。
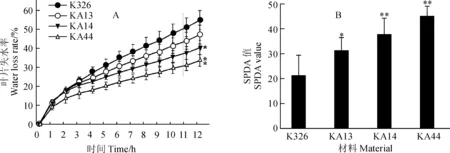
A. 叶片失水率;B. 叶绿素含量(SPAD值)图3 各材料叶片失水率及叶绿素含量的比较A. Water loss rate of tobacco leaves. B. Chlorophyll content of tobacco leaves (in SPDA value)Fig.3 The comparison of water loss rate and chlorophyll content of transgenic tobacco and wild type
2.5 干旱条件下各材料细胞内活性氧清除能力的比较
模拟干旱胁迫12 h后,通过DAB染色发现,K326叶片绝大部分区域呈现黄褐色,而转基因植株中黄褐色的区域较少,株系KA44的叶片几乎看不到明显的黄褐色区域(图2,C)。此结果说明,转基因株系对的H2O2清除能力较强,从而积累的H2O2较少。
为探索转基因株系对H2O2的清除能力产生的原因,对转基因株系中编码超氧化物歧化酶和过氧化氢酶及过氧化物酶的基因NtSOD、NtCAT和NtAPX的表达量进行了检测。结果表明,NtCAT和NtAPX基因的表达量受干旱的强烈诱导,表达量增加很多。尤其是NtAPX基因的表达量在KA14和KA44中分别提高了近15与20倍(图5,B、C)。同时,尽管NtSOD基因的表达量受干旱诱导表达量增加较少,但其在转基因材料中的表达量却远高于野生型K326(图5,A)。
此结果说明,AtCIPK23基因通过提高活性氧清除相关基因的干旱响应表达水平,有效促进了转基因植株在遭遇干旱胁迫后活性氧的清除能力,使转基因植物体内活性氧的积累维持在较低的水平,从而有利于提高转基因材料对干旱的耐受能力。
2.6 干旱条件下抗旱相关基因的诱导表达情况
采用qRT-PCR的方法,对干旱前后参试材料中3个干旱相关基因(NtDREB、NtLEA5和NtCDPK2)的表达量进行了分析,结果如图6所示。干旱处理前,NtDREB、NtLEA5和NtCDPK2在转基因材料中的表达量均高于野生型K326,其中,以NtCDPK2增加的量最多,NtDREB次之,NtLEA5基因的表达量增加最小。干旱处理后,所检测的3个基因的表达量在转基因材料中均有较大幅度提高,其中,以NtDREB受诱导表达最为强烈,以NtCDPK2,NtLEA5基因的受诱导表达量最小。同时,检测的结果还表明,所检测的3个基因在不同转基因株系中的表达量不同,其中,以NtDREB在3个转基因株系中的表达量差异较大,趋势呈现为KA44>KA14>KA13;而NtCDPK2和NtLEA5的表达量,无论干旱前后,在3个株系之间的差异均不大。
干旱相关基因表达量检测结果说明,AtCIPK23基因促进了这3个基因的表达,并有可能导致了转基因材料抗旱性的提高。
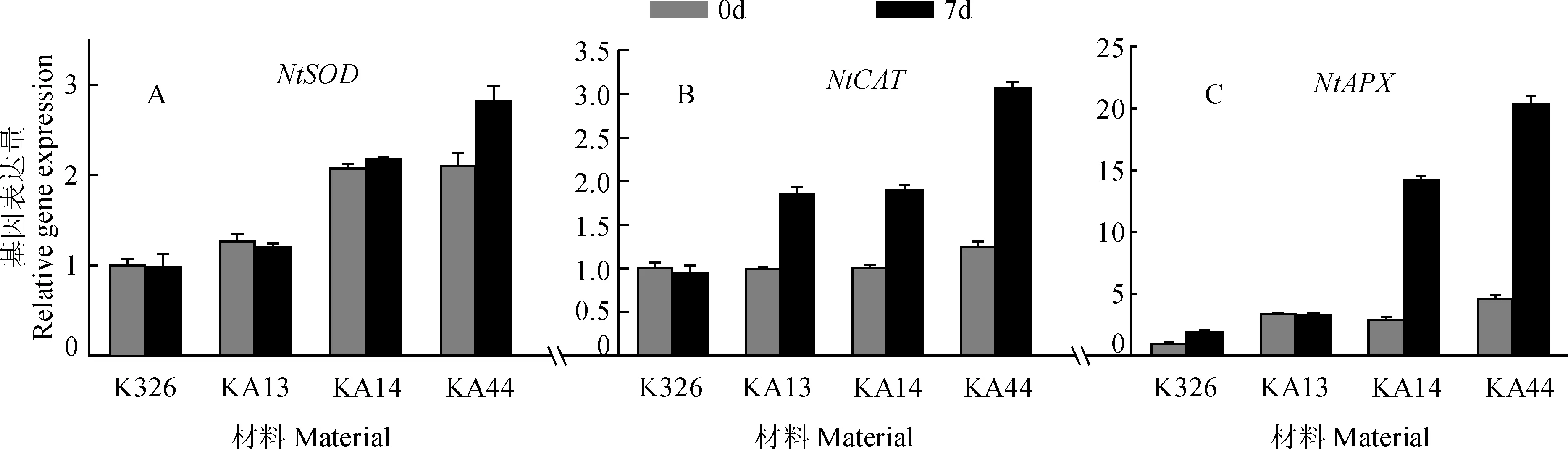
图5 NtSOD、NtCAT和NtAPX基因表达量分析Fig.5 Gene expression analysis of NtSOD, NtCAT and NtAPX
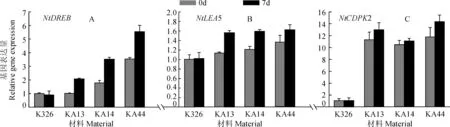
图6 干旱胁迫前后3个干旱相关基因的表达量分析Fig.6 Expression profiles of 3 drought relative genes in WT and transgenic lines at 0 and 7 days after drought stress
3 讨 论
本研究通过对转AtCIPK23基因烟草及野生型K326进行自然干旱,探讨了各参试材料的耐旱性。结果表明,转AtCIPK23基因的烟草植株具有较强的耐旱性。
Ca2+作为细胞内的第二信使,广泛参与并调节了植物的生长、发育和抗逆等各项生命活动[7,20]。在植物响应干旱胁迫的过程中,钙信号蛋白发挥了十分重要的作用[3-8,11]。CIPK蛋白是一类在植物体内发挥重要作用的蛋白[20-23],也参与了植物的逆境响应[12,15]。研究表明,CBL1/CBL9-CIPK23-AKT1途径遭到抑制时,保卫细胞气孔开度降低,从而有效减少了植物的水分散失,间接提高了植物的抗旱能力[16]。此结果说明,AtCIPK23可能参与了植物的干旱逆境响应。本研究的结果表明,在干旱胁迫下,AtCIPK23转基因烟草表现出了较为耐旱的表型。其叶片水分散失的速率较低、细胞膜的完整性较好,叶绿素含量较高,均有利于干旱环境中水分的吸收与保持、保护细胞内正常的生理生化反应,从而使转基因植株对干旱具有更强的耐受性。
在植物的干旱响应中,渗透调节物质发挥着十分重要的作用。前人的研究结果说明,渗透调节物质的积累有利于对胁迫下植物体内产生的活性氧和自由基的清除、细胞渗透势的降低以及叶片水分含量的维持[24]。本研究的结果也证实了转基因植株积累了较多的脯氨酸及可溶性糖等渗透调节物质,这些物质的含量较高,可能也是导致转基因烟草具有较强的耐旱能力的原因之一。
植物在逆境胁迫时,会产生活性氧物质ROS(reactive oxygen species, ROS)。ROS如果不及时清除,则会攻击植物细胞的DNA、蛋白质及膜脂质等生物大分子,从而使植物细胞不能够正常行使功能,导致植物生长受到影响,并降低农作物的产量与品质[25]。SOD、POD、CAT 和 APX 等保护酶类,构成了植物的活性氧清除系统。它们在植物体内共同发挥作用,能够减轻ROS对植物细胞的伤害[26-29]。Zhou等[8]的研究结果证实,CKP8能够调节CAT3的活性,提高拟南芥对ROS的清除能力,从而提高了拟南芥的抗旱性。本研究也得出了类似的研究结果。DAB染色的结果显示,过表达AtCIPK23的烟草植株对ROS的清除能力强于野生型,同时,其NtSOD、NtCAT和NtAPX基因的表达量明显提升,暗示了对ROS的清除能力较强,是转AtCIPK23的烟草植株抗旱能力增强的重要原因。
干旱相关基因的诱导表达,与植物的耐旱性密切相关。在干旱胁迫下,OsCIPK23过表达植株的干旱相关基因DREB2A、rd29A、Rab18 及NCED3被强烈诱导表达[15]。本研究的结果表明,转AtCIPK23基因烟株表现出耐旱性增强,同时,伴随着3个干旱相关基因NtDREB、NtLEA5和NtCDPK2在转基因植株内表达量的急剧上升。这就说明,CIPK蛋白在不同的物种内可能采取类似的机制参与了植物对干旱胁迫的响应。
本研究的结果证实,AtCIPK23能够增强烟草的耐旱能力。然而,植物对外界干旱胁迫的分子响应,是一个较为复杂的过程。AtCIPK23究竟是如何调控烟草细胞的生理生化活动,从而实现其耐旱能力的增强,尚待进一步研究。
[1] BRAY E A, BAILEY-SERRES J, WERETILNYK E. “Responses to abiotic stresses,” in Biochemistry and Molecular Biology of Plants[M]. B. B. Buchanan,W. Gruissem, and R. L. Jones (Rockville: American Society of Plant Physiologists), 2000, 1 158-1 203.
[2] SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. Gene expression and signal transduction in water stress response[J].PlantPhysiology, 1997, 115:327-334.
[3] MAGNAN F, RANTY B, CHARPENTEAU M,etal. Mutations in AtCML9, a calmodulin-like protein fromArabidopsisthaliana, alter plant responses to abiotic stress and abscisic acid[J].PlantJournal, 2008, 56: 575-589.
[4] PANDEY N, RANJAN A, PANT P,etal. CAMTA1 regulates drought responses inArabidopsisthaliana[J].BMCGenomics, 2013, 14: 216.
[5] BOUDSOCQ M.and SHEEN J. CDPKs in immune and stress signaling[J].TrendinPlantScience, 2013, 18(1): 30-40.
[6] CHOI H I, PARK H J,PARK J H,etal. Arabidopsis calcium-dependent protein kinase AtCPK32 interacts with ABF4, a transcriptional regulator of abscisic acid-responsive gene expression, and modulates its activity[J].PlantPhysiology, 2005, 139(4): 1 750-1 761.
[7] ZHU S Y, YU X C, WANG X J,etal. Two calcium-dependent protein kinases, CPK4 and CPK11, regulate abscisic acid signal transduction inArabidopsis[J].PlantCell, 2007, 19: 3 019-3 036.
[8] ZOU J J, LI X D, RATNASEKERA D,etal. Arabidopsis CALCIUM-DEPENDENT PROTEIN KINASE8 and CATALASE3 function in abscisic acid-mediated signaling and H2O2homeostasis in stomatal guard cells under drought stress[J].PlantCell, 2015, 27:1 445-1 460.
[9] ZOU J J, WEI F J, WANG C,etal. Arabidopsis calcium-dependent protein kinase CPK10 functions in abscisic acid- and Ca 2+ -mediated stomatal regulation in response to drought stress[J].PlantPhysiology, 2010, 154:1 232-1 243.
[10] CHEONG Y H, SUNG S J, KIM B G,etal.Constitutive overexpression of the calcium sensorCBL5 confers osmotic or drought stress tolerance inArabidopsis[J].MolecularCells, 2010, 29(2): 159-165.
[11] PANDEY G K, CHEONG Y H, KIM K N,etal. The calcium sensor calcineurin B-like 9 modulates abscisic acid sensitivity and biosynthesis inArabidopsis[J].PlantCell, 2004, 16(7): 1 912-1 924.
[12] CHEN L, WANG Q Q, ZHOU L,etal.ArabidopsisCBL-interacting protein kinase (CIPK6) is involved in plant response to salt/osmotic stress and ABA[J].MolecularBiologyReports, 2013, 40(8): 4 759-4 767.
[13] CHEONG Y H, KIM K N,etal. CBL1, a calcium sensor that differentially regulates salt, drought, and cold responses inArabidopsis[J].PlantCell, 2003, 15(8): 1 833-1 845.
[14] THODAY-KENNEDY E L, JACOB A K, ROY S J. The role of the CBL-CIPK calcium signalling network in regulating ion transport in response to abiotic stress[J].PlantGrowthRegulation, 2015, 76(1): 3-12.
[15] YANG W Q, KONG Z S, OMO IKERODAH E,etal. Calcineurin B-like interacting protein kinase OsCIPK23 functions in pollination and drought stress responses in rice (OryzasativaL.)[J].JournalofGeneticsandGenomics, 2008, 35(9): 531-543.
[16] CHEONG Y H, PANDEY G K,etal. Two calcineurin B-like calcium sensors, interacting with protein kinase CIPK23, regulate leaf transpiration and root potassium uptake inArabidopsis[J].PlantJournal, 2007, 52(2): 223-239.
[17] XU J, LI H D, CHEN L Q,etal. A protein kinase, interacting with two calcineurin B-like proteins, regulates K+transporter AKT1 inArabidopsis[J].Cell. 2006, 125(7): 1 347-1 360.
[18] CLAUSSEN W. Proline as a measure of stress in tomato plants[J].PlantScience, 2005, 168: 241-248.
[19] YANG D L,JING R L,CHANG X P,etal. Identification of quantitative trait loci and environmental interactions for accumulation and remobilization of water-soluble carbohydrates in wheat (TriticumaestivumL.) stems[J].Genetics, 2007, 176(1): 571-584.
[20] MORI I C, MURATA Y,YANG Y,etal. CDPKs CPK6 and CPK3 function in ABA regulation of guard cell S-type anion- and Ca2+-permeable channels and stomatal closure[J].PLoSBiology, 2006, 4: 327.
[21] KIM K N, CHONG Y H, GUPTA R,etal. Interaction specificity ofArabidopsiscalcineurin B-like calcium sensors and their target kinases[J].PlantPhysiology, 2000, 124: 1 844-1 853.
[22] BATISTIC O, and KUDLA J. Integration and channeling of calcium signaling through the CBL calcium sensor/CIPK proteins kinase network[J].Planta, 2004, 219: 915-924.
[23] 王 琦,王 伟,申腾飞,等.玉米中3个CIPK同源基因在干旱和低温胁迫下的表达分析[J].华中农业大学学报, 2011, 30(5):545-551.
WANG Q, WANG W, SHEN T F,etal. Expression analysis of three CIPKs homologus gene in maize under drought and cold stresses[J].JournalofHuazhongAgricultureUniversity, 2011, 30(5):545-551.
[24] BABITA M, MAHESWARI M, RAO L M,etal. Osmotic adjustment,drought tolerance and yield in castor (RicinuscommunisL.) hybirds[J].EnvironmentalandExperimentalBotany, 2010, 69:243-249.
[25] BLOKHINA O, VIROLAINEN E,etal. Antioxidants, oxidative damage and oxygen deprivation stress: a review[J].AnnalsofBotany, 2003, 91(2): 179-194.
[26] LIANG Y C, CHEN Q,etal. Exogenous silicon increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (HordeumvulgreL.)[J].JournalofPlantPhysiology, 2003, 160(10):1 157-1 164.
[27] XI D M, LIU W S,etal. Seed specific overexpression of antioxidant genes inArabidopsisenhances oxidative stress tolerance during germination and early seedling growth[J].PlantBiotechnologyJournal, 2010, 8(7): 796-806.
[28] WU T H, LIAO M H,etal. Characterization of copper/zinc and manganese superoxide dismutase in green bamboo (Bambusaoldhamii): cloning, expression and regulation[J].PlantPhysiologyandBiochemistry, 2011, 49(2): 195-200.
[29] LECLERCQ J, MARTIN F, SANIER C,etal. Over-expression of a cytosolic isoform of theHbCuZnSODgene in Hevea brasiliensis changes its response to a water deficit[J].PlantMolecularBiology, 2012, 80(3): 255-272.
(编辑:宋亚珍)
Physiological Response of Transgenic Tobacco CarryingAtCIPK23 Genes to Drought Stress
YANG Linglong1, LI Ke1, LU Liming1,2*
(1 College of Agronomy, Sichuan Agricultural University, Chengdu 611130, China; 2 State Key Laboratory of Plant Physiology and Biochemistry, Beijing 100094, China)
In order to study the roles of ArabidopsisAtCIPK23 gene played in response to drought stress, we treated threeAtCIPK23 gene transgenic lines and wide type tobacco K326 by drought stress. The leaf water loss rate, proline, chlorophyll, soluble sugar contents and electrical conductivity were measured. Meanwhile, ROS elimination ability, and gene expression of ROS elimination and drought resistance related genes were analyzed. The results showed that: (1) the water loss speed of leaves detached from transgenic lines distinctly slower than that of K326. After 7 days of drought stress treatment in natural environment, K326 plants showed yellowish and withered. The re-watering survival rate of transgenic lines was higher than that of K326 after 7 days drought stress. (2) The concents of proline, chlorophyll and soluble sugar in transgenic lines were obvious higher than that of K326. The electrical conductivity of transgenic lines leaves was significantly lower than that of K326. (3) Under drought stress, the accumulation of H2O2in K326 was significantly higher than that of three transgenic lines, and three ROS elimination related genesNtSOD,NtCATandNtAPXwere up-regulated only in the transgenic lines. (4) The drought resistance related genesNtAREB,NtLEA5 andNtCDPK2 were induced by drought stress in transgenic tobacco plants. These results suggest that theAtCIPK23 gene can improve the drought stress ability of transgenic tobacco.
tobacco; transgenic plants;AtCIPK23 gene; Ca2+signal; drought stress
1000-4025(2016)08-1534-07
10.7606/j.issn.1000-4025.2016.08.1534
2016-05-08;修改稿收到日期:2016-07-08
植物生理学与生物化学国家重点实验室开放课题(SKLPPBKF1505)
杨玲珑(1989-),女,在读硕士研究生,主要从事烟草栽培生理研究。E-mail:23702967@qq.com
*通信作者:鲁黎明,副教授,主要从事烟草栽培生理研究。E-mail:luliming@sicau.edu.cn
Q789
A

