叶绿素含量降低对水稻叶片光抑制与光合电子传递的影响
周振翔,李志康,陈 颖,王志琴,杨建昌,顾骏飞
叶绿素含量降低对水稻叶片光抑制与光合电子传递的影响
周振翔,李志康,陈 颖,王志琴,杨建昌,顾骏飞
(扬州大学农学院/江苏省作物遗传生理国家重点实验室培育点/江苏省粮食作物现代产业技术协同创新中心,江苏扬州225009)
【目的】水稻突变体叶片叶绿素含量显著低于其野生型,但其光合电子传递效率与净光合值显著高于对照,文章旨在阐明其生理学机理并探讨其在高光效育种中的潜在应用价值。【方法】通过人工气候室的盆栽试验设置高光强(光照强度为700—800 µmol·m-2·s-1)与低光强(光照强度约为100—200 µmol·m-2·s-1)2个处理,并结合大田试验,观测突变体与野生型的叶绿素荧光、超氧阴离子含量、丙二醛含量、SOD酶活性、叶绿体超微结构、叶片荧光显微结构与冠层温度。【结果】突变体材料叶绿素含量显著低于其野生型,并且光照强度对其叶绿素含量的效应也不相同。随着光照强度的增强,突变体叶片叶绿素含量增加60%,而野生型品种叶片叶绿素含量却降低20%以上。光反应曲线表明,突变体光合值显著高于野生型,尤其在1 000 µmol·m-2·s-1光照下,低光强与高光强处理中低叶绿素含量突变体光合值分别比野生型高9.4%和46.5%。叶绿素荧光数据也表明,水稻突变体的电子传递速率(ETR)、光系统Ⅱ的量子产量(ΦPSⅡ)、光化学淬灭()、光下最大光化学效率(F′v/F′m)显著高于其野生型。在高光强处理下,野生型材料中的应激活性氧超氧阴离子与丙二醛(MDA)含量受到光抑制。叶绿体超微结构与荧光显微结构表明,野生型材料叶绿体受到一定程度的损伤,且其维管束间距离显著大于突变体,其维管束面积小于突变体,不利于水分在叶片中的传输。田间冠层热力学图像表明中午高温、高光照条件下,突变体冠层温度显著低于其野生型。综合以上结果,野生型叶片叶绿素含量高,在高光强下会导致过量光吸收,光系统Ⅱ电子传递效率下降,超氧阴离子与丙二醛累计,导致叶绿素结构与功能的破坏,因此,其光合值显著低于突变体材料。同时过量光吸收会导致叶片与冠层温度上升,不利于冠层群体光合。【结论】在未来高光效育种中选育叶绿素含量适当降低的品种,有助于避免高光强下叶片的过量光吸收,从而缓解活性氧的产生与光抑制,并有利于降低冠层温度从而缓解水稻群体光合“午休”现象。
水稻;光合速率;叶绿素;叶绿素荧光;光抑制
0 引言
【研究意义】人口增加和经济发展给中国粮食增产带来了巨大压力。预计到2030年,中国人口将达到16亿,中国农作物的单产需在现有的基础上提高50%以上才能满足粮食的安全供给[1]。水稻作为中国主要的粮食作物,其产量提高显得尤为迫切。在“绿色革命”中,随着水稻矮秆耐肥新品种的选育和氮肥的施用,水稻产量增加了近一倍[2]。然后在过去的十年间,水稻产量几乎没有提高,人们迫切希望有第二次“绿色革命”来提高水稻的产量。【前人研究进展】Long等[3-4]和von Caemmerer等[5]认为第二次“绿色革命”的希望在于提高水稻的光合作用。光合作用是植物将光能转化为化学能的过程。天线色素分子吸收的光能用于反应中心的光化学反应[6]。在现代大气条件下,植物吸收的光能远远超过了植物生理代谢的需求,过量吸收的光能需要通过热耗散等途径来消除,从而避免产生活性氧等有害物质[7]。Zhu等[8]研究表明C3作物只能利用1.9%的光能。而现代水稻品种对光合有效辐射波段(400—700 nm)的光吸收率在80%以上,从而易导致产生PSⅡ效率下降、光抑制、光氧化,甚至PSⅡ反应中心的破坏,表现早衰[9]。这些过量吸收的能量需要通过各种保护机制来消耗掉[7],同时这些保护机制也大大浪费了能量[10]。【本研究切入点】Ort等[10-11]提出如果能够降低植物叶片中叶绿素(如天线色素、反应中心色素)的含量,将有利于减少光抑制,提高光能利用效率。相关研究已在藻类与蓝藻细菌中取得了进展[12-13]。而在水稻中鲜有相关报道。【拟解决的关键问题】本文拟通过研究在不同光强水平处理下,一个叶绿素含量降低的水稻突变体叶绿素降低对水稻光合、叶绿素荧光、光胁迫的影响,旨在为缓解光抑制,改善水稻光合性能,最终提高产量提供理论依据。
1 材料与方法
1.1 试验材料与栽培概况
试验于2014年在扬州大学实验农场进行。前茬作物为小麦,土壤类型均为沙壤土,土壤含有机质22.7 g·kg-1、速效氮96.5 mg·kg-1、速效磷20.4 mg·kg-1、速效钾120.0 mg·kg-1。试验材料为低叶绿体含量突变体(YL)与其野生型(WT,浙辐802)。低叶绿体含量突变体由籼稻品种浙辐802经物理辐射诱变而成,由浙江大学程方民教授提供。该突变体已多年种植,株型形态等遗传性状已经稳定。
大田试验于5月12日播种育秧,6月7日插秧,株行距为25 cm×15 cm,每穴2苗。全生育期施纯氮240 kg N·hm-2。小区面积为15 m2,重复3次。氮肥作基肥(移栽前1 d施)、分蘖肥(移栽后7 d施)、穗肥(约移栽后40 d施)的比例分别为50%、20%和30%。移栽前各小区施用过磷酸钙(含P2O513.5%)300 kg·hm-2和氯化钾(含K2O 52%)195 kg·hm-2。按照常规高产栽培管理水分,全生育期严格控制杂草与病虫害。
盆栽试验于5月12日播种,大田育秧,6月12日移栽至盆钵,盆钵直径25 cm,高30 cm,内装过筛土18 kg(取自大田)。每盆3穴,每穴2苗。共80盆,施氮量为3.6 g尿素/盆,尿素施用比例为移栽前﹕移栽后7 d﹕穗分化期(抽穗前30—35 d)=50%﹕20%﹕30%。所有处理施0.5 g磷酸二氢钾(KH2PO4)作基肥。5叶期移入人工气候室生长15—20 d。同时设置2个光照处理,即高光强(光照强度为700—800 µmol·m-2·s-1)和低光强(光照强度为100—200 µmol·m-2·s-1)。人工气候室白天28℃(12 h),晚上23℃(12 h),相对湿度65%。5叶期黄绿突变体各处理移入20盆。取样与光合生理测量时间为七叶期。
1.2 取样与测定
1.2.1 叶绿素含量的测定 取新鲜叶片100 mg,加少量石英砂和少量碳酸钙粉末,7 mL 95%乙醇研磨呈匀浆状,倒入带塞试管中,置于60—65℃的温箱中保温浸提,叶色变白后取出过滤至棕色瓶,将滤纸洗净,在暗处贮存或稀释,以95%乙醇为空白,分别在665、649和470 nm下测定吸光度,并计算叶绿素含量[14]。
1.2.2 吸收光谱的测定 取大田新鲜无病害、无机械损伤、长势相同的叶片,去除表面灰尘,保证表面干净无水层,并用保鲜膜包好,带回实验室,用Ava Spec-2048型光纤光谱仪(波长200—1 100 nm,分辨率0.04—20 nm)测量每个时期每个品种每个处理5—10株,选择叶片中部,每片叶测3次,取平均值。
1.2.3 光合响应曲线与荧光参数测定 于五叶期将盆栽水稻移入人工气候室,人工气候室温度设定为白天28℃(12 h),晚上23℃(12 h),相对湿度65%,光照强度分别为100—200 µmol·m-2·s-1和700—800 µmol·m-2·s-1。至第七叶时,使用LI-6400便携式光合测定仪测定光响应曲线,叶室内初始光照强度设为1 500 µmol·m-2·s-1,叶片温度和叶室内空气湿度分别控制在25℃和65%。将叶片夹入叶室约10 min后调用自动程序,叶室内光强梯度设定为2 000、1 500、1 000、500、170、100、70、50、30、10 µmol·m-2·s-1和0。测定时间为3—4 min,整个程序约40 min。
叶绿素荧光参数使用MINI-PAM-II(德国WALZ公司生产)测定叶片叶绿素荧光参数。作用光1 000 µmol·m-2·s-1,饱和脉冲>4 000 µmol·m-2·s-1,闪光(0.9 µmol·m-2·s-1,间隔30 s)。参照Genty等[15-16]方法测定并计算光适应状态下电子传递速率(electron transport rate,ETR)、光化学效率(F′v/F′m)、光化学淬灭(photochemical quenching,)、光适应状态下PSⅡ的实际量子产量(the actual photochemical efficiency of PSⅡ,ΦPSⅡ)。
1.2.4 超氧阴离子红色荧光测定 使用上海哈灵生物技术公司试剂盒,按照使用说明方法并稍做修改,先加100 μL清理液(Reagent A)在载玻片上,选取新鲜叶片的同一部位,避开大叶脉,使用国产ZQP-86振动切片机切取宽为50 μm的横切面,放入清理液中,用解剖针小心压碎,移去清理液,然后再加入1 mL清理液,同时加入10 μL荧光染色剂二氢溴化乙啶(dihydroethidium,DHE),放入37℃培养箱孵育20 min,取出后,移去DHE,使用清理液清洗,即可在荧光显微镜(Axio Imager D2,ZEISS,Germany)下观察,设置激发波长540 nm,散发波长590 nm。并参考RODRÍGUEZ-SERRANO等[17]方法添加叠氮化钠(N3Na)对照处理。
1.2.5 超氧化物歧化酶(superoxyde dismutase,SOD)活性和丙二醛(malonaldehyde,MDA)含量测定 待人工气候室盆钵植株第七叶完全展开时,摘取置液氮冷冻,-70℃保存备用。采用NBT光化还原法[18]测定超氧化物歧化酶(SOD)活性,利用SOD酶抑制氮基四唑的光化还原特性,且抑制强度与酶活性在一定范围内成正比,并将抑制NBT光化还原50%的酶量定为1个酶活力单位;采用硫代巴比妥酸法[19]测定MDA含量。重复3次,取平均值。利用丙二醛与硫代巴比妥酸反应生成红棕色三甲川在532 nm具有最大光吸收的原理,测量丙二醛含量,同时试验过程中要排除可溶性糖的干扰。
1.2.6 叶片的荧光显微结构与叶绿体的超微结构观察 将用于光学显微镜观察的材料使用国产ZQP-86振动切片机切取宽为100 μm的横切面,在荧光显微镜(Axio Imager D2,ZEISS,Germany)下观察。叶绿体超微结构的观测步骤如下:用锋利刀片分别截取叶片的同一个部位,尽量避开大叶脉,材料离体后立即投入到预冷的2.5%戊二醛中进行固定2 h;用0.1 mol·L-1pH 7.2磷酸缓冲液(phosphate buffer saline,PBS)清洗3次,每次15 min;再用1% OsO4固定2 h;PBS清洗3次,每次15 min;再经梯度浓度乙醇脱水、环氧丙烷过渡、环氧树脂浸透和包埋,聚合成包埋块,用Ultra-Jung超薄切片机切成50 —70 nm的切片,醋酸双氧铀和柠檬酸铅双重染色,最后置于透射电子显微镜(Philips, CM100, 荷兰)下观察,拍照并做记录。
1.2.7 热力学照相 于植株的不同生育时期,挑选晴朗白天的早中晚3个时间段,使用FLIR ThermaCAMTMS65系列红外热像仪拍摄大田不同处理的冠层热力学图片,该摄像机的波长范围为7.5—13 mm,可侦测温度范围为-40—500℃。选取10—20株水稻剑叶中段温度,取其平均值。
1.3 数据处理
用Microsoft Excel软件整理数据,SPSS16.0软件统计分析数据,Sigmaplot 10.0绘图。
2 结果
2.1 突变体与野生型叶片叶绿素的含量及吸收光谱
由图1可知,突变体叶片叶绿素含量显著低于野生型,在低光强(100 —200 µmol·m-2s-1)处理下,突变体叶片叶绿素含量比野生型降低约73%;在高光强(700—800 µmol·m-2s-1)处理下,比野生型降低约45%。随着光照强度的增强,突变体叶片叶绿素含量增加了60%,而野生型品种却减少20%以上。表明在高光强条件下,可能由于吸收了过多强光,导致野生型品种叶绿体结构的破坏和功能的丧失。野生型品种叶片对光合有效辐射波段(400—700 nm)的光吸收率显著高于突变体(图2),进一步证明了这一结果。

LL:低光处理(100—200 µmol·m-2·s-1);HL:高光处理(700—800 µmol·m-2·s-1)。图柱上不同小写字母表示叶绿素含量在0.05水平上差异显著。下同
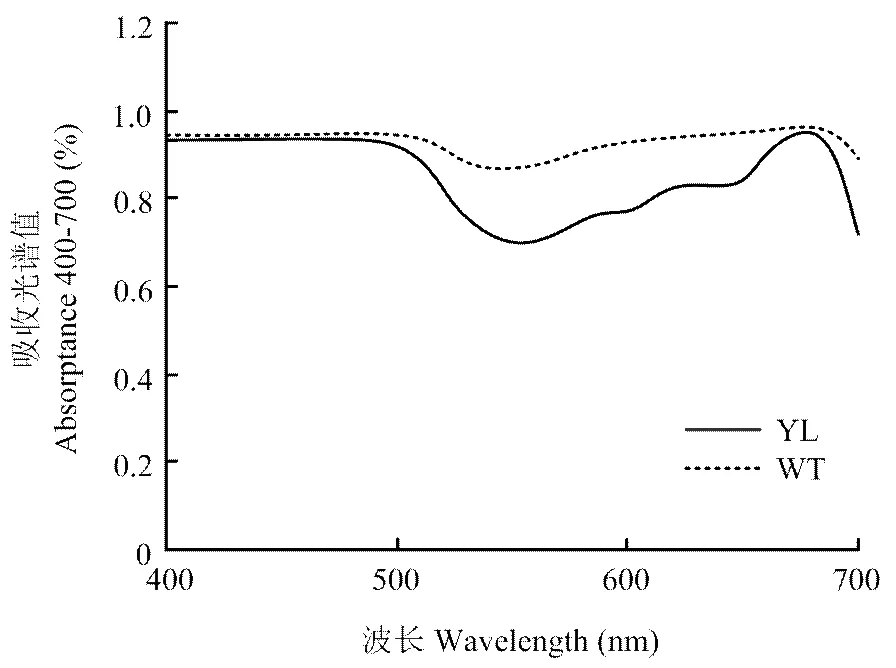
图2 突变体(YL)与野生型(WT)的吸收光谱
2.2 突变体与野生型光反应曲线
虽然突变体叶片叶绿素含量显著低于野生型,但并没有抑制其光合速率(图3)。尤其在高光强的处理下,突变体光合速率显著高于野生型,在饱和光强(1 000 µmol·m-2·s-1)条件下,经过低光强与高光强处理,低叶绿素含量突变体光合值分别比野生型高9.4%和46.5%。野生型在饱和光强(1 000 µmol·m-2·s-1)条件下,高光强处理比低光强处理的光合值降低了19.1%,然而突变体的光合值增加了8.3%(图3-A和3-B)。这说明野生型在高光强环境下发生了光抑制,低叶绿素含量突变体在高光强条件下有优势。
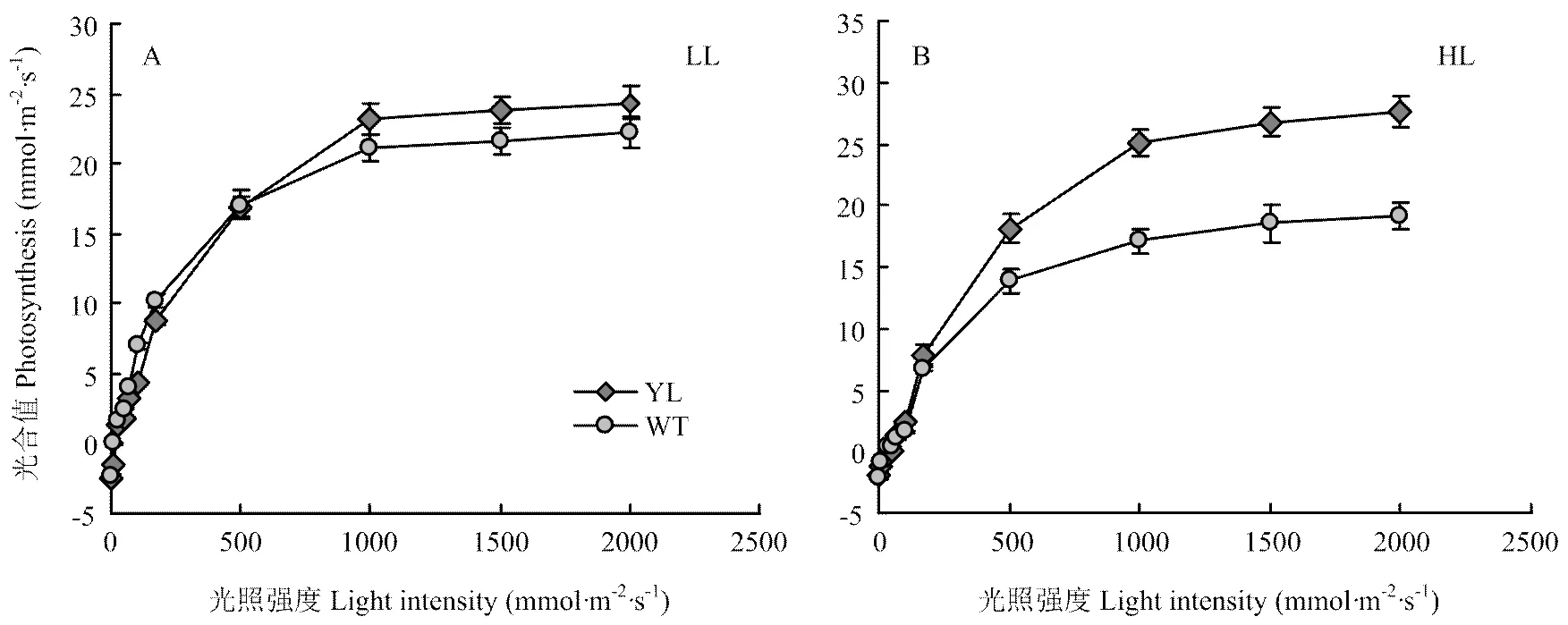
图3 突变体(YL)与野生型(WT)在不同光照条件下的光反应曲线
2.3 突变体与野生型的荧光参数
由图4可知,在光照强度为1 000 µmol·m-2·s-1时,突变体水稻的电子传递速率(ETR)、光系统Ⅱ的量子产量(ΦPSⅡ)、光化学淬灭()、光下最大光化学效率(F′v/F′m)显著高于对照。随着环境光照强度的增加,荧光参数也出现了一定程度的下降,但并不显著,野生型的下降幅度更为明显。这可能与野生型较高的光吸收有关(图2),其吸收的光能超出了叶绿体本身的负荷,使光系统发生了损伤,导致其电子传递速率与光系统Ⅱ效率显著下降。
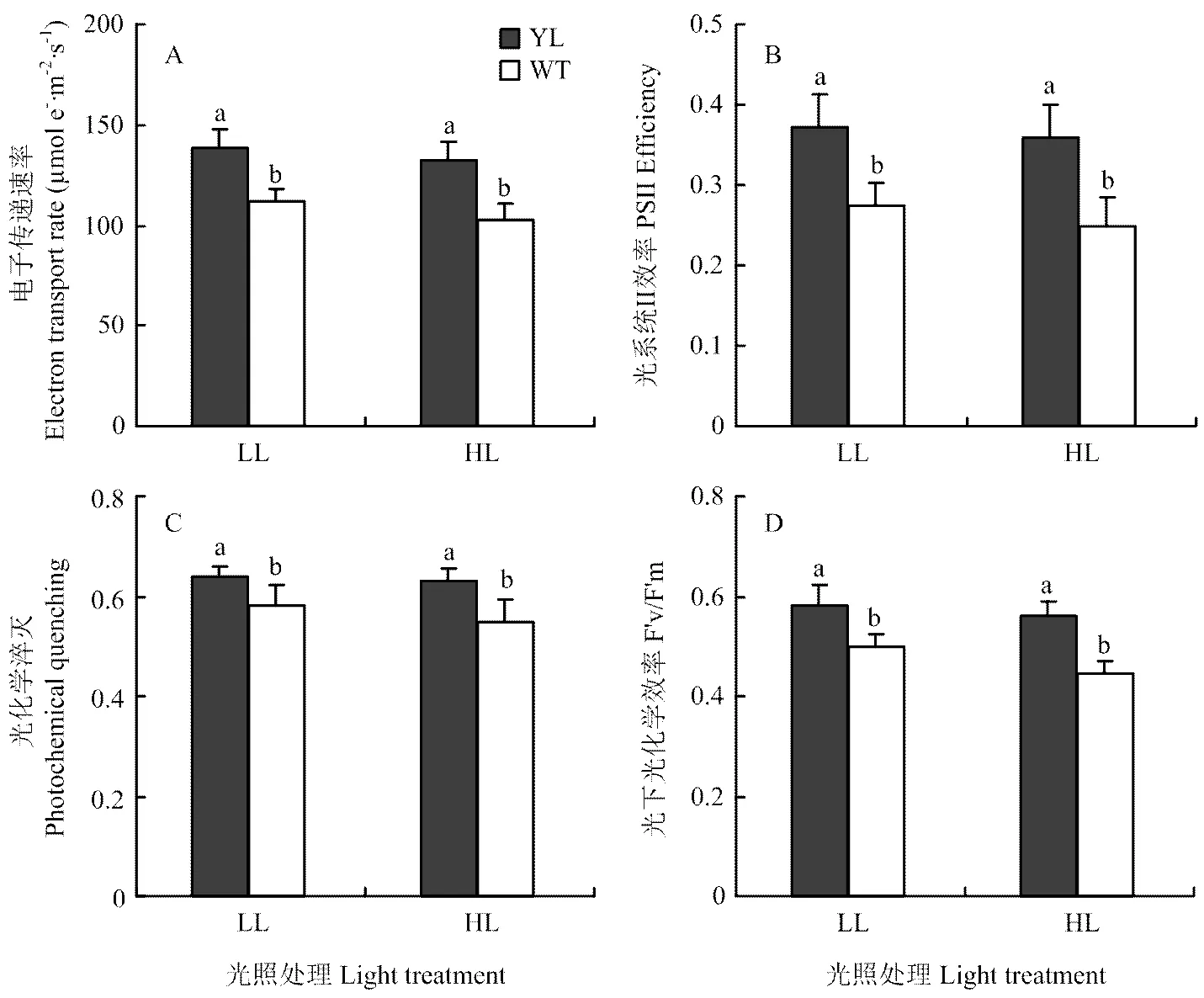
A:电子传递速率;B:光系统II效率;C:光化学淬灭;D:光下光化学效率
2.4 突变体与野生型的超氧阴离子、丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性
植物体内氧化应激活性氧超氧阴离子极不稳定,难以测定,需要二氢溴化乙啶(DHE)特异性染料产生荧光用于观察[20]。图5显示,相较于对照处理,随着光照强度的增强,突变体与野生型的红色荧光信号显著增加,证明其超氧阴离子显著增多,同时,低光强处理下,野生型的荧光信号略高于突变体,随着光照的增强,这种差异逐渐增大。在高光强环境下,野生型品种吸收了较多的光能(图2),但其实际光系统Ⅱ的效率少于30%,说明只有<30%的叶片吸收的光能被用于驱动光合电子传递,其余一部分过量吸收的能量产生超氧阴离子(图5-F),导致光抑制。超氧阴离子自由基可以使细胞的膜相系统发生脂质过氧化[21],而脂质过氧化的结果导致丙二醛(MDA)的形成。随着光照强度的增大,突变体与野生型材料叶片丙二醛含量显著增加,高光照处理下,野生型材料叶片内膜脂过氧化的程度显著高于突变体(图6-A)。同时,作为机体内天然存在的超氧自由基清除因子——SOD酶,其活性也随着光照强度的增加而显著提高,突变体叶片内SOD酶活性显著高于野生型。
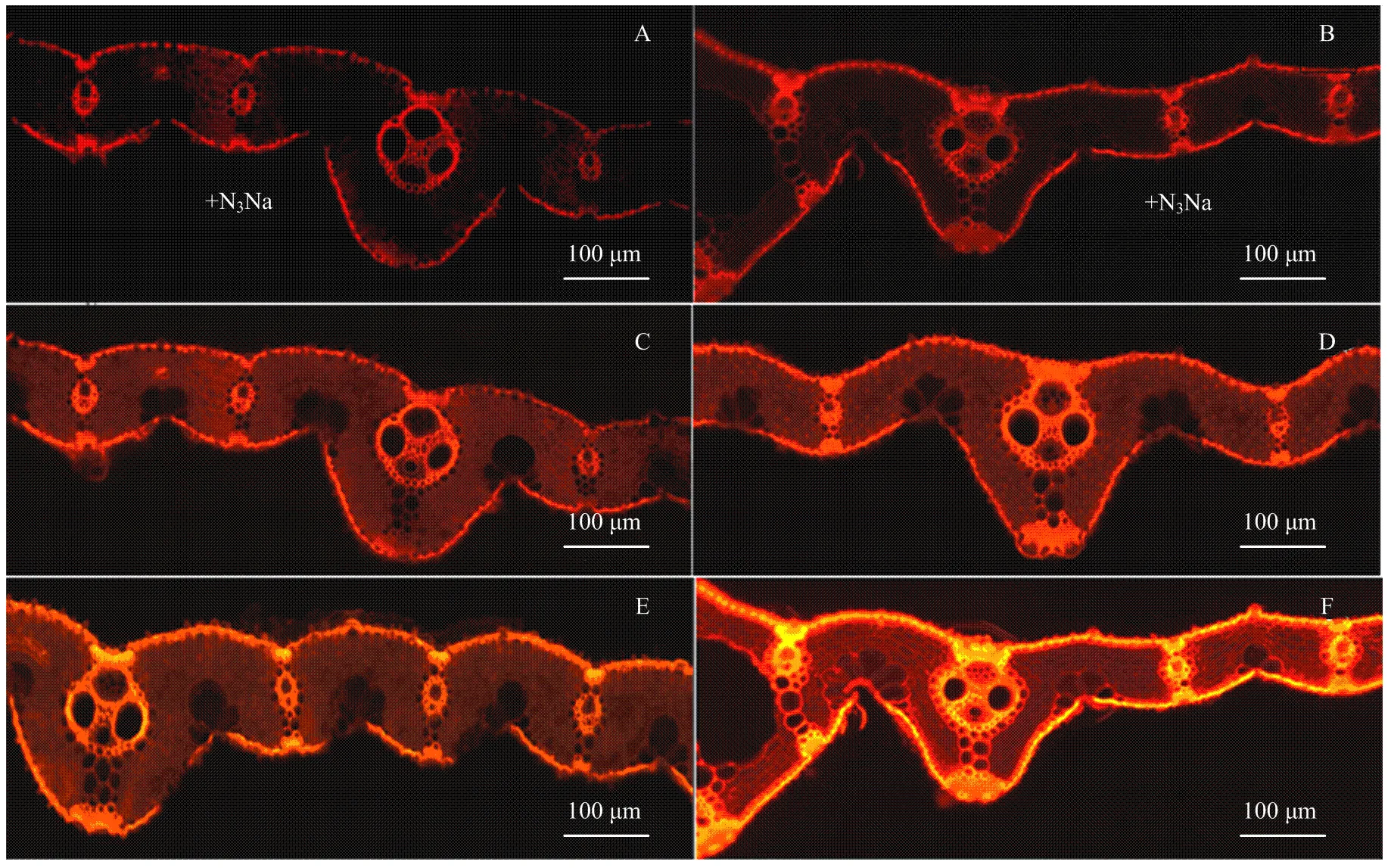
A、B:对照处理,添加N3Na(O2-清洗剂);C、D:低光强(LL, 100—200 µmol·m-2·s-1)处理;E、F:高光强(LL,700—800 µmol·m-2·s-1)处理。标尺为100 μm
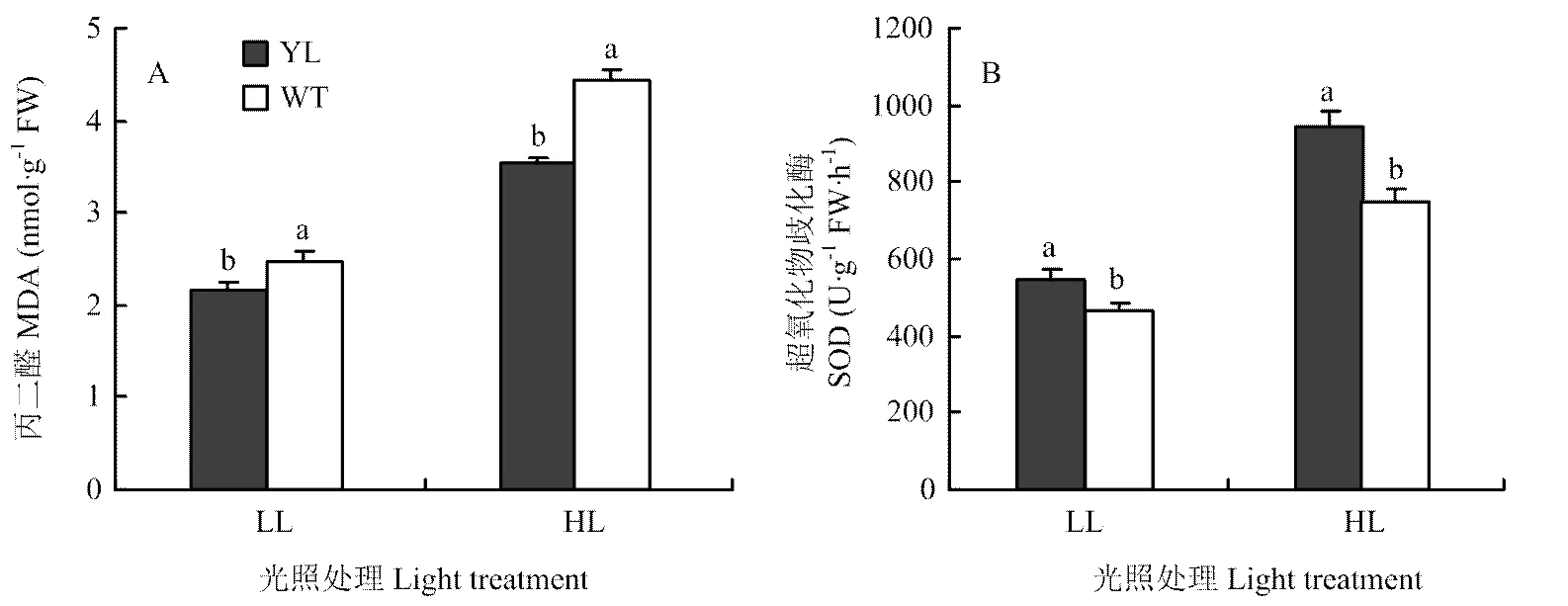
A:丙二醛;B:超氧化物歧化酶
2.5 突变体与野生型水稻的叶绿体超微结构及荧光显微结构
结合大田常规施氮水平(240 kg N·hm-2)下的突变体与野生型水稻的叶绿体超微结构,可以看出二者的叶绿体整体结构无明显差异(图7-A与图7-C),突变体的叶绿体内部垛叠紧密而清晰,基质片层连接形成连续的膜体系,而野生型的叶绿体内部片层结构模糊,嗜锇体的数目增多,这表明类囊体膜系统发生了一定程度的损伤。

A、C图中标尺为5 µm;B、D图中标尺为1 µm;Th:类囊体;OB:嗜锇体
随着光照强度的增加,突变体叶绿素含量增加,野生型叶绿素含量减少(图8),与图1结果一致。高光强条件下,野生型品种叶片维管束间距离(inter-vein distance,IVD)比突变体增加了7.1%,而低光强条件下增加了10.2%。同时,相较于低光强处理,突变体与野生型叶片在高光强处理下的维管束间距离分别提高了8.0%与5.0%。然而荧光显微结构中显示,高光强环境下的突变体叶片内大维管束面积为(11 220.6±120.3)µm²,相较于低光强环境下的大维管束面积(8 616.3±59.1)µm²,增加30.2%左右。维管束面积和维管束密度的增加,意味着木质部更加发达,使得突变体的叶片维持较高的水势,提高叶片的气孔导度,最终导致突变体具有较高的光合能力。
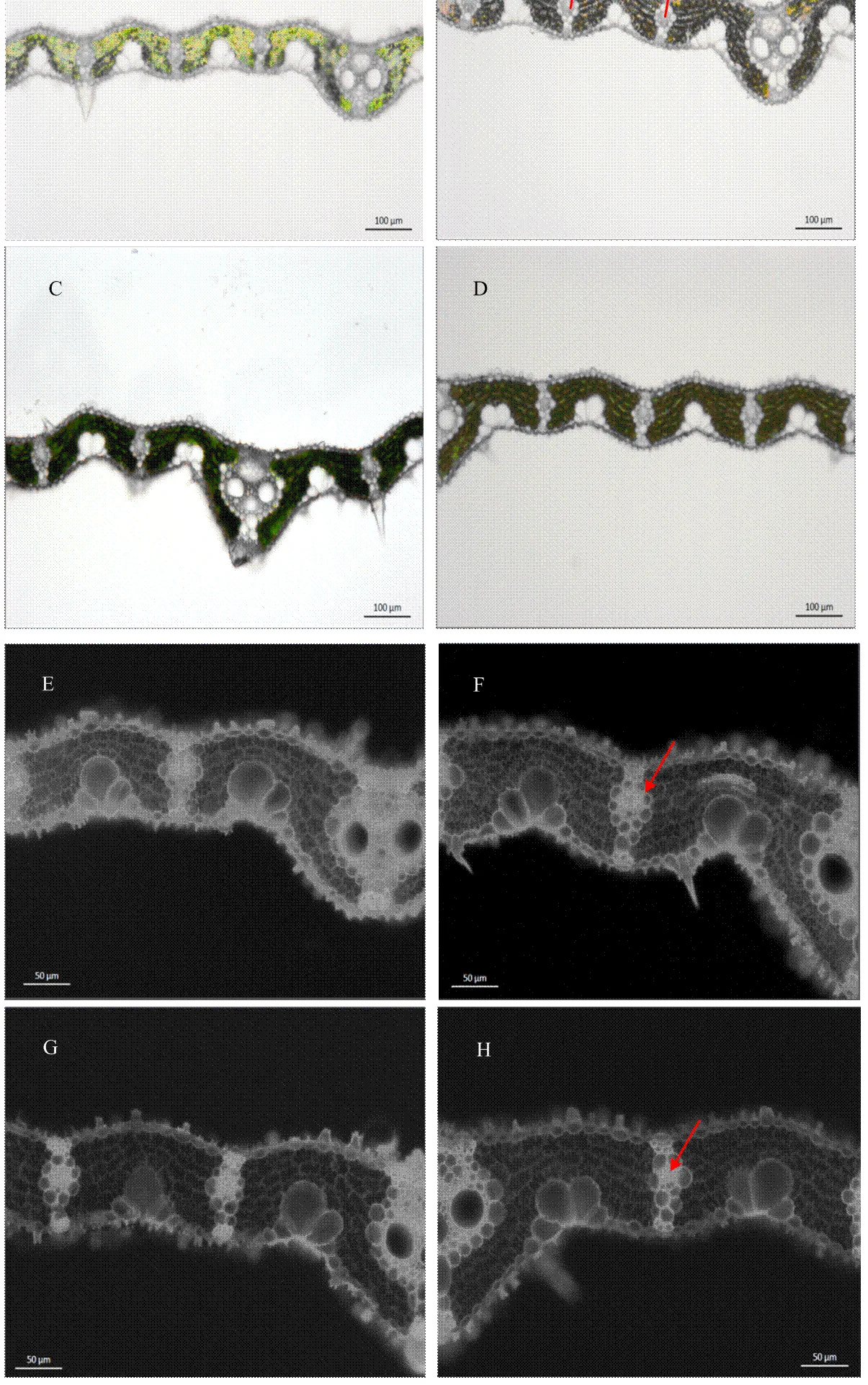
A、C、E、G:低光强(LL,100—200 µmol·m-2·s-1)处理;B、D、F、H:高光强(LL,700—800 µmol·m-2·s-1)处理。A、B、C、D图中标尺为100 µm;E、F、G、H图中标尺为50 µm。图中箭头指向为维管束;IVD:维管束间距离
2.6 突变体与野生型水稻的热力学图像
在水稻生产中,中午气温高,光照强度强,冠层温度高,不利于冠层光合,常常表现为水稻的“光合午休”现象。图9是一天之中冠层温度的变化趋势,可见中午突变体冠层温度显著低于野生型,这是因为叶绿素含量降低之后,光吸收减少,有益于冠层光合。也可能与其较高的叶片水势有关。
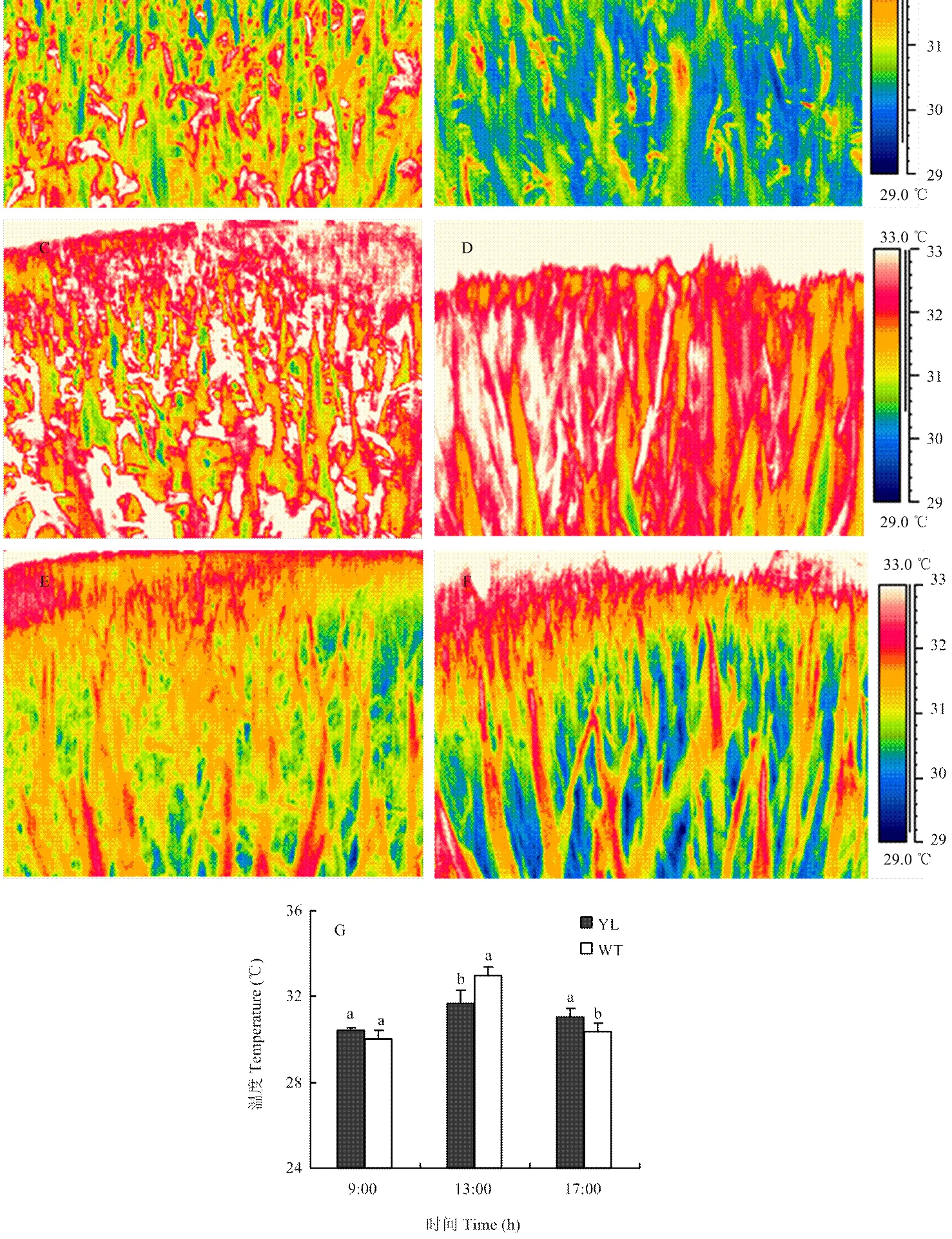
A、B:早上9点;C、D:中午1点;E、F:下午5点
3 讨论
光合作用是一系列复杂的代谢反应总和[22],因此,单单维持叶片高叶绿素含量并不是提高有效光合速率的必要条件。本研究中相较于野生型,突变体中50%左右的叶绿素吸收了80%以上的光能(图1与图2),单位叶绿素吸收的光能上升,这表明野生型水稻叶绿素含量过量[23]。Yin等[24]研究表明C3作物光能利用效率只有2.2%,这意味着植物实际用于光化学反应的能量只有一小部分,大部分甚至需要通过热耗散、荧光等保护机制来消除[25-26](图5)。
早有研究表明过量的光吸收会对植物造成潜在的伤害,这是因为强光会抑制光合作用,降低最大光合速率(图3-B),发生光抑制现象[27-28]。光抑制的机理主要表现为2个方面:(1)光合机构的破坏,(2)热耗散的增加[29-30]。较多研究[30-31]已经证明光抑制对于光合结构破坏的主要部位在PSⅡ,主要指PSⅡ反应中心复合体中核心组分D1蛋白的破坏、降解和净损失,具体表现为荧光产额与电子传递活性的大幅度下降。但事实上,PSⅠ与PSⅡ均容易受到光抑制伤害[32-34]。由于产物和反应物之间存在巨大的氧化还原电势差,以及一些激发态中间产物的生成,所以光化学反应过程中就会产生活性氧族(ROS)或氧化性较强的分子,例如梅勒反应的产物——超氧阴离子自由基(O2-)[35],对PSⅠ的抑制主要来自于在其附近产生的活性氧族。本试验中,野生型品种在高光处理下超氧阴离子的浓度显著增加,然而作为专职保护PSⅠ的活性氧清除机制——SOD酶的增量并不足以抵消由于活性氧增加而带来的损伤,这可能是造成野生型品种电子传递速率显著下降的原因之一。与本试验的结果一致,Ort等[36-37]提出通过降低植物叶片中叶绿素(如天线色素、反应中心色素)的含量,而减少光抑制,提高光合。Melis等[38-39]在绿藻中通过突变减小叶绿素含量,从而缓解光抑制,提高了3倍光合效率。
诸多研究[40-42]已表明在各种营养条件充足的前提下,饱和光下的光合速率主要受暗反应中固碳作用的影响,而不是电子传递速率。那么,在不改变Rubisco酶含量与活性的前提下,改善叶绿体内CO2浓度就是提高光合速率的最有效途径[43]。在本试验中,相较于野生型,突变体具有更为密集的维管束结构,更大的维管束面积,有利于维持较高的叶片水势,提高气孔导度(图8)。同时,突变体具有一定的冠层温度缓冲能力,可以自动调节剑叶温度维持在光合适宜的温度范围内,减少夏季正午时分由于高温而引起的光合“午休”现象,提高气孔开放时间(图8)。
4 结论
在高光强条件下,适当降低叶绿素含量,有利于缓解因过量光吸收而导致的活性氧的产生以及对光系统的破坏,缓解光抑制,提高光系统Ⅱ光电转化效率与光合电子传递效率,提高光合能力。同时降低叶绿素含量可以降低午间高光强下冠层温度,有利于冠层光合。叶绿素含量降低突变体在高光效育种中具有潜在的应用价值。
References
[1] Murchie E H, Pinto M, Horton P. Agriculture and the new challenges for photosynthesis research., 2009, 181(3): 532-552.
[2] Peng S, Khush G S, Virk P, Tang Q, Zou Y. Progress in ideotype breeding to increase rice yield potential., 2008, 108: 32-38.
[3] Long S P. We need winners in the race to increase photosynthesis in rice, whether from conventional breeding, biotechnology or both., 2014, 37(1): 19-21.
[4] Long S P, Marshall-Colon A, Zhu X G. Meeting the global food demand of the future by engineering crop photosynthesis and yield potential., 2015, 161(1): 56-66.
[5] von Caemmerer S, Quick W P, Furbank R T. The development of C4 rice: current progress and future challenges., 2012, 336(6089): 1671-1672.
[6] Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: the basics., 1991, 42(1): 313-349.
[7] Murchie E H, Niyogi K K. Manipulation of photoprotection to improve plant photosynthesis., 2011, 155: 86-92.
[8] Zhu X G, Long S P, Ort D R. Improving photosynthetic efficiency for greater yield., 2010, 61: 235-261.
[9] Demao J, Xia L, Xueqing H, WEI C, TINGYUN K, MAURICE S B K. The characteristics of CO2assimilation of photosynthesis and chlorophyll fluorescence in transgenic PEPC rice., 2001, 46(13): 1080-1084.
[10] Ort D R, Merchant S S, Alric J, Barkan A, Blankenship R E, Bock R, Croce R, Hanson M R, Hibberd J M, Long S P. Redesigning photosynthesis to sustainably meet global food and bioenergy demand., 2015, 112: 8529-8536.
[11] Ort D R, Zhu X G, Melis A. Optimizing antenna size to maximize photosynthetic efficiency., 2011, 155: 79-85.
[12] Nakajima Y, Itayama T. Analysis of photosynthetic productivity of microalgal mass cultures., 2003, 15: 497-505.
[13] Kirst H, Formighieri C, Melis A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size., 2014, 1837:1653-1664.
[14] Holden M. Chlorophyll// Goodwin T W... London: Academic Press, 1976: 1-37.
[15] Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence., 1989, 990: 87-92.
[16] Maxwell K, Johnson G N. Chlorophyll fluorescence-A practical guide., 2000, 51: 659-668.
[17] RODRÍGUEZ-SERRANO M, ROMERO-PUERTAS M C, Zabalza A N A,CORPAS F J, GÓMEZ M, DEL RÍO L A, SANDALIO L M. Cadmium effect on oxidative metabolism of pea (L.) roots. Imaging of reactive oxygen species and nitric oxide accumulation., 2006, 29(8): 1532-1544.
[18] 王爱国, 罗广华, 邵从本, 吴淑君, 郭俊彦. 大豆种子超氧物歧化酶的研究. 植物生理学报, 1983, 9(1): 77-84.
Wang A G, Luo G H, Shao C B, Wu S J, Guo J Y. A study on the superoxide dismutase of soybean seeds., 1983, 9(1): 77-84. (in Chinese)
[19] 赵世杰, 许长成, 邹琦, 孟庆伟. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 1994, 30: 207-210.
Zhao S J, Xu C C, Zou Q, Meng Q W. Improvements of method for measurement of malondialdehyde in plant tissues., 1994, 30: 207-210. (in Chinese)
[20] Zhao H, Kalivendi S, Zhang H, JOSEPH J, NITHIPATIKOM K, Vásquez-Vivar J,Kalyanaraman B. Superoxide reacts with hydroethidine but forms a fluorescent product that is distinctly different from ethidium: potential implications in intracellular fluorescence detection of superoxide., 2003, 34(11): 1359-1368.
[21] 刘占才, 牛俊英. 超氧阴离子自由基对生物体的作用机理研究. 焦作教育学院学报, 2002, 18(4): 48-51.
Liu Z C, Niu J Y. Research on the mechanism of the organism on superoxide anion., 2002, 18(4): 48-51. (in Chinese)
[22] Horton P. Prospects for crop improvement through the genetic manipulation of photosynthesis: morphological and biochemical aspects of light capture., 2000, 51: 475-485.
[23] Li Y, Ren B, Gao L, DING L, JIANG D, XU X, SHEN Q, GUO S. Less chlorophyll does not necessarily restrain light capture ability and photosynthesis in a chlorophyll-deficient rice mutant., 2013, 199(1): 49-56.
[24] Yin X, Struik P C. Constraints to the potential efficiency of converting solar radiation into phytoenergy in annual crops: from leaf biochemistry to canopy physiology and crop ecology., 2015, 62: 3489-3499.
[25] Mu H, Jiang D, Wollenweber B, DAI T, JING Q, CAO W. Long-term low radiation decreases leaf photosynthesis, photochemical efficiency and grain yield in winter wheat., 2010, 196(1): 38-47.
[26] Geacintov N E, Breton J, Knox R S. Energy transfer and fluorescence mechanisms in photosynthetic membranes., 1987, 5(1): 1-44.
[27] Kok B. On the inhibition of photosynthesis by intense light., 1956, 21(2): 234-244.
[28] Foyer C H, Noctor G. Leaves in the dark see the light., 1999, 284(5414): 599-601.
[29] Aro E M, Virgin I, Andersson B. Photoinhibition of photosystem II. Inactivation, protein damage and turnover., 1993, 1143(2): 113-134.
[30] Krause G H. Photoinhibition of photosynthesis. An evaluation of damaging and protective mechanisms., 1988, 74(3): 566-574.
[31] Barber J. Molecular basis of the vulnerability of photosystem II to damage by light., 1995, 22(2): 201-208.
[32] Takagi D, Takumi S, Hashiguchi M, SEJIMA T, MIYAKE C. Superoxide and singlet oxygen produced within the thylakoid membranes both cause photosystem I photoinhibition., 2016, Doi: 10.1104/pp.16.00246.
[33] HUANG W, YANG Y J, ZHANG J L, HU H, ZHANG S B. PSI photoinhibition is more related to electron transfer from PSII to PSI rather than PSI redox state in., 2016, 129(1): 85-92.
[34] TIWARI A, MAMEDOV F, GRIECO M, SUORSA M, JAJOO A, STYRING S, TIKKANEN M, ARO E M. Photodamage of iron- sulphur clusters in photosystem I induces non-photochemical energy dissipation., 2016, 2: 16035.
[35] Clarke J E, Johnson G N.temperature dependence of cyclic and pseudocyclic electron transport in barley., 2001, 212(5/6): 808-816.
[36] Ort D R, Merchant S S, Alric J, BARKAN A, BLANKENSHIP R E, BOCK R, CROCE R, HANSON M R, HIBBERD J M, LONG S P, MOORE T A, MORONEY J, NIYOGI K K, PARRY M A J, PERALTA-YAHYA P P, PRINCE R C, REDDING K E, SPALDING M H, VAN WIJK K J, VERMAASW F J, CAEMMERER S V, WEBWE A P M, YEATES T O, YUAN J S, ZHU X G. Redesigning photosynthesis to sustainably meet global food and bioenergy demand., 2015, 112: 8529-8536.
[37] Ort D R, Zhu X G, Melis A. Optimizing antenna size to maximize photosynthetic efficiency., 2011, 155: 79-85.
[38] Polle J E, Kanakagiri S D, Melis A. tla1, a DNA insertional transformant of the green alga Chlamydomonas reinhardtii with a truncated light-harvesting chlorophyll antenna size., 2003, 217: 49-59.
[39] Melis A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency., 2009, 177: 272-280.
[40] Sukenik A, Bennett J, Falkowski P. Light-saturated photosynthesis—limitation by electron transport or carbon fixation?, 1987, 891(3): 205-215.
[41] Long S P, ZHU X G, Naidu S L, ORT D R. Can improvement in photosynthesis increase crop yields?, 2006, 29(3): 315-330.
[42] Gu J, Yin X, Struik P C, STOMPH T J, WANG H. Using chromosome introgression lines to map quantitative trait loci for photosynthesis parameters in rice (L.) leaves under drought and well-watered field conditions., 2012, 63(1): 455-469.
[43] Griffiths H. Plant biology: designs on Rubisco., 2006, 441(7096): 940-941.
(责任编辑 李莉)
Effects of reduced chlorophyll content on photoinhibition and photosynthetic electron transport in rice leaves
Zhou Zhen-xiang, Li Zhi-kang, Chen Ying, Wang Zhi-qin, Yang Jian-chang, Gu Jun-fei
(College of Agriculture, Yangzhou University/Jiangsu Key Laboratory of Crop Genetics and Physiology/Co-Innovation Center for Modern Production Technology of Grain Crops of Jiangsu Province, Yangzhou 225009, Jiangsu)
【Objective】The chlorophyll content of a chlorophyll-deficit rice mutant (YL) is significantly lower than its wild type (WT), but its photosynthetic electron transport rate and net photosynthetic rate are significantly higher than its WT. The aim of this study is to understand the physiological basis, and its potential use in high photosynthetic efficiency breeding was prospected.【Method】A pot experiment in the climate chamber at high light intensity (HL) and low light intensities (LL), and a field experiment were conducted. Chlorophyll fluorescence, the concentration of super oxygen anion and malodialdehyde, superoxide dismutase activity, light fluorescent and electron micrographs, canopy temperature were investigated. 【Result】 The results show that the chlorophyll content was significantly lower in the mutant than its WT, and the light treatment had different effects on chlorophyll content in the mutant and its WT. When compared the HL and LL treatments, the chlorophyll content was increased by 60% in the mutant, but decreased by 20% in the WT. The light response curves showed that the mutant has a higher photosynthetic capacity than its WT. At the irradiance of 1 000 µmol·m-2·s-1, the photosynthetic rate was 46.5% and 9.4% higher in the mutant than its WT, in HL and LL treatments, respectively. The chlorophyll fluorescence measurements indicate that the photosynthetic electron transport rate (ETR), photosystem Ⅱ efficiency (ΦPSⅡ), photosynthetic quenching (), and maximum efficiency of open photosystem Ⅱ in the light (F′v/F′m) were significantly higher in mutant than its WT. The content of oxygen anion and malondialdehyde were higher in WT than the mutant, especially in HL treatment, indicating photoinhibition in WT. The electron micrographs and light fluorescent micrographs of the mutant and its WT indicated that the chloroplast was to some extent harmed. The inter-vein distance was also found larger in WT than in the mutant, and the area of vascular bundle is smaller in WT than in the mutant, indicating a better water status in mutant than in its WT. The thermal image indicated that the canopy temperature was significantly lower in mutant than in its WT at noon with high irradiance. All the results suggested that the high chlorophyll content in the WT excessively absorbed light energy, causing photoinhibition (high oxygen anion and malondialdehyde content, reduced photosystem Ⅱefficiency and decreased SOD activity), and had a lower photosynthetic rate than the mutant. The excessively absorbed light energy also contributed the higher canopy temperature in WT than in mutant, which is adverse for canopy photosynthesis.【Conclusion】All these results implicate that selecting for moderate chlorophyll content in breeding would help avoiding the generation of reactive oxygen species and alleviating the photoinhibition, improving photosynthesis, especially at noon under high solar radiation.
rice; photosynthetic rate; chlorophyll; chlorophyll fluorescence; photoinhibition
2016-03-18;接受日期:2016-06-27
国家“973”计划(2015CB150400)、国家自然科学基金(31501254,31371562)、江苏省自然科学基金(BK20140480)、中国博士后基金(2014M550312,2015T80590)、江苏省高校优势学科建设项目
周振翔,E-mail:zhouzhenxiang91@163.com。通信作者顾骏飞,Tel:0514-87979317;E-mail:gujf@yzu.edu.cn

