温度降低对厌氧氨氧化脱氮效能及污泥胞外聚合物的影响
宋成康,王亚宜,韩海成,陈 杰,王晓东,常青龙
温度降低对厌氧氨氧化脱氮效能及污泥胞外聚合物的影响
宋成康,王亚宜*,韩海成,陈 杰,王晓东,常青龙
(同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092)
本研究系统考察了阶梯降温并恢复至室温(33→25→20→15→10→22℃)长期变化过程厌氧氨氧化反应器的动态脱氮效能和厌氧氨氧化活性变化,分析了厌氧氨氧化污泥胞外聚合物(EPS)的变化特性,计算获得了厌氧氨氧化反应的活化能.结果表明,在温度20~33℃下,序批式厌氧氨氧化反应器可稳定高效运行,总氮去除负荷维持在0.4gN/(L·d)左右,最大比厌氧氨氧化活性(SAA)大于0.32gN/(gVSS·d).10℃是厌氧氨氧化菌代谢活性的转折点:当温度降至10℃时,SAA为0.044gN/(gVSS·d),较33℃时下降91%.当温度恢复至22℃,厌氧氨氧化活性恢复至0.24gN/(gVSS·d).厌氧氨氧化反应的活化能a在10~33℃和10~20℃范围内分别为68.4,152.9kJ/mol.在本实验温度(33→15℃)范围内,EPS含量随着温度降低而升高;在10℃时,EPS含量显著下降,出水中悬浮物升高,造成部分厌氧氨氧化污泥流失.
厌氧氨氧化;温度;活化能;SAA;胞外聚合物
厌氧氨氧化反应以氨氮作为电子供体,以亚硝酸盐作为电子受体,应用于污水的脱氮处理,具备了无需外加碳源、节省动力消耗和污泥产量少等优点[1-2].
如何维持低温和低氨氮条件下厌氧氨氧化的活性及厌氧氨氧化污泥的高度持留是厌氧氨氧化技术应用于主流线污水生物脱氮亟待解决的瓶颈问题.厌氧氨氧化反应的功能菌为厌氧氨氧化菌(AnAOB)(中温菌),其最适生长温度范围为30~40℃[3-6],因此大部分厌氧氨氧化反应器温度均维持在30℃以上[3-5],以减缓低温厌氧氨氧化菌低生长速率使得厌氧氨氧化运行效能低的问题[7].研究表明,温度每降低5℃,AnAOB的生长速率下降30~40%[4-5].同时,温度降低也将导致最大比厌氧氨氧化活性(SAA)降低,从而影响厌氧氨氧化反应器的脱氮效能.Hendrickx等[8]在10℃下培养厌氧氨氧化污泥(主要厌氧氨氧化菌为Brocadia fulgida),其比厌氧氨氧化活性为0.030~0.044gN/(gVSS·d).而Lotti等[7]在10~20℃研究厌氧氨氧化颗粒污泥流化床反应器处理效果,在10℃时容积氮去除负荷高达0.34gN/(L·d),比厌氧氨氧化活性为0.06gN/(gVSS·d).随着厌氧氨氧化技术拟在城市污水主流工艺应用中的推进,厌氧氨氧化在中温和低温条件下的反应活性以及污泥形态特性变化亟需了解和掌握.
本文主要研究了温度阶梯下降过程,厌氧氨氧化反应器(短程-厌氧氨氧化二段式的后段)的动态脱氮效果、活性变化和污泥胞外聚合物(EPS)特性变化,目的是获得可接受厌氧氨氧化活性条件下的最低温度,研究结果可以为厌氧氨氧化技术在城市污水主流线等常温(或者低温)开放环境下的应用提供理论基础和技术支撑.
1 实验材料与方法
1.1 实验装置
厌氧氨氧化反应在序批式反应器(SBR)(图1)中进行.该反应器总容积为2.5L,有效容积为2L,利用恒温循环水浴锅控制反应器反应区的温度.反应器一天运行3个周期,每个周期运行480min,包括进水5min,反应395min,沉淀55min,闲置20min,各反应过程采用自动控制系统实现.
1.2 实验用水
实验用水为人工配制的含氨氮和亚硝酸盐氮模拟废水,进水温度通过恒温循环水浴锅控制.模拟废水主要包括(g/L):NH4Cl(按需配制64± 46~147±28mg NH4+-N/L,表1), NaNO2(按需配制80±53~196±18mg NO2--N/L,表1),NaHCO3,1.05; KH2PO4,0.02; CaCl2, 0.014;MgSO4·7H2O,0.08; FeSO4·7H2O,0.015;Na2EDTA,0.02和微量元素浓缩液1mL/L.
微量元素浓缩液包括(g/L): H3BO3,0.018; CoCl2·2H2O,0.262;CuSO4·5H2O,0.312;ZnSO4·7H2O, 0.538,MnCl2·4H2O,1.238;NiCl2·6H2O,0.238;NaMoO4·
2H2O,0.275;EDTA,7.5.
1.3 接种污泥
反应器污泥接种于本课题组已驯化成熟的厌氧氨氧化污泥.该厌氧氨氧化污泥稳定运行时SAA约为(0.31±0.01)gN/(gVSS·d),混合液挥发性悬浮固体浓度(MLVSS)约为5g/L.荧光原位杂交(FISH)检测结果显示该厌氧氨氧化污泥中厌氧氨氧化菌为Kuenenia stuttgartiensis (所用探针为EUB338mix and KST-1275).接种1L该污泥到2L厌氧氨氧化反应器中,该厌氧氨氧化反应器以絮体和颗粒为主,通过进行16S rDNA测序,发现33℃稳态条件下(118d)厌氧氨氧化功能菌为:Kuenenia(2.2%)、Brocadia(1.4%)和Jettenia(1.3%).
1.4 实验测定项目及方法
NH4+-N,纳氏试剂比色法;NO2--N,N-(1奈基)-乙二胺分光光度法;NO3--N,紫外分光光度法[9];pH,WTW pH3310SenTix41复合电极直接测定;ORP,WTW pH3310SenTixORP复合电极直接测定.温度采用不锈钢温度计(精确度0.1℃).
胞外聚合物(EPS):分光光度法.取7mL混合均匀的污泥,采用改进的热提取法提取EPS[11], EPS中多糖(PS)测定采用蒽酮法[12],以葡萄糖作为标准物质;蛋白质(PN)及腐殖质(HS)测定采用修正的Folin-Lowry法,以牛血清蛋白作为标准物质.
16S rDNA测序:对提取到的基因组DNA进行琼脂糖电泳检测,查看基因组DNA的完整性与浓度.利用Qubit2.0DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应应该加入的DNA量.PCR所用的引物已经融合了Miseq测序平台的通用引物.所选择的细菌 16S rDNA测序引物是338F (ACTCCTACGGGAGGCAGC- AG)和806R (GGACTACHVGGGTWTCTAAT).
PCR结束后,对PCR产物进行琼脂糖电泳,采用OMEGA Gel Extraction kit(cat:D2500-01)对DNA进行回收.回收产物用Qubit2.0定量,根据测得的DNA浓度,将所有样品按照1:1的比例进行混合;混合后充分震荡均匀.该混合样品可用于后续的样品建库(加测序标签)与测序.
SAA:取典型单周期实验数据进行SAA计算,具体计算公式如下:
式中:∆为基质(NH4+-N +NO2--N)的降解量, mgN/L;∆为反应时间,min;∆/∆为基质降解对时间线性拟合的最大斜率;VSS为反应器污泥的浓度,gVSS/L.SAA单位为mgN/ (gVSS·min),将其单位换算为gN/(gVSS·d),换算系数为1.44.
1.5 试验方案
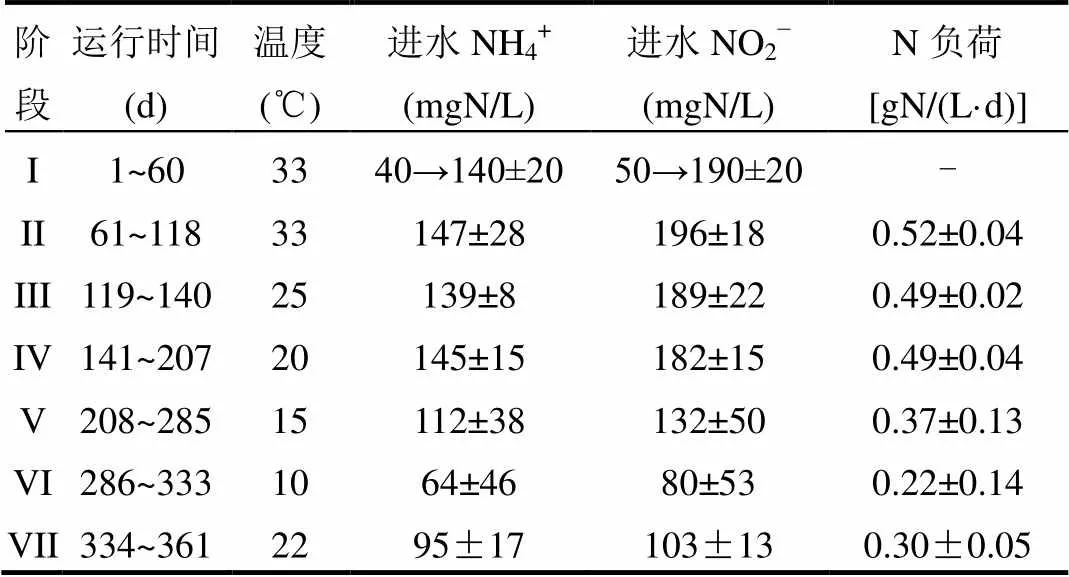
表1 进水特征及各阶段运行参数 Table 1 Operational phases and corresponding influent characteristics and parameters
注:进水NH4+和NO2-比率按照厌氧氨氧化反应理论比1:1.32配置.
如表1所示,根据实验过程中负荷及温度的变化,将试验过程分为VII个阶段.其中阶段I为污泥驯化阶段,总氮负荷随着反应器处理能力的提高而升高;阶段II为污泥稳定运行阶段;从阶段II到阶段VI采用阶梯降温的方式运行,通过恒温水浴锅控制反应器温度.
2 结果与分析
2.1 厌氧氨氧化反应器在不同温度下的长期脱氮效能
厌氧氨氧化反应器在不同的温度下运行361d,其在7个阶段的运行参数见表1.各阶段氮素动态变化情况如图3所示.阶段I为初期驯化阶段,氨氮由40mg/L逐步升高为140mgN/L左右,亚硝氮由50mgN/L增加为190mgN/L左右.阶段II,该反应器已达到稳定的脱氮效果,氨氮去除率稳定在90%以上,亚硝氮去除率接近100%,消耗的NO2--N/NH4+-N约为1.45±0.10,略高于文献报道的理论值1.32[4,13],这可能是因为该反应器中存在硝化细菌(NOB)发生了硝化反应所致.
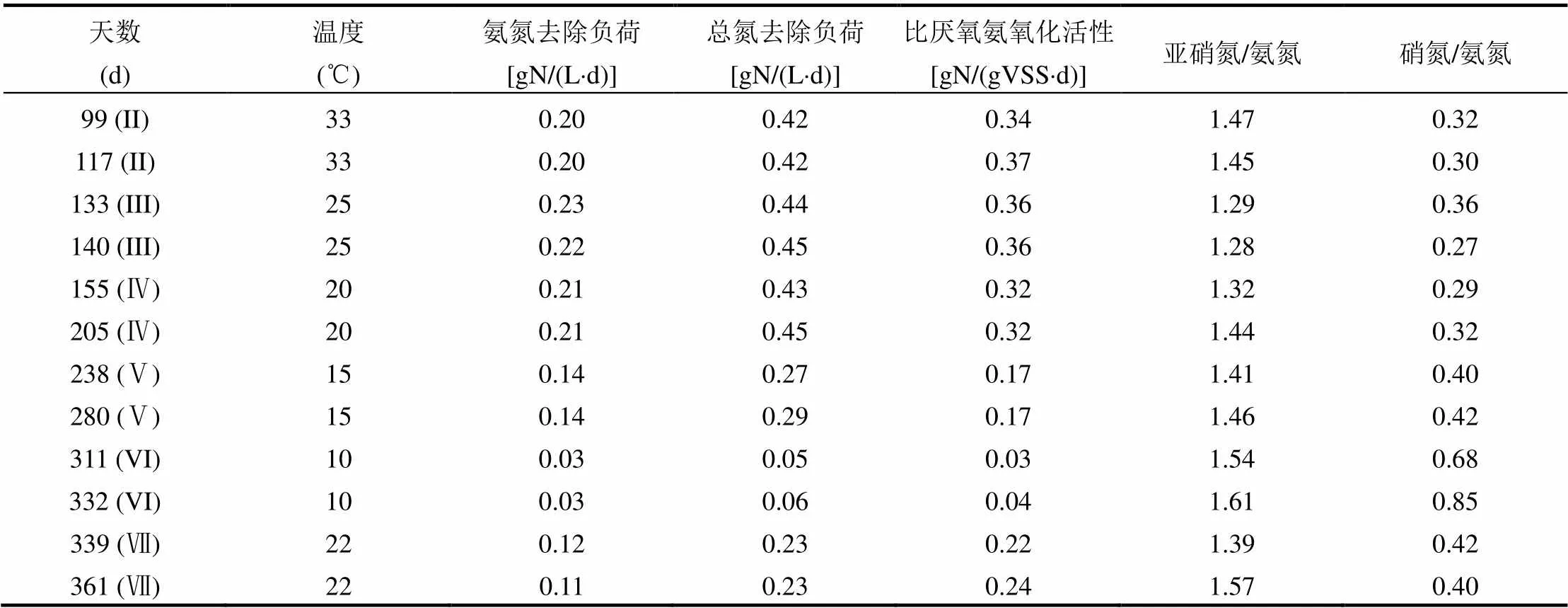
表2 不同温度水平厌氧氨氧化SBR工艺脱氮效果 Table 2 The nitrogen removal performance of the anammox-SBR process under different temperature levels
注:均根据各温度水平下厌氧氨氧化反应稳态状态下典型周期计算所得.
阶段III(119~140d),将厌氧氨氧化反应器温度降低为25℃.此时,其中进水氨氮及亚硝氮分别约为139mg/L和189mg/L,出水氨氮及亚硝氮未检出,说明该温度条件下厌氧氨氧化反应器脱氮效能良好.阶段IV(141~207d),厌氧氨氧化反应器在20℃下运行,出水氨氮约为6.13mg/L,出水亚硝氮未检出.表2列出了根据SBR典型周期计算获得的厌氧氨氧化最大反应速率,表中数据显示厌氧氨氧化反应速率在20℃和25℃下与33℃下基本相似,这说明该厌氧氨氧化反应器可以在20~33℃下稳态高效运行.Hendrickx等[14]利用气提池,研究温度对厌氧氨氧化反应的影响,发现该反应系统在20℃时可以得到0.31gN/(L·d)的总氮去除负荷.厌氧氨氧化菌在20℃条件下获得了较高的反应活性,为该技术常温(适温)处理含氮废水提供了可能.
阶段V(208~285d)将厌氧氨氧化反应器温度降为15℃.如图2所示,在第211d时,出水氨氮及亚硝氮分别高达61.44mg/L和63.63mg/L,反应器处理效果明显下降,亚硝酸盐积累最高达107.49mg/L,高浓度的亚硝酸严重抑制下一周期厌氧氨氧化反应的进行[4].为避免高亚硝酸盐积累导致的抑制作用,在第214d降低了进水氮负荷,即将进水氨氮及亚硝氮分别调低至90mg/L和92mg/L,观察到出水氨氮及亚硝氮浓度明显降低.随后,保持进水氨氮及亚硝氮分别为112mg/L和132mg/L,总氮去除负荷可维持在(0.24±0.02)gN/ (L·d).
继续降低厌氧氨氧化SBR反应器反应温度至10℃(运行阶段VI(286~333d)),此时总氮去除负荷较15℃下降一个数量级,为(0.04±0.02)gN/ (L·d),这与文献报道的10℃下的总氮去除负荷接近[8,14].厌氧氨氧化反应器的总氮去除率降低为20%左右,反应器处于崩溃状态.为了避免高亚硝酸盐积累对厌氧氨氧化菌的抑制,降低进水氮负荷为0.22±0.14gN/(L·d)并且驯化一个月,厌氧氨氧化活性SAA维持在0.035gN/(gVSS·d),未观察到有升高趋势.Hendrickx等[9]在10℃下长期培养下的厌氧氨氧化菌SAA为0.044gN/(gVSS·d);而Lotti等[8]的研究结果表明,在10℃下厌氧氨氧化菌的SAA为0.08gN/(gVSS·d),虽然与本实验结果处于同一数量级,但已2倍于本实验获得SAA值.通过化学计量学系数比较发现,本实验条件获得NO2-/NH4+及NO3-/NH4+在10℃时比值明显偏高,推测此时反应器厌氧氨氧化菌活性非常低,且存在NOB发生硝化反应(可能由于进水带入部分氧气),Hellinga等[16]的确发现在温度低于15℃时,NOB的生长速率较高,有利于它们与厌氧氨氧化菌竞争底物亚硝酸盐,导致NO2-/NH4+及NO3-/NH4+值高于厌氧氨氧化反应的理论值.
阶段Ⅶ(334~361d),将厌氧氨氧化反应器恢复至室温22℃下运行. 如图2(a)及表2所示,运行3d后,总氮去除负荷逐步恢复为0.22gN/(L·d)左右,总氮去除率达到79%左右,厌氧氨氧化活性恢复至0.24gN/(gVSS×d),厌氧氨氧化反应脱氮效能在室温条件下稳定提升.
2.2 温度突变对厌氧氨氧化活性的影响
为考察温度变化对厌氧氨氧化菌活性的动态影响,特别考察了稳定运行(稳态条件下的SBR典型周期)及温度突变(SBR在温度降低后的第一个典型周期)情况下的SAA动态变化,结果如图3所示.
厌氧氨氧化反应器在温度降为25℃之前一直在最佳温度33℃条件下运行,33℃条件下的稳态脱氮率为(0.41±0.04)gN/(L·d).由图3可知,温度突然降低时,SAA随之降低:当温度由33℃突然降低为25℃时,SAA由0.37gN/(gVSS·d)下降为0.22gN/(gVSS·d),降幅为40%;当温度由25℃突然降低为20℃时,SAA由稳态运行的0.36gN/ (gVSS·d)降为0.28gN/(gVSS·d),降幅约为22%,这可能是因为经过25℃驯化,该厌氧氨氧化污泥对于温度变化产生一定适应能力.在20℃下,厌氧氨氧化SBR反应器运行66d达到稳定的脱氮效果;而将温度由20℃突变为15℃后,SAA由0.32gN/(gVSS·d)降为0.17gN/(gVSS·d),下降了近47%.最后,当温度由15℃突变为10℃时,SAA由0.17gN/(gVSS·d)降为0.07gN/(gVSS·d),降幅高达59%.可见,温度突降均将使得厌氧氨氧化活性显著下降,尤其是在温度较低时,厌氧氨氧化活性下降幅度较大.
2.3 厌氧氨氧化活化能Ea计算
活化能表示底物分子从常态转变为容易发生化学反应的活跃状态所需要的能量,活化能越小表明该反应越易进行,因此活化能可以反映生化反应发生的难易程度.在废水生物处理中,生化反应的活化能取值范围通常为8.37~83.68kJ/ mol[1].
通常,反应速率常数与温度的关系可以用Arrhenius方程表示:
式中:a为反应所需活化能,J/mol;为气体常数,8.314J/(K·mol);为热力学温度,K;为反应速率常数.
Arrhenius方程转换方程为:
式中:为Arrhenius常数.
将各温度水平下的SAA(图4(a)和表2)代入公式2中的,利用阿伦尼乌斯(Arrhenius)方程线型拟合(图4(b))可以计算获得活化能a.本实验中,温度10~33℃下的厌氧氨氧化反应活化能Ea=68.4kJ/mol.该值与Dosta 等[5]报道的Kuenenia Stuttgartiensis在10~40℃下的a=63kJ/mol相近(表3).同时,Dalsgaard 和Thamdrup报道的海洋沉积物中厌氧氨氧化菌的活化能为61kJ/mol(6.5~37℃)[17],也与本实验获得的a值相近(表3).
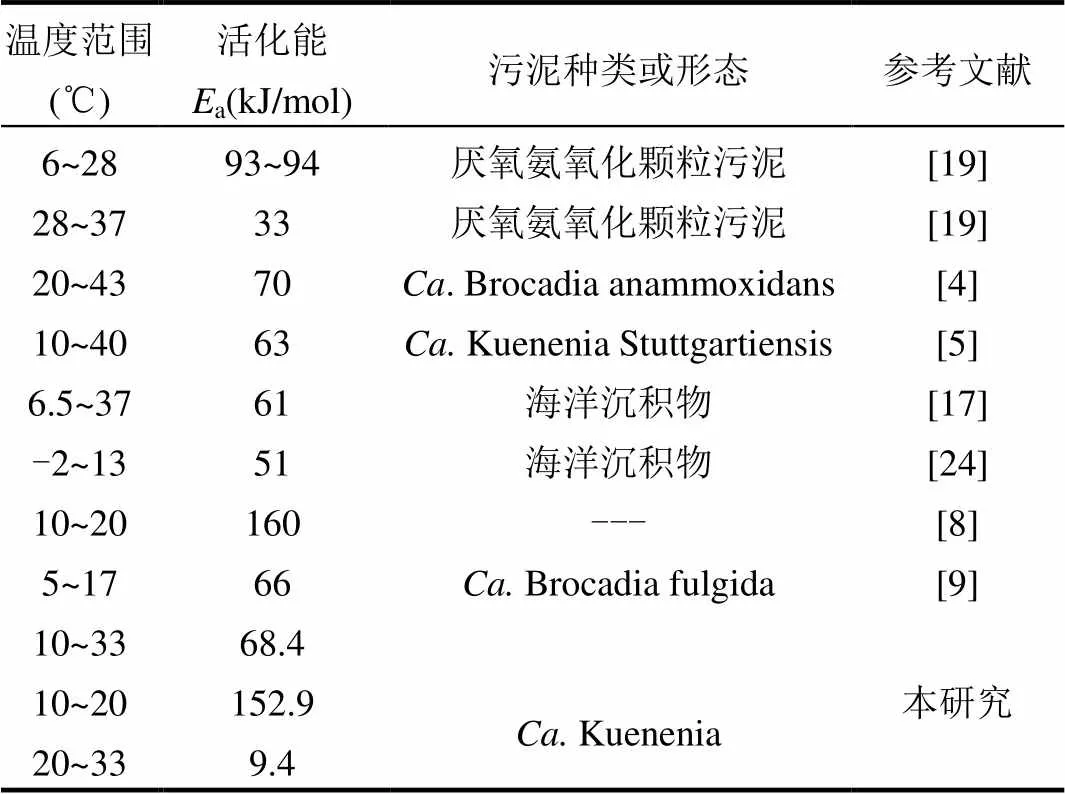
表3 厌氧氨氧化活化能对比 Table 3 Anaerobic ammonia oxidation activation energy
本实验条件下获得的厌氧氨氧化活化能Ea在温度10~20℃和20~33℃时分别为152.9kJ/ mol和9.4kJ/mol.可见,温度较高(20~33℃)时的活化能明显小于温度较低(10~20℃)时的值,说明温度较高时(20~33℃)更有利于厌氧氨氧化反应的进行,这与Lotti等[18]的研究结果一致.等[8]研究发现,在10~20℃下的活化能为160kJ/ mol(表3),与本研究非常接近.Isaka等[19]利用厌氧氨氧化颗粒污泥获得温度6~28℃和28~37℃厌氧氨氧化活化能分别为93~94, 33kJ/mol,高于本实验的研究结果,这可能是因为本实验污泥为驯化比较成熟的厌氧氨氧化颗粒与絮体混合污泥,而颗粒污泥对于温度变化有更强的应对能力.
2.4 不同温度条件下厌氧氨氧化污泥EPS的变化
EPS是微生物在其生长过程中分泌的粘性物质.从微生物角度讲,EPS有利于细胞膜的稳定,对保持生物膜微观结构和功能的完整性起着关键作用,而且还可以作为微生物的保护屏障[20],利于微生物适应不同环境下的生存.EPS的主要成分为多糖、蛋白质及腐殖质,还有少量的核酸、脂质等[21].EPS的稳定性对于厌氧氨氧化污泥尤其重要,因厌氧氨氧化菌生长周期较长,因而确保厌氧氨氧化污泥絮体和颗粒的完整性,继而维持厌氧氨氧化污泥良好的沉降性及其在反应器中的高度持留,对保持厌氧氨氧化脱氮的高效和稳定非常关键.
图5显示了不同温度水平EPS含量和组分的变化规律.随着温度由33℃变为15℃,EPS含量呈现上升趋势,反应温度的降低对厌氧氨氧化菌产生了应激反应,因此产生了较高的EPS,EPS含量的增加有助于微生物聚集体的形成,维持污泥絮体及颗粒的稳定性.但当温度为10℃时,EPS含量很低,这主要是因为低温(10℃)严重抑制了微生物的代谢活性,进而减少了其EPS的分泌量.本研究SBR体系,当低温EPS减少后,出现了颗粒解体的情况,可以明显观察到出水更加浑浊,带有较多污泥絮体;而Lotti等[8]在温度低至10℃,厌氧氨氧化颗粒仍然维持高密度和形态,并未因低温而解体,还发现有新的厌氧氨氧化颗粒的形成,他们分析可能是其研究的UASB体系,水利剪切力比较小的缘故.
由图5可以看出,无论厌氧氨氧化污泥的EPS如何变化,其蛋白质含量都比相应的多糖含量高,在不同温度下,蛋白含量占总EPS含量为52%~58%,而多糖含量仅占5%~14%,这可能与水体中较低的C/N比有关[22].图5数据显示,,从33℃时的8%,提高到10℃时的14%.
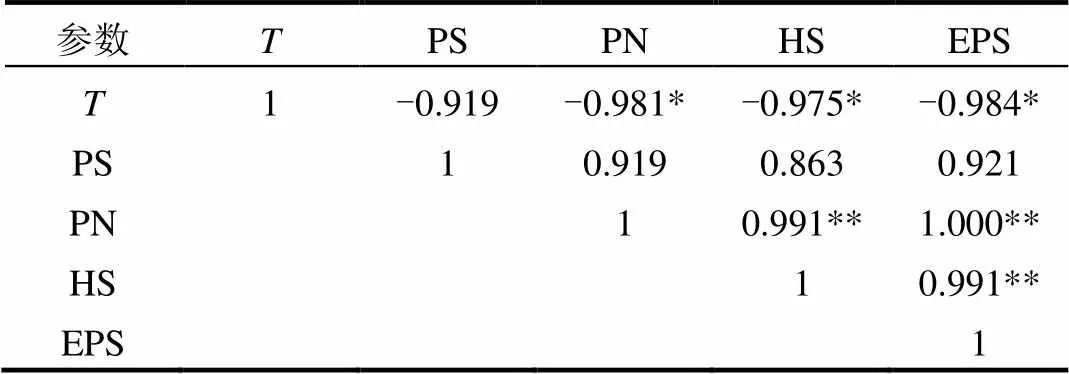
表4 温度与EPS组分之间的皮尔逊相关系数 Table 4 Pearson correlation coefficient between the temperaturea and components of EPS
注:温度范围在15~33℃;*: 在0.05水平(双侧)上显著相关; **:在0.1水平(双侧)上显著相关.
表4列出了温度与EPS组分之间的皮尔逊相关情况,EPS含量与温度呈现负相关,且各组分含量均呈负相关.EPS和蛋白质的变化呈现正相关性(=1.000,<0.01),这意味着,当微生物受到外界环境的胁迫(如温度变化)时,微生物主要通过分泌蛋白质来应对其胁迫.而且Wilen 等[23]在研究实际污水厂污泥絮体组成及絮凝性、沉降性的关系时发现,夏季的 EPS含量低于冬季, EPS的含量与温度存在负相关,且多糖、蛋白质、腐植酸均呈负相关.
3 结论
3.1 厌氧氨氧化反应器在20~33℃长期运行时,可达到稳定的厌氧氨氧化脱氮效果,其中总氮去除负荷稳定在0.4gN/(L·d)左右.说明即使在常温条件下,也可获得较好的厌氧氨氧化效果.但当温度为15℃时,厌氧氨氧化反应器出现亚硝酸盐积累,可以通过降低进水负荷保持厌氧氨氧化反应器的稳定运行.10℃是中温驯化厌氧氨氧化菌代谢的转折点.
3.2 在10~33℃范围内,本研究厌氧氨氧化活化能Ea为68.4kJ/mol;在10~20℃范围内,厌氧氨氧化活化能Ea为152.9kJ/mol.
3.3 本实验温度范围内(33→15℃),厌氧氨氧化污泥的EPS总含量与温度呈现负相关,且各组分均呈负相关.
3.4 温度突然降低会使得厌氧氨氧化活性明显降低,且温度越低时,突然降低温度对厌氧氨氧化反应影响更大.
郑 平,徐向阳,胡宝兰. 新型生物脱氮技术 [M]. 北京:科学出版社, 2004.
李 冬,邱文新,张 男,等.常温ANAMMOX工艺运行性能及功能菌研究 [J]. 中国环境科学, 2013,33(1):56-62.
Van Hulle S W H, Vandeweyer H J P, Meesschaert B D, et al. Engineering aspects and practical application of autotrophic nitrogen removal from nitrogen rich streams [J]. Chemical Engineering Journal, 2010,162(1):1–20.
Strous M, Kuenen J G, Jetten M S M. Key physiology of anaerobic ammonia oxidation [J]. Applied Environmental Microbiology, 1999,65(7):3248–3250.
Dosta J, Fernández I, Vázquez-Padín J R, et al. Short- and long-term effects of temperature on the Anammox process [J]. Journal of Hazardous Materials, 2008,154(1–3):688–693.
姚俊芹,刘志辉,周少奇.温度变化对厌氧氨氧化反应的影响 [J]. 环境工程学报, 2013,10:3993-3996.
Van der Star W R L, Abma W R, Blommers D, et al. Startup of reactors for anoxic ammonium oxidation: experiences from the first full-scale anammox reactor in Rotterdam [J]. Water Research, 2007,41:4149–4163.
Lotti T, Kleerebezem R, van Erp Taalman Kip C, et al. Anammox growth on pretreated municipal wastewater [J]. Environmental Science Technology, 2014,48:7874−7880.
Hendrickx T L G, Kampmana C, Zeeman G, et al. High specific activity for anammox bacteria enriched from activated sludge at 10℃ [J]. Bioresource Technology, 2014,163:214-221.
国家环境保护局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:258-282.
Li X Y, Yang S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge [J]. Water Research, 2007,41:1022–1030.
Gaudy A F. Colorimetric determination of protein and carbohydrate [J]. Ind. Water Wastes, 1962,7:17–22.
Jetten M S M, Strous M, van de Pas-Schoonen K T, et al. The anaerobic oxidation of ammonium [J]. FEMS microbiology reviews, 1999,22:421–437.
Hendrickx T L G, Wang Y, Christel Kampman, et al. Autotrophic nitrogen removal from low strength waste water at low temperature [J]. Water Research, 2012,46:2187-2193.
Hu Z, Lotti T, de Kreuk M, et al. Nitrogen removal by a nitritation-anammox bioreactor at low temperature [J]. Applied Environmental Microbiology, 2013,79(8):2807-12.
Hellinga C, Schellen A J C, Mulder J W, et al. The SHARON process: an innovative method for nitrogen removal from ammoniumrich waste water [J]. Water Science and Technology, 1998,37:135-142.
Dalsgaard T, Thamdrup B. Factors controlling anaerobic ammonium oxidation with nitrite in marine sediment [J]. Applied Environmental Microbiology, 2002,68:3802–3808.
Lotti T, Kleerebezem R, van Loosdrecht M C M. Effect of Temperature Change on Anammox Activity [J]. Biotechnology and Bioengineering, 2015,112(1):98-103.
Isaka K, Date Y, Kimura Y, et al. Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures [J]. FEMS Microbiology Letters, 2008,282(1):32–38.
Liu Y Q, Liu Y, Tay J H. The effects of extracellular polymeric substances on the formation and stability of biogranules [J]. Applied Microbiology Biotechnology, 2004,65:143–148.
Sheng G P, Yu H Q, Li X. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review [J]. Biotechnology Advances, 2010,28(6): 882-894.
Liu Y, Fang H H P. Influence of extracellular polymeric substances (EPS) on flocculation, settling, and dewatering of activated sludge [J]. Critical Reviews Environmental Science Technology, 2003,33:237–273.
Wilèn B M, Lumley D, Mattsson A, et al. Relationship between floc composition and flocculation and settling properties studied at a full scale activated sludge plant [J]. Water Research, 2008,42:4404-4418.
Rysgaard S, Glud R N, Risgaard-Petersen N, et al. Denitrification and anammox activity in Arctic marine sediments [J]. Limnol Oceanogr, 2004,49:1493–1502.
* 责任作者, 教授, yayi.wang@tongji.edu.cn;wyywater@126.com
Effect of decreasing temperature on the performance and extracellular polymer substance of anaerobic ammonia oxidation sludge
SONG Cheng-kang, WANG Ya-yi*, HAN Hai-cheng, CHEN Jie, WANG Xiao-dong, CHANG Qing-long
(State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China)., 2016,36(7):2006~2013
In this study, a long term dynamic change in anammox reaction in response to the gradient decreased and recovered temperature (33→25→20→15→10→22 ℃) was evaluated in a sequencing batch reactor (SBR) running over 360days; both the specific anammox activity (SAA) and extracellular polymers (EPS) contents were assessed. Results showed that anaerobic ammonia oxidation reaction in the SBR remained stable and efficient at 20~33℃; the total nitrogen removal load was 0.4gN/(L·d) and the SAA was over 0.32gN/(gVSS·d). The temperature of 10℃ was the turning point for the anammox bacteria metabolic activity. At 10℃, anammox treatment capacity reduced significantly, with the SAA being decreased by 91% when compared with that at 33℃. However, anammox activity could be recovered to 0.24gN/(gVSS·d) at 22℃. The apparent activation energy (a) values was 68.4kJ/mol at 10~33℃ and 152.9kJ/mol at 10~20℃. In the range of 15~33℃, the EPS content of the anammox biomass increased with decreasing temperature; however, after temperature decreased to 10℃, the EPS content dropped significantly, and anammox sludge broke up into smaller flocs, leading to the loss of biomass from the bioreactor.
anaerobic ammonium oxidation;temperature;apparent activation energy;specific anammox activity;extracellular polymer substance
X703
A
1000-6923(2016)07-2006-08
宋成康(1991-),男,同济大学硕士研究生,主要从事污水生物处理理论和新技术的研究工作.
2015-12-20
国家自然科学基金资助项目(51522809;51378370);国家重点实验室自主研究课题(PCRRY14001)

