早衰因子及其突变对BACE1活性调控的研究
李诺敏,邱云洁,庆宏
(北京理工大学生命学院,北京,100081)
早衰因子及其突变对BACE1活性调控的研究
李诺敏,邱云洁,庆宏*
(北京理工大学生命学院,北京,100081)
阿尔兹海默症(Alzheimer's Disease,AD)是一种以记忆力减退、认知功能障碍为特征的中枢神经系统退行性疾病,其典型病理特征为神经元胞外沉积的大量β淀粉样蛋白(Amyloid β peptide,Aβ)而形成的老年斑。Aβ是由β-淀粉样前体蛋白(Amyloid precursor protein,APP)通过β-分泌酶(beta-site amyloid β precursor protein cleaving enzyme 1,BACE1)和γ-分泌酶有序切割产生的。而γ-分泌酶的活性中心早衰因子(Presenilin1,PS1)对BACE1的调控作用,可能对Aβ的产生发挥重要的作用。通过Western Blot和Real Time PCR的方法探讨了PS1缺失情况下,BACE1的表达水平以及活性,结果显示在MEF PS1敲除细胞中,BACE1的表达水平会显著下降,对APP的水解切割能力也会显著下调,当瞬时转染PS1后,这种现象会被翻转,BACE1的表达水平和mRNA水平均会显著上调。同时还发现在加入γ-分泌酶抑制剂L-685,458后,也可以很好的翻转MEF PS1-/-PS2-/-细胞中瞬时过表达PS1后所产生的影响。PS1突变L166P和Q223R可以显著性的增加APP的水解切割过程以及BACE1的表达水平以及活性,当加入γ-分泌酶抑制剂L-685,458后,能显著性的抑制PS1突变对BACE1的表达水平,活性以及mRNA水平。以上结果表明,PS1能够调控BACE1的表达水平,进而影响Aβ的产生。
阿尔兹海默症; β-分泌酶; 活性中心早衰因子
阿尔兹海默症(Alzheimer's Disease,AD)是一种以记忆力减退、认知功能障碍为特征的中枢神经系统退行性疾病,其典型病理特征为神经元胞外沉积的大量β淀粉样蛋白(Amyloid β peptide,Aβ)而形成的老年斑[1]。老年斑的主要组成为淀粉样蛋白Aβ40和Aβ42,其中Aβ42为毒性成分[2]。Aβ是由β-淀粉样前体蛋白(Amyloid precursor protein,APP)通过β-分泌酶(beta-site amyloid β precursor protein cleaving enzyme 1,BACE1)和γ-分泌酶有序切割产生的[3]。首先BACE1切割APP,生成分泌型的sAPPβ及跨膜的羧基末端C99,切割形成的羧基端片段C99继续在γ-分泌酶作用下,产生Aβ[4]。而在非Aβ生成途径中,APP首先在Aβ部分被α-分泌酶切割产生分泌型sAPPα和C83。C83继续被γ-分泌酶切割但不产生Aβ。在正常状态下体内以非Aβ生成途径为主
BACE1作为APP水解切割产生Aβ的关键酶,研究发现在AD病人脑内BACE1基因表达上调且活性增加[5,6],这表示BACE1的表达调控在AD病理过程中具有重要作用。
γ-分泌酶是一种由多个亚基构成的复合体,目前已知它包括早衰因子(Presenilin,PS1/2),Nicastrin,Aph1及Pen-2。PS1作为γ-分泌酶的重要组成参与APP的代谢,由PS1基因突变而导致的AD约占家族性AD(Family Alzheimer's Disease,FAD)的90%,家族性AD中的PS突变可能是通过影响PS依赖的γ-分泌酶活性而改变APP水解切割和Aβ产生的,继而引发一系列神经退行性病变[7]。有研究表明目前已有许多关于PS1突变的报道,与家族性AD有关的大多数PS1突变位于早衰因子的跨膜区[8,9],PS1突变可以调控BACE1的表达和活性,增加Aβ42的生成。因此我们选取有关PS1的两种家族性突变L166P及Q223R,就其对BACE1的调控及其在APP水解切割过程的影响进行探究。结果显示瞬时转染PS1-L166P或Q223R 到PS1-/-PS2-/-细胞后,BACE1的表达和活性显著上调。当加入γ-分泌酶抑制剂L-685,458后,可以有效反转PS1-/-PS2-/-细胞中瞬时过表达PS1后所产生的影响。因此我们的结果表明PS1能够调控BACE1的表达和活性,并且与家族性AD相关的突变体PS1-L166P、PS1-Q223R可以通过增加BACE1表达或促进BACE1蛋白的活性,影响APP的水解切割过程。
1 材料与方法
1.1试剂与耗材
DMEM(Dulbecco's modified Eagle's medium)培养基(高糖型,含L-谷氨酰胺和丙酮酸钠)、Opti-MEM、胎牛血清购自美国Gibco公司;100×双抗(10kU/ml青霉素+ 10mg/ml硫酸链霉素)、0.25%胰酶-EDTA购自北京索来宝公司,γ-分泌酶抑制剂L-685,458购自美国Sigma公司;转染试剂Lipofectamine 2000 购自Invitrogen 公司;RNA抽提试剂Trizol Reagent购自invitrogen公司;反转录使用RNasin Plus RNase Inhibitor、RNase-free water、Oligo(dT)15 Primer、dNTP、M-MLV Reverse Transcriptase购自美国Promega公司;2×TransStart Top Green qPCR SuperMix购自北京全式金生物技术有限公司;抗BACE1小鼠单抗购自美国R&D公司;兔源抗体C20(抗APP C端)为加拿大哥伦比亚大学宋伟宏教授惠赠;抗β-actin小鼠单抗购自美国Sigma公司;HRP标记山羊抗小鼠二抗、HRP标记山羊抗兔二抗购自北京中杉金桥生物技术有限公司;IMMOBILON WESTERN CHEMILUM HRP化学发光底物购自美国Millipore公司;Human Aβ42试剂盒,HumanAβ40试剂盒购自美国Thermo公司。
1.2细胞培养,转染与抑制剂处理
MEF(PS1-/-PS2-/-,PS1+/+PS2+/+,PS1-/-)细胞来源于小鼠胚胎成纤维细胞,细胞在含有10%胎牛血清、1%NEAA(非必需氨基酸)和1%双抗的DMEM高糖培养基中培养,细胞于37℃,5% CO2的条件下培养。
细胞培养于60mm培养皿,待细胞密度达到70~80%时,按照质粒与lipofectamine2000 1:2的比例稀释于Opti-MEM培养基中,静置20min,将混合液加入细胞培养基中,轻轻混匀,4~6h后更换为完全培养基,转染48h后收集细胞。γ-分泌酶抑制剂为细胞转染48h后加入,10μM处理90min。
1.3Western blot检测
细胞转染48h后,胰酶消化,离心收集细胞,加入适量含有蛋白酶抑制剂的RIPA裂解液于冰上裂解30min,超声破碎,4℃ 12000rpm离心10min,取上清,Bradford法进行蛋白定量。取50μg蛋白进行SDS-PAGE电泳,电泳完毕后将蛋白转移至PVDF膜,PVDF膜置于质量分数为5%脱脂牛奶中室温封闭1h,一抗(C20 1:10000,BACE1 1:1000,β-acting 1:8000)4℃孵育过夜;TBST洗6次,每次10min,加入对应的辣根过氧化物酶标记的二抗(山羊抗小鼠,山羊抗兔1:5000)室温孵育2h,TBST洗6次每次10min,ECL显影,灰度分析使用Image Lab软件。APP-CTF使用16.5% Tris-tricine胶检测。
1.4RNA提取与Real-time PCR检测
细胞转染48h后,使用Trizol Reagent(invitrogen)抽提总RNA,根据测定的RNA浓度,计算5μg RNA体积进行反转录;Real-time PCR检测BACE1基因(Forward:TGGAGGGCTT TGGAGGGCTTCTACGTTGTCTT,Reverse:CATCATGGAAGGTTT CTATGTCGTCTTC),内参GAPDH(Forward:GACTTCAACAGCAACTCCCACTCTTCC,Reverse:TGG GTGGTCCAGGGTTTCTTACTCCTT)。
1.5ELISA检测
Aβ检测根据Aβ ELISA试剂盒说明书操作。细胞转染48h后,收集细胞上清液为待测样品;试剂盒室温平衡20min,在样品孔中加入10μL样品和40μL稀释液的混合液,在标准孔中加入50μL不同浓度梯度的标准品,对照孔加入50μL的未培养细胞的培养基,Blank孔中不加入任何液体,随后在各孔中加入检测抗体50μL,室温孵育3h;孵育完成后,弃去孔内的液体,用wash buffer洗四次,每次1min;在孔内加入100μL Anti-Rabbit IgG HRP溶液,室温孵育30min;孵育完成后,弃去孔内的液体,用wash buffer洗四次,每次1min;在孔内加入100μL的Stabilized Chromogen,这时孔中液体逐渐变蓝,在室温下避光孵育30min;孔中加入100μL的终止液,待孔中液体变黄,30min内在450nm处进行检测;根据标准品的吸光值绘制出标准曲线,计算每孔样品内Aβ42和Aβ40的含量。
1.6统计学处理
数据及其标准差均采用Microsoft Office Excel 2010和GraphPad Prism 6.0软件进行统计与计算,Western Blot用Image Lab Version 4.0进行相对定量分析。数据以平均值±标准差呈现。对数据进行两两比较时采用t-test进行显著性分析,组间采用one-way ANOVA( Dunnett's post hoc test ),p<0.05即认为结果显著。
2. 实验结果
2.1PS1调控BACE1蛋白转录及翻译
研究发现AD病人脑内BACE1基因表达上调,其表达调控在AD病理过程中具有重要作用,因此我们首先研究了PS1是否会影响BACE1蛋白的表达水平。与对照组MEF PS1-/-PS2-/-细胞相比,过表达PS1后细胞内BACE1蛋白的表达水平显著上调。
由于BACE1的基因表达可在转录水平调控,我们就PS1对BACE1 mRNA水平的影响进行探讨。结果显示当MEF PS1-/-PS2-/-细胞中瞬时过表达PS1后,BACE1的mRNA水平显著上调。这一结果与BACE1蛋白水平的变化一致。也有研究者在HEK293细胞中发现了类似的结果,HEK293细胞中瞬时转染PS1-WT后,BACE1的mRNA水平以及BACE1的活性都出现了上调趋势[10]。
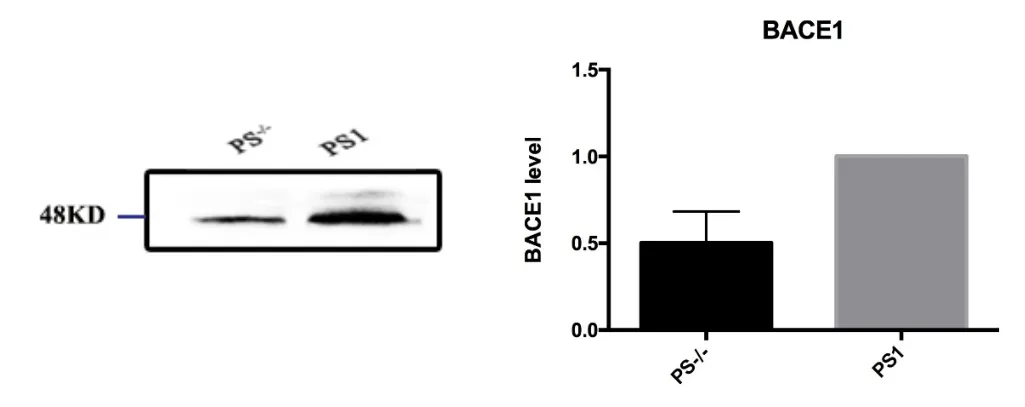
图1 MEF PS1-/-PS2-/-及过表达PS1细胞中BACE1蛋白表达水平的改变Fig.1 The effect of PS1/PS2 knock out on BACE1 protein level in MEF cell line
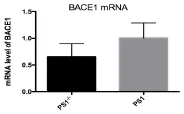
图2 MEF PS1-/-PS2-/-细胞中BACE1 mRNA水平的改变Fig.2 The effect of PS1/PS2 knock out on BACE1 mRNA level in MEF cell line
2.2FAD相关PS1突变影响APP水解切割
与家族性AD有关的多数PS1突变可以通过降低Aβ40或增加Aβ42上调Aβ42与Aβ40的比例[11,12]。PS1突变L166P及Q223R分别位于PS1的第2及第5个跨膜区,为了探究这两种家族性突变对Aβ生成的影响,我们首先对过表达突变体L166P 及Q223R后分泌型Aβ水平进行检测。结果显示,与野生型PS1相比,过表达L166P或Q223R时分泌到细胞外的Aβ水平发生改变,Aβ42与Aβ40的比例显著性上调。
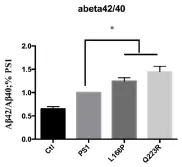
图3 .28 PS1突变对Aβ42/Aβ40的影响(*P<0.05,**P<0.01)The Aβ42/ Aβ40 ratio.
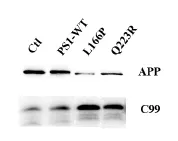
图3 PS1突变对APP水解切割过程的影响Fig.3 The effect of Presenilin1 mutations on APP cleavage pathway
由于APP、BACE1及γ-分泌酶对Aβ产生过程中的重要性,结果提示我们PS1突变在影响PS1功能的同时也会影响BACE1的表达和活性,因此我们对BACE1的蛋白水平及其切割APP产生的CTF水平进行检测,在20E2细胞中过表达PS1-L166P或Q223R后,与野生型PS1相比,PS1突变L166P与Q223R会显著性增加CTF99的水平,相对应的APP水平显著下降,表明这两种PS1突变可以显著性促进APP的水解过程,促进BACE1的水解切割活性。同时,突变体L166P过表达后BACE1蛋白水平没有显著变化,而转入Q223R时BACE1的表达水平显著提高,继而促进APP的水解切割,引起CTF99表达水平的增加。
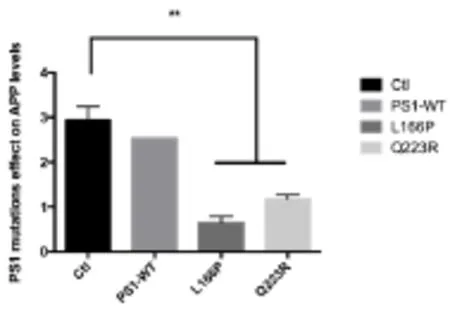
图4 APP蛋白水平灰度分析图(*P<0.05,**P<0.01)Fig.4 Relative level of APP(*P<0.05,**P<0.01)
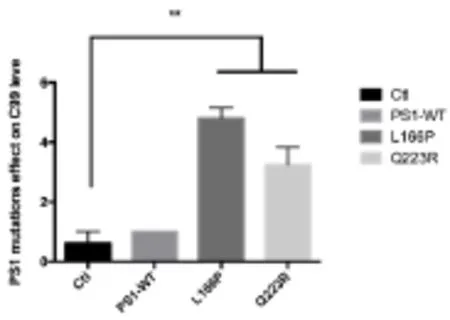
图5 C99表达水平灰度分析图(*P<0.05,**P<0.01)Fig.5 Relative level of C99(*P<0.05,**P<0.01)
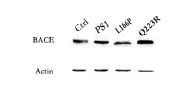
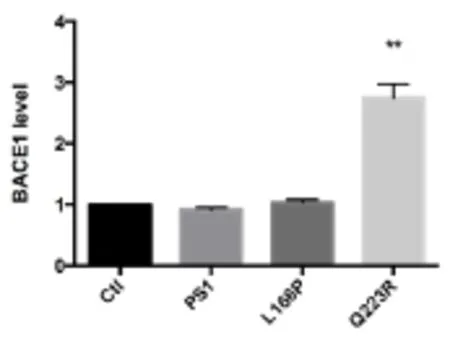
2.3γ-分泌酶抑制剂调控BACE1的表达和活性
为了进一步验证PS1及其突变对BACE1活性及表达水平的影响,加入γ-分泌酶抑制剂L-685,458研究其能否抑制BACE1的表达水平或活性。在MEF PS1-/-PS2-/-转入PS1-WT、PS1-L166P或PS1-Q223R时,BACE1的表达水平和活性均上调;当加入γ-分泌酶抑制剂后,其BACE1蛋白的表达水平显著下降,而且对APP的切割水平具有显著的抑制作用。Luca研究小组也发现,在HEK293细胞中一些PS1突变可以增加BACE1的mRNA水平和表达水平,包括M146V,S170F,L392V和A246E,当加入γ-分泌酶抑制剂XIX后,BACE1的表达水平和mRNA水平下调,这个结果与本实验得到结果具有一致性。
同时我们也对瞬时转染PS1突变后加入γ-分泌酶抑制剂时BACE1 mRNA水平进行检测。结果与BACE1蛋白水平具有一致性,在瞬时转入PS1突变:L166P和Q223R后加入γ-分泌酶抑制剂L-685,458,能够显著性的降低BACE1蛋白mRNA的水平。以上结果表明在加入γ-分泌酶抑制剂后,γ-分泌酶抑制剂L-685,458能够抑制了PS1的活性,而PS1活性的丧失会导致BACE1蛋白水平和活性的下降。

图3 .31: γ-分泌酶抑制剂L-685,458对BACE1蛋白表达水平及APP水解切割的影响Figure 3.31 The effect of γ-secretase inhibitor L-685.458 on BACE1 level and APP pathway
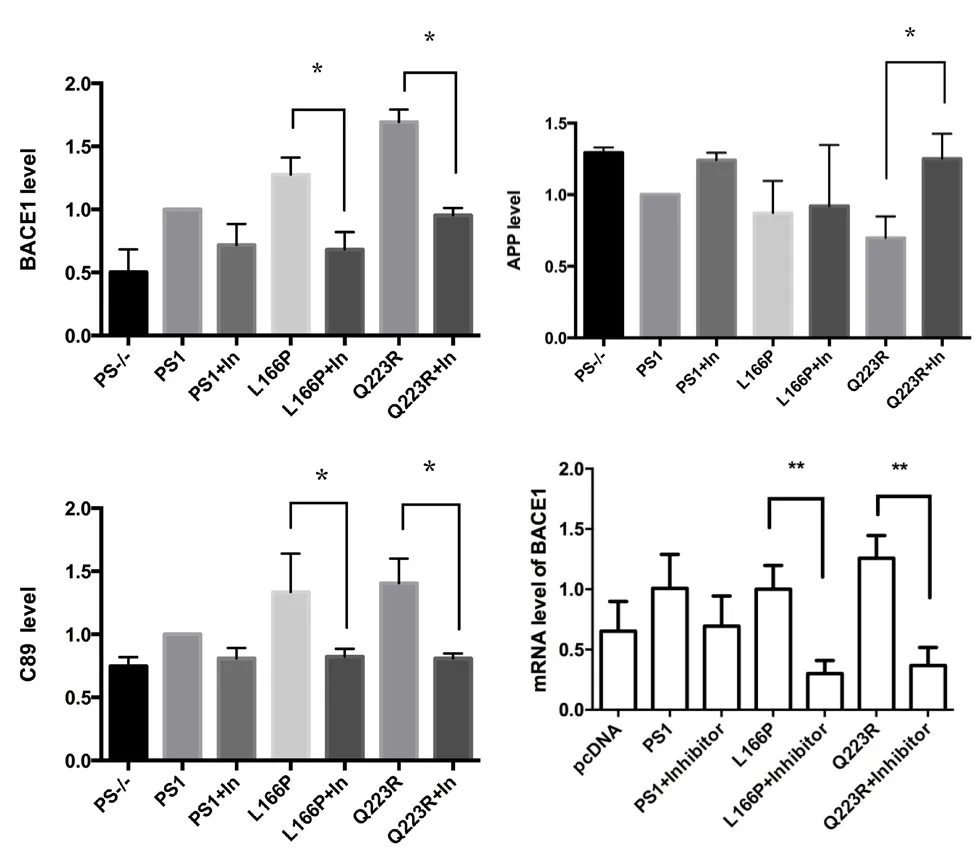
图3 .33 γ-分泌酶抑制剂L-685,458对BACE1 mRNA水平的影响(*P<0.05,**<0.01)Figure 3.33 The effect of γ-secretase inhibitor L-685,458 on BACE1 mRNA level(*P<0.05,**<0.01)
3. 讨论
BACE1作为APP水解过程的关键酶,对于Aβ生成和AD的病理发生具有至关重要的作用。已有研究发现PS1作为γ-分泌酶的重要组成,可以调控BACE1的成熟与活性[13]。我们首先在MEF PS1-/-PS2-/-细胞中验证PS1对BACE1的调控作用,结果显示当转入PS1后,BACE1的蛋白水平和mRNA水平显著上调,说明PS1可在转录和翻译水平均可调控BACE1。
与家族性AD有关的PS1突变可以改变PS1的功能,是否也会影响BACE1的表达和活性,为了研究与FAD有关的PS1突变对BACE1的调控作用,我们选取了分别位于PS1蛋白第2及第5个跨膜区上的突变位点L166P及Q223R,对其APP水解切割过程相关产物进行检测。结果表明,这两种PS1突变均可促进BACE1对APP的水解作用,并提高Aβ42与Aβ40的比例。而且转入Q223R突变后的BACE1蛋白水平也显著上调,而当转入L166P突变后BACE1水平并没有显著改变,表明不同突变体可能通过不同方式,包括促进BACE1的转录和翻译以及增加BACE1的活性调控BACE1的功能[14]。利用γ-分泌酶抑制剂L-685,458抑制PS1蛋白的功能活性,此时无论野生型或两种PS1突变,BACE1的表达水平和活性均相应下调,进一步验证了PS1及其突变对BACE1的调控作用。
不同的PS1突变可以通过增加BACE1的表达或促进其活性继而影响β-分泌酶的功能,而对于PS1与BACE1的具体作用机制仍然未知,PS1对BACE1表达水平的调控是否由于启动子或转录水平的调控实现的,仍需要利用荧光素酶及染色质免疫共沉淀的方法进一步研究,而PS1对BACE1蛋白功能的促进作用具体发生机制也需要深入探讨。综上所述,研究发现PS1及其突变L166P、Q223R能够调节BACE1的表达和活性,影响APP水解切割和Aβ的产生,这为研究AD的发病机制及寻找新的AD治疗靶点提供了理论基础。
[1]Bondareff W,Mountjoy C Q,Roth M. Bondareff W,Mountjoy CQ,Roth M. Loss of neurons of origin of the adrenergic projection to cerebral cortex(nucleus locus coeruleus)in senile dementia. Neurology 32: 164-168 [J]. Neurology,1982,32(2):164-168.
[2]Vidoni E D,Yeh H W,Morris J K,et al. Cerebral beta-Amyloid Angiopathy Is Associated with Earlier Dementia Onset in Alzheimer's Disease [J]. Neuro-degenerative diseases,2016,
[3]Chow V W,Mattson M P,Wong P C,et al. An overview of APP processing enzymes and products [J]. Neuromolecular medicine,2010,12(1): 1-12.
[4]Gordon S C,Landa D. Disclosure of the genetic risk of Alzheimer's disease [J]. The New England journal of medicine,2010,362(2): 181-182; author reply 182.
[5]Cheng X,He P,Lee T,et al. High activities of BACE1 in brains with mild cognitive impairment [J]. The American journal of pathology,2014,184(1): 141-147.
[6]Wang H,Li R,Shen Y. beta-Secretase: its biology as a therapeutic target in diseases [J]. Trends in pharmacological sciences,2013,34(4): 215-225.
[7]Saura C A,Choi S Y,Beglopoulos V,et al. Loss of presenilin function causes impairments of memory and synaptic plasticity followed by age-dependent neurodegeneration [J]. Neuron,2004,42(1): 23-36.
[8]Futai E,Osawa S,Cai T,et al. Suppressor Mutations for Presenilin 1 Familial Alzheimer Disease Mutants Modulate gamma-Secretase Activities [J]. The Journal of biological chemistry,2016,291(1): 435-446.
[9]Wanngren J,Lara P,Ojemalm K,et al. Changed membrane integration and catalytic site conformation are two mechanisms behind the increased Abeta42/Abeta40 ratio by presenilin 1 familial Alzheimer-linked mutations [J]. FEBS open bio,2014,4(393-406.
[10]Giliberto L,Borghi R,Piccini A,et al. Mutant presenilin 1 increases the expression and activity of BACE1 [J]. The Journal of biological chemistry,2009,284(14): 9027-9038.
[11]Bentahir M,Nyabi O,Verhamme J,et al. Presenilin clinical mutations can affect gamma-secretase activity by different mechanisms [J]. Journal of neurochemistry,2006,96(3): 732-742.
[12]Kretner B,Fukumori A,Gutsmiedl A,et al. Attenuated Abeta42 responses to low potency gamma-secretase modulators can be overcome for many pathogenic presenilin mutants by secondgeneration compounds [J]. The Journal of biological chemistry,2011,286(17): 15240-15251.
[13]Kuzuya A,Uemura K,Kitagawa N,et al. Presenilin 1 is involved in the maturation of beta-site amyloid precursor protein-cleaving enzyme 1(BACE1)[J]. Journal of neuroscience research,2007,85(1): 153-165.
[14]Shen J,Kelleher R J,3rd. The presenilin hypothesis of Alzheimer's disease: evidence for a loss-of-function pathogenic mechanism [J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(2): 403-409.
The Investigation of Regulatory Role of Presenilin1 in BACE1 Activity and Expression
Li Nuomin,Qiu Yunjie,Qing Hong*
(Beijing Institute of Technology School of Life Sciences,Beijing,100081)
As a kind of neurodegenerative disease,Alzheimer's disease(AD)is characterized by memory loss and cognitive disorder. The typical pathological feature of AD is the senile plaques accumulated in the extracellular matrix of central nervous system. Amyloid β peptide(Aβ),the main component of senile plaques,is sequentially generated by Beta-site amyloid β precursor protein cleaving enzyme 1(BACE1)and γ-secretase through the hydrolysis of Amyloid precursor protein(APP). Presenilin1(PS1)is the active site of γ-secretase and may be of great importance in the synthesis of Aβ due to its regulatory role towards BACE1. In the present study,the expression and activity of BACE1 was investigated in the absence of PS1. The results showed that both of the two parameters were significantly decreased in MEF PS1-/-cell line,which was reversed when transiently transfected with PS1. Meanwhile,the effects caused by transient overexpression of PS1 could be potently suppressed by γ-secretase inhibitor L-685,458 in MEF PS1-/-PS2-/-cells. PS1 mutations,L166P and Q223R,dramatically enhanced BACE1 expression and activity,and thus increased the amount of Aβ. L-685,458 also notably inhibited the function of PS1 mutations. All the data above supports the conclusion that PS1 regulates BACE1 and thereby affects the synthesis of Aβ.
Alzheimer's Disease; BACE1; PS1
Q74 [Document Code] A
10. 11967/ 2016140407
Q74
ADOI:10. 11967/ 2016140407
国家自然基金(项目编号:81171206)。
李诺敏,博士,研究方向:神经生物学。
庆宏 教授。Email:hqing@bit.edu.cn。

