芥菜型油菜B03染色体黄籽基因区域BAC重叠群的构建及分析
徐海鹏,刘显军,陆 赢,马 鹏,胡庆一,刘忠松
(湖南农业大学油料作物研究所,长沙 410128)
芥菜型油菜B03染色体黄籽基因区域BAC重叠群的构建及分析
徐海鹏,刘显军,陆赢,马 鹏,胡庆一,刘忠松*
(湖南农业大学油料作物研究所,长沙 410128)
在前人研究中,芥菜型黄籽基因被定位到B03连锁群的1.5 cM区域内。本试验利用与B03染色体控制黄籽基因区域紧密连锁的unigene(通过RNA_seq技术获得的芥菜型油菜种皮的非冗余基因)和BESs开发标记,并对芥菜型油菜作图群体亲本紫叶芥BAC文库(ZBjuH BAC文库)进行筛选,由开发的320对引物共筛到BAC 920个,对其中483个BACs进行了末端测序,返回序列860条。构建了6段芥菜型油菜B03染色体黄籽区域BAC重叠群,共计长约3.3 Mb;通过BES blast分析表明,在B03染色体黄籽区域与A03、A09染色体存在高度的重复序列。
芥菜型油菜;黄籽基因;B03染色体;BAC重叠群
油菜是唯一的冬季油料作物,同时也是世界上第三大油料作物,包括了白菜型、芥菜型和甘蓝型三种类型。在相同遗传背景下,黄籽油菜与黑籽油菜相比,在种皮、色素、含油量、蛋白质含量和菜饼饲用价值方面更具优势[1,2],因此黄籽油菜是现代油菜育种的重要目标。而在甘蓝型油菜中,并没有发现天然的黄籽材料,一般都是通过远缘杂交或者诱变育种获得,但是其后代遗传具有不稳定性,对甘蓝型黄籽油菜的市场推广和种质选育产生严重制约。
在白菜型油菜种皮颜色基因定位中,Rahman等[3,4]通过SRAP标记扩增产物测序,推测出白菜型油菜和甘蓝型油菜可能具有相同的黄籽基因。而Kebede等[5]和Xiao等[6]通过进一步研究,将白菜型油菜的黄籽基因定位于A09染色体。
相比较而言,芥菜型油菜天然黄籽材料更加丰富,占芥菜型油菜资源一半还多[7]。在前人研究中,认为芥菜型油菜黄籽基因一般由两个基因位点控制[8~10]。Padmaja[11]通过关联作图找到位于2个不同连锁群的3个和种皮颜色基因连锁的SSR标记,分别是Ra2A11、Na10A08、Ni4F11。王卓等[12]通过PCR步移筛选法构建了芥菜型油菜A09染色体黄籽区域的BAC重叠群。刘显军等[13]以高代回交分离群体作材料,将黄籽基因定位到A09和B03两个连锁群的0.9 cM和1.5 cM区域里。Lakshmi等[14]通过同源克隆推测并克隆出与黄籽性状相关联的TT8基因,但未证实与其共分离标记区域之间是否存在其他基因影响黄籽性状的表达。
本研究利用与芥菜型油菜B03染色体黄籽基因区域相关的标记,对芥菜型油菜作图亲本紫叶芥BAC文库进行四维筛选,构建目的区域的BAC重叠群,并通过测序获得序列,研究芥菜型油菜黄籽形成的分子机制,为定位黄籽候选基因提供参考,为油菜黄籽育种和芥菜型油菜基因组研究奠定基础。
1 材料与方法
1.1材料
材料包括芥菜型油菜紫叶芥(Purple-leaf Mustard,PM)、四川黄籽(Sichuan Yellow Seed,SY)、由紫叶芥和四川黄籽连续回交获得的近等基因系A(Near-Isogenic Line A,NILA)和近等基因系B(Near-Isogenic Line B,NILB)。其中紫叶芥作为试验用亲本,用其构建芥菜型油菜BAC文库既ZBjuH BAC文库(华中农业大学罗美中教授实验室协助完成)。
1.2方法
1.2.1亲本(紫叶芥)DNA的提取
试验检测用亲本DNA采取CTAB法[15]提取。步骤如下:(1)取指甲大小幼嫩鲜叶(紫叶芥)放入事先清洗干净的研钵中,加950 μL2%CTAB研磨,而后转入2.0 mL离心管置于冰上;(2)放入65℃水浴锅1 h,每10~15 min颠倒数次;(3)取出将每管大致分配均匀,加入1000 μL24∶1氯仿/异戊醇,置于冰上15 min,12 000 rpm离心10 min,取上清,重复步骤(3);(4)取上清入1.5 mL离心管,加入2倍体积预冷(-20℃)无水乙醇,-30℃保存30 min;(5)挑出DNA入新1.5 mL离心管,加入75%乙醇1000 μL,颠倒数次,8000 rpm离心3 min,去上清,再次加入1000 μL75%乙醇,10 000 rpm离心5min,去上清;(6)吹干DNA(超净工作台),加入100 μLddH2O,-20℃保存备用。
1.2.2BAC文库DNA混合池的构建
作图亲本紫叶芥ZBjuH BAC文库包含187块平板,每块平板都是横向16行(编号A-P)和纵向24列(编号1-24),每块平板含有384(16×24)个单克隆,总共71 808(384×187)个BAC单克隆。为了减轻标记筛选过程中的压力,利用文库构建了3个水平的混合池(一级池、二级池、三级池)。
三级池:包括纵向和横向两个池,其中横向池为一块平板相邻两行48个单克隆混合而成(如100号平板的AB、CD、EF…OP);纵向池为一块平板的相邻2列32个单克隆混合而成(如100号平板的1,2、3,4、5,6…23,24)。
二级池:一个二级池由一块平板所有单克隆(384个)混合而成。
一级池:总共19个一级池。每个一级池由连续相邻的10块平板组成(即10个二级池),其中第19号一级池只有7个二级池(181~187)混合组成。
1.2.3目标BAC克隆的筛选
利用已有的标记对ZBjuH文库进行四维筛选。首先是对19个一级池筛选,得到阳性一级池,接着筛选阳性一级池所包含的二级池,再对阳性二级池所包含的三级池(横向和纵向)进行筛选。此步骤得到4个可能的BAC克隆(如100-AB-3,4),从文库中挑出这4个BAC克隆摇菌过夜,再利用标记筛选这4个克隆,得到最终目的阳性BAC。
1.2.4引物开发
引物来源主要为目的基因区域BAC末端序列设计的末端引物、利用unigene设计的引物以及利用芥菜型油菜SURVEY序列设计的引物。引物设计采用Primer Premier 5.0或者利用在线网址(http://122.205.95.67/tools/primer.php)上的Primer 3设计。引物长度控制在20~30个碱基内,扩增产物大小300~500 bp,GC含量尽量要求大于45%。
引物由上海立菲生物有限公司合成。
1.2.5BAC末端测序和全长测序
BAC末端测序由Invitrogen生物公司或生工生物上海有限公司完成,测序引物为M13R和S2。
BAC全长测序由武汉未来组生物技术有限公司完成。
1.2.6BAC序列的BLAST分析
测序获得的序列在实验室建成的数据库(http://172.28.10.232/index.php)进行比对和分析。
2 结果和分析
2.1B03染色体黄籽基因区域标记分析
试验利用已定位到芥菜型油菜B03黄籽基因区域的连锁标记Ni4F11、TT8和参考芥菜型油菜unigene序列设计的引物对作图亲本紫叶芥ZBjuH BAC文库进行四维筛选。本试验利用测得的目的基因区域的BAC末端序列设计了219对STS引物,其中204对引物可以扩增;利用芥菜型油菜unigene序列设计36对引物,其中35对引物可以扩增;利用芥菜型基因组SURVEY序列设计41对引物,其中39对引物可以扩增;另外还合成了15对IP标记引物,其中14对可以扩增(表1)。
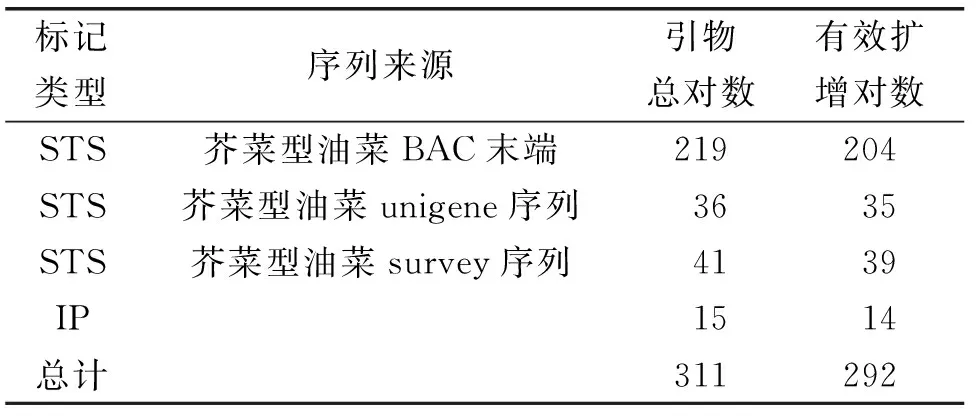
表1 有效扩增引物统计Table 1 Statistics of effective amplification primer
并用近等基因系对部分标记进行多态性分析,检测标记是否与目的性状连锁。部分引物序列信息及筛选到的BAC于表2,多态性分析结果于图1。

图1 芥菜型油菜亲本及其近等基因系多态性分析结果Fig.1 Polymorphism analysis of the primers using the parents and their nearisogenic lines of Brassica juneca注:SY.四川黄籽(aabb);PM.紫叶芥亲本(AABB);NILA.近等基因系A(AAbb);NILB.近等基因系B(aaBB)。

引物名称引物序列(5'→3')扩增产物长度(bp)筛到的BACsNi4F11F:CGTAAGTTTCAATTGTCAACGGR:TCGTACGAAACAATCAACGG295099-K-04 146-B-03115-K-08 161-J-23B15_3884F:GCAAAAGCCAAATTGTCGATR:TAGAGTCGGCGAAAAGGAGA350027-P-09 041-M-20101-N-06 102-J-20159-J-08 171-B-24ST8F:CCGTGCTTGATGGCGTTTTGGAR:TTTGACTTCGGGTGGTTGTGGA328005-J-08033-E-04036-F-18SY_5263F:AGGCGGTGGTTTGAGTTTCGGTGGCR:GCCTTTACCTATCTTCTCCTCACGGTTA-CAGTCCTC266001-P-23 031-F-06059-L-09 014-J-10099-O-18 101-F-06144-J-05 149-A-11B15_39736F:TAACAGGTGATGTCGATCCAAGR:CTTTTGTCGTGAAGACGATGAG318119-P-24 165-P-15020-O-04 028-H-14
2.2芥菜型油菜B03染色体目的区域BAC重叠群构建及分析
试验通过对ZBjuH文库筛选,获得BAC克隆640个,对其中435个克隆进行末端测序,得到BAC末端序列866条(部分测序结果不理想)。分别利用与芥菜型油菜B03染色体紧密连锁的标记B15_33151,B15_3884,B15_39736,SY15_5263,以及与B03染色体控制黄籽基因紧密连锁的标记筛选到的BAC为支点,构建了6段芥菜型油菜B03染色体黄籽基因区域的BAC重叠群(图2)。

图2 芥菜型油菜B03染色体黄籽基因区域种子BAC群Fig.2 Seeds BACs contigs of yellow-seeded locus of the chromosome B03 in B.juncea注:图中用一条长线代表B03染色体,箭头表示该引物在B03染色体上的位置,短竖线表示引物,短横线表示BAC并用数字-字母-数字表示BAC名称。
图2为构建的重叠群的种子BAC群,共计有48个BAC和49个标记。此6段BAC重叠群其中心标记(B15_33151,B15_3884,Ni4F11,B15_39736,ST8,SY15_5263)用近等基因系分析都具有多态性,与目的性状连锁。第一段BAC重叠群为引物B15_33151筛到并延伸,左起BAC147-A-13(标记为BJS4447-1),右至045-M-17(标记为184F10L),包含6个种子BAC;第二段为引物B15_3884-1筛到并延伸,左起BAC187-C-13(标记为102J20R-1),右至029-A-10(标记为015M19R-2),包含8个种子BAC;第三段为引物Ni4F11筛到并延伸,左起BAC053-I-19(标记为146B03L),右至006-M-09(标记为146B03R),包含6个种子BAC;第四段为引物B15_39736-1筛到并延伸,左起BAC175-G-14(标记为119P24L),右至BAC129-K-23(标记为033J20L),包含7个种子BAC;第五段为引物ST8筛到并延伸,左起BAC036-F-18(标记为B15_39506-4),右至BAC056-H-03(标记为011G16L),包含11个种子BAC;第六段为引物SY15_5263筛到并延伸,左起BAC139-F-06(标记为143K05R),右至BAC014-J-10(标记为SY15_5263),包含10个种子BAC。
芥菜型油菜(AABB)、甘蓝型油菜(AACC)、白菜型油菜(AA)这3种油菜,虽然具有不同的基因组,但是仍然存在大量的重复区域和片段。在Truco等[16]的研究中,发现白菜型、芥菜型、甘蓝型油菜中的A、B、C3个基因组中,存在大量的保守区块(BLOCK);Kumar等[17]进一步研究将芥菜型油菜分成24个保守区块,而且其中A09、A03、B03染色体存在相同的保守区块block O和block P,这两个相同的保守区块正好是B03染色体黄籽基因区域。在本试验中,利用BAC033-E-04末端序列设计引物033E04R筛选到了BAC142-O-19,而后测序利用其末端序列设计引物142O19L,筛得BAC090-N-23。但是经过BLAST分析和设计引物验证,证明BAC142-O-19位于A03染色体000064支架上,而BAC033-E-04和BAC090-N-23位于目标区域;另外利用引物B15-39736可以筛到BAC171-K-20、114-I-20、052-G-12等,但证明这些BAC均位于A03染色体000001支架上;利用引物090N23L筛到了BAC015-F-18,而在前人对芥菜型油菜A09黄籽区域研究中,已对ZBjuH015F18进行了全长测序,并确定该BAC位于芥菜型油菜A09染色体的黄籽区域。证明在芥菜型油菜中,染色体A09黄籽基因区域和B03黄籽基因区域及A03染色体存在高度同源的重复序列。也正是由于这些重复序列的存在,所以在本试验研究过程中,需要加强对筛到的BAC进行验证及分析,保证引物设计的特异性和保证文库不被混杂。
2.3全长测序BAC
在试验计划中,从24个候选BAC中选取了5个(ZBjuH036F18,ZBjuH090N23,ZBjuH171K20,ZBjuH146B03,ZBjuH153B10)送往武汉未来组生物技术有限公司进行BAC全长测序。其中ZBjuH036F18,ZBjuH090N23,ZBjuH171K20完成全长测序。后经对返回序列分析及验证,认为ZBjuH171K20此BAC位于A03染色体,得到的返回序列中确定2个BAC全长序列位于芥菜型油菜B03染色体黄籽区域,即ZBjuH036F18(138 109 bp)和ZBjuH090N23(125 151 bp)。在实验室对这两个BAC进行组装和注释后,发现由这两个BAC组成的重叠群(长254 376 bp)编码12个基因,并包含转录因子基因TT8。刘显军等[13,14]认为,TT8是控制芥菜型油菜种皮颜色形成的基因。
3 讨论
本试验通过PCR步移筛选文库构建了6段重叠群,但是未将整个重叠群整合,重叠群之间存在间隙,如何填补这些间隙是接下来的主要工作。在使用标记筛选BAC文库过程中,有些标记无法筛到BAC继续延伸。出现无法延伸重叠群的一般情况为:(1)引物设计出现差错;(2)引物在筛选文库过程中出现误筛、漏筛等情况;(3)我们的BAC文库覆盖度为整个芥菜型基因组的8.7倍,但不能排除基因组某些区域仍存在没有BAC片段插入的情况。针对这些情况,首先要保证引物设计的特异性高,同时筛选过程中尽量保证菌池不受污染,以尽量降低假阳性片段的出现;再就是注意试验过程中引物进行PCR时的退火温度、电泳时琼脂糖胶的浓度及电泳仪的电压都会对实验结果产生误差。如已进行全长测序的BAC 036-F-18,利用036-F-18R端和对应的芥菜型基因组survey序列(B.juncea_gss_scaffold54318_27.4)设计了6对引物对文库进行筛选,均无法使重叠群继续延伸。因为设计了6对引物对该引物进行筛选延伸,且引物均可以扩增,故推测在此区域是否是构建文库时无BAC插入片段,在后续试验时可进行进一步分析和验证。
芥菜型油菜黄籽基因是一对等位基因,在A09染色体和B03染色体上高度保守,而相对于基因信息丰富的A09染色体,芥菜型油菜B基因组信息比较缺乏,且与A09染色体及A03染色体存在同源区块和重复序列,因此在研究过程中获得的序列、标记等信息资源是否可靠,更加需要反复思量、多次验证,注意延伸出去的克隆与原克隆之间的重叠关系,预估延伸区域、重叠区域的大小、未填补的间隙(Gap)的大小,注意标记之间的回筛验证,并加密标记筛选,以保证构建的重叠群的质量。
在本试验中,利用引物筛到BAC并进行测序获得末端序列后,我们先将其末端序列和芥菜型基因组survey序列进行比对,选择匹配度较高(高于95%)的survey序列,可利用这段survey序列比对,分析是否含有与近等基因系NILB相对应的unigenes,如果存在则可以利用三者之间共同的碱基序列设计引物。另外,有些BAC末端序列无法找到相对应的survey序列,我们发现利用其设计的末端引物也很难筛到BACs,推测其可能不是此区域BAC,或者是由于存在大量重复序列导致无法筛出BAC。
4 结论
本试验利用定位到芥菜型油菜B03染色体黄籽基因区域标记筛选BAC文库,并开发引物,构建了芥菜型油菜B03染色体黄籽区域共计3.3 Mb的重叠群,为B03染色体黄籽基因区域提供了新的分子标记,为芥菜型油菜黄籽基因的精细定位和图位克隆提供参考。由于目标区域与A09及A03染色体存在较高程度重复序列和区块,且B03基因组信息较为缺乏,因此构建重叠群难度较高。在以后的试验过程中,在综合PCR筛选、BAC测序、标记多态性检测等方法上,应注重结合生物信息学分析。
[1]刘后利.对油菜品质改良的看法[J].作物杂志,1992(3):6-7.
[2]谌利,唐章林,张学昆.甘蓝型油菜高油分育种初报[J].西南农业大学学报(自然科学版),2004,26(5):550-553.
[3]Rahman M,McVetty PB.A review ofBrassicaseed color[J].Can J Plant Sci,2011,91:437-446.
[4]Rahman M,McVetty PB,Li G.Development of SRAP,SNP and Multiplexed SCAR molecular markers for the major seed coat color gene inBrassicarapaL[J].Theor Appl Genet,2007,115:1101-1107.
[5]Kebede B,Cheema K,Greenshields DL,et al.Construction of genetic linkage map and mapping of QTL for seed color inBrassicarapa[J].Genome,2012,55:813-823.
[6]Xiao L,Zhao Z,Du D,et al.Genetic characterization and fine mapping of a yellow-seeded gene in Dahuang (aBrassicarapalandrace) [J].Theor Appl Genet,2012,124:903-909.
[7]刘淑艳,刘忠松,官春云.芥菜型油菜种质资源研究进展[J].植物遗传资源学报,2007,8(3)351-358.
[8]Negi M,Device M,Delseny M,et al.Identification of AFLP fragments linked to seed coat colour inBrassicajunceaand conversion to a SCAR marker for rapis selection[J].Theor Appl Genet,2000,101:146-152.
[9]Mahmood T,Rahman M,Stringam G,et al.Molecular markers for seed colour inBrassicajuncea[J].Genome,2005,48:755-760.
[10]严明理.芥菜型油菜黄籽形成的分子机理研究[D].长沙:湖南农业大学博士学位论文,2007.
[11]Padmaja KL,Arumugam N,Gupta V,et al.Mapping and tagging of seed coatcolor and the identification of microsatellite markers formarker-assisted manipulation of the trait inBrassicajuncea[J].Theor Appl Genet,2005,111:8-14.
[12]王卓,袁玉辉,胡学芳,等.芥菜型油菜A09黄籽基因区域BAC重叠群的构建[J].湖南农业科学,2012(11):1-3,7.
[13]刘显军,袁谋志,官春云,等.芥菜型油菜黄籽性状的遗传、基因定位和起源探讨[J].作物学报,2009,35:839-847.
[14]Lakshmi KP,Parul A,Vibha G,et al.Natural mutations in two homoeologousTT8 genes control yellow seed coat trait in allotetraploidBrassicajuncea(AABB) [J].Theor Appl Genet,2014,127(2):339-347.
[15]Doyle JJ,Doyle JL.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemistry Bulletin,1987,19:11-15.
[16]Truco MJ.Inter-and intra-genomic homology of theBrassicagenomes:implications for their origin and evolution[J].Theoretical and Applied Genetics,1996,93(8):1225-1233.
[17]Kumar P,Vibha G,Satish KY,et al.RNA-seq based SNPs for mapping inBrassicajuncea(AABB):synteny analysis between the two constituent genomes A (fromB.rapa) and B (fromB.nigra) shows highly divergent gene block arrangement and unique block fragmentation patterns[J].BMC Genomics,2014,15:396-410.
Construction and Analysis of BAC Contigs Around the Yellow-Seeded Locus of the Chromosome B03 in Brassica juncea
XU Haipeng,LIU Xianjun,LU Ying,MA Peng,HU Qingyi,LIU Zhongsong*
(Oil Crops Research Institute,Hunan Agricultural University,Changsha,Hunan 410128,China)
The yellow seed genes were located in 1.5 cM region of B03 linkage group ofBrassicajunceain previous studies.Yellow seed genetic regions (through the mustard RNASeq technology of rape seed non redundant genes) and BESs tightly linked to yellow seed genes of B03 were used to design markers in this study,and the markers were used to screenBrassicajunceamapping population parents purple leaf mustard BAC library (ZBjuH BAC library).In this study,320 markers were exploited and 920 BACs screened out from them,483 BACs of which were subject to end sequencing,and 860 sequences were returned.Six contigs (about 3.5Mb) were constructed around yellow seed coat gene on B03 chromosome in B.juncea.It was found that highly repetitive sequences are present in the area with yellow seed B03,A03,and A09.
Brassicajuncea;yellow seed coat gene;B03 chromosome;BAC contig
2016-03-07
徐海鹏(1991-),男,硕士研究生,Email:315214941@qq.com。*通信作者:刘忠松,博士,教授,Email:zsliu48@sohu.com。
国家自然科学基金(30471098)。
S565.403.2
A
1001-5280(2016)04-0353-06
10.16848/j.cnki.issn.1001-5280.2016.04.02

