肺灌注显像联合细胞因子预测放射性肺炎的临床研究
连相尧 梁云微 胡潺潺 李爱科 李青山
[摘 要] 目的:观察肺癌患者放疗前后肺灌注显像及放疗前血浆中IL-6、TGF-β1、ACE含量变化,探讨其与放射性肺炎发生的相关性。方法:30例肺癌患者接受三维适形放疗,放疗前后行肺灌注显像检查,比较前后两次肺灌注显像变化。放疗前采血冻存,采用酶联免疫吸附法检测血液中IL-6、TGF-β1、ACE含量。放射性肺炎根据美国肿瘤放射治疗组(RTOG)标准评定。分析治疗前后肺灌注显像变化情况及血浆IL-6、TGF-β1、ACE水平与放射性肺炎发生的相关性。结果:30例肺癌患者中10例(33.3%)发生了≥2级放射性肺炎。肺灌注受损加重者≥2级放射性肺炎发生率为63.6%,肺灌注受损改善者≥2级放射性肺炎发生率为10.5%,差异有统计学意义。放疗前血浆TGF-β1水平高者及ACE水平低者,放疗后出现≥2级放射性肺炎比率高。放疗前后肺灌注显像变化联合放疗前血浆TGF-β1水平分组,各组间发生2级以上放射性肺炎差异有统计学意义。结论:放疗前后肺灌注显像变化联合放疗前血浆TGF-β1水平对放射性肺炎有一定预测价值。
[关键词] 肺癌;放射性肺炎;肺灌注显像;细胞因子
中图分类号:R563.1 文献标识码:B 文章编号:2095-5200(2016)04-006-03
DOI:10.11876/mimt201604003
放疗是局部晚期肺癌主要治疗手段之一,放射性肺炎是胸部肿瘤放疗的主要剂量限制性副反应。据报道,接受放疗的肺癌患者,≥2级放射性肺炎发生率为5%~50%,即使采用适形放疗或调强放疗仍有8%~10%患者出现严重的放射性肺炎[1-2]。局部晚期肺癌患者往往肺功能状况不佳,出现放射性肺损伤更早,限制临床使用更高、更有效的照射剂量。因此,如何在有效的控制肿瘤的同时,减少严重放射性肺损伤的发生,是胸部放疗时关注的焦点问题。本研究拟通过观察患者行三维适形放疗前后肺灌注受损范围的变化,探讨肺灌注受损变化联合细胞因子对放射性肺炎发生的预测价值。
1 资料与方法
1.1 病例资料
选择2011年11月—2014年3月我院肿瘤科住院治疗的已确诊初治肺癌患者30例,入选条件:无胸腔和(或)心包积液,无血行转移。KPS评分≥70分,血常规、肝肾功能、心电图正常,1秒钟肺活量(FEVl)>预计值的50%。其中男22例,女8例,年龄45~70岁,中位年龄58岁;有吸烟史20例,无吸烟史10例;鳞癌13例,腺癌8例,小细胞癌9例;中央型22例,周围型8例。所有患者接受三维适形放疗。放疗后随访时间6个月,随访率100%。
1.2 方法
1.2.1 肺灌注显像方法 美国GE公司InfiniaVC HawKeye采用低能高分辨准直器的双探头单光子发射SPECT/CT仪。患者仰卧位,经肘正中静脉缓慢注射锝-99m(99mTc)标记的人血清大颗粒聚合白蛋白(MAA)200 MBq后即刻行肺灌注扫描,获得八个体位(前位、后位、左前斜、左后斜、右前斜、右后斜、左侧位、右侧位)的肺静态图像,矩阵128x128,20s采集1帧,180°采集,放大倍数1.0,最后获横断面、冠状面、矢状面的断层图像。
1.2.2 放疗计划及治疗方法 采用CT扫描模拟定位,医师以CT图像勾画大体肿瘤靶区(GTV),包括肺部原发灶和转移淋巴结,GTV外放1cm-1.6cm形成计划靶区(PTV)。物理师制订适形放疗计划。所有患者给予根治性放疗剂量56Gy-66Gy,中位剂量60Gy。95%等剂量曲线涵盖PTV,2Gy/次,5次/周。危及器官限制:肺V20≤30%,心脏V50≤40%,食管Dmax≤60Gy,脊髓Dmax≤45Gy。所有患者同步或序贯含铂类方案化疗2~4个周期。
1.2.3 肺灌注受损及放射性肺损伤评价 依据SPECT肺血流灌注图像,参考文献[3]分析方法,放疗前按缺损区与肿瘤病灶的大小关系分为0~3级。放疗后依据50%等剂量线在断层图像上勾画计算区域。按计算区域照射前后的肺灌注情况平均计数值占相应全肺平均计数值的百分比,比较照射前后肺灌注受损情况。从放疗开始至结束后6月内,根据RTOG对放射性肺炎(RP)进行分级,观察≥2级放射性肺炎发生情况。
1.2.4 血液细胞因子测定 采集所有受试者放疗前后清晨空腹外周静脉血。酶联免疫吸附实验法(ELISA)检测IL-6、TGF-β1、血管紧张素转化酶(Angiotcnsin Converting Enzyme,ACE)水平。
1.2.5 统计学方法 采用SPSS16.0软件进行统计学分析,均数比较采用独立样本t检验,RP发生率的比较采用χ2检验和Fishers精确概率法,P<0.05为有统计学差异。
2 结果
2.1 放疗前细胞因子水平检测结果
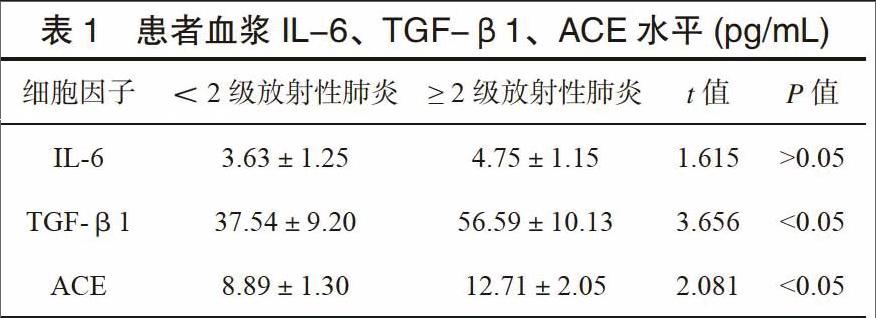
≥2级放射性肺炎组TGF-β1值高于<2级放射性肺炎组,血清ACE值低于<2级放射性肺炎组,两组间差异有统计学意义(P<0.05)。两组间IL-6值差异无统计学意义,见表1。
2.2 肺灌注受损发生情况及发生放射性肺炎影响因素
30例患者治疗前均表现出不同程度灌注受损,其中中央型肺癌患者肺灌注受损较为严重,>2级为77.27%(17/22),周围型肺癌>2级为25.0%(2/8)( χ2 =6.096,P=0.028)。
第两次肺灌注检查结果肺灌注受损改善者19例(63.3%),其余患者受损加重。根据放疗前后肺灌注缺损变化情况及TGF-β1水平分为3组:低危组肺灌注受损改善且TGF-β1≤56pg/mL;中危组受损改善且TGF-β1>56 pg/mL或受损加重且TGF-β1≤56 pg/mL;
高危组受损加重且TGF-β1>56 pg/mL。
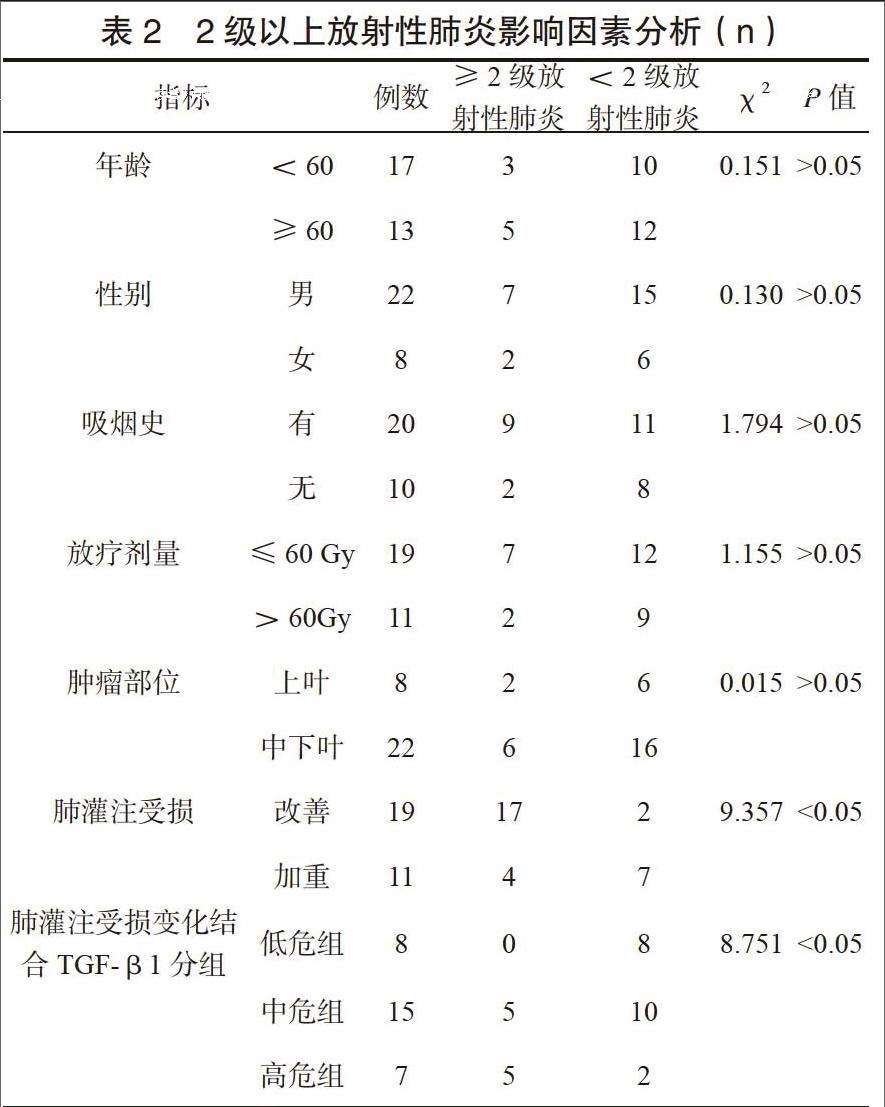
2级以上放射性肺炎发生率33.3%(10/30)。年龄、性别、病灶位置、有无吸烟史方面对其发生率影响无统计学意义,肺灌注受损加重与改善对≥2级放射性肺炎发生率影响,差异有统计学意义(P<0.05),肺灌注受损变化结合TGF-β1分组各组间发生2级以上放射性肺炎差异有统计学意义,见表2。
3 讨论
肺癌患者因放射治疗引起的主要副损伤包括急性放射性肺炎和放射性纤维化。目前,放射性肺损伤的诊断主要依靠症状及影像学检查,然而胸部CT及X线几乎不能发现早期放射性损伤。肺通气血流的变化通常在发生放射性肺炎前就会出现变化。肺灌注显像能显示肺组织血流灌注,可反映肺血流分布和受损情况[4]。Boersma等[5]发现肺灌注成像可以显示肺的充盈和缺损状态,和肺功能检查情况相似,且可用来估测肺损伤发生。Agrawal[6]研究也证实肺灌注显像对评价放疗前肿瘤对肺血流灌注功能的影响、局部肺功能及放疗引起的肺功能变化均较为敏感,并可在亚临床水平评估肺损伤情况。
本组结果显示放疗后肺灌注受损加重者放射性肺炎的发生率较改善者升高,差异有统计学差异。放疗前患者肺功能储备与放射性肺损伤的发生有一定相关性。当肺功能储备不足时对放射损伤的耐受力差,放射性肺损伤更易出现,并且更严重。放疗前肺灌注受损范围大者肺功能相对较差,放疗过程中出现肺功能损伤的几率也大[7]。
肺的放射性损伤由肺泡上皮细胞、巨噬细胞、内皮细胞以及成纤维细胞等多种细胞参与,研究表明促进成纤维细胞增殖分化、调节细胞外基质代谢、介导炎症反应和血管损伤及修复相关的因子(如IL-6、TNF-β1、ACE等)在放射性肺炎发生中扮演重要角色[8]。IL-6是一种炎性细胞因子,可在肺实质内的多种细胞中被合成分泌,检测血液的IL-6水平可用于判断肺组织的炎性状态。Aripin等[9]对96例实施三维适形肺癌患者观察发现放疗前IL-6水平与放射性肺炎的发生无明显相关性,放射性肺炎组放疗2周时的IL-6水平明显升高,IL-10水平降低,认为放疗前IL-6水平不能很好地预测放射性肺炎的发生,但其放疗过程中的变化可能对预测放射性肺炎有一定价值。TGF-β1是一种多效性细胞因子,具有诱导细胞增殖、分化、凋亡和炎症等生物学效应,能诱导结缔组织的胶原形成,并减低其分解,导致纤维化。TGF-β1已经被证实与肺组织损伤高度相关,Boothe等[10]发现放疗前及放疗中血浆TGF-β1水平与有症状放射性肺炎的发生呈正相关,TGF-β1升高可以预测放射性肺炎。ACE可影响很多生理过程,肺毛细血管是体内最大血管床,血液循环中ACE多来源于肺内皮细胞。当肺受到照射后,肺毛细血管内皮细胞受损,抑制了ACE合成[11]。赵路军等[12]报告了肺照射后导致血清ACE浓度的下降,进一步表明ACE浓度的降低可能与放射性肺炎发生相关。本研究结果也发现放疗前ACE水平低者发生放射性肺炎的概率也高,血浆ACE水平有希望作为放射性肺炎易感性的预测指标。笔者将功能影像(放疗前后肺灌注缺损变化)与生物指标 (TGF-β1、ACE)分别结合后进行统计学分析,发现肺灌注缺损变化和TGF-β1组合是放射性肺炎最佳的预测因素。肺灌注受损改善者且疗前TGF-β1≤56 pg/mL没有1例发生严重的放射性肺炎,肺灌注受损加重者且疗前TGF-β1>56 pg/ml有71.4%发生≥2级放射性肺炎。
总之,本研究结果提示放疗前后肺灌注显像变化以及血浆TGF-β1、ACE水平,可预测放射性肺损伤的发生。肺灌注显像与血浆TGF-β1结合有望作为预测放射性肺炎发生指标。但本研究的样本量较少,其预测价值还需要进一步研究验证。
参 考 文 献
[1] Mehta V.Radiation pneumonitis and pulmonary fibrosis in non-small-cell lung cancer: pulmonary function, prediction, and prevention[J]. Int J Radiat Oncol Biol Phys ,2005,63(1): 5-24.
[2] Marks LB, Yu X, Vujaskovic Z, et al: Radiation-induced lung injury[J]. Semin Radiat Oncol , 2003,13(3): 333-345.
[3] Kim S, Kim HK, Kang DY,et al: Intra-operative sentinel lymph node identification using a novel receptor-binding agent (technetium-99m neomannosyl human serum albumin, 99mTc-MSA) in stage I non-small cell lung cancer[J]. Eur J Cardiothorac Surg , 2010,37(2): 1450-1456.
[4] GHAFOORI P, MARKS LB, VUJASKOVIC Z, et al. Radiation-induced lung injury. Assessment, management, and prevention[J]. Oncology (Williston Park, NY), 2008,22(1):37-47.
[5] BOERSMA LJ, DAMEN EM, DE BOER RW, et al. A new method to determine dose-effect relations for local lung-function changes using correlated SPECT and CT data[J]. Radiother Oncol, 1993, 29(2): 110-116.
[6] Agrawal S,Raj MK,Kheruka SC,et al.Utility of single photon emission computed tomography perfusion scans in radiation treatment planning of locally advanced lung cancers[J].Indian J Nucl Med, 2012,27(1):10-15.
[7] De Jaeger K,Seppenwoolde Y,B0ersma LJ,et a1.Pulmonary function following high-dose radiotherapy of non-small-cell lung cancer[J].Int J Radiat Oneol Biol Phys ,2003,55(5):1331-1340.
[8] Kong FM, Ao X, Wang L, Lawrence TS. The use of blood biomarkers to predict radiation lung toxicity: a potential strategy to individualize thoracic radiation therapy[J]. Cancer Control ,2008,15(2):140–150.
[9] Aripin D,Perol D,Blay JY.Early variations of circulating interleukin-6 and interleukin—10 levels during thoracic radiotherapy are predictive for radiation pneumonitis[J].J Clin Oncol,2005,23(24):8748-8756.
[10] Boothe DL, Coplowitz S, Greenwood E, et al. Transforming growth factor β1 (TGF-β1) is a serum biomarker of radiation induced fibrosis in patients treated with intracavitary accelerated partial breast irradiation: preliminary results of a prospective study[J]. Int J Radiat Oncol Biol Phys,2013,87(5):1030-1036.
[11] Kong FM, Ao X, Wang L, Lawrence TS. The use of blood biomarkers to predict radiation lung toxicity: a potential strategy to individualize thoracic radiation therapy[J]. Cancer Control, 2008,15(2):140-150.
[12] 赵路军.张雯杰,王绿化,等.肺灌注显像检查预测肺癌放射性肺损伤的价值[J].中华肿瘤杂志,2006,28(2):127-129.

