慢性乙型肝炎病毒感染女性孕晚期应用核苷(酸)类似物安全性的回顾性研究
李丽 易为 胡玉红 刘敏 万钢
100015 北京,首都医科大学附属北京地坛医院妇产科
·病毒病诊断与治疗·
慢性乙型肝炎病毒感染女性孕晚期应用核苷(酸)类似物安全性的回顾性研究
李丽易为胡玉红刘敏万钢
100015 北京,首都医科大学附属北京地坛医院妇产科
目的探讨慢性乙型肝炎病毒(hepatitis B virus,HBV)感染孕妇孕晚期应用抗病毒药物对母儿的安全性。方法利用医院电子病历系统回顾性收集首都医科大学附属北京地坛医院分娩的慢性HBV感染孕妇,根据孕妇孕28周后是否应用抗病毒药物分为用药组(孕晚期使用拉米夫定、替比夫定或替诺福韦)和对照组(孕期未使用任何抗病毒药物),比较两组孕妇妊娠并发症发生率,以及两组新生儿不良事件的发生率。结果共收集到符合条件孕妇4 018例,其中用药组1 045例(其中用拉米夫定487例、替比夫定556例、替诺福韦2例),对照组2 973例,两组孕妇剖宫产率相似(49.5% vs 51.7%P=0.306),围产期胆汁酸增高、羊水过多、羊水过少、产后出血、早产、羊水Ⅲ度粪染等并发症发生率相比均无统计学差异(P值均>0.05)。两组新生儿出生体重、身长、1 min Apgar评分差异均无统计学意义(3 390 g vs 3 389 gP=0.728;50.22 cm vs 50.20 cmP=0.577;9.96 vs 9.94P=0.168),新生儿畸形发生率无差异(1.5% vs 1.4%P=0.783)。拉米夫定及替比夫定两种药物相比,孕妇围产期胆汁酸增高、羊水过多、羊水过少、产后出血、早产、羊水Ⅲ度粪染等并发症发生率相比差异均无统计学意义(P值均>0.05)。结论孕晚期服用抗病毒药物不增加孕妇围产期并发症的发生率,未影响胎儿宫内发育,不增加新生儿畸形的发生率;抗病毒药物孕晚期使用对母儿基本安全;拉米夫定、替比夫定两组药物孕晚期使用安全性相当;尚需更长期、细致随访观察。
【主题词】肝炎病毒,乙型;核苷酸类;妊娠;安全性
Fundprograms:BeijingMunicipalScienceandTechnologyCommissionforthecategoryof“Capitalclinicalcharacteristicsappliedresearch” (Z141107002514131);BeijingHealthcareSystemforthe“High-levelTechnicalPersonnelTrainingProject” (2015-3-106);InitialResearchFund,BeijingDitanHosipital,CapitalMedicalUniversity(DTQH201407)
乙型肝炎病毒(HepatitisBvirus,HBV)感染是严重威胁人类健康的社会公共卫生问题。据世界卫生组织报道,全球约20亿人曾感染过HBV,3.5亿人为慢性HBV感染者[1,2],女性感染者约占41.6%-47.6%,妊娠女性中5%为慢性HBV感染者,其中50% 以上为乙肝e抗原(HepatitisBeantigen,HBeAg)[3,4]阳性。2006年我国流行病学调查显示我国的HBV感染率为7.18%,成为中等流行国家,估计有两千万慢性乙型肝炎患者[5,6]。
HBV的主要传播途径为:经血和血制品传播、母婴传播、经破损的皮肤和黏膜传播及性接触传播[7]。母婴传播是我国HBV传播的最重要途径,估计30%-50%的慢性HBV感染者来自母婴传播[8,9]。有研究显示影响HBV感染慢性化的重要因素是HBV感染的时间,宫内感染者几乎100%发展为慢性HBV携带者,新生儿期感染为90%[10, 11],而幼年期感染将来发展为肝硬化及肝细胞性肝癌的风险越高[12],因此,尽早干预HBV的母婴传播是预防乙型肝炎的重要环节。研究显示孕妇高HBV含量是母婴传播的高危因素[13-15],已有许多研究证实妊娠晚期服用抗病毒药物(拉米夫定、替比夫定)可有效地降低母亲血清HBVDNA水平,提高HBV母婴阻断成功率[15, 16-20]。
抗病毒药物为核苷(酸)类似物,会影响细胞核酸代谢,虽有一些研究证实孕晚期使用抗病毒药物安全有效,但尚缺乏大样本量的观察。本研究拟回顾性收集我院妇产科分娩的慢性HBV携带孕妇及新生儿,统计分析孕产妇及新生儿围产期不良事件发生率,了解孕晚期使用抗病毒药物的安全性。
1 资料与方法
1.1病例收集查询医院病例信息系统(HIS),回顾性收集2009年1月-2013年11月在首都医科大学附属北京地坛医院分娩的慢性HBV感染孕妇。根据孕妇妊娠28周后是否服用抗病毒药物,分为用药组(孕晚期服用拉米夫定、替比夫定或替诺福韦)和对照组(孕晚期未使用抗病毒药物)。
病例入选标准:①孕妇HBsAg持续阳性大于半年,HBVDNA阳性;②不合并甲型肝炎、丙型肝炎、戊型肝炎、梅毒、艾滋、巨细胞病毒、EB病毒等其他病原学感染;③孕早期及中期胎儿畸形筛查未发现异常;④ 单胎妊娠;⑤非肝硬化孕妇。该研究经首都医科大学附属北京地坛医院伦理委员会讨论批准。
1.2观察指标比较2组孕妇围产期各种妊娠并发症的发生率,比较2组新生儿分娩时间、出生体重、身长、1minApgar评分、新生儿畸形发生率,探讨孕晚期使用抗病毒药物对孕产妇及新生儿的安全性。同时对比孕晚期使用拉米夫定和替比夫定2种药物对孕妇及新生儿的影响。
1.3统计学方法定量指标用均数±标准差表示,采用t检验。定性指标以百分率表示,采用卡方检验;所有统计学分析经SPSS17.5统计学分析软件完成。P< 0.05定义差异有统计学意义。
2 结果
2.1孕晚期使用抗病毒药物对妊娠结局的影响
2.1.1孕晚期用药及不用药两组孕妇基线情况: 从我院信息系统共收集符合条件且资料完整孕妇共4 018例,其中用药组1 045例(其中用拉米夫定487例、替比夫定556例、替诺福韦2例),对照组2 973例,两组孕妇基线情况如表1。由表可知,两组孕妇年龄、丙氨酸氨基转移酶(Alanineaminotransferase,ALT)基线水差异平均无统计学意义。
2.1.2孕晚期使用抗病毒药物对母儿妊娠结局的影响:两组孕妇及新生儿围产期不良事件发生情况见表2。由表2可知,两组孕妇分娩前ALT水平、凝血酶原活动度(Prothrombintimeactivity,PTA)正常,相比亦无显著性差异。两组孕妇剖宫产率以及产后出血、羊水过多、羊水过少等各种围产期并发症的发生率均无统计学差异。两组新生儿出生时分娩孕周、出生体重、身长、新生儿畸形率、1minApgar评分及性别比均无明显差异。
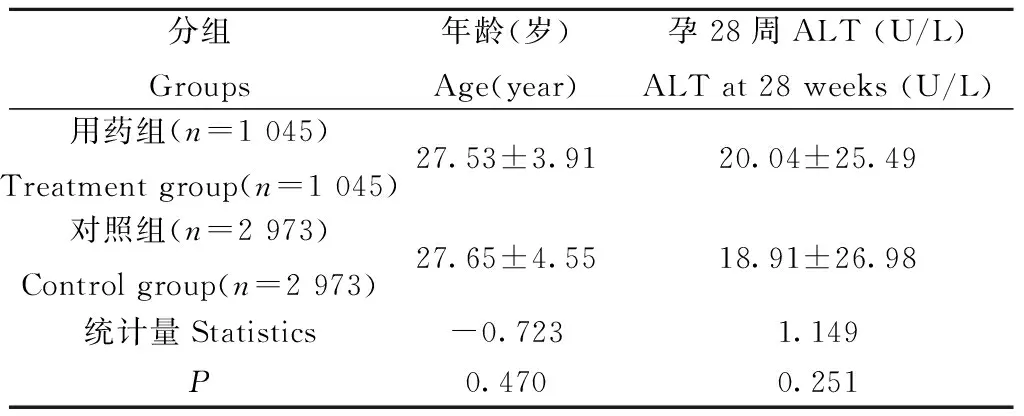
表1 两组孕妇孕28周基线情况
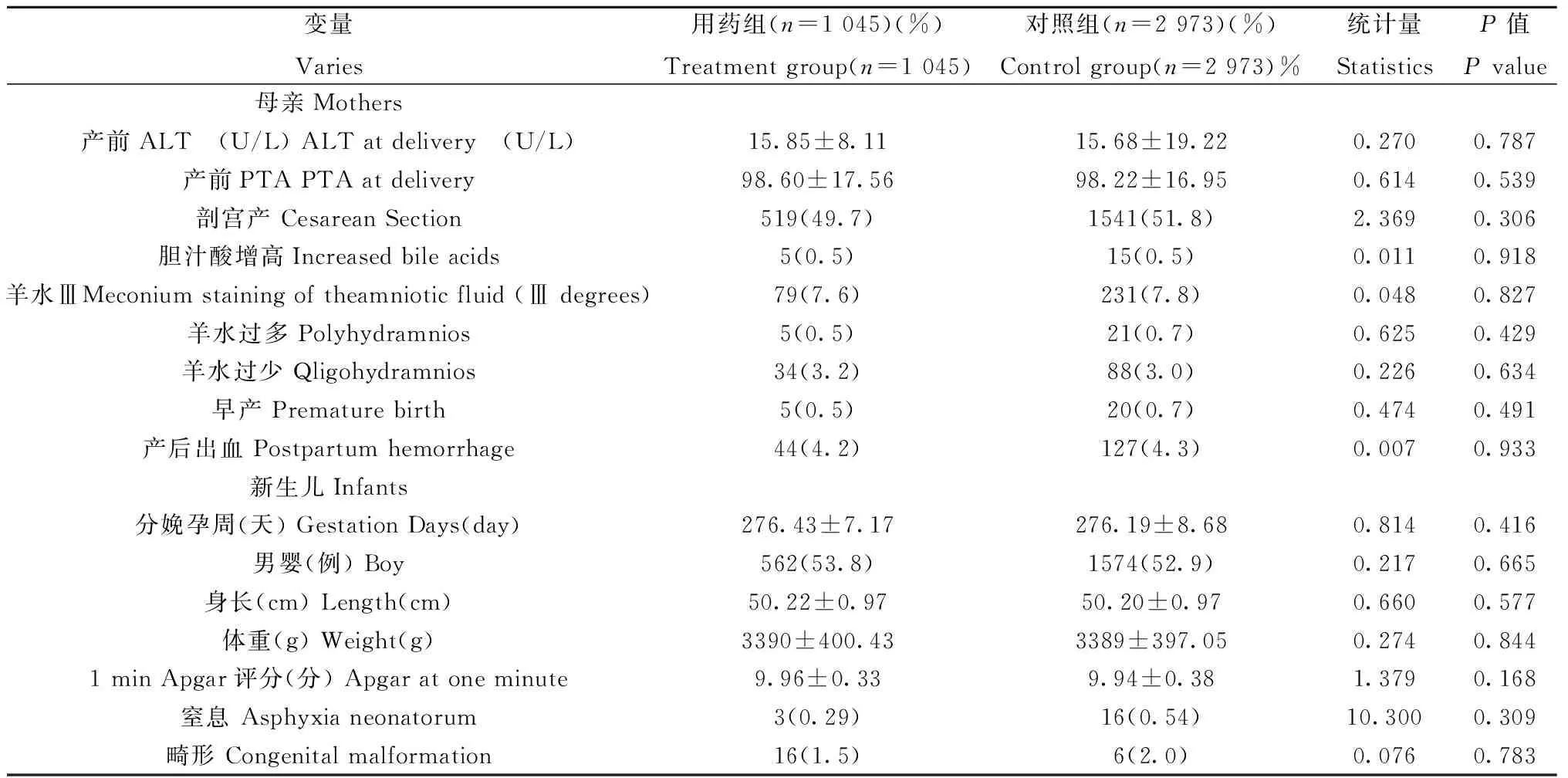
表2 两组孕妇及新生儿妊娠结局
2.2两种不同抗病毒药物对妊娠结局的影响2.2.1使用两种不同抗病毒药物孕妇基线情况: 本研究中,孕晚期使用拉米夫定487例,使用替比夫定556例;由于使用替诺福韦孕妇仅2例,因此排除这2例孕妇。拉米夫定组和替比夫定组孕妇基线情况见表3。由表3可知,使用不同抗病毒药物的两组孕妇年龄、用药前ALT水平、均无显著性差异。2.2.2使用2种抗病毒药物两组孕妇妊娠结局对比: 使用拉米夫定和替比夫定2组孕妇妊娠并发症发生情况及新生儿情况见表4。由表4可知,两组孕妇分娩前ALT水平、剖宫产率及产后出血发生率有显著性差异,进一步比较替比夫定组与孕晚期未用药组孕妇,2组产后出血发生率差异无统计学意义(5.6% vs 4.3%,P=0.180)。两组孕妇孕晚期胆汁酸增高、羊水Ⅲ度粪染、早产、羊水过多、羊水过少发生率无差异。新生儿分娩孕周、性别比、出生身长、体重、1 minApgar评分、新生儿窒息、新生儿畸形情况两组相比均无显著性差异。
3 讨论
在我国,母婴传播是乙型肝炎最主要的传播途径[8,9],而孕妇高HBV含量是母婴传播的高危因素[10-12],已有许多研究证实妊娠晚期服用抗病毒药物(拉米夫定、替比夫定)可有效地降低母亲血清HBV DNA水平,提高HBV母婴阻断成功率[10, 13-20]。但孕晚期服用抗病毒药物对母儿的安全性如何,虽然在上述研究中均有涉及,但样本量均较少,其中最多的一项研究为孕晚期服用替比夫定,用药组为134例,对照组为88例。因此目前尚缺乏大样本的研究。本研究收集5年内我院分娩的所有符合条件的慢性HBV携带孕妇4 018例,其中用药组达1 045例;用药组中使用拉米夫定487例、替比夫定556例,样本量较大,结论有一定科学性。

表3 拉米夫定组和替比夫定组孕妇基线情况
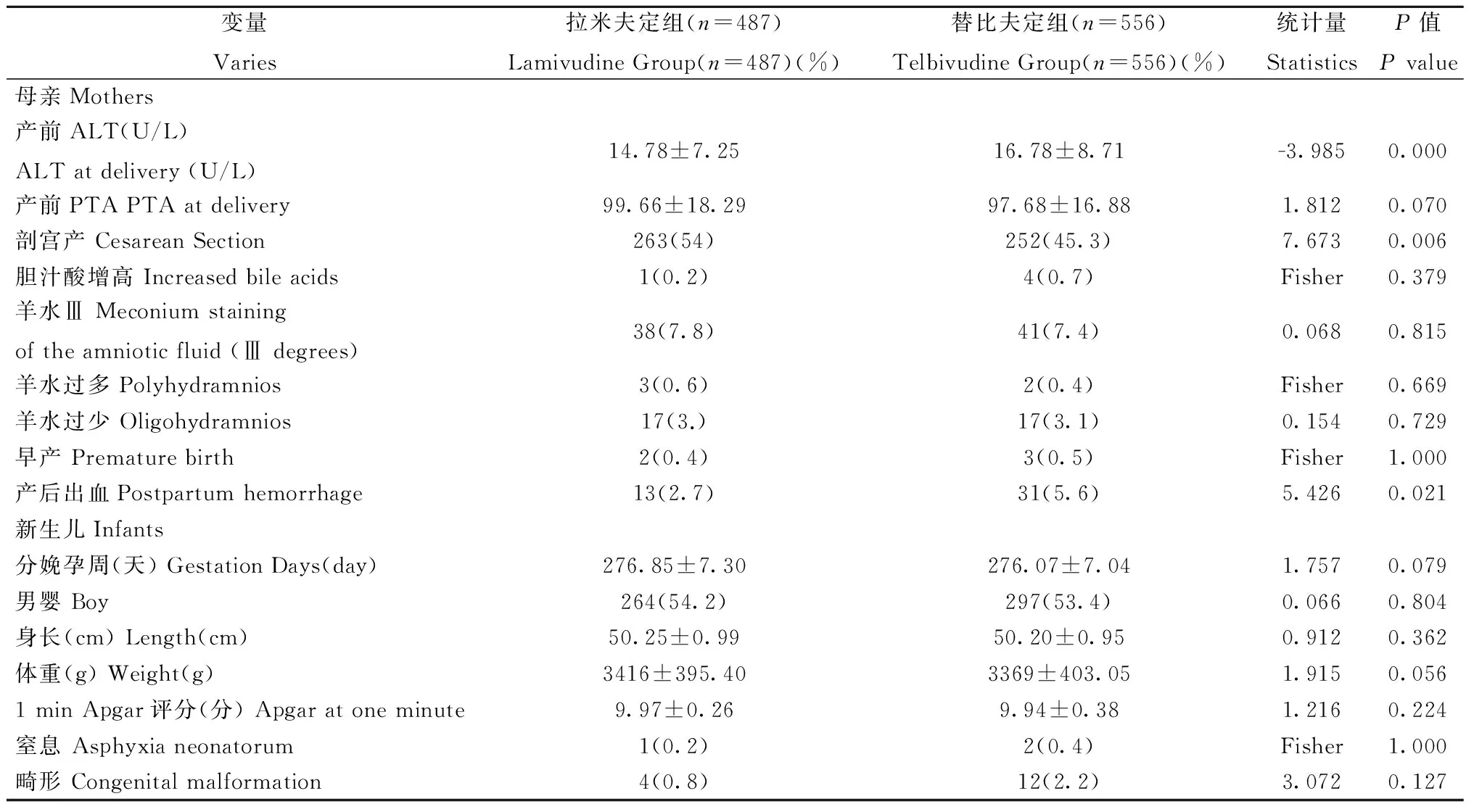
表4 使用拉米夫定和替比夫定两种抗病毒药物孕妇的妊娠结局
本研究显示,孕28周用药组及未用药组孕妇年龄、肝功能、凝血功能等基线情况相比无统计学差异,用药组孕妇在胆汁酸增高、产后出血、早产、羊水过多、羊水过少、羊水Ⅲ等孕期常见并发症的发生率与未用药组孕妇无统计学差异,两组孕妇分娩前ALT水平差异无统计学意义,提示孕晚期用药不增加孕产妇孕期并发症的风险。本研究未将妊娠期糖尿病纳入统计范围,因为妊娠期糖尿病在孕24-28周即做出诊断,而所有孕妇均未用药,所以其发生与是否用药无关。本研究未提出妊娠胆汁瘀积症发生率,而只统计妊娠胆汁酸增高,是因为在HBV感染孕妇,很难区分胆汁酸增高是妊娠胆汁瘀积症还是HBV活跃导致,因此本研究中未作区分。
进一步比较使用拉米夫定和使用替比夫定两组孕妇情况发现,两组孕妇剖宫产率存在差异,可能由于使用拉米夫定孕妇主要集中在收集病例的早期,当时剖宫产率较高,而使用替比夫定孕妇主要集中在收集病例的后期,由于近2年北京市控制剖宫产率的政策,导致其剖宫产率下降。两组孕妇分娩前ALT水平存在差异,其中替比夫定组ALT水平稍高于拉米夫定组,可能由于替比夫定抗病毒效果强于拉米夫定,导致有更多的孕妇在使用抗病毒药物初期出现肝功能异常有关,这也可能导致替比夫定组产后出血发生率亦高于拉米夫定组,但替比夫定组与未用药组孕妇相比,产后出血发生率无显著性差异。其他妊娠期合并症,如:孕晚期胆汁酸增高、羊水Ⅲ度粪染、早产、羊水过多、羊水过少等两组孕妇发生率无差异。以上结果提示两组药物孕晚期选择对孕妇基本安全。
本研究中,用药组与未用药组新生儿出生体重、身长、1 min Apgar评分、新生儿畸形发生率均无统计学差异,提示孕晚期用药不影响新生儿宫内生长发育,不增加新生儿畸形风险,孕晚期使用抗病毒药物对新生儿基本安全。进一步比较使用两种不同抗病毒药物所生新生儿情况,亦发现两组新生儿出生体重、身长、1 min Apgar评分、新生儿畸形发生率均无统计学差异,提示拉米夫定、替比夫定两种药物孕晚期使用对新生儿的安全性相当。但抗病毒药物对新生儿的影响可能是长期的,因此今后还需进一步延长对这部分婴儿的观察期,进行更为细致的观察,包括智力发育等,做到长期随访。
[1]Ganem D,Prince AM. Hepatitis B virus infection—natural history and clinical Consequences[J]. N Engl J Med,2004,350(11):1118-1129. doi:10.1056/NEJMra031087
[2]Organization WH. Hepatitis B. World Health Organization Fact Sheet 204 dex. (Revised October 2000). WHO Web site. http://www.who.int/mediacentre/factsheets/fs204/en/in html.
[3]Leung N. Chronic hepatitis B in Asian women of childbearing age[J].Hepatol Int, 2009,3(Suppl 1):24-31. doi:10.1007/s12072-009-9142-1
[4]Petrova M,Kamburov V. Breastfeeding and chronic HBV infection: clinical and social implications[J].World J Gastroenterol,2010,16(40): 5042-5046. doi:10.3748/wjg.v16.i40.5042.
[5]Liang X,Bi S,Yang W,et al. Epidemiological serosurvey of hepatitis B in China—declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine,2009,27(47):6550-6557. doi:10.1016/j.vaccine.2009.08.048.
[6]Lu FM,Zhuang H. Management of hepatitis B in China[J]. Chin Med J (Engl),2009,122(1):3-4.
[7]European Association For The Study Of The Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection[J]. J Hepato,2012,57(1): 167-185.doi:10.1016/j.jhep.2012.02.010.
[8]Lee AK,Ip HM,Wong VC. Mechanisms of maternal-fetal transmission of Hepatitis bB virus[J]. J Infect Dis,1978,138(5):668-671. doi: 10.1093/infdis/138.5.668.
[9]Alvarez-Munoz MT,Vazquez-Rosales JG,Torres-Lopez FJ,et al. Infection of pregnant women with hepatitis B and C viruses and risks for vertical transmission[J].Arch Med Res,1997,28(3):415-419.
[10]骆抗先. 乙型肝炎基础与临床[M]. 北京:人民卫生出版社, 1997: 233.
[11]谢新宝,朱启. 乙型肝炎病毒母婴传播和预防研究进展[J]. 国外医学(儿科学分册),2004,31(5):225-227. doi:10.3760/cma.j.issn.1673-4408.2004.05.001.
[12]Centers for Disease Control and Prevention (CDC). Hepatitis B vaccination among high-risk adolescents and adults—San Diego, California, 1998-2001[J]. MMWR Morb Mortal Wkly Rep,2002,51(28): 618-621.
[13]Xu WN,Cui YT,Wang L,et al. Lamivudine in late pregnancy to prevent perinatal transmission of hepatitis B virus infection: a multicentre,randomized, double-blind,placebo-controlled study[J]. J Viral Hepat,2009,16(2): 94-103.doi: 10.1111/j.1365-2893.2008.01056.x
[14]Wiseman E,Fraser MA,Holden S,et al. Perinatal transmission of hepatitis B virus: an Australian experience[J]. Med J Aust,2009,190(9): 489-492.
[15]Zou H,Chen Y,Duan Z,et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers [J].Journal of Viral Hepatitis,2012,19(2),e18-e25. doi:10.1111/j.1365-2893.2011.01492.x
[16]Han L, Zhang HW, Xie JX, et al. A meta-analysis of lamivudine for interruption of mother-to-child transmission of hepatitis B virus[J]. World J Gastroenterol 2011,17(38): 4321-4333. doi:10.3748/wjg.v17.i38.4321.
[17]van ZM,van NAB,Niesters HG,et al. Lamivudine treatment during pregnancy to prevent perinatal transmission of hepatitis B virus infection[J].J Viral Hepat,2003,10(4): 294-297. doi:10.1046/j.1365-2893.2003.00440.x
[18]韩忠厚,陈妍华,李力玮,等. 拉米夫定阻断乙型肝炎病毒母婴垂直传播的疗效和安全性观察[J].中华内科杂志,2005,44(5):378. doi:10.3760/j.issn:0578-1426.2005.05.018.
[19]李文凡,姜瑞,卫峥,等. 拉米夫定阻断慢性HBV感染孕妇母婴传播的临床效果和安全性[J].肝脏,2006,11(2):106-107. doi:10.3969/j.issn.1008-1704.2006.02.012.
[20]冯慧芬, 张淑凤. 拉米夫定阻断乙型肝炎病毒母婴传播的作用[J]. 实用儿科临床杂志,2007,22(13):1019-1020. doi:10.3969/j.issn.1003-515X.2007.13.029.
Retrospective study of the security about nucleoside analogues to chronic Hepatitis B virus infected women in late pregnancy
LiLi,YiWei,HuYuhong,XieYao,LiuMin,WanGang
DepartmentofObstetricsandGynecology,BeijingDitanHosipital,CapitalMedicalUniversity,Beijing100015,China
YiWei,Email:yiwei1215@163.com
ObjectiveTodiscussthesecurityofnucleosideanaloguestopregnantwomenwithchronicHepatitisBvirus(HBV)infectioninlatepregnancy.MethodsPregnantwomenwithchronicHBVinfectionwhodeliveredintheBeijingDitanHospitalwereretrospectivelycollectedthroughthehospitalinformationsystem(HIS).Theyweredividedintotwogroupsaccordingtowhetherusingnucleosideanaloguesafter28weeksofgestation:treatmentgroup(lamivudine,telbivudineortenofovirused)andcontrolgroup(nodrugused).Theincidenceofpregnancycomplicationsandneonataladverseeventswerecomparedbetweenthetwogroups.ResultsTotalof4 018pregnantwomenmettherequirementswerecollected, 1 045intreatmentgroup, 2 973incontrolgroup.Intreatmentgroup, 487casesusedlamivudine, 556casesusedtelbivudineand2casesusedtenofovir.Thecesareandeliveryrateofthetwogroupsaresimilar(49.5%vs51.7% P=0.306).ThereisnosignificantdifferenceinpregnancycomplicationsincludingperinatalIncreasedbileacid,polyhydramnios,oligohydramnios,postpartumhemorrhage,prematuredeliveryandⅢdegreeamnioticfluiddung(P >0.05).Andthereisnosignificantdifferenceinnewbornbirthweight(3390gvs3 389gP=0.728),bodylength(50.22cmvs50.20cmP=0.577),thefirstminuteapgarscore(9.96vs9.94 P=0.168)andtheincidenceofbirthdefects(1.5%vs1.4% P=0.783)betweenthetwogroups.Furthermore,thedifferencesofincidenceofpregnancycomplicationsandneonataladverseeventsarecomparedbetweenthelamivudinegroupandtelbivudinegroup.Itshowsnosignificantdifference.ConclusionUsingnucleosideanaloguesinlatepregnancydosenotincreasetheincidenceofpregnancycomplicationsandbirthdefects,dosenotaffectfetusdevelopmentintrauterinely.Theyaregenerallysecuretomotherandfetus.Thesafetyoflamivudineandtelbivudineinlatepregnancyisapproximatelythesame.While,long-term,carefulfollow-upobservationsarestillneeded.
HepatitisBvirus;Nucleosides;Pregnancy;Security
易为,Email:yiwei1215@gmail.com
10.3760/cma.j.issn.1003-9279.2016.04.014
北京市科委首都临床特色应用课题(Z141107002514131);北京市卫生系统高层次卫生人才项目(2015-3-106);首都医科大学附属北京地坛医院院内科研基金“启航计划”项目(DTQH201407)
(2016-02-26)

