猪流行性腹泻病毒间接ELISA检测方法的建立
孟 琼,孔 宁,单同领,吴永光,左叶雯,童 武,郑 浩,李国新,于 海,童光志,徐永杰
(1. 信阳师范学院,信阳 464000;2.中国农业科学院上海兽医研究所,上海200241)
·研究论文·
猪流行性腹泻病毒间接ELISA检测方法的建立
孟 琼1,2,孔 宁2,单同领2,吴永光2,左叶雯2,童 武2,郑 浩2,李国新2,于 海2,童光志2,徐永杰1
(1. 信阳师范学院,信阳 464000;2.中国农业科学院上海兽医研究所,上海200241)
本研究获得5个猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)S1基因截短基因,原核表达后制备多克隆抗体。酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)、Western blot 和间接免疫荧光检测(indirect immunofl uorescence assay,IFA)显示,仅有SE蛋白诱导的多克隆抗体具有免疫活性。因此以SE蛋白为抗原建立间接ELISA抗体检测方法,优化各反应参数并确定临界值为0.155。经特异性和符合性分析,该ELISA检测方法具有PEDV特异性,符合率为93.7%。批内、批间重复率变异系数均小于10%,表明建立的iELISA方法重复性良好。抗S蛋白的ELISA检测方法的建立为PEDV血清学抗体检测和疫苗评估奠定了基础。
间接ELISA;猪流行性腹泻病毒;截短S蛋白
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)感染引起的一种急性、高度接触性肠道传染病,以呕吐、水样腹泻、脱水和哺乳仔猪高致死率为主要特征[1]。自2010年以来,PED以仔猪高病发率和死亡率给中国养猪业造成严重经济损失,是当前仔猪腹泻死亡的重要病因之一[2]。因此,PEDV诊断技术的研究具有重要的意义。
PEDV为冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)中 I 群成员[3]。S蛋白是冠状病毒属成员最重要的一个表面囊膜糖蛋白,形成病毒粒子表面特征性的冠状结构。比较S蛋白S1和S2亚基之间GxCx及保守九聚体同源性,S蛋白被划分为S1(第1~789位氨基酸)和S2(第790~1383位氨基酸)两个功能区[4],其中S1区包含多个病毒主要中和表位和受体结合域[5]。
Ren等[6]利用PEDV M 蛋白的单克隆抗体建立了竞争阻断ELISA诊断方法。Hou等[7]利用PEDV重组N蛋白抗原建立了间接ELISA方法。Oh等[8]用病毒全蛋白为包被抗原建立了ELISA方法,该方法与中和试验符合率达到84.2%。本研究以S1蛋白作为靶蛋白,将其分为5个相互重叠的片段,通过原核表达系统高效表达各截短蛋白,制备多克隆抗体,确定S1免疫活性区,并以PEDV S1区具有免疫活性的SE蛋白(666~789 aa)为抗原建立了间接ELISA检测方法。
1 材料和方法
1.1病毒、细胞及血清 PEDV强毒株JS-2013由本实验室分离并保存(JS-2013为PEDV变异株,从江苏省某猪场爆发变异PEDV的1~5日龄腹泻仔猪的小肠和内容物中分离得到);Vero细胞由本实验室保存;猪伪狂犬病毒(Porcine pseudorabies virus,PRV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)及PEDV阴阳性血清均由本实验室保存。
1.2试剂及试剂盒 pCold TF表达载体和BL21 (DE3)宿主菌为本试验室保存;BamHⅠ限制性内切酶、Ex Taq DNA聚合酶、dNTP、In-Fusion HD Cloning Kit 均购自TaKaRa公司;蛋白定量试剂盒PierceTMBCA Protein Assay Kit购自Thermo公司;6周龄雌性BALB/c鼠购自上海灵畅生物科技有限公司;弗氏完全佐剂(FCA)和弗氏不完全佐剂(FICA)、四甲基联苯胺(TMB)、HT 混合盐、HAT 混合盐和HRP 标记羊抗鼠IgG 、FITC羊抗鼠IgG均购自Sigma公司;DMEM 培养基购自Gibco公司;Nickel magnetic beads for protein purification蛋白纯化试剂盒购自Biotool公司。
1.3蛋白的原核表达与纯化 通过DNAStar软件分析,将S1基因截短为5个相互重叠的基因片段SA、SB、SC、SD和SE,以实验室构建的包含S1基因的重组质粒为模板进行PCR扩增,测序正确的目的片段与表达载体pCold TF经BamHⅠ酶切,连接转化至BL21感受态中,阳性菌液经0.5%IPTG诱导表达,使用Nickel magnetic beads for protein purification蛋白纯化试剂盒纯化表达的各目的蛋白,并用PierceTMBCA protein assay kit蛋白定量试剂盒测定其浓度,保存于-80℃备用。
1.4多克隆抗体的制备与特异性鉴定
1.4.1多克隆抗体的制备 以纯化的SA、SB、SC、SD和SE重组蛋白为抗原,分别对6周龄雌性BALB/ c小鼠进行注射免疫。初次免疫,重组蛋白抗原0.5 mg/mL与等量弗式完全佐剂乳化混合,腹部皮下多点注射200 μL;此后每2周免疫1次,加等量弗氏不完全佐剂;三免后,小鼠眼球采血,分离血清于-20℃保存。
1.4.2多克隆抗体效价测定 以纯化的SA、SB、SC、SD和SE重组蛋白为抗原分别包被ELISA板,以对照组小鼠血清为阴性对照,通过间接ELISA检测方法测定三免后小鼠的抗体效价水平,并结合Western blot与间接免疫荧光(indirect immunofluorescence assay,IFA)检测方法,鉴定免疫小鼠血清的免疫原性。
1.5间接ELISA检测方法的建立
1.5.1间接ELISA反应条件的优化 用方阵滴定法确定ELISA各个试验条件。阳性血清OD450(P)与阴性血清OD450(N)的比值(P/N值)最大孔所对应的反应条件为最佳反应条件。具体的试验步骤按常规的ELISA程序进行[7]。
1.5.2间接ELISA检测方法临界值的确立 根据优化的ELISA检测方法对实验室已知背景的PEDV阴性血清样品进行检测,计算检测样品的平均值(x)和标准差(s)[9]。
1.5.3特异性、符合率分析 在相同条件下对PRV和TGEV阳性血清进行检测,同时设置PEDV的阴阳性血清对照。用优化的间接ELISA检测已知背景的猪血清,对比检测结果,计算间接ELISA抗体检测方法的符合率。总符合率(100%)=[(阳性数+阴性数)/检测总数]×100%
1.5.4间接ELISA重复性试验 批内重复试验:从同批次包被酶标板中随机抽取3块,检测已知背景的猪血清样品6份,统计检测结果,计算批内变异系数。批间重复试验:用3块不同批次包被的酶标板同时检测上述血清样品,统计检测结果,计算批间变异系数[9]。
2 结果
2.1基因扩增及重组质粒的构建 截短的5个片段SA、SB、SC、SD、SE基因大小分别为609、573、654、630、369 bp。运用Primer Premier 5.0设计各基因引物(表1)。测序正确的pCold TF-SA~SE重组质粒经限制性内切酶BamHⅠ酶切后,可见约5700 bp的载体片段和400~600 bp目的基因片段,大小与预期相符(图1)。

表1 SA、SB、SC、SD和SE基因引物Table 1 Primers for SA, SB, SC, SD and SE gene

图1 SA、SB、SC、SD和SE重组表达质粒酶切鉴定Fig. 1 Enzyme-digested products of the fragments SA,SB, SC, SD and SE
2.2蛋白诱导表达和纯化 测序正确的pCold TFSA~SE菌液经IPTG诱导8 h后,取菌体超声破碎,收集上清,纯化表达的各目的蛋白。将纯化后的SA、SB、SC、SD和SE蛋白进行SDS-PAGE电泳检测(图2)。
2.3多克隆抗体效价测定 取三免后的小鼠血清进行ELISA抗体效价检测,结果表明SA、SB、SC和 SD组的抗体效价均低于1.0×103,而SE组抗体水平达到1.0×105,表明SE蛋白具有较好的免疫原性(图3)。
PEDV感染Vero细胞后,Western blot检测细胞中的S蛋白(图4),IFA检测Vero细胞中的病毒(图5)。结果显示,SE组的小鼠血清中的多克隆抗体具有免疫原性。
2.4间接ELISA的建立及反应条件的优化 确定以SE蛋白为包被抗原建立间接ELISA检测方法,运用方阵滴定法确定并优化了ELISA检测方法的条件。将纯化好的SE蛋白用碳酸盐溶液包被,包被浓度为100 ng/孔,37℃孵育1 h,PBST洗3次,每次5 min;5% SMP封闭 200 μL/孔,常温孵育1.5 h,PBST洗涤(方法同上);一抗1:50稀释常温孵育1 h,PBST洗涤;二抗1:10 000稀释后,37℃孵育30 min,PBST洗涤;50 μL/孔TMB显色,常温显色15 min,加硫酸终止液50 μL/孔终止反应,OD450值测定。
2.5间接ELISA临界值的确立 选取实验室已知背景的32份PEDV阴性血清样品进行ELISA检测。统计结果显示:平均值为0.100,标准差为0.018。按照间接ELISA临界值标准,该检测方法的临界值如下:当OD450≥X+3SD=0.155时,可判定为阳性;OD450≤X+2SD=0.137时,可判定为阴性;介于两者之间为可疑血清(表2)。
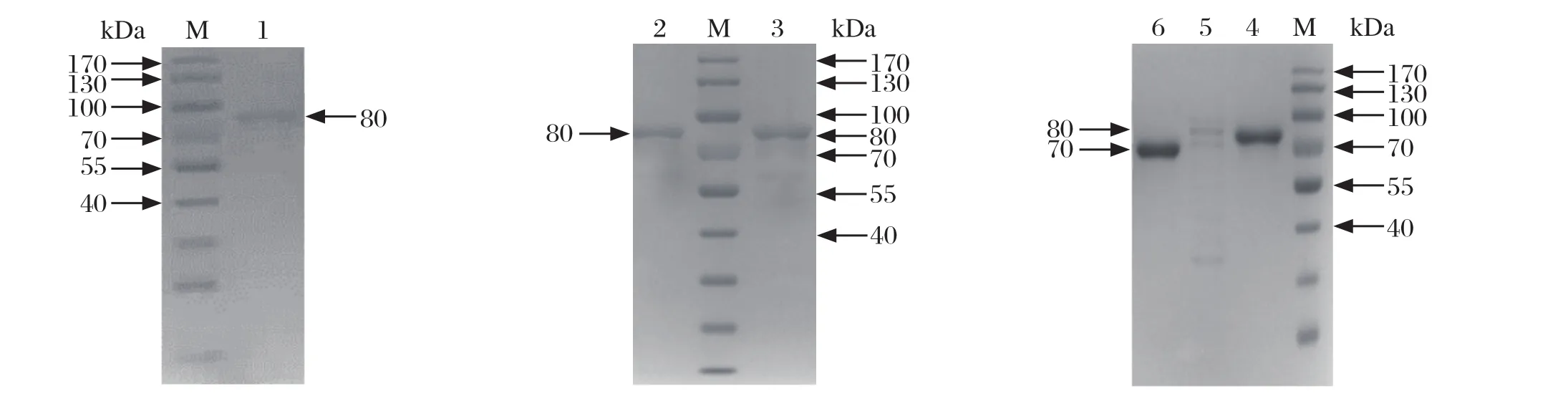
图2 SA、SB、SC、SD和SE蛋白纯化结果Fig. 2 Purifi cation of proteins SA, SB, SC, SD and SE
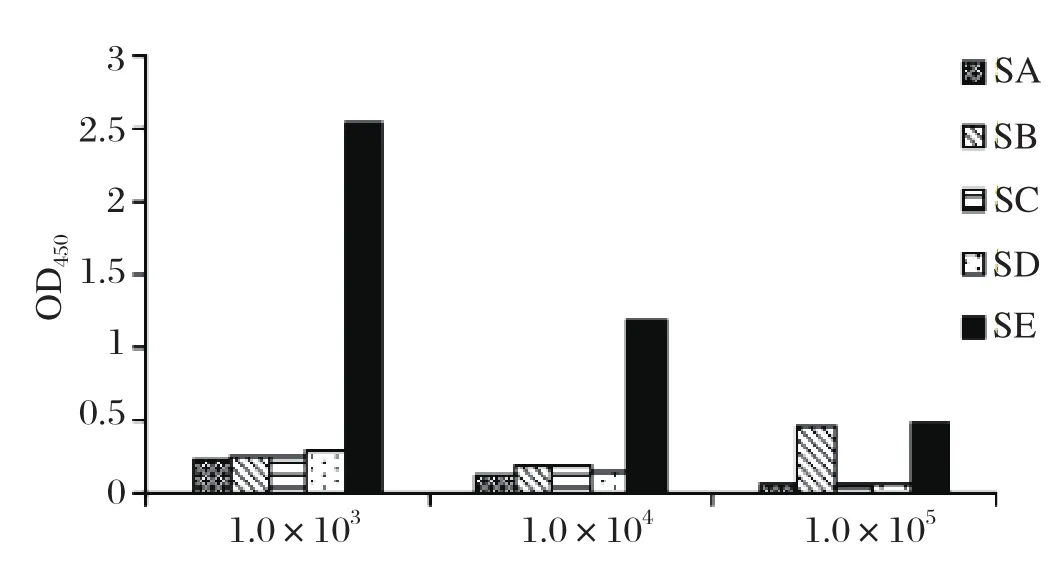
图3 SA、SB、SC、SD、SE蛋白多克隆抗体效价Fig. 3 Titer of polyclonal antibody to SA, SB, SC, SD, SE protein

图4 多克隆抗体的Western blot鉴定Fig. 4 Western blot analysis of polyclonal antiserum
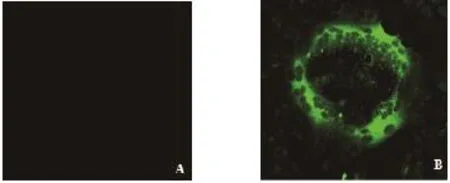
图5 PEDV感染Vero细胞的间接免疫荧光检测Fig. 5 Immunofl uorescence analysis of PEDV in Vero cell
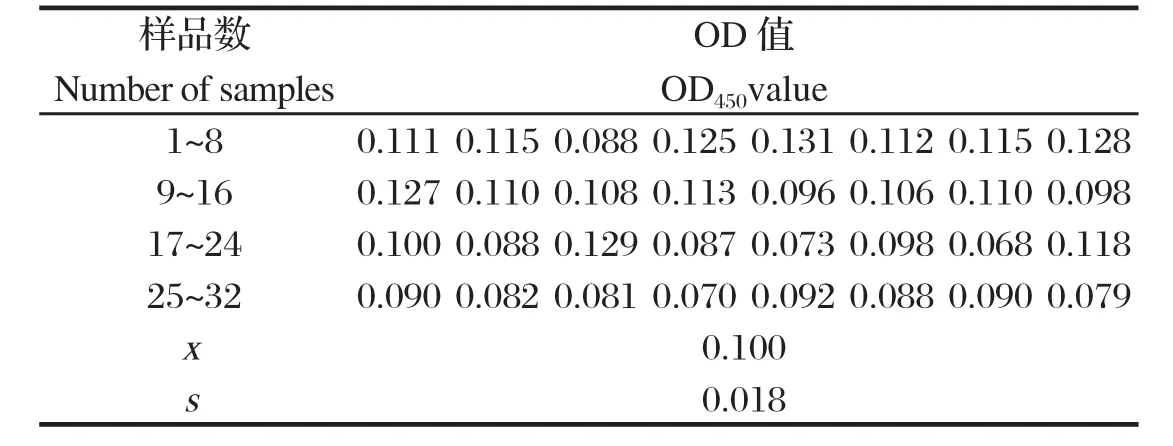
表2 32份PEDV阴性血清的ELISA检测结果Table 2 ELISA results of 32 PEDV negative serum samples
2.6特异性及符合性试验结果 利用建立的间接ELISA方法对PRV、TGEV及PEDV阴阳性猪血清进行检测,结果显示TGEV、PRV感染猪的阳性血清OD450值均小于0.137,为PEDV阴性,表明该间接ELISA方法具有较好的特异性。
用已经建立的间接ELISA方法对64份已知背景的血清样品进行检测,结果显示阳性样品32份均检测为阳性,阴性样品32份中28份为阴性,4份为可疑,计算符合率结果为93.7%。
2.7重复性试验结果 批内重复试验变异系数为1.4%~8.3%(表3),批内重复变异系数为2.1%~7.8%(表4),均未超过10%,表明该间接ELISA方法具有良好的重复性。
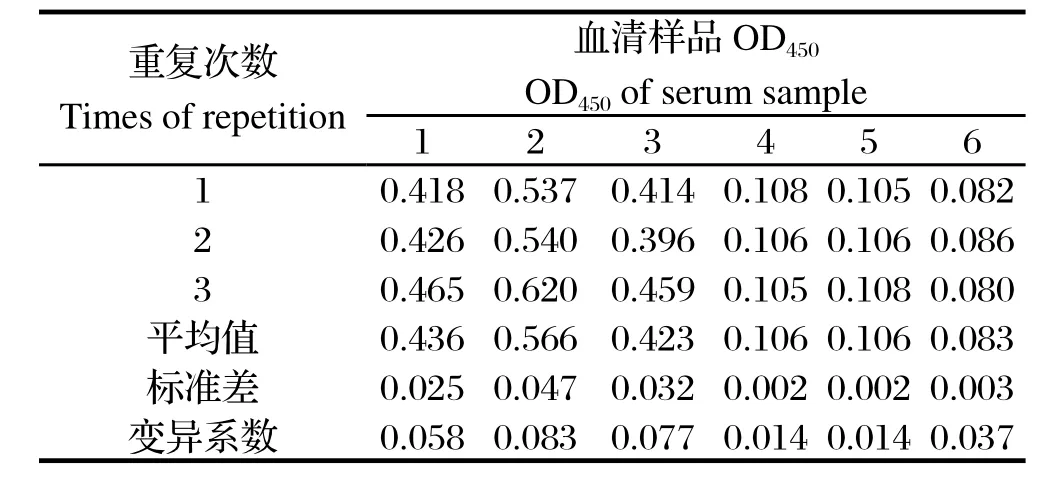
表3 批内重复性试验结果Table 3 The results of intra-assay repeat tests
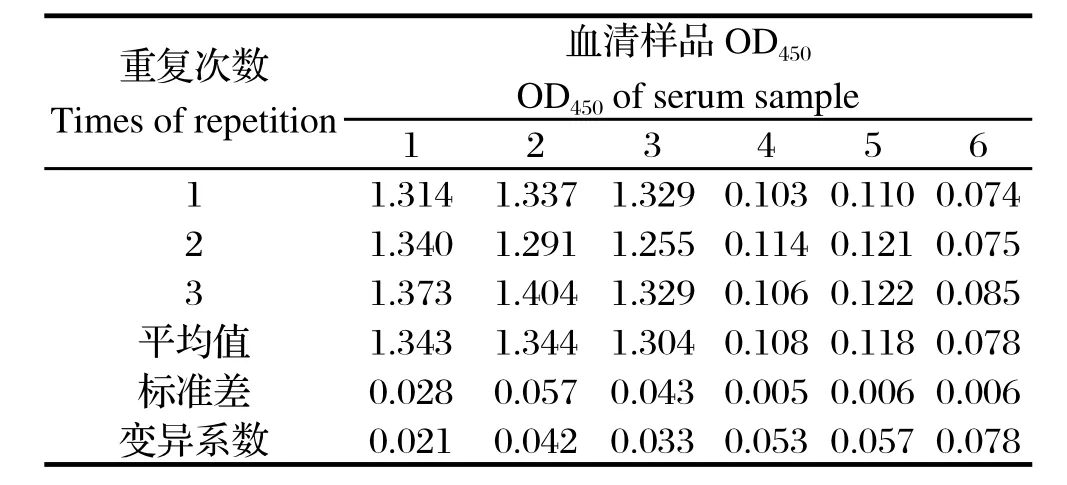
表4 批间重复性试验结果Table 4 The results of inter-assay repeat tests
3 讨论
目前,病毒中和试验是使用最广泛的PEDV抗体血清学检测方法,在疫苗接种后能高效特异性的测定抗体效价,但是该检测方法十分昂贵且操作复杂耗时。ELISA用于大分子抗原和特异性抗体检测,具有快速、灵敏、简便、载体易于标准化等优点,适用于临床应用。早期的间接ELISA方法选取的包被抗原为Vero细胞分离出的全病毒或细胞表达的病毒蛋白。由于免疫动物血清中含有细胞培养的PEDV,可能与细胞表达的ELISA包被抗原发生交叉反应,导致特异性低、背景高。因此,本研究采用原核表达的方法制备间接ELISA包被抗原,避免了细胞源的交叉反应。
PEDV是囊膜病毒,表面的囊膜糖蛋白在病毒侵入宿主细胞以及感染宿主体内介导中和抗体产生的过程中发挥决定性作用[3]。PEDV S蛋白的S1区包含病毒主要的中和抗原表位和受体结合域[10]。为精确定位间接ELISA包被抗原,本研究根据氨基酸的亲疏水性将S1区截短为SA(第1~340位氨基酸)、SB(第167~357位氨基酸)、SC(第321~789位氨基酸)、SD(第504~789位氨基酸)和SE(第666~789位氨基酸)5个片段,分别进行原核表达并制备多克隆抗体,经间接ELISA、Western blot及IFA检测对多抗特异性的筛选,确定了具有免疫活性的SE (666~789 aa)蛋白为抗原建立间接ELISA检测方法。通过对32份已知PEDV阴性血清的检测,确定了阴阳性临界值,为样品阴阳性判断提供依据。经特异性、符合率及重复率分析,表明本研究建立的ELISA方法具有较高的特异性和稳定性。
SE蛋白由123个氨基酸组成,位于S1D区(636~789 aa),该区在PEDV S蛋白S1区高度保守,且是中和表位区[11],因此,作为ELISA包被抗原,SE蛋白能更特异和准确与血清中的PEDV S蛋白多克隆抗体结合。本研究建立的间接ELISA方法为血清学抗体检测和流行病学研究、S1蛋白结构与功能的研究、抗原表位的鉴定及新型免疫学检测方法的研发奠定了基础。
[1] Jung K, Saif L. Porcine epidemic diarrhea virus infection: Etiology, epidemiology, pathogenesis and immunoprophylaxis[J]. Vet J (London, England : 1997),2015, 204(2): 134-143.
[2] Li W, Li H, Liu Y, et al. New variants of porcine epidemic diarrhea virus, China, 2011[J]. Emerg Infect Dise, 2012, 18(8): 1350-1353.
[3] Brian D, Baric R. Coronavirus genome structure and replication[J]. Curr Top Microbiol Immunol, 2005, (287): 1-30.
[4] Follis K, York J, Nunberg J. Furin cleavage of the SARS coronavirus spike glycoprotein enhances cell-cell fusion but does not affect virion entry[J]. Virology, 2006,350(2): 358-369.
[5] Chang S, Bae J, Kang T, et al. Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J]. Mol Cells,2002, 14(2): 295-299.
[6] Ren X, Suo S, Jang Y. Development of a porcine epidemic diarrhea virus M protein-based ELISA for virus detection[J]. Biotechnol Lett, 2011, 33(2): 215-220.
[7] Hou X L, Yu L Y, Liu J. Development and evaluation of enzyme-linked immunosorbent assay based on recombinant nucleocapsid protein for detection of porcine epidemic diarrhea (PEDV) antibodies[J]. Vet Microbiol,2007, 123(1-3): 86-92.
[8] Oh J S, Song D S, Yang J S, et al. Comparison of an enzyme-linked immunosorbent assay with serum neutralization test for serodiagnosis of porcine epidemic diarrhea virus infection[J]. J Vet Sci, 2005, 6(4): 349-352.
[9] Liu J, Zhou D, Cheng Z, et al. Development and evaluation of enzyme-linked immunosorbent assay based on recombinant inorganic pyrophosphatase gene antigen for the detection of Mycoplasma suis antibodies[J]. Res Vet Sci, 2012, 93(1): 48-50.
[10] de Haan C A, Te Lintelo E, Li Z, et al. Cooperative involvement of the S1 and S2 subunits of the murine coronavirus spike protein in receptor binding and extended host range[J]. J Virol, 2006, 80(22): 10909-10918.
[11] Sun D B, Feng L, Shi H Y, et al. Spike protein region (aa 636789) of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J]. Acta Virol, 2007,51(3): 149-156.
DEVELOPMENT OF AN INDIRECT ELISA OF PORCINE EPIDEMIC DIARRHEA VIRUS
MENG Qiong1,2, KONG Ning2, SHAN Tong-ling2, WU Yong-guang2, ZUO Ye-wen2, TONG Wu2,ZHENG Hao2, LI Guo-xin2, YU Hai2, TONG Guang-zhi2, XU Yong-jie1
(1. Xinyang Normal University, Xinyang 464000, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
Five overlopping fragments covered the gene S1 of Porcine epidemic diarrhea virus, were separately expressed and be used to prepare the murine polyclonal antibody. Enzyme-linked immunosorbent assay (ELISA), Western blot and indirect immunofl uorescence assay (IFA) assays showed that the polyclonal antibody induced by SE protein has immune activity. Therefore, we developed an indirect enzyme-linked immunosorbent assay (iELISA) based on the protein SE. The parameters of iELISA were optimized and the cutoff value determined as 0.155. The coincidence rate of iELISA was 93.7%, and the coeffi cients of variation of the intra and inter batch were both less than 10%. In addition the method has a good specifi city of PEDV. The results suggested this iELISA was specifi c, sensitive, and repeatable. Based on iELISA against S protein, it might be easy to detect serological antibody and evaluate the vaccine effi cacy.
Indirect ELISA; Porcine epidemic diarrhea virus; truncated S protein
S852.659.6
A
1674-6422(2016)04-0007-06
2016-03-01
国家自然科学基金项目(31201915);上海市科技兴农重点攻关项目(沪农科攻字(2013)第3-6号,第5-5号)作者简介:孟琼,女,硕士研究生,动物学专业
徐永杰,E-mail:yongjx81@126.com;单同领,E-mail:shantongling@shvri.ac.cn

