长白山林下仿野生栽培紫芝主要活性成分研究△
孟令文,田淋淋,李志成,季存蕊,张辉,孙佳明
(长春中医药大学,吉林 长春 130117)
·基础研究·
长白山林下仿野生栽培紫芝主要活性成分研究△
孟令文,田淋淋,李志成,季存蕊,张辉*,孙佳明*
(长春中医药大学,吉林 长春 130117)
目的:对长白山林下仿野生栽培紫芝子实体中3类活性成分进行分析研究,为其开发利用提供依据。方法:以长白山林下仿野生栽培紫芝子实体为研究对象,采用高效液相色谱-电喷雾串联质谱法对超临界CO2萃取得到的紫芝油中三萜类成分进行分析,采用气相色谱-质谱法分析紫芝油中脂肪酸类物质的组成,采用苯酚-硫酸法测定提取紫芝油后的残渣中多糖含量。结果:长白山林下仿野生栽培紫芝油中含有较丰富的三萜酸类成分,总三萜占紫芝油质量的40%,并初步分析了其中含有Ganoderic acid A 等15个三萜酸的结构;紫芝油中共检出15种脂肪酸,其中不饱和脂肪酸占68.9%,含量较大的为油酸和亚油酸;经测定提取紫芝油后的残渣中多糖含量为0.79%;结论:本品中含有丰富的多糖、三萜和脂肪酸这3类活性成分,表明长白山林下仿野生栽培紫芝具有很大的应用开发价值。
长白山;林下仿野生栽培; 紫芝; 活性成分
紫芝GanodermasinenseZhao,Xu et Zhang为担子菌纲多孔菌科紫芝属真菌,《中华人民共和国药典》2010版将其与赤芝G.lucidum的干燥子实体共同定为灵芝药用正品[1]。灵芝是我国传统名贵中药材,并已有悠久的药用历史,具有抗肿瘤、抗氧化、免疫调节、保肝解毒和镇痛,镇静安神,等临床价值。现代临床中亦用作癌症放化疗后白细胞减少等症状,效果显著,除药用价值外灵芝及其深加工产品也经常用作人体保健品,具有相当高的市场价值[2]。而灵芝主要含有三萜类、多糖(肽)类、生物碱、脂肪酸类、核苷类、氨基酸及微量元素等成分[3]。现代药理研究表明,灵芝三萜类成分具有抗HIV、保肝、抗组胺、辅助降血压等活性,其不饱和脂肪酸类成分具有对人体免疫系统、神经系统、心血管系统等均有很好的调节作用,灵芝多糖具有显著的提高免疫力抗肿瘤功效、清除自由基抗衰老等活性。这三类成分是灵芝的主要活性成分。
随着灵芝产业的发展,野生灵芝远不能满足市场的需求,逐渐形成一种灵芝仿野生化栽培的抚育技术,即人工灵芝三级或者二级菌种[4]。菌种栽种于除红松外的松科木段中,一般三到四年出芝,该模式为仿野生栽培方式,生产的灵芝品质是否能够替代野生灵芝还有待评价。因此本文对长白山地区仿野生化栽培紫芝的药用价值进行的全面评价,采用LC-MS、GC-MS和UV分别分析这三类活性成分,为其开发利用提供科学依据。
1 实验仪器与材料
1.1 实验材料
长白山林下仿野生栽培紫芝药材经长春中医药大学张辉教授鉴定为多孔菌科紫芝属真菌紫芝GanodermasinenseZhao,Xu et Zhang的子实体。
1.2 实验仪器及试剂
Agilent 1100 series LC-MSD液质联用仪,包括:Agilent SL 型多级离子阱质谱仪、低压四元梯度泵、二极管阵列检测器(DAD)、自动进样、柱温箱、Chemistation 化学工作站等;GL-20G-H型低温超速离心机;BP211D型十万分之一电子天平(北京赛多利斯天平有限公司)。Aglent6890N GCsystem;质谱:Angilent 5973 Network MSD(MassSelctive Detector),NIST98数库;Agilent 7683 series自动进样器。蒸馏装置,分光光度计,电子天平,苯酚,硫酸。实验所用乙腈为色谱纯,水为娃哈哈纯净水,其余试剂为分析纯。
2 实验方法
2.1 应用LC-MS分析长白山林下仿野生栽培紫芝油中三萜类成分
2.1.1 样品制备 取长白山林下仿野生栽培紫芝超临界CO2萃取得到紫芝油1 g,加入甲醇20 mL,超声30 min,离心取上清,上清液回收溶剂至干,得黄色粉末状总三萜40 mg。另取该粉末1 mg,加甲醇1 mL,超声溶解,过0.22 μm膜供LC-MS分析。
2.1.2 色谱条件 Eclipse plus C18色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈/0.1%的甲酸水溶液二元线性梯度洗脱,流动相梯度设置(见表1)。流速:0.3 mL·min-1;检测波长:257 nm;柱温:30 ℃;进样量:10 μL[5-7]。

表1 流动相梯度表
2.1.3 质谱条件 电离源:电喷雾离子源(ESI);检测方式:正、负离子同时采集;扫描范围:m/z 50~1200;目标分子量:500;干燥气温度:350 ℃;干燥气流量:9 L·min-1;雾化气压强:0.24 MPa(35.0 psi);毛细管电压:4 kV。
2.2 应用GC-MS分析长白山林下仿野生栽培紫芝油中脂肪酸成分
2.2.1 样品溶液制备 精密称取长白山林下仿野生栽培紫芝孢子油5 mg,加1 mL正己烷超声提取30 min,静置,取上清待用[13-15]。
2.2.2 方法与条件 工作条件:DB-1MS石英毛细管色谱柱(30.00 m×0.25 mm×0.25 μm);进样口260 ℃,柱温70 ℃(2 min)~290 ℃(5 min),10 ℃/min;气质接口280 ℃载体为He,流速1.2 mL·min-1。进样量为1 μL;离子源温度230 ℃,四极杆温度50 ℃。电离方式EI,电子能量70eV。数据采集电子扫描范围35~500 aum[13-15]。
2.3 应用苯酚-硫酸法测定提取紫芝油后药材残渣中多糖
2.3.1 供试品溶液制备 称取长白山林下仿野生栽培紫芝提取紫芝油后药材残渣1 g,精密称定,置圆底烧瓶中,加蒸馏水20 mL,100 ℃回流提取3次,每次1 h,过滤,合并滤液,加乙醇至75%,静置过夜,过滤,滤液减压回收乙醇至无醇味,剩余水液冻干,得棕黄色粗多糖,备用。取粗多糖1 mg,加蒸馏水,超声溶解,定容至1 mL量瓶中,摇匀,即得。
2.3.2 对照品溶液制备 精密称取干燥至恒重的D-无水葡糖糖对照品10 mg于100 mL容量瓶中,加蒸馏水稀释至刻度,得到0.1 mg·mL-1的对照品溶液,置冰箱中备用。
2.3.3 标准曲线绘制 精密吸取对照品溶液0.2,0.4,0.6,0.8,1.0 mL分别置于具塞试管中,各加蒸馏水至1 mL,加入5%的苯酚1 mL,快速加入硫酸溶液5 mL摇匀,放至5 min水浴加热15 min,冷却至室温,以蒸馏水1 mL为空白,同法操作,于490 nm处测定吸光度(A),以质量浓度(C)为横坐标,A为纵坐标绘制标准曲线[16-17],标准曲线方程为A=8.675 7C+0.014 0(r=0.995 2),线性范围0.02~0.1 mg·mL-1[21-22]。
2.3.4 精密度试验 精密量取对照品溶液6份,各0.4 mL,分别加蒸馏水定容至1 mL,按2.3.3方法连续测定,结果RSD 2.5%,表明仪器精密度良好。
2.3.5 重复性试验 精密称取同一样品6份,按2.3.1制备供试品溶液,按2.3.3方法测定,计算总多糖含量,结果RSD 3.7%,表明重复性良好。
2.3.6 稳定性试验 精密量取供试品溶液1mL,按2.3.3方法操作,分别于0,1,2,3,4 h测定A,结果吸光度RSD 1.8%,表明供试品溶液在4 h内稳定。
2.3.7 加样回收率试验 取同一批已知含量的供试品6份各0.5 g,分别加入适量葡萄糖溶液,按2.3.1制备供试品溶液,按2.3.3测定A。回收率在98.7%~103.9%,RSD 2.6%。
2.3.8 样品含量测定 称取长白山林下仿野生栽培紫芝提取紫芝油后药材残渣,按2.3.1制备供试品溶液,平行3份。精密吸取0.1 mL至试管中,按2.3.3测定其吸光度A。
3 结果与讨论
3.1 紫芝油中三萜类成分分析
采用LC-MS联用技术,根据每一组分的保留时间、色谱紫外吸收特征、准分子离子峰和二级质谱碎片信息,并参考文献[5-13]进行解析,鉴定了长白山林下仿野生栽培紫芝油中15个三萜类化学成分的可能结构,结果见图1,表2。
在长白山林下仿野生栽培紫芝油总三萜中已经初步确定了15个三萜酸的结构,其中13个集中在9.3~21.0 min,它们的峰面积占总色谱峰面积的93.4%。而长白山林下仿野生栽培紫芝油总三萜的质量占紫芝油的40%,说明长白山林下仿野生栽培紫芝油中含有较丰富的三萜酸类成分。
3.2 紫芝油中脂肪酸成分分析
长白山林下仿野生栽培紫芝孢子油经GC-MS鉴定,实验结果表明至少有15个特征峰出现,共检出油酸,亚油酸,肉豆蔻酸,棕榈酸,2,3,4-三甲基癸烷,1-甲氧基-4-(1-丙烯基)苯等15种化合物。采用面积归一化计算各组分的相对含量,总离子流图和化合物鉴定详细结果见图2、表3。

图1 长白山林下仿野生栽培紫芝油中三萜类成分的液相色谱图和总离子流图
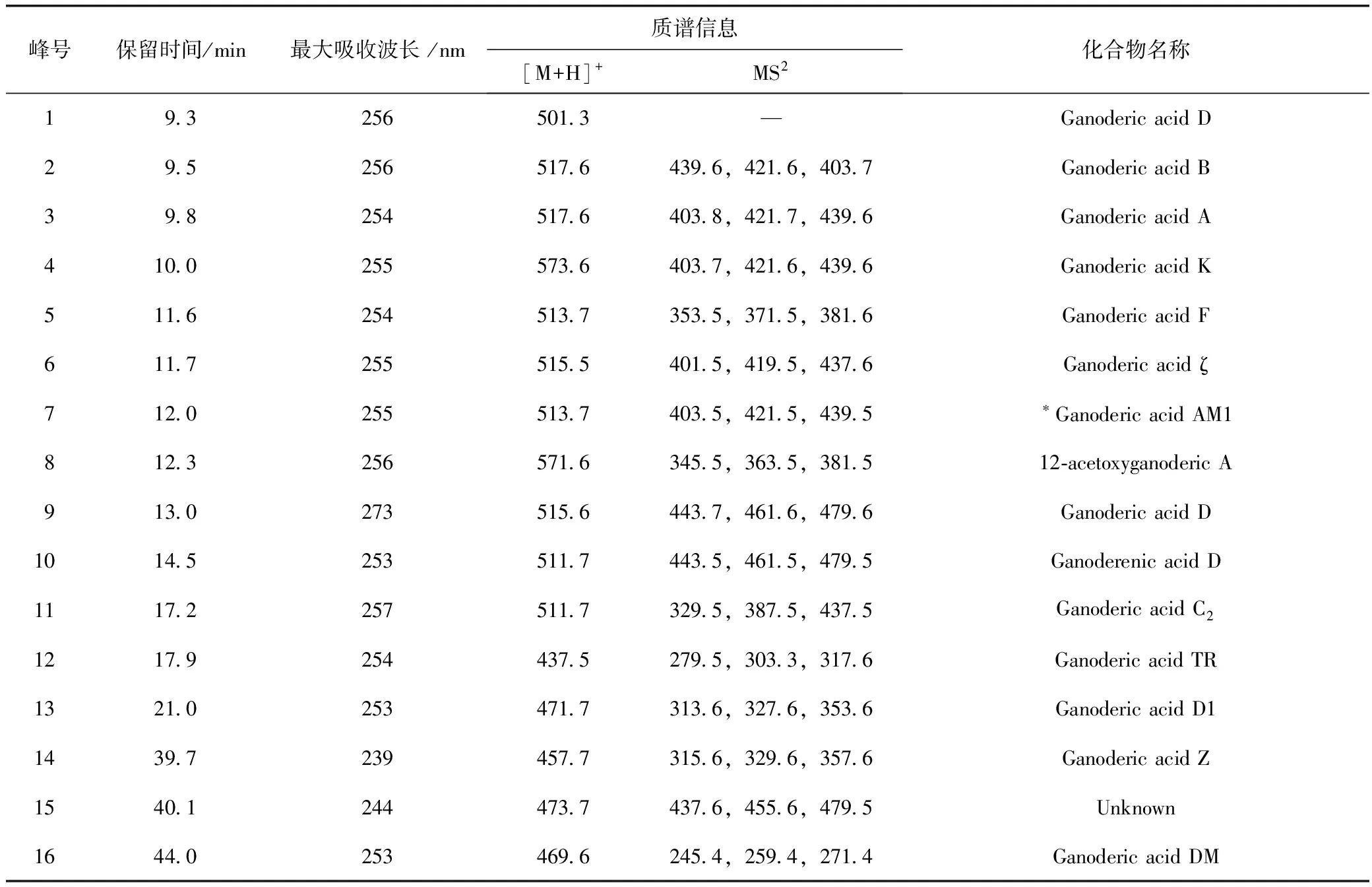
表2 长白山林下仿野生栽培紫芝油三萜类成分正离子扫描模式的LC-MS分析结果
*Ganoderic acid AM1的准分子离子峰和碎片峰为负离子模式下检测,标注为[M-H]-。
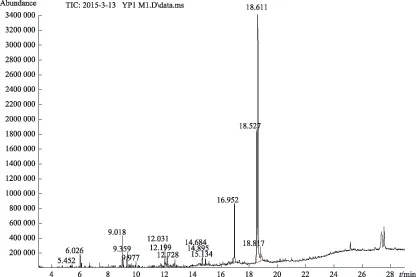
图2 长白山林下仿野生栽培紫芝油脂肪酸类成分GC-MS分析总离子流图

表3 长白山林下仿野生栽培紫芝油脂肪酸类成分GC-MS分析结果
由表3可知,长白山林下仿野生栽培紫芝油中富含多种脂肪酸,不饱和脂肪酸占68.9%,其中油酸占47.397%,亚油酸占21.491%;饱和脂肪酸以硬脂酸,棕榈酸,肉豆蔻酸为主,含量分别为4.414%,9.606%和0.991%。此外,紫芝油样品中还检测出少量2,6-二甲基壬烷,3,6-二甲基癸烷,2,6,10,14-四甲基十六烷,2,3,4-三甲基癸烷,二十五烷,二十八烷,二十七烷类烷烃,以及芳香类化合物1-甲氧基-4-(1-丙烯基)苯,2,5-二叔丁基酚。以上分析数据为利用长白山林下仿野生栽培紫芝孢子油提供了科学依据。
3.3 提取紫芝油后药材残渣多糖测定
1 g长白山林下仿野生栽培紫芝提取紫芝油后药材残渣经提取纯化得到粗多糖22.7 mg,测得粗多糖中多糖含量为34.7%,折合药材残渣中多糖含量为0.79%。
3.4 讨论
采用LC-MS方法对长白山林下仿野生栽培紫芝中三萜类成分进行分析,结果紫芝油中含有较丰富的三萜酸类成分,而且现已经初步确定了15个三萜酸的结构;采用GC-MS法对紫芝油中脂肪酸类物质进行结构和含量分析,结果紫芝油中富含多种脂肪酸,其中不饱和脂肪酸占总量的68.9%,与文献报道的灵芝中不饱和脂肪酸含量(61.2%~73.6%)无明显差别[13-17];尤其是长白山林下仿野生栽培紫芝提取紫芝油后的药材残渣多糖量含量为0.79%,略高于《中华人民共和国药典》2010版灵芝中多糖含量不低于0.5%的标准[1]。
现代药理研究表明,紫芝具有良好的抗肿瘤、提高免疫力、清除自由基和抑菌等活性,而紫芝所含的三萜、多糖和不饱和脂肪酸类成分系其主要药效物质基础。其中紫芝胞内酸性三萜和胞外酸性三萜在250 μg·mL-1时,对人肝癌细胞BEL7402和人乳腺癌细胞MCF-7均有显著抑制作用,另外紫芝含有的三萜类化合物Ganoderic acid F和Ganoderic acid Z具有阻止乳癌生长的作用,可作为治疗癌症的辅助剂[19,23]。紫芝胞内酸性三萜在40 mg·mL-1时,对大肠杆菌Escherichia coli和金黄色葡萄球菌Staphylococcus aureus的生长均具有显著抑制作用,且紫芝胞外三萜物质也表现出不同抑菌活性,其中对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的最小抑菌浓度分别为30、30、60 mg·mL-1[24-25]。在紫芝总多糖口服给药剂量为40.5 mg·kg-1时,对H22肝癌小鼠的抑瘤率为63.94%,对Lewis肺癌小鼠的抑瘤率为58.32%,表现出较明显的抗癌活性;对紫芝液体深层发酵菌丝体精制多糖进行进一步分离纯化得到的单一组分GS-A-1对荷瘤小鼠由环磷酰胺引起的化疗损伤具有保护作用[26-27]。而紫芝粗多糖经DEAE-52柱层析纯化得到的3种多糖组分GSP1、GSP2和GSP3,均具有抗氧化活性,其中GSP2在1.6 mg·mL-1时DPPH自由基清除率达到76.3%,抗氧化活性尤为明显[28]。紫芝富含的不饱和脂肪酸中油酸、亚油酸则能通过提高SOD活性等作用表现出显著的清除自由基活性,以及通过促进正常小鼠幼生IL-2促进ConA诱导的脾T淋巴细胞增殖反应,从而起到调节免疫的作用[29]。
综上,长白山林下仿野生栽培紫芝具有野生灵芝相当的药用价值,具有很大的市场开发前景。目前,以灵芝中三萜和不饱和脂肪酸类成分开发的灵芝油软胶囊的产品较多,但提油后剩余物作为工业残渣被扔掉,其中富含的多糖没有得到充分利用,十分可惜。为了对长白山林下仿野生栽培紫芝资源进行科学合理的综合利用,根据本文的研究结果,应进一步对提油后的紫芝残渣中的多糖进行提取纯化,进而为开发具有免疫调节活性的功能食品和药品奠定基础。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:174-175.
[2] 柯永建,乐仁昌,江小昱.灵芝活性成分及药用价值[J].中国科技博览,2009(33):255.
[3] 刘超,王洪庆,李保明,等.紫芝的化学成分研究[J].中国中药杂志,2007,32(3):235-237.
[4] 陈朝阳,王玲,徐艳,等.灵芝仿野生高产栽培技术[J].陕西农业科学,2005(6):131-132.
[5] Tang W,Gu T Y,Zhong J J.Separation of targeted ganoderic acids from Ganoderma lucidum by reversed phase liquid chromatography with ultraviolet and mass spectrometry detections[J].Biochemical Engineering Journal,2006,32(3):205-210.
[6] Ruan W M,Popovich David G.Ganoderma lucidum triterpenoid extract induces apoptosis in human colon carcinoma cells (Caco-2)[J].Biomedicine Preventive Nutrition 2012,2(3):203-209.
[7] Pan D W,Chen L Q,Cong H,et al.Structure characterization of a novel neutral polysaccharide isolated from Ganoderma lucidum fruiting bodies [J].Food Chemistry,2012,135(3):1097-1103.
[8] Liu Y L,Liu Y P,Qiu F,et al.Sensitive and selective liquid chromatography-tandem mass spectrometry method for the determination of five ganoderic acids in Ganoderma lucidum and its related species[J].Journal of pharmaceutical and biomedical analysis,2011,54(4):717-721.
[9] Keypour S,Rafati,H,Riahi H,et al.Qualitative analysis of ganoderic acids in Ganoderma lucidum from Iran and China by RP-HPLC and electrospray ionisation-mass spectrometry (ESI-MS)[J].Food Chemistry.2010,119(4),1704-1708.
[10] Da J,Cheng C R,Yao S,et al.A reproducible analytical system based on the multi-component analysis of triterpene acids in Ganoderma lucidum[J].Phytochemistry.2014(8):7.
[11] Cheng C R,Yang M,Yu K,et al.Metabolite identification of crude extract from Ganoderma lucidum in rats using ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry [J].Journal of Chromatography B,941,90-99.doi:10.1016/j.jchromb.2013.10.006.
[12] Chen Y,Yan Y,Xie M Y,et al.Development of a chromatographic fingerprint for the chloroform extracts of Ganoderma lucidum by HPLC and LC-MS.[J]Journal of Pharmaceutical and Biomedical Analysis.2008,47(3):469-477.
[13] 田弋夫,李金华,余德顺,等.超临界CO2萃取灵芝孢子油的GC/MS分析[J].中国油脂,2003,28(9):44-45.
[14] 陈体强,吴锦忠,徐洁,等.灵芝孢子油脂肪酸组分的分析[J].菌物研究,2005,3(2):35-38.
[15] 孟凡冰,李云成,钟耕.灵芝孢子油的提取及脂肪酸检测[J].食品科学,2013(2):42-45.
[16] 胡居吾,范青生,肖小年,等.菌草灵芝孢子油与段木灵芝孢子油中脂肪酸组成的比较研究[J].天然产物研究开发,2006,18(4):606-608.
[17] 王卫霄,吕艳茹,姚苗苗,等.灵芝孢子粉抗肿瘤活性的研究进展[J].河北医药,2015(1):105-108.
[18] 伍明,罗霞,江南,等.灵芝抗肿瘤组分的分离[J].时珍国医国药,2011,22(8):1919-1922.
[19] 唐庆九,季哲,郝瑞霞,等.灵芝中性三萜类成分的抗肿瘤作用[J].食用菌学报,2010,17(1):60-64.
[20] 郝瑞霞,张劲松,唐庆九,等.灵芝子实体中三萜类成分对肿瘤细胞的抑制作用[C].//第二届全国食用菌中青年专家学术交流会论文集.杭州:[出版者不详],2008:365.
[21] 杨勇杰,姜瑞芝,陈英红,等.苯酚-硫酸法测定杂多糖含量的研究[J].中成药,2005,27(6):706-708.
[22] 张志军,刘建华,李淑芳,等.灵芝多糖含量的苯酚硫酸法检测研究[J].食品工业科技,2006,(2):193-195.
[23] 杨国红,杨义芳,金隽迪.紫芝液体深层发酵液的抗肿瘤活性部位研究[J].中草药,2008(6):877-880.
[24] 王晓玲,刘高强,周国英.紫芝发酵菌体中三萜类化合物的抑菌活性研究[J].时珍国医国药,2008(11):2636-2637.
[25] 刘高强,赵艳.紫芝胞外三萜物质的体外抑菌作用[J].食品工业科技,2008(12):67-68,73.
[26] 牛莉鑫,杨义芳,赵正保.紫芝多糖GS-A-1的结构鉴定与生物活性研究[J].中成药,2012(5):968-971.
[27] 谢丽源,甘炳成,彭卫红,等.灵芝深层发酵产物抗氧化活性物质与抗氧化能力分析[J].食品工业科技,2015(2):105-109.
[28] 戚跃明,陈涛.紫芝胞外多糖分离纯化及抗氧化性的研究[J].食品工业科技,2013(4):105-108,113.
[29] 余素,王勇.灵芝孢子油的研究进展[J].海峡药学,2013(12):20-23.
AnalysisofMainActiveIngredientsofWild-imitatedGanodermasinenseCultivatedUnderForestofChangbaiMountain
MENG Lingwen,TIANLinlin,LIZhicheng,JICunrui,ZHANGHui*,SUNJiaming*
(ChangchunUniversityofChineseMedicine,Changchun130117,China)
Objective:Three kinds of different active ingredients from the fruiting bodies from wild-imitatedGanodermasinensecultivated under the forest of Changbai mountain have been studied.The experimental data could be used as a basis for its development and utilization.Methods:Triterpenoids ofG.sinenseoil extracted by supercritical CO2were analyzed using LC-ESI-MS/MS.Fatty acid compositions ofG.sinenseoil were analyzed by GC-MS.The polysaccharide ofG.sinenseresidue after extracted oil was measured by phenol-sulfuric acid method.Results:G.sinenseoil contained rich triterpenoids.The total triterpenoid content was 40% ofG.sinenseoil,in which 15 triterpenes have benn initially identified including ganoderic acid A by LC-MS.15 fatty acids were detected inG.sinenseoil,in which unsaturated fatty acid content is 68.9% and the content of oleic acid and linoleic aeid is the most.The content of sugars in polysaccharide fromG.sinenseresidue after extracted oil was 0.79%;Conclusion:G.sinense oil contains rich triterpenoids,fatty acids and polysaccharides,which indicate that wild-imitatedG.sinensecultivated under the forest of Changbai mountain has great application value for development.
Changbai mountain;wild-imitated cultivation under the forest;Ganodermasinense;active ingredients
2015-04-20)
中医药行业科研专项(201207002-05)
*
张辉,教授,研究方向:中药化学、中药资源学;Tel:(0431)86172080,E-mail:zhanghui_8080@163.com 孙佳明,教授,研究方向:中药化学、中药资源学; E-mail:sun_jiaming2000@163.com
10.13313/j.issn.1673-4890.2016.2.002

