IL-10改善蛛网膜下腔出血患者脑血管痉挛临床分析
敖雪玲 金 秀 陈 敏 刘吉谦 强尧生(通讯作者)
1)兰州军区总医院心内科 兰州 730050 2)兰州大学第一医院肝胆外科 兰州 730000
IL-10改善蛛网膜下腔出血患者脑血管痉挛临床分析
敖雪玲1)金秀1)陈敏1)刘吉谦1)强尧生2)(通讯作者)
1)兰州军区总医院心内科兰州7300502)兰州大学第一医院肝胆外科兰州730000
目的研究白介素-10(interleukin-10,IL-10)改善蛛网膜下腔出血(subarachnoid hemorrhage,SAH)患者脑血管痉挛(cerebral vasospasm,CVS)的临床疗效,以期为临床治疗提供参考。方法选取2013-01—2015-01入院诊治的蛛网膜下腔出血脑血管痉挛患者96例,随机分为实验组(48例)和对照组(48例)。2组均应用常规的止血、绝对卧床、脱水及对症治疗,实验组则在此基础上皮下注射IL-10。观察2组治疗效果与CVS、再出血的发生率。结果实验组治愈18例,好转25例,总有效率为89.58%,对照组治愈15例,好转17例,总有效率为66.67%,2组差异有统计学意义(P<0.05)。实验组治疗后CVS发生5例(10.42%),再出血1例(2.08%),死亡1例(2.08%),对照组分别为17例(35.42%)、11例(22.02%)、5例(10.42%),2组差异有统计学意义(P<0.05)。经治疗后,实验组患者在MCA与ACA左右两侧脑血管收缩峰流速均较对照组显著下降(P<0.05)。结论白介素-10 对蛛网膜下腔出血患者脑血管痉挛具有显著改善作用,并可降低脑血管收缩峰流速。
白介素-10;蛛网膜下腔出血;脑血管痉挛
蛛网膜下腔出血又称为原发性蛛网膜下腔出血,指脑表面或脑底部的病变血管破裂,血液直接流入蛛网膜下腔引起的一种临床综合征。SAH的致病原因还包括脑室或脑实质内出血,硬膜外或硬膜下血管破裂,血液穿破脑组织流入蛛网膜下腔,即继发性蛛网膜下腔出血[1]。脑血管痉挛是动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)最严重并发症,重度和弥散性的血管痉挛导致局部脑血流量严重下降,是SAH致死、致残的主要原因。本文就IL-10改善蛛网膜下腔出血患者脑血管痉挛的临床效果分析如下。
1 资料与方法
1.1一般资料选取2013-01—2015-01入院诊治的蛛网膜下腔出血脑血管痉挛患者96例,随机分为实验组(48例)和对照组(48例)。SAH诊断标准:患者嗜睡、意识昏迷或反复昏迷,神经系统存在局灶性的病变症状,如失语、偏瘫及偏盲等。在进行治疗后病变症状反复甚至加重,且排除SAH患者的二次出血情况。CVS诊断标准[2]:血流速度表现为大脑中动脉平均血流速度 121~140 cm/s则是轻度痉挛,141~200 cm/s是中度痉挛,>200 cm/s是重度痉挛,且血流紊乱同声频谱。所有患者均符合上述诊断标准,并经头颅CT扫描及脑血管造影确诊。排除标准:患者合并严重心肝肾等脏器器质性病变,患者精神或智力障碍不能配合此次研究。实验组男28例,女20例;年龄38~77(54.7±5.1)岁;病程1~5 a,平均(3±1.1)a。对照组男27例,女21例;平均36~78(54.1±5.4)岁;病程1~5 a,平均(3±0.9)a。2组患者在年龄、性别、病程等一般资料比较差异无统计学意义(P>0.05),具可比性。
1.2治疗方法2组患者入院后均绝对卧床休息,应用氨甲环酸或6-氨基己酸止血,常规脱水或20%甘露醇降低颅内压,同时应用镇静和抗感染等综合治疗办法。实验组应用重组人白介素-10(货号CYT-500;以色列ProSpec-Tany公司),应用剂量为25 μg/kg,皮下注射,1次/d,疗程一般为2周。如出现过敏反应或其他不良反应剂量可调整为12.5 μg/kg。
1.3观察指标观察2组治疗效果与CVS、再出血的发生率。疗效标准:治愈:患者出血、高热、嗜睡等临床症状消失,病情无反复,且神经系统体征消失,大脑中动脉平均血流速度正常(100~121 cm/s)。好转:患者出血、高热。嗜睡等症状有效改善,病情反复发作率降低,神经系统体征有效缓解,大脑中动脉平均血流速度趋于正常。无效:患者临床症状及神经系统体征无改善甚至恶化。总有效=治愈+好转。
CVS及再出血诊断需结合患者的临床症状和经颅多普勒血流分析[3]:(1)血流速度明显加快;(2)血流频谱紊乱或回声频谱;(3)有杂音;(4)受检血流速度逐日大幅递增,每日递增超过15 cm/s,即可诊断CVS。同时应用经颅多普勒观察2组患者治疗后脑血管收缩峰流速,分别探测大脑中动脉(middle cerebral artery,MCA)、大脑前动脉(anterior cerebral artery,ACA)。根据CT检查观察患者再出血情况。

2 结果
2.12组疗效比较实验组治愈18例(37.5%),好转25例(52.08%),无效5例(10.42%),总有效率89.58%;对照组治愈15例(31.25%),好转17例(35.42%),无效16例(33.33%),总有效率66.67%,2组差异有统计学意义(P<0.05)。
2.2CVS及再出血发生情况实验组治疗后CVS发生5例(10.42%),再出血1例(2.08%),死亡1例(2.08%);对照组治疗后CVS发生17例(35.42%),再出血11例(22.02%),死亡5例(10.42%)。2组差异有统计学意义(P<0.05)。
2.3脑血管收缩峰流速经治疗后,实验组患者在MCA与ACA左右两侧脑血管收缩峰流速均较对照组显著下降(P<0.05)。见表1。
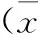
表1 2组治疗后脑血管收缩峰流速比较±s,cm/s)
3 讨论
SAH发生后,引起血管收缩作用的增强和平滑肌细胞超微结构与功能的改变,继而诱发CVS。但关于SAH后CVS的具体发病机制尚未完全明确。就目前的研究提示,作为血管舒张因子的一氧化氮表达下调、具有收缩血管作用的内皮素-1水平持续升高、损伤血管平滑肌的胆红素氧化产物含量升高以及SAH后血管壁的炎症反应和炎症细胞的浸润表现与SHA后CVS的发生密切相关[4-6]。细胞因子如肿瘤坏死因子-α、IL-1/、IL-6、IL-8等均在CVS患者中表达上调,并且针对细胞因子的靶向治疗被证明有效[7]。在我国,每年6~20万人发生SAH,该病在世界范围内均属于严重的常见病症,约占急性脑卒中的10%[8]。目前针对SAH患者CVS的主要治疗办法是止血、脱水、对症治疗,但效果有限。在本次研究中,单纯应用常规治疗的对照组治疗总有效率为66.67%,并且治疗后CVS发生高达17例(35.42%),MCA与AVA左右两侧脑血管收缩峰流速显著较高。
1989年国外学者首次描述了辅助性T细胞2细胞克隆产生的一种可抑制辅助性T细胞1克隆分泌干扰素- γ的细胞因子,当时被称为细胞因子合成抑制因子[9],即IL-10。IL-10在炎症性动物模型表现的强大免疫调节功能,在正常志愿者、银屑病、类风湿性关节、丙型肝炎等患者中均表现出良好的耐受性与免疫调节功能[10]。安学峰等[11]应用日本大耳白兔建立SAH后CVS动物模型,研究IL-10对蛛网膜下腔出血所致脑血管痉挛的治疗作用与机制;研究提示白细胞介素-10可通过强大的免疫调节功能有效控制SAH后中枢神经系统炎性细胞因子引发的级联炎症免疫反应,并尽可能降低由此引发的CVS所造成的继发性损伤,以此促进恢复脑功能。本次研究提示白细胞介素-10对蛛网膜下腔出血患者脑血管痉挛具有显著的改善作用,并可降低脑血管收缩峰流速。
另有研究显示,SAH导致CVS发生的独立危险因素包括年龄、Hunt-Hess分级、白细胞计数,并且CVS发病率与发病意识正相关、血钙水平呈负相关。故在临床诊治SAH后CVS患者中,应密切观察相关因素,及时、有效的预防与治疗CVS。
[1]许彩云.干预性护理对蛛网膜下腔出血患者脑血管痉挛的防治作用[J].中国中医药现代远程教育,2014,12(2):114-115.
[2]De Lima Oliveira M,Kairalla AC,Fonoff ET,et al.Cerebral microdialysis in traumatic brain injury and subarachnoid hemorrhage:state of the art[J].Neurocritical Care,2014,21(1):152-162.
[3]韦英海,吴振宏,欧阳强,等.老年蛛网膜下腔出血后脑血管痉挛患者黏附分子与细胞因子的表达[J].中国老年学杂志,2012,32(6):1 157-1 158.
[4]颜燕红,惠品晶,王中,等.动脉瘤性蛛网膜下腔出血患者的脑血流动力学分析[J].江苏医药,2012,38(12):1 407-1 409;封3.
[5]安殿梅,胡晓芳.炎性标志物在蛛网膜下腔出血后脑血管痉挛中的作用[J].山东医药,2012,52(9):93-94.
[6]赵一平,张贺,李松柏,等.蛛网膜下腔出血后脑血管痉挛常规影像诊断方法的研究[J].临床放射学杂志,2013,32(4):469-474.
[7]陆新宇,李巧玉,陆培松,等.动脉瘤破裂致蛛网膜下腔出血患者死亡原因分析[J].中华神经医学杂志,2012,11(1):68-70.
[8]Greenhalgh AD,Brough D,Robinson EM,et al.Interleukin-1 receptor antagonist is beneficial after subarachnoid haemorrhage in rat by blocking haem-driven inflammatory pathology[J].Disease models & mechanisms,2012,5(6):823-833.
[9]王校伟,冯春国.脑出血患者血清细胞因子的动态变化及其与周围脑组织水肿的相关性[J].实用临床医药杂志,2015,19(5):25-27.
[10]蒋国红,黄良国,施迎兵,等.IL-10对脑出血大鼠HSP70、caspase-3表达的影响[J].重庆医学,2012,41(19):1 948-1 950;封2.
[11]安学锋,潘力,杨铭,等.白细胞介素-10对蛛网膜下腔出血所致脑血管痉挛的治疗作用及机制[J].中华实验外科杂志,2015,32(2):346-348.
(收稿2015-09-21)
R743.35
A
1673-5110(2016)17-0064-02

