内质网蛋白27(ERp27)在小鼠卵母细胞的定位及在精卵融合中的作用
王锦凤,肖露,王若琳,钱卫平,周亮
(1.北京大学深圳医院生殖医学科,深圳 518036;2.汕头大学医学院,汕头 515041;3.湖南省岳阳市妇幼保健院,岳阳 414000)
内质网蛋白27(ERp27)在小鼠卵母细胞的定位及在精卵融合中的作用
王锦凤1,2,肖露3,王若琳1,2,钱卫平1*,周亮1*
(1.北京大学深圳医院生殖医学科,深圳518036;2.汕头大学医学院,汕头515041;3.湖南省岳阳市妇幼保健院,岳阳414000)
目的探讨内质网蛋白27(ERp27)在小鼠卵母细胞的表达定位,以及该蛋白在小鼠精卵融合中的作用。方法将性成熟后的小鼠促排卵后,取出卵母细胞,并分为空白对照组(不做任何处理)、阴性对照组(与正常血清IgG共孵育)、抗ERp27抗体封闭组(与抗ERp27单克隆抗体共孵育),用免疫荧光法检测ERp27在小鼠卵母细胞上的定位;通过穿卵实验观察抗ERp27抗体对受精率、受精指数的影响。结果免疫荧光结果显示ERp27在小鼠MI期卵母细胞主要分布在胞浆的周边区域中,在MⅡ期卵母细胞则均匀分布于卵母细胞胞质;穿卵实验结果显示,空白对照组、阴性对照组及抗ERp27抗体封闭组受精率分别为90.91%、89.13%和76.00%,差异无统计学意义(P>0.05),受精指数分别为(5.20±1.32)、(5.40±1.07)和(3.20±0.92),抗ERp27抗体封闭组的受精指数显著低于空白对照组和阴性对照组,差异有统计学意义(P<0.05)。结论ERp27在小鼠MⅠ及MⅡ期卵母细胞中均有表达,该蛋白可能与精卵融合有关。
内质网蛋白27;间接免疫荧光;精卵融合
【Abstract】
Objective:To investigate the localization of endoplasmic reticulum protein 27 (ERp27) on mouse oocytes and its role in gamete fusion.
Methods:The oocytes were collected from sexually mature male mice after controlled ovarian hyperstimulation. The oocytes were randomly divided into blank control (no treatment) group,negative control (co-incubated with IgG) group and anti-ERp27 group (co-incubated with ERp27 antibody). The localization of ERp27 was detected by immunofluorescence analysis. The effect of anti-ERp27 antibody on fertilization rate (FR) and fertilization index (FI) was observed by sperm-oocyte fusion assay.
Results:According to indirect immunofluorescence analysis,ERp27 was mainly distributed in the cytoplasm of the peripheral region in MⅠ oocytes,while evenly distributed in the cytoplasm in MⅡ oocytes. The fertilization rate (90.91% vs. 89.13% vs. 76.00%) was not significantly different among the blank control,negative control and anti-ERp27 groups (P>0.05). The fertilization index of anti-ERp27 group (3.20±0.92) was significantly lower than the other two groups [(5.20±1.32),(5.40±1.07) ](P<0.05).
Conclusions:ERp27 was expressed in MI and MⅡ stage oocytes in mouse and this protein may play a role in facilitating sperm-oocyte fusion.
(JReprodMed2016,25(9):827-831)
内质网蛋白27(Endoplasmic reticulum protein 27,ERp27)是由Alanen等[1]于2006年新发现的一个内质网蛋白,是蛋白质二硫键异构酶家族(protein disulfide isomerase family,PDI)中一个不具有氧化还原活性的成员。ERp27目前只在脊椎动物中被发现,人类ERp27的同源物在小鼠、黑猩猩、狗、牛、恒河猕猴、绿色的河豚鱼和斑马鱼中都有发现。人类ERp27在很多组织中都有表达,例如骨髓、肺、肾、脾等,其中在胰腺中的表达最显著[1]。PDIs是一类主要定位于内质网的巯基/二硫键氧化还原酶[2],都含有一个或多个硫氧还蛋白同源结构域,其中具有C-X-X-C催化中心的结构域为α型,没有催化中心的为β型,其主要功能是催化底物蛋白质二硫键的形成、异构和还原,辅助新合成的蛋白质形成正确空间构象。大约有三分之一的细胞蛋白通过分泌途径排出,且随后在内质网中进行氧化折叠[3]。ERp27是分子量大小为27.7 kDa,缺少C-X-X-C活性位点结构,由两个硫氧还蛋白折叠结构域构成,同源于PDI非催化活性的bb’结构域。关于该蛋白的具体生理功能目前尚不清楚,在生殖细胞中的表达及功能也少见报道。本文将探讨ERp27在小鼠不同时期卵母细胞中的定位及该蛋白与精卵融合的关系。
材料与方法
一、材料
1. 实验动物:SPF级昆明雌、雄性小白鼠,购自广州实验动物中心(合格证编号:No.44007200 021665),检疫1周无异常情况后,进入实验。其中雌性小鼠6~8周龄,体重28~32 g;雄性小鼠8~10周龄,体重38~42 g。
2. 实验试剂:兔ERp27抗体(Abcam,英国);Alexa Fluor 594 标记的羊抗兔IgG(Life Technologies,美国);DAPI染色试剂盒(江苏凯基生物);孕马血清促性腺激素(PMSG)和HCG(宁波三生药业);人血清白蛋白、改良的人输卵管液(HTF,ART-1023)、受精液(ART-1020)、透明质酸酶和组织培养油(Quinn’s Sage,美国);羊血清(北京中杉金桥)。
二、实验方法
1.小鼠超促排卵及取卵、取精:取6~8周性成熟雌鼠,经12 h明/暗循环周期喂养,饲以灭菌水、食物及垫料1周后,腹腔内注射PMSG 10 U/只,46~48 h腹腔注射 HCG 10 U/只。12~14 h后,将雌鼠脱颈椎处死,并取出输卵管壶腹部,转移到盛有输卵管液的培养皿中;在体视显微镜下用1 ml注射器撕破膨大部,卵冠丘复合物成团溢出,用透明质酸酶去除颗粒细胞,转移到盛有培养液滴的培养皿中。雄鼠颈脱臼处死后,取附睾尾,置于装有培养液的EP管中,用1 ml注射器扎数个小口,上游15 min后吸取上层精子,将密度调至(1~3)×106个/ml,培养箱中获能2 h备用。
2.小鼠卵母细胞间接免疫荧光:将小鼠卵母细胞放入PBS(pH 7.4)中洗涤3次,用4%多聚甲醛室温下固定30 min,洗脱液洗3次,5 min/次;体积分数0.5%的Triton X-100(Sigma,美国)室温下透膜20 min,洗脱液洗3次,5 min/次;用1% BSA室温下封闭1 h,然后加入ERp27单克隆抗体(1∶100),同时以加入进口羊血清为阴性对照,37℃孵育1 h,洗脱液洗3次,5 min/次;加入Alexa Fluor 594 标记的羊抗兔IgG(1∶500),于37℃避光孵育1 h,洗脱液洗3次,5 min/次;加入DAPI(1∶20)染核,避光操作,室温孵育15 min,洗脱液洗1次,5 min/次;在玻璃底皿中滴入防荧光淬灭剂,卵母细胞置于其中,用激光共聚焦显微镜观察。
3.穿卵实验:将去颗粒细胞后的卵母细胞分为3组:空白对照组(44枚,不做任何处理)、阴性对照组(46枚,与正常血清IgG共孵育)、抗ERp27抗体封闭组(50枚,与抗ERp27单克隆抗体共孵育)。去透明带,将各组卵母细胞分别放入酸性HTF(浓盐酸与HTF体积比为1∶20)溶液中,显微镜下观察到透明带消失时,立刻吸出卵母细胞;将卵母细胞移入装有培养液滴的培养皿,加入已获能的精子悬液50 μl,石蜡油覆盖后置于含5% CO2的培养箱中37℃孵育3 h。移出受精卵,在培养液中清洗3次,除去表面松散精子,4%多聚甲醛固定30 min,洗脱液洗3次,5 min/次;加入DAPI(1∶20)染核,避光操作,室温孵育15 min,洗脱液洗涤后,加入滴有防荧光淬灭剂的玻璃底皿中,用激光共聚焦显微镜观察精卵融合情况。
受精率和受精指数作为判断精卵融合的标准。受精率指被精子穿入的卵细胞所占百分比,受精指数是穿入卵细胞内的精子个数。
三、统计学处理
每次实验重复3次,采用SPSS 17.0统计软件,进行χ2检验分析各组受精率之间的差异,用单因素方差分析法分析各组间受精指数的差异;P<0.05认为差异有统计学意义。
结 果
一、ERp27在小鼠卵母细胞的亚细胞定位
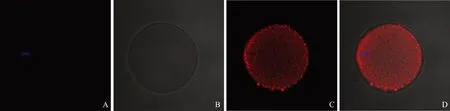
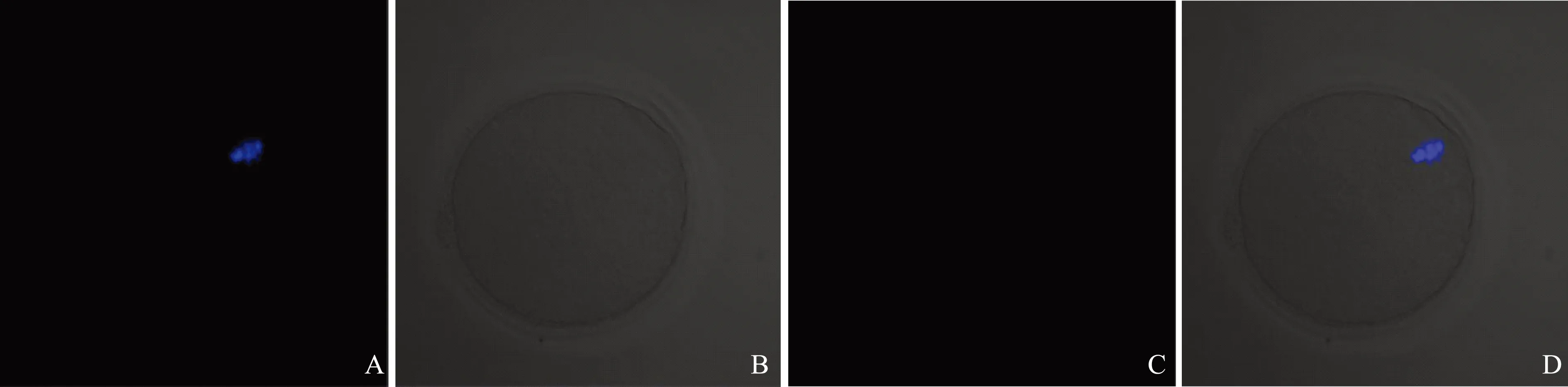
间接免疫荧光的实验结果显示,在MⅠ期小鼠卵母细胞中,ERp27主要分布在卵母细胞胞浆的周边区域(图1);在MⅡ期的小鼠卵母细胞中,ERp27均匀分布在卵母细胞胞浆中(图2)。阴性对照未见明显荧光信号(图3)。
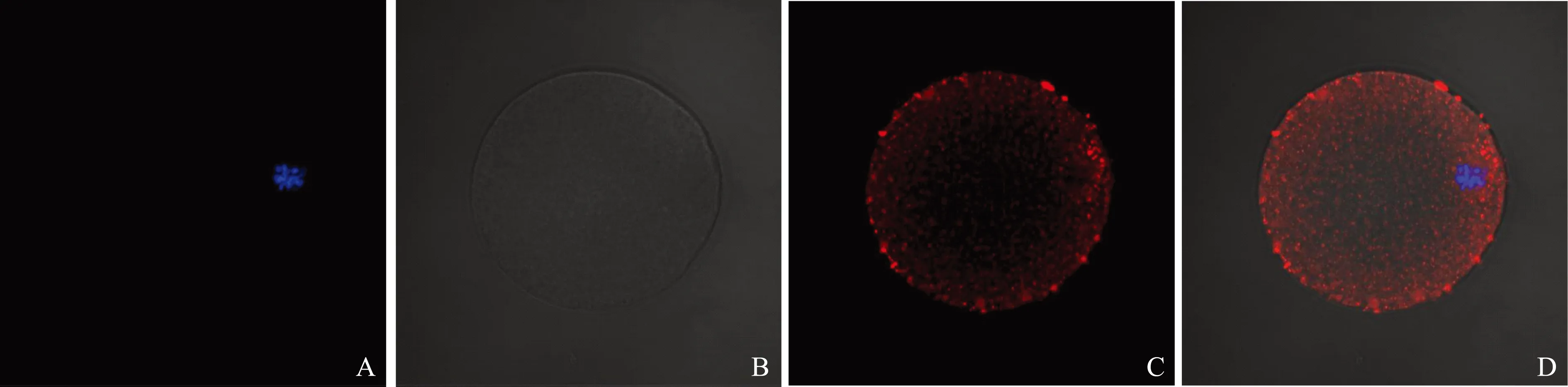
A:小鼠MⅠ期卵母细胞中DAPI所染的染色质(蓝光);B:DIC图像;C:ERp27在小鼠MⅠ期卵母细胞中的定位(红光);D:Merged图像图1 ERp27在MⅠ期小鼠卵母细胞中的定位
A:小鼠MⅡ期卵母细胞中DAPI所染的染色质(蓝光);B:DIC图像;C:ERp27在小鼠MⅡ期卵母细胞中的定位(红光);D:Merged图像图2 ERp27在MⅡ期小鼠卵母细胞中的定位
A:小鼠卵母细胞中DAPI所染的染色质(蓝光);B:DIC图像;C:ERp27在小鼠卵母细胞中表达的阴性对照(无明显荧光信号);D:Merged图像图3 ERp27在小鼠卵母细胞表达阴性对照
二、ERp27单克隆抗体与受精率和受精指数的关系
空白对照组、阴性对照组及抗ERp27抗体封闭组的受精率比较,差异无统计学意义(P>0.05)。抗ERp27抗体封闭组的受精指数明显低于空白对照组和阴性对照组,差异有统计学意义(P<0.05)。
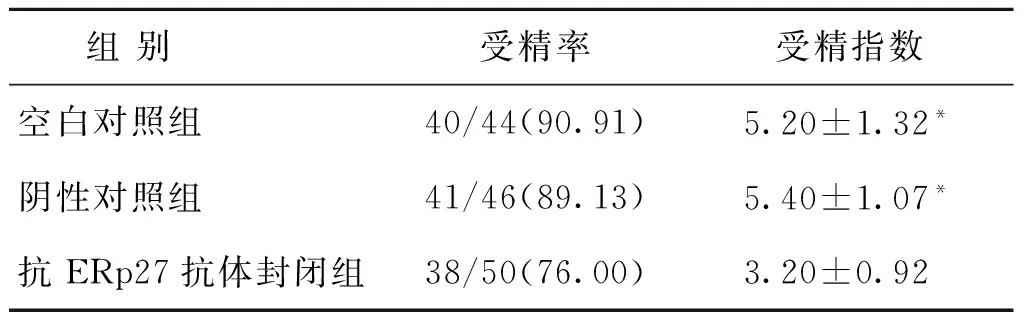
表1 三组小鼠受精率和受精指数的比较[(x-±s),n(%)]
注:与抗ERp27抗体封闭组比较,*P<0.05
讨 论
蛋白质二硫键异构酶(PDI)家族是第一类被发现参与二硫键形成的酶类。有证据表明,该家族的组成具有种属依赖性,例如酿酒酵母中有5个PDI家族成员[4],而在人类已经发现了有至少20个[2]。该家族蛋白最为人所知的作用是促进二硫键的正确形成,这一过程对于胞外蛋白和细胞表面蛋白的折叠过程是非常关键的[5]。
近年来的研究表明,PDI家族蛋白与精子、卵母细胞的成熟发育及精卵融合等密切相关。2006年,Ellerman等[6]报道ERp57定位于小鼠顶体反应后精子的赤道区,与精卵融合有关。随后在人类精子的研究中也发现,ERp57主要定位于精子的顶体和尾部,顶体反应后位于赤道部;且在IVF受精率低的患者中,精子ERp57的表达量明显低于高受精率精子[7]。另外,Liu等[8]的研究表明,在大鼠卵母细胞中MⅡ期卵母细胞ERp57的表达量明显高于MI期卵母细胞,且主要分布在偏心核对立面的微绒毛区。ERp29是PDI家族中一个不具有催化活性的成员,近年来也被报道与生殖细胞的成熟相关。2007年,Guo等[9]的研究表明,精子在大鼠附睾头到附睾尾的运行过程中,ERp29的表达量显著增加,可能参与分泌性蛋白质的合成,在精子成熟的过程中发挥重要作用。随后,Ying等[10]报道,ERp29主要分布在附睾头部精子的头部、附睾尾部精子的头部和尾部主段,顶体反应后分布在赤道区及顶体后区;可能通过影响精卵膜融合影响受精。
ERp27是分子量为27.7 kDa的内质网蛋白,缺少C-X-X-C活性位点结构,由两个硫氧还蛋白折叠结构域构成,同源于蛋白质二硫键异构酶PDI非催化活性的bb’结构域。含有一段结构Asp-Glu-Trp-Asp,位于b’结构域的一个环中,类似于钙联蛋白和钙网蛋白P-结构域顶端的Glu-Asp-Trp-Asp区域。ERp27正是通过该区域与ERp57连接相互作用。而ERp29与ERp27都是PDIs中不具有催化活性的成员,都缺少C-X-X-C活性位点,不能催化巯基到二硫键的转换;但都具有连接底物的特性。二者都是结构简单的两结构域蛋白,ERp29的一个结构域为硫氧还蛋白折叠,另一个结构域则全由α-螺旋构成;ERp27的两个结构域均为硫氧还蛋白折叠。ERp57、ERp29已分别被证实与生殖细胞的成熟及精卵融合相关。
本文研究ERp27与小鼠生殖细胞及受精的关系,结果表明在MI期的小鼠卵母细胞中,ERp27主要分布在卵母细胞胞浆的周边区域,而在MⅡ期卵母细胞中,该蛋白则均匀分布在胞质,根据其在卵母细胞成熟过程中分布的变化,推测其可能与小鼠卵母细胞的成熟发育过程有关;而这一蛋白在这两个减数分裂时期的表达量是否存在差异,还需要后续的蛋白质免疫印迹(Western blot)加以验证。
精子穿进透明带进入卵周间隙,这时的精卵膜融合是精子头部遗传物质进入卵母细胞内的关键过程,也是受精成功必不可少的一步[11]。为研究ERp27在精卵融合中的作用,我们进行了精子穿小鼠卵母细胞透明带的实验。早在1976年就有文献首次报道了人精子穿仓鼠卵的实验[12],随后被公认是判断精卵结合能力的经典方法[13],并且也是作为鉴定男性不育检查项目的一种。目前,这一穿卵实验也常被用于鉴定某一蛋白在精卵融合过程中发挥的作用,例如SP-10[14]、SOB2[15]等均是通过穿卵实验从而证实与精卵融合相关。近年来这一实验方法也有了发展和改进,Ying等[10]2010年的研究表明,用小鼠精子和小鼠卵母细胞行穿卵实验,效果良好。本研究参照上述实验方法,结果显示,抗ERp27抗体对受精率无明显影响,对受精指数有抑制作用,表明ERp27在精卵融合中可能发挥着重要作用,一方面可能与我们的样本量较小有关,另一方面考虑到ERp27与ERp57在结构上的相互连接,而ERp57已被证实与精卵融合相关,我们推测ERp27与ERp57可能共同发挥促进精卵融合的作用。
综上所述,本研究初步探讨了ERp27在生殖细胞中的分布,及其与精卵融合的关系。而该蛋白在卵母细胞发育过程中发挥何种作用,是否与该家族其他蛋白相互作用以及影响精卵融合的机制还需要更深入的研究。
[1]Alanen HI,Williamson RA,Howard MJ,et al. ERp27,a new non-catalytic endoplasmic reticulum-located human protein disulfide isomerase family member,interacts with ERp57[J]. J Biol Chem, 2006,281:33727-33738.
[2]Amin NT,Wallis AK,Wells SA,et al. High-resolution NMR studies of structure and dynamics of human ERp27 indicate extensive interdomain flexibility[J]. Biochem J, 2013,450:321-332.
[3]Kober FX,Koelmel W,Kuper J,et al. The crystal structure of the protein-disulfide isomerase family member ERp27 provides insights into its substrate binding capabilities[J]. J Biol Chem,2013,288:2029-2039.
[4]Norgaard P,Westphal V,Tachibana C,et al. Functional differences in yeast protein disulfide isomerase[J]. J Cell Biol,2001,152:553-562.
[5]Freedman RB,Gane PJ,Hawkins HC,et al. Experimental and theoretical analyses of the domain architecture of mammalian protein disulphide-isomerase[J]. Biol Chem,1998,379:321-328.
[6]Ellerman DA,Myles DG,Primakoff P. A Role for Sperm Surface Protein Disulfide Isomerase Activity in Gamete Fusion:Evidence for the Participation of ERp57[J]. Developmental Cell,2006,10:831-837.
[7]Zhang J,Wu JD,Huo R,et al. ERp57 is a potential biomarker for human fertilization capability[J]. Mol Hum Reprod, 2007,13:633-639.
[8]Liu Y,Zhu YM,Wu XH,et al. Increased expression of ERp57 in rat oocytes during meiotic maturation is associated with sperm-egg fusion[J]. Mol Reprod Dev, 2014,81:315-325.
[9]Guo W,Qu F,Xia L,et al. Identification and characterization of ERp29 in rat spermatozoa during epididymal transit[J]. Reproduction, 2007,133:575-584.
[10]Ying X,Liu Y,Guo Q,et al. Endoplasmic reticulum protein 29(ERp29),a protein related to sperm maturation is involved in sperm-oocytefusion in mouse[J]. Reprod Biol Endocrinol, 2010,8:10-19.
[11]张蔚,李建远,谷翊群. 人类受精相关精子功能蛋白质研究进展[J]. 生殖医学杂志,2015,24:1051-1055.
[12]Yanagimachi R,Yanagimachi H,Rogers BJ. The use of zona-free animal ova as a test-system for the assessment of the fertilizing capacity of human spermatozoa[J]. Biol Reprod,1976,15:471-476.
[13]Liu DY,Baker HW. A new test for the assessment of sperm-zona pellucida penetration:relation-ship with results of other sperm tests and fertilization in vitro[J]. Hum Reprod,1994,9:489-496.
[14]Hamatani T,Tanabe K,Kamei K,et al. A monoclonal antibody to human SP-10 inhibits in vitrothe binding of human spain to hamster oolemma but not to human Zona pellucida[J]. Biol Reprod,2000,62:1201-1208.
[15]Lefevre A,Martin RC,Chokomian S,et al. Characterization and isolation of SOB2,a human sperm protein with a potential role in oocyte membrane binding[J]. Mol Hum Reprod,1997,3:507-516.
[编辑:辛玲]
Localization of ERp27 on mouse oocytes and its role in gamete fusion
WANG Jin-feng1,2,XIAO Lu3,WANG Ruo-lin1,2,QIAN Wei-ping1*,ZHOU Liang1*
1.DepartmentofReproductiveMedicine,PekingUniversityShenzhenHospital,Shenzhen518036 2.MedicalCollegeofShantouUniversity,Shantou515041 3.CenterforReproductiveMedicine,YueyangHospitalforMaternal&ChildHealthCare,Yueyang414000
ERp27;Indirect immunofluorescence analysis;Sperm-oocyte fusion
10.3969/j.issn.1004-3845.2016.09.012
2016-02-24;
2016-04-10
国家自然科学基金(30900817);广东省医学科研基金(A2015397);深圳市科技研发资金基础研究计划面上项目(JCYJ20120616144719076)
王锦凤,女,湖北孝感人,硕士研究生,病理学与病理生理学专业.(*
,Email:zhouliang1002@163.com)

