人脐带间充质干细胞体外分离培养及其生物学特性的研究*
韩 潇,白 海,赵 强,杨 柯,欧剑锋
(1.兰州大学第二医院血液内科,兰州 730030;2.兰州军区兰州总医院血液科/全军血液病中心,兰州 730050)
论著·基础研究
人脐带间充质干细胞体外分离培养及其生物学特性的研究*
韩潇1,2,白海2△,赵强2,杨柯2,欧剑锋2
(1.兰州大学第二医院血液内科,兰州 730030;2.兰州军区兰州总医院血液科/全军血液病中心,兰州 730050)
目的研究人脐带间充质干细胞(MSCs)详细的生物学特性,包括其细胞形态、免疫表型、纯度及增殖能力,从而建立稳定的MSCs体外分离培养体系。方法将剔除动静脉及内膜的新鲜人脐带组织剪切成1 mm3小块,用含10% 胎牛血清的DMEM/F12培养,得到贴壁细胞。观察贴壁细胞形态,利用CCK-8试剂盒测定生长曲线,流式细胞术研究特殊细胞表面抗原CD29、CD73、CD90、CD105、CD31、CD14、CD34、CD45、CD11b、HLA-DR表达,并检测细胞周期。结果体外培养7~10 d后,可见细胞从组织块中游出;细胞主要呈纺锤体样、成纤维细胞样形态;生长曲线显示其增殖能力强;特殊表面抗原CD29、CD73、CD90、CD105表达强阳性,造血性抗原标志CD31、CD14、CD34、CD45、CD11b、HLA-DR表达均呈阴性,流式细胞仪周期检测结果显示G0/G1期细胞超过80%。结论利用组织块法可有效获得人脐带MSCs,具有高纯度、低成本优点,并在体外较易培养、扩增。
流式细胞术;人脐带间充质干细胞;培养;分离;组织工程
间充质干细胞(mesenchymal stem cells,MSCs)是存在于多种组织中的一种非造血多能干祖细胞,可诱导分化成不同的细胞系。人体内包括骨髓、脂肪组织、皮肤、肝脏、胎盘及脐带在内的组织均可产生MSCs[1]。然而,来源不同的MSCs在分化成多种细胞系时具有不同的潜能。在活体条件下,MSCs最重要的特性是具有较强的自我更新能力和分化潜能,如成骨细胞、脂肪细胞、软骨细胞或骨骼肌细胞[2]。最近研究表明,体外培养的MSCs具有修复受损组织和免疫调节的潜能,已应用于临床[3]。但人体骨髓单核细胞功能中MSCs所占比例极小,其增殖分化潜能和扩增数量随着供体年龄的增加而下降,且骨髓穿刺是一种侵入性过程,也使其来源受限。因此,当前认为人脐带MSCs是一种理想的取代骨髓MSCs的资源[4-5]。本研究从人脐带分离扩增培养MSCs,鉴定其详细的生物学特征,为组织工程种子细胞提供有效的体外扩增培养体系和方法。
1 材料与方法
1.1仪器与试剂脐带取自兰州军区兰州总医院产科同一足月剖宫产健康产妇,符合伦理学要求且均知情同意,收集标本后4 h内处理。DMEM/F12培养液、胎牛血清(fetal bovine serum,FBS)及0.25%胰蛋白酶-EDTA(1×)均购自美国Gibco公司,培养皿、培养瓶及冻存管均购自美国Corning公司,CCK-8购自日本Dojindo研究所,流式细胞仪(FACS Calibur)及CD29-PE、CD73-PE、CD90-PE、CD105-PE、CD31-PE、CD14-PE、CD34-PE、CD11b-PE、CD45-Percp、Anti-HLA-DR-FITC标记的抗人单克隆抗体均购自美国Becton Dickinson公司,二甲基亚砜(DMSO)购自韩国BIOSHARP公司,CO2培养箱购自美国Thermo公司,倒置相差显微镜购自日本Olympus公司,酶联免疫分析仪购自奥地利Tecan集团公司,细胞周期检测试剂盒购自上海碧云天生物技术研究所。
1.2细胞分离与培养足月生产后获取新鲜人脐带,4 h内用DMEM/F12(含10% FBS)培养基4 ℃运至实验室,在超净工作台内浸入75% 乙醇30 s,PBS反复冲洗直至无血液及血块后,置于DMEM/F12培养基大皿中,剔除动静脉血管及内膜,培养基清洗数次,剪为1 mm3大小组织块,以适当密度接种于直径15 cm的大皿中,加入5.0 mL含体积分数10% FBS 的DMEM/F12培养基,置于37 ℃,5% CO2饱和湿度的培养箱内培养。次日加入10.0 mL相同培养基,继续培养3~5 d后待组织块贴壁后半量换液,此后每5~7 天更换1次培养基,10~14 d后剔除组织块。待全血细胞贴壁融合至80%时,用0.25%胰蛋白酶-EDTA消化收集细胞,按1∶3的比例传代培养。
1.3脐带MSCs生长曲线测定取第3代细胞,按2×104/mL密度接种于96孔培养板内,每板按4×5的规格连续接种20孔,每孔200 μL,共计7板。接种第2天起,每天固定时间取1板加入10 μL CCK-8液,混匀。37 ℃继续孵育3 h后,酶标仪测定每孔吸光度(A)值,连测7 d,根据A450nm值绘制细胞生长曲线,每板3次重复。
1.4脐带MSCs表面抗原检测取第3代细胞,弃去培养液,PBS洗涤1遍,0.25%胰蛋白酶-EDTA消化收获细胞,每管加入100 μL密度为1×106/mL的单细胞悬液,然后分别加入CD29-PE、CD73-PE、CD90-PE、CD105-PE、CD31-PE、CD14-PE、CD34-PE、CD45-Percp、CD11b-PE、HLA-DR-FITC抗体各10 μL,室温避光孵育30 min,PBS洗涤重悬,流式细胞仪上机检测,Cell-Quest(Mac)软件分析,每个样本至少收获20 000个细胞。
1.5脐带MSCs细胞周期检测取第3代细胞,弃去培养液,PBS洗涤1遍,0.25%胰蛋白酶-EDTA消化收获细胞,再用PBS液洗涤1遍,加入1.0 mL-20 ℃的70%乙醇,混匀,4 ℃固定24 h,离心去上清,加入1.0 mL冷浴PBS,混匀,再次离心去上清后,每管加入0.5 mL配好的PI染液,混匀,37 ℃避光温浴30 min,流式细胞仪检测,ModFitLT V3.2(Mac)软件分析,每个样至少收获20 000个细胞。
2 结 果
2.1脐带MSCs的形态学观察组织块培养7~10 d后,可见组织块周围有细胞游出,且在组织块周围形成50%~75%的融合,其细胞形态呈多角形或短梭形,不规则(图1)。继续培养8~10 d后去除组织块,并换液培养3~5 d后,贴壁细胞迅速增生,达80%~90%融合,形态类似于短成纤维细胞,胞质丰富,核偏大,呈平行排列、旋涡状、网状、辐射状生长,细胞界限不清楚(图2),消化传代。传代细胞在4~12 h内完全贴壁,继续培养3~5 d后,重新变为长梭形成纤维样细胞,细胞大小均一,低倍镜下观察见细胞呈旋涡状或单极向放射状生长(图3)。细胞传代后生长迅速,增生快,5~7 d达到80%~90%融合。

A:4倍镜下所见;B:10倍镜下所见。
图1组织块培养7 d时形态
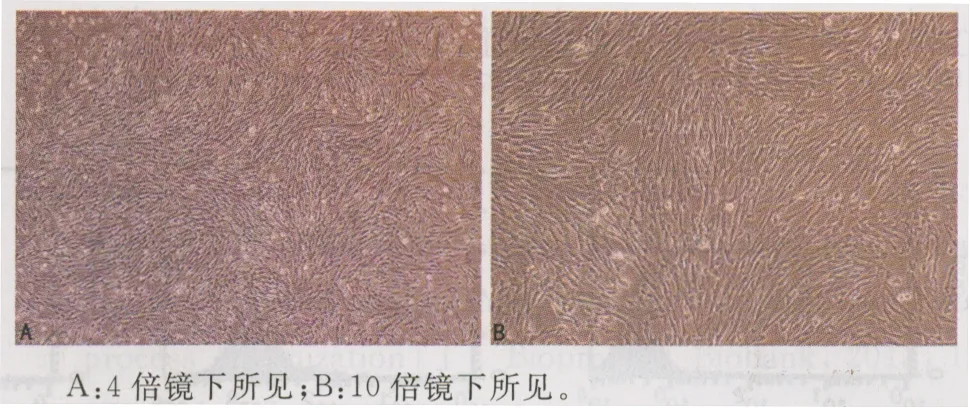
A:4倍镜下所见;B:10倍镜下所见。
图2去除组织块培养3 d后所见形态

图3 第1代所见细胞形态(4倍镜下所见)
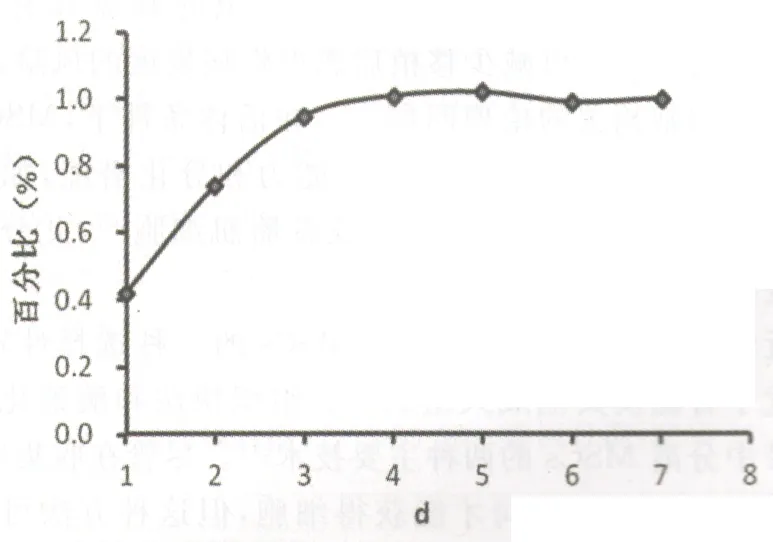
图4 脐带MSCs生长曲线
2.2脐带MSCs生长曲线的分析由图4可见,1~3 d曲线陡升,为细胞生长对数期,3~5 d曲线平缓,略有上升,第6天开始有所下降,说明细胞生长已进入平台期,整个过程符合干细胞生长规律。经计算其倍增时间约为50 h。
2.3脐带MSCs的细胞周期分析通过检测脐带MSCs细胞的DNA含量,发现G1期细胞超过80%,G2/G1=1.86,说明此贴壁细胞增殖活跃,与干细胞生长特性相一致,见图5。
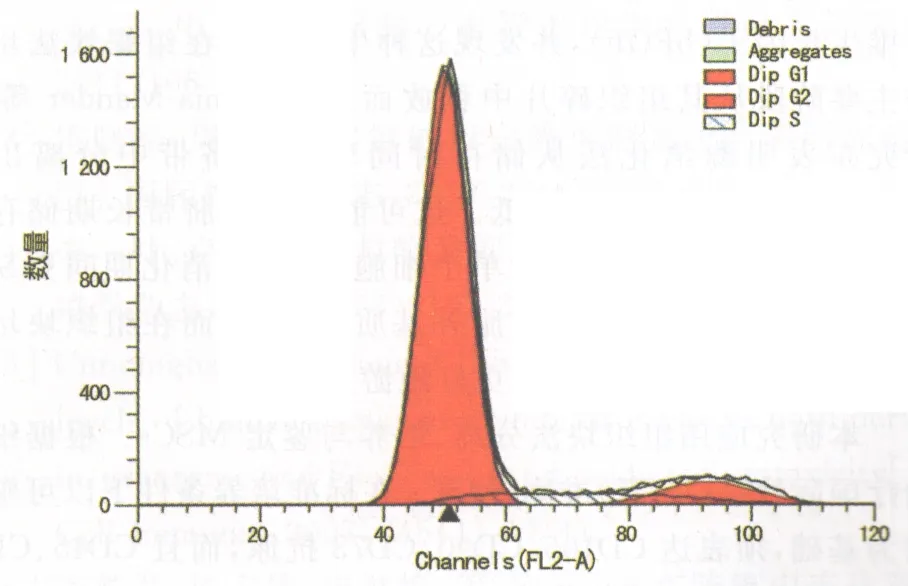
图5 细胞周期分析结果
2.4脐带MSCs细胞表面抗原特性流式细胞仪检测抗原结果显示,脐带MSCs特殊表面抗原CD29、CD73、CD90、CD105表达强阳性,造血性抗原标志CD31、CD14、CD34、CD45、CD11b、HLA-DR表达则呈阴性,见图6。

图6 细胞表面抗原分析结果
3 讨 论
1960年,有研究者首次在骨髓间叶组织中发现一种非造血干细胞并将其命名为MSCs,他们发现这是一种具有可塑黏附、成纤维样细胞,并可分化为软骨细胞、脂肪细胞和骨细胞。大量研究表明,MSCs治疗对各种组织的修复具有重要意义[6]。应用MSCs可减少移植后恶性疾病发展的风险,还能避免胚胎干细胞相关的伦理问题[7]。在活体条件下,MSCs最重要的特性是具有明显的自我更新能力和分化潜能,如脂肪细胞、成骨细胞、软骨细胞、神经元或骨骼肌细胞[2],此分化过程是促进再生的一个基本步骤。
近年来,脐带代替骨髓作为MSCs的一种选择性资源,其特性优于骨髓及其他成人组织[8]。组织块法和酶消化法是从人脐带中分离MSCs的两种主要技术[9]。尽管在收集脐带后,组织块法花费更多时间才能获得细胞,但这种方法可获得更纯、少血源性细胞,且增殖率较高[10]。相对于酶消化法,组织块法实验强度较小,且更能节省成本,因此,此法更适合临床目的。酶消化法可能引起一些问题,包括在应用于临床但未证实的不同样本中,由于细胞溶解酶活性及其对胶原酶敏感性的差异,从而减弱了细胞的生存能力[11]。Yoon等[12]分别用组织块法和酶消化法从沃顿胶质中分离MSCs,并描述了组织块法产生的细胞生存能力更强,且MSCs数量也更多。他们的研究显示组织块法提取MSCs的数量是酶消化法提取MSCs数量的2.8倍。他们也检测了培养基中由沃顿胶质碎片分泌的基础成纤维生长因子(bFGF),并发现这种生长因子在组织块法培养的主要阶段从其组织碎片中释放而出。Iftimia-Mander 等[13]研究亦表明酶消化法从储存时间较长的脐带中分离出的MSCs,其产量较组织块法低。这可能是由于脐带长期储存未处理,使细胞更容易分离为单个细胞,从而在消化期间更易受损。此外,脐带储存期间细胞外基质降解,从而在组织块培养过程中,间充质贴壁细胞能更好地游出组织。
本研究应用组织块法分离、培养与鉴定MSCs。根据细胞治疗国际社会(ISCT)准则,MSCs在标准培养条件下以可塑黏附为基础,须表达CD105、CD90、CD73抗原,而且CD45、CD34呈阴性表达[14]。本实验通过流式细胞仪检测,脐带MSCs特殊表面抗原CD29、CD73、CD90、CD105表达强阳性,而造血细胞表面抗原CD31、CD14、CD34、CD45、CD11b、HLA-DR表达均为阴性,均与ISCT准则相符合。细胞周期显示80%以上的细胞处于G1期,符合干细胞自我更新特征的静止期。这些结果均显示组织块法可分离出具有干细胞特征的MSCs。组织块法的另一个益处似乎是培养基中含有自组织碎片分泌的细胞因子和生长因子,这些因子可刺激细胞生长[15]。因此,培养基中不需再添加额外的任何生长因子。由此在研究和临床环境中组织块法提取MSCs可使用单纯培养基,从而节省更多成本[16]。
用简单可再生的组织块法从整条脐带中分离出大量成纤维细胞样的MSCs,具有高增殖性,能较好地忍受低温保存,复苏后可长期增殖,更重要的是,他们能合成大量营养因子,如神经营养因子、促血管再生因子和造血因子[17]。总之,从脐带分离的细胞能满足干细胞库所有需求,包括再生医学领域中细胞材料可利用的永久性。虽然组织块法限制脐带游出的细胞数量,但其获得的细胞具有更强的新陈代谢活性。实际上,通过应用组织块技术分离和培养原始细胞,细胞从体内转到体外,这个过程同时伴有相关组织碎片,且不能从其先前体内条件下立即分离出来。因此,这一过渡阶段使细胞能更好地忍受分离压力;反之,在酶消化分离技术中,当细胞转入体外后将忍受来自身体和酶干扰分离的双重压力。在这方面,Otte等[18]证实了MSCs在原始组织片段存在下的长期体外培养期间保持干细胞特性,这意味着相应组织片段提供一个MSCs可保持其干细胞样状态的微环境。
总之,本研究利用组织块法从人脐带中成功分离出MSCs,且检测了其详细的生物学特性,包括其细胞形态、免疫表型、纯度及增殖能力,结果显示脐带中富含高增殖性的MSCs,且操作简单、成本低,从而建立了稳定的MSCs体外分离培养体系。因此,此研究为干细胞种子工程研究和人脐带MSCs大规模的临床应用奠定了基础。
[1]Faraoni I,Antonetti FR,Cardone J,et al.miR-155 gene:a typical multifunctional microRNA[J].Biochim Biophys Acta,2009,1792(6):497-505.
[2]Moroni L,Fornasari PM.Human mesenchymal stem cells:A bank perspective on the isolation,characterization and potential of alternative sources for the regeneration of musculoskeletal tissues[J].J Cell Physiol,2013,228(4):680-687.
[3]Shi Y,Su J,Roberts AI,et al.How mesenchymal stem cells interact with tissue immune responses[J].Trends Immunol,2012,33(3):136-143.
[4]Majore I,Moretti P,Stahl F,et al.Growth and differentiation properties of mesenchymal stromal cell populations derived from whole human umbilical cord[J].Stem Cell Reviews and Reports,2011,7(1):17-31.
[5]Schipani E,Kronenberg HM.Adult mesenchymal stem cells--Stem Book[J].In StemBook (Cambridge),2008,5(6):2124-2128.
[6]谢文友,王廷华.骨髓间充质干细胞移植治疗脑外伤的研究进展[J].重庆医学,2013,42(11):1296-1299.
[7]李晓玲,朱旅云,宋光耀,等.脐带间充质干细胞移植治疗糖尿病下肢血管病变[J].中国组织工程研究,2014,18(23):3670-3675.
[8]Christodoulou I,Kolisis FN,Papaevangeliou D,et al.Comparative evaluation of human mesenchymal stem cells of fetal(wharton′s jelly)and adult(adipose tissue)origin during prolonged in vitro expansion:considerations for cytotherapy[J].Stem Cells International,2013,2013:246134.
[9] Seshareddy K,Troyer D,Weiss ML.Method to isolate mesenchymal-like cells from Wharton′s jelly of umbilical cord[J].Methods Cell Biol,2008,86:101-119.
[10]Salehinejad P,Alitheen NB,Ali AM,et al.Comparison of different methods for the isolation of mesenchymal stem cells from human umbilical cord Wharton′s jelly[J].In Vitro Cell Dev Biol Anim,2012,48(2):75-83.
[11]Han YF,Tao R,Sun TJ,et al.Optimization of human umbilical cord mesenchymal stem cell isolation and culture methods[J].Cytotechnology,2013,65(5):819-827.
[12]Yoon JH,Roh EY,Shin S,et al.Comparison of explant-derived and enzymatic digestion-derived MSCs and the growth factors from wharton′s jelly[J].Biomed Res Int,2013,2013:428726.
[13]Iftimia-Mander A,Hourd P,Dainty R,et al.Mesenchymal stem cell isolation from human umbilical cord tissue:understanding and minimizing variability in cell yield for process optimization[J].Biopreserv Biobank,2013,11(5):291-298.
[14]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The international society for cellular therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[15]Venugopal P,Balasubramanian S,Sen MA,et al.Characterization,and gene expression analysis of wharton′s jelly-derived mesenchymal stem cells under xeno-free culture conditions[J].Stem Cells Cloning,2011,21(4):39-50.
[16]Hendijani F,Sadeghi-Aliabadi H,Javanmard SH.Comparison of human mesenchymal stem cells isolated by explant culture method from entire umbilical cord and Wharton′s jelly matrix[J].Cell Tissue Bank,2014,15(4):555-565.
[17]Galderisi U,Giordano A.The gap between the physiological and therapeutic roles of mesenchymal stem cells[J].Med Res Rev,2014,34(5):1100-1126.
[18]Otte A,Bucan V,Reimers K,et al.Mesenchymal stem cells maintain long-term in vitro stemness during explant culture[J].Tissue Eng Part C Methods,2013,19(12):937-948.
The study of isolation and culture in vitro of human umbilical cord mesenchymal stem cells and their biological properties*
HanXiao1,2,BaiHai2△,ZhaoQiang2,YangKe2,OuJianfeng2
(1.DepartmentofHematology,SecondHospitalofLanzhouUniversity,Lanzhou,Gansu730030,China;2.DepartmentofHematology,LanzhouMilitaryAreaGeneralHospital/CenterforHematologicDiseasesofChinesePLA,Lanzhou,Gansu730050,China)
ObjectiveTo identify a detailed biological characterization of mesenchymal stem cells (MSCs) isolated from human umbilical cord(UC) tissue regarding their morphology,immunophenotype,purity and proliferative capacity and establish a reasonably cultured and amplified system.MethodsAfter stripping off arteries and veins,the remaining parts of umbilical cord were cut into 1 mm3small sections and cultured with DMEM/F12 containing 10% fetal bovine serum.Adhere cells were obtained and the morphology of the cells was observed under inverted phase contrast microscope.The growth curves of them were drawn by CCK-8 and the cell cycle and surface antigens (CD29,CD73,CD90,CD105,CD31,CD14,CD34,CD45,CD11b,HLA-DR) were detected by flow cytometry.ResultsSeven to ten days after primary culture,adhere cells came out of fragments.The MSCs harvested were a high purity and mainly presented as a fibroblast-like morphology.UC-MSCs had a strong ability of proliferation through the cell growth curve.The special surface antigens CD29,CD73,CD90,CD105 were positive expression,while CD31,CD14,CD34,CD45,CD11b,HLA-DR were negative.More than 80% cells of MSCs were found at G0/G1phase.ConclusionHuman UC-MSCs could be cultured and proliferated in vitro.
flow cytometry;human umbilical cord mesenchymal stem cells;culture;isolate;tissue engineering
10.3969/j.issn.1671-8348.2016.07.004
甘肃省科技重大专项(1102FKDA005)。作者简介:韩潇(1990-),在读硕士,主要从事血液病及间充质干细胞研究。△
,E-mail:baihai98@tom.com。
R329
A
1671-8348(2016)07-0876-04
2015-09-08
2015-11-10)

