不同剂量盐酸右美托咪定对犬机械通气相关性肺损伤模型中炎性因子表达的影响*
李 鹏, 陈丹丹, 陈彰强, 李 霞, 杨文超, 彭晓红
华中科技大学同济医学院附属普爱医院麻醉科,武汉 430022
实验研究
不同剂量盐酸右美托咪定对犬机械通气相关性肺损伤模型中炎性因子表达的影响*
李鹏,陈丹丹,陈彰强,李霞,杨文超,彭晓红△
华中科技大学同济医学院附属普爱医院麻醉科,武汉430022
目的建立犬机械通气相关性肺损伤模型,评价不同剂量盐酸右美托咪定对犬机械通气相关性肺损伤炎性因子表达的影响。方法健康比格犬30只,体重10~12 kg,采用随机数字表法,将其随机分为5组(n=6):正常对照组(C),机械通气(MV)组和不同剂量盐酸右美托咪定组(Dex1~3组)。C组行气管插管术自主呼吸,MV组呼吸机机械通气4 h,吸入氧浓度50%、通气频率15次/min、潮气量20 mL/kg、PEEP 2 cmH2O。Dex1~3组在行机械通气前20 min内静脉泵入右美托咪定0.5、1.0、2.0 μg/kg负荷剂量5 mL,继以0.5、1.0、2.0 μg/(kg·h)泵入维持4 h。分别于基础状态、MV1h、MV2h、MV4h取颈静脉血,测定血清中NO水平,取颈动脉血测定PaO2。机械通气4 h后颈动脉放血处死动物,测定肺组织湿重/干重比(W/D),髓过氧化物酶(MPO)活性,RT-PCR检测肺组织NF-κB mRNA、TNF-α mRNA、iNOS mRNA表达。结果与基础值相比,MV2h、MV4h的PaO2显著降低(均P<0.05);与C组比较,其他各组肺组织W/D显著性增高(均P<0.05),MPO活性显著性增高(均P<0.05);与MV组比较,DEX2、3两组MPO活性显著性降低(均P<0.05)。与基础值相比,机械通气导致血清NO水平显著增高(P<0.05);与MV组比较,Dex2和Dex3组在机械通气2 h及4 h血清NO水平显著降低(均P<0.05)。与C组比较,MV组肺组织NF-κB mRNA、TNF-α mRNA和iNOS mRNA表达增加(均P<0.05);与MV组比较,Dex各组肺组织NF-κB mRNA、TNF-α mRNA和iNOS mRNA表达均降低(均P<0.05)。结论盐酸右美托咪定可降低犬机械通气相关性肺损伤炎性因子的表达。
盐酸右美托咪定;机械通气;肺损伤;炎性因子
盐酸右美托咪定是一种高选择性α2-肾上腺素受体激动剂,具有抑制交感神经、镇静和镇痛等作用。越来越多的研究证明右美托咪定在器官缺血、缺氧性损伤中具有器官保护作用。临床研究中发现,右美托咪定可调节巨噬细胞和单核细胞细胞因子的生成,降低非特异性的炎症反应[1-2],然而右美托咪定对犬机械通气相关性肺损伤(VILI)中炎性因子表达的影响尚无定论,与之相关的研究也少见报道。因此,我们采用大动物实验,构建机械通气相关性肺损伤模型,并给予不同剂量的右美托咪定进行干预,从而评价右美托咪定对犬机械通气相关性肺损伤炎性因子表达的影响,为临床提供有价值的参考。
1 材料与方法
1.1材料
主要试剂:盐酸右美托咪定,江苏恒瑞药业;iNOS引物、TNF-α引物,NF-κB引物,由上海生工生物工程技术服务有限公司提供;SDS-PAGE、凝胶制备试剂盒、细胞总蛋白提取试剂盒由谷歌生物公司提供;Actin,Santa公司;GAPDH,Santa公司;PMSF(100 mmol/L)、磷酸化蛋白酶抑制剂、5×蛋白上样缓冲液、丽春红染液、考马斯亮蓝G-250染液、抗体洗脱液、显影、定影液、ECL液由谷歌生物公司提供;胶片,Kodak公司;牛血清白蛋白(BSA),Roche公司;脱脂奶粉,国产;PVDF膜0.45 μm,Millipore公司;蛋白Marker(10~170 kD),Fermentas公司;逆转录试剂盒,Invitrogen公司,美国;SYBR qPCR mix,TOYOBO公司,日本;NO ELISA试剂盒,上海博谷生物科技有限公司;MPO试剂盒,南京建成生物工程研究所。
主要仪器:动物天平UX8200,日本岛津;电子天平,PR203-B,梅特勒-托利多(上海)公司;低温离心机,5415R,Eppendorf公司,美国;低温冰箱ELT-B,Cryostar公司,美国;动物呼吸机,DW-2000,中国上海;电热鼓风干燥箱,CS-101-2 AB,重庆实验设备厂;多功能生命监护仪,Marquette series2000,Marquette公司,美国;紫外分光光度计,752-P,上海现科仪器有限公司;台式离心机,TGL-16c,上海安亭科学仪器厂;冷冻离心机,纯水仪,AJC-0501-P,重庆艾科浦公司;磁力搅拌器,79-1,常州澳华仪器有限公司;脱色摇床,WD-9405A,北京六一仪器厂;电泳仪,DYY-6C,北京六一仪器厂;水浴锅,TL-420D,姜堰市天力医疗器械有限公司;暗匣,AX-Ⅱ,广东粤华医疗器械厂有限公司;封口机,PF PF-S-200,温州市江南机械厂;450 nm酶标仪,SLAN,上海宏石医疗科技有限公司;血气分析仪,ABL80,FLEX美国i-STAT公司。
实验动物:健康成年比格犬30只,体重10~12 kg,由我院实验动物中心提供。造模前2周常规喂养,前1晚禁食不禁饮。
1.2方法
动物分组和模型建立:用随机数字表法将实验动物均分成5组(n=6):正常对照组(C),机械通气(MV组)和不同剂量右美托咪定组(Dex1~3组)。构建机械通气相关性肺损伤模型:开放犬腕关节以上内侧静脉置管,戊巴比妥钠30 mg/kg,阿托品0.05 mg/kg静脉麻醉,仰卧位固定动物,开放颈静脉置管取血,连接心电监护仪开放静脉通道,颈部伸直,使口腔与气管成一直线,将犬的上下颌拉开,用舌钳夹住犬舌稍向外拉。使用喉镜伸入喉部,轻挑会厌,暴露声门,行气管插管术,插入5.0号气管导管。通气,听诊双肺,确定在主支气管,固定,连接动物呼吸机行机械通气,吸入氧浓度50%,通气频率15次/min,潮气量20 mL/kg,PEEP 2 cmH2O(1 cmH2O=0.098 kPa),麻醉维持采用静注戊巴比妥钠2 mg/(kg·h),生理盐水6 mL/(kg·h)维持。C组自然呼吸空气4 h;MV组呼吸机机械通气4 h;Dex1~3组气管插管前20 min内静脉输注右美托咪定0.5、1.0、2.0 μg/kg负荷剂量5 mL,0.5、1.0、2.0 μg/(kg·h)维持4 h。
PaO2测定:分别于基础状态、MV1h、MV2h、MV4h采集颈动脉血样1 mL,采用全自动血气分析仪测定PaO2。
肺组织湿重/干重比测定:MV4h颈动脉放血处死动物,取右肺上叶部分组织,吸水纸吸干表面水分和血液,采用电子天平称湿重,置于80℃烘箱内烘干24 h至恒重,称干重,计算肺组织湿重/干重比(W/D)。
肺组织髓过氧化物酶(MPO)活性测定:MV4h颈动脉放血处死动物,取右肺上叶部分组织,按重量体积比1∶19加入缓冲液制备5%组织匀浆,测定MPO活性。肺组织MPO活性反映肺组织中中性粒细胞浸润程度,具体步骤按试剂盒说明操作。
ELISA法检测血清中NO含量:分别于基础状态、MV1h、MV2h、MV4h采集静脉血样5 mL,3 000 r/min离心15 min收集血清,-80℃保存,备测。取出冻存标本,加入一定量的生理盐水,用手工或匀浆器将标本匀浆充分。离心20 min左右(2 000~3 000 r/min)。吸取收集上清分装。采用酶联免疫吸附实验(ELISA)方法测定血清NO水平及比值,操作步骤均严格按照试剂盒(R&D,USA)说明书进行。
半定量PCR法检测肺组织NF-κB mRNA,TNF-α mRNA,iNOS mRNA的表达水平:MV4h颈动脉放血处死动物,取右肺上叶部分组织备用。采用逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)检测肺组织NF-κB mRNA,TNF-α mRNA,iNOS mRNA的表达。操作步骤均严格按照试剂盒说明书进行。
1.3统计学处理

2 结果
2.1各组犬机械通气各时点动脉血PaO2的变化
各机械通气组与基础值相比,MV2h、MV4h时的PaO2显著降低(均P<0.05)。右美托咪定各剂量组与MV组比较,PaO2差异无统计学意义(均P>0.05)(表1)。

表1 各组犬机械通气各时点动脉血PaO2的
与C组比较,aP<0.05。与基础值比较,bP<0.05
2.2各组犬肺组织湿干重比(W/D)的比较
C组(4.05±0.51)U/克组织湿重,MV组(5.81±0.33)U/克组织湿重,Dex1组(5.72±0.47)U/克组织湿重,Dex3组(5.65± 0.45)U/克组织湿重。与C组比较,其他各组肺组织在通气4 h后W/D显著性增高(均P<0.05)。
2.3各组犬肺组织MPO活性的比较
各组MPO活性如下:C组(0.78±0.09)U/g,MV组(1.62±0.18)U/g,Dex1组(1.58±0.14)U/g,Dex2组(1.28±0.15)U/g,Dex3组(1.01±0.14)U/g。与C组比较,其他各组肺组织MPO活性显著性增高(均P<0.05)。与MV组比较,Dex2、Dex3两组MPO活性显著性降低(均P<0.05)。
2.4各组犬机械通气各时点血清NO含量的变化
与基础值相比,机械通气能导致血清NO水平显著增高(P<0.05)。与MV组比较,Dex2和Dex3组在机械通气2 h及4 h血清NO水平显著降低(均P<0.05)(表2)。

表2 各组犬机械通气各时点血清NO含量变化的比较
与C组比较,aP<0.05;与基础值比较,bP<0.05;与MV组比较,cP<0.05
2.5各组犬肺组织NF-κB mRNA、TNF-α mRNA、iNOS mRNA的表达水平的比较
与C组比较,MV组肺组织NF-κB mRNA、TNF-α mRNA和iNOS mRNA表达增加(均P<0.05);与MV组比较,Dex各组肺组织NF-κB mRNA、TNF-α mRNA和iNOS mRNA表达均降低(均P<0.05)(表3,图1)。
3 讨论
VILI是指在呼吸机应用过程中,在机械通气诸多因素和患者肺部原发病的共同作用下导致的肺组织损伤。VILI的类型分为气压伤、容积伤、不张伤


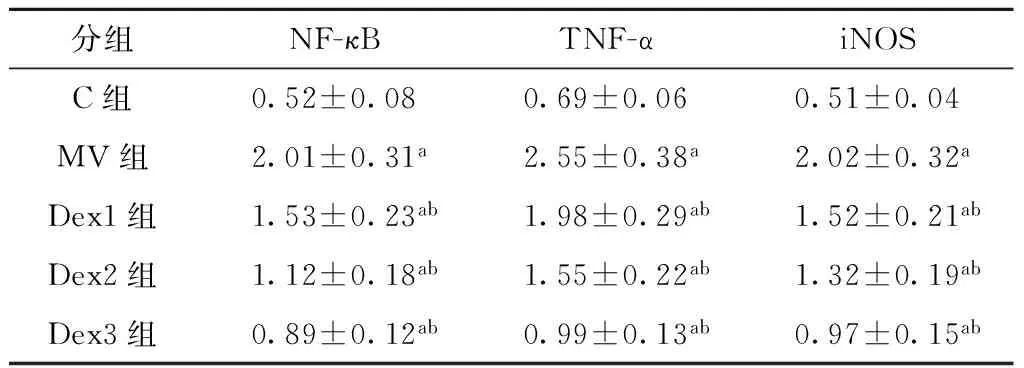
分组NF-κBTNF-αiNOSC组0.52±0.080.69±0.060.51±0.04MV组2.01±0.31a2.55±0.38a2.02±0.32aDex1组1.53±0.23ab1.98±0.29ab1.52±0.21abDex2组1.12±0.18ab1.55±0.22ab1.32±0.19abDex3组0.89±0.12ab0.99±0.13ab0.97±0.15ab
与C组比较,aP<0.05;与MV组比较,bP<0.05

图1 各组犬肺组织NF-κB mRNA、TNF-α mRNA、iNOS mRNA表达水平的比较Fig.1 Comparison of NF-κB,TNF-α and iNOS mRNA expression levels in dogs undergoing mechanical ventilation
和生物伤4种。有学者通过调节PEEP时肺泡压力的大小成功建立VILI的气压伤模型[1]。容积伤指因高容量通气使肺泡过度膨胀和过度牵拉引起的肺泡损伤,主要与潮气量过大有关[2]。大潮气量机械通气可致肺弥漫性损伤和肺微血管内皮细胞通透性增加。董春山等[3]研究了机械通气时不同潮气量对动物肺的影响,结果表明大潮气量组的肺部均出现病理改变,损伤较小潮气量组明显。不张伤指肺泡周期性开放与关闭引起的剪切力造成的肺损伤。生物伤指在机械伤(气压伤、容积伤、剪刀力等)的基础上,大量炎性细胞和炎性因子作用于肺组织导致的炎性损伤。其机制是机械损伤激活各种信号转导通路,导致炎性细胞因子如白细胞介素(IL-1,IL-6等)、肿瘤坏死因子(TNF)和NF-κB等的释放,后者激活中性粒细胞,使白细胞向肺组织趋化、聚集,引发肺部炎性反应[4]。VILI早期出现机械伤,包括气压伤、容积伤、不张伤等,随着病情进展,机械伤可通过机械刺激激活肺组织细胞内各种信号转导通路,导致各炎性因子释放,引起肺部炎性损伤,即生物伤。
右美托咪定是一种新型、高选择性α2-肾上腺素能受体激动剂,它与α2、α1-肾上腺素能受体结合比例约为1 600∶1,具有镇静催眠、镇痛、抗焦虑、抑制交感活性且无呼吸抑制的药理性质。除上述特点外右美托咪定还具有其它方面的重要应用,如神经保护[5-6]、心肌保护[7]和肾脏保护作用[8]
研究证明,VILI的模型可通过多种方式来制作,包括:①采用高通气压力(45 cmH2O)升高气道内压造成肺气压伤;②采用大潮气量(40~65 mL/kg)使肺泡过度膨胀和过度牵拉引起肺的容积伤;③采用气管内应用氮芥、肺泡灌洗等,损伤肺表面活性物质等方法。其中大潮气量合并无呼气末正压通气[9](PEEP=0)是现今研究VILI最常用方法。然而临床研究表明,对已有肺部原发病的患者行机械通气时,即使以正常潮气量行机械通气也会导致VILI的出现[10]。参照文献[7]的方法和预实验结果制备犬机械通气相关性肺损伤模型,结果表明,犬机械通气后4 h较基础值PaO2明显降低,肺组织W/D比和MPO活性较C组明显升高,提示犬机械通气相关性肺损伤模型制备成功。参照文献[11]并结合预实验结果,本研究选择气管插管前20 min内静脉输注右美托咪定0.5、1.0、2.0 μg/kg负荷剂量5 mL,0.5、1.0、2.0 μg/(kg·h)维持4 h进行研究。VILI早期出现机械性损伤,随后以炎性细胞、细胞因子介导的生物伤为主[12-13]。机械应力激发刺激自由基的产生,从而促进P-选择素的胞外分泌,同时通过核转录因子κB(NF-κB)刺激血管细胞黏附分子的产生和炎症反应[14]。NF-κB活化结合到编码细胞因子如TNF-α、TNF-β、iNOS等基因的启动子或增加子的κB结合位点,调节这些基因的表达,进一步促进机械性肺损伤的发生。
本研究结果表明,右美托咪定1.0、2.0 μg/kg负荷剂量5 mL,1.0、2.0 μg/(kg·h)维持4 h明显抑制犬机械通气后NF-κB mRNA、TNF-α mRNA和iNOS mRNA的表达,右美托咪定对肺泡高压引起的炎症反应以及伴随的中性粒细胞浸润起减轻作用。提示右美托咪定可通过抑制炎性反应,从而改善肺水肿和降低MPO活性,减轻犬机械通气相关肺损伤。PaO2是指溶解在血中的氧气所产生的压力,氧分压与细胞氧利用度相关,机械通气相关肺损伤中机械应力作用的肺泡损伤,导致PaO2降低。本研究中,右美托咪定对机械通气所致物理性损伤的PaO2降低无改善作用。
综上所述,右美托咪定1.0、2.0 μg/kg负荷剂量,1.0、2.0 μg/(kg·h)维持剂量可通过抑制犬机械通气后NF-κB mRNA、TNF-α mRNA和iNOS mRNA的表达,减轻炎性反应,减轻犬机械通气相关肺损伤。
[1]Hoegl S,Boost K A,Flondor M,et al.Short-term exposure to high-pressure ventilation leads to pulmonary biotrauma and systemic inflammation in the rat[J].Int J Mol Med,2008,21(4):513-519.
[2]Macintyre N R.Current issues in mechanical ventilation for respiratory failure[J].Chest,2005,128(5 Suppl 2):S561-S567.
[3]董春山,徐志新,徐瑞好,等.机械通气诱导大鼠肺损伤病理及炎性细胞因子的变化[J].中国呼吸与危重监护杂志,2008,7(2):135-139,插8.
[4]Musch G,Venegas J G,Bellani G,et al.Regional gas exchange and cellular metabolic activity in ventilator-induced lung injury[J].Anesthesiology,2007,106(4):723-735.
[5]Yuan S Z,Runold M,Hagberg H,et al.Hypoxic-ischaemic brain damage in immature rats:effects of adrenoceptor modulation[J].Eur J Paediatr Neurol,2001,5(1):29-35.
[6]Prielipp R C,Wall M H,Tobin J R,et al.Dexmedetomidine-induced sedation in volunteers decreases regional and global cerebral blood flow[J].Anesth analg,2002,95(4):1052-1059.
[7]Biccard B M,Goga,S,de Beurs J.Dexmedetomidine and cardiac protection for non-cardiac surgery:a meta-analysis of randomised controlled trials[J].Anaesthesia,2008,63(1):4-14.
[8]乔红,吴新民.右美托咪定对脓毒症大鼠肾功能的影响[J].临床麻醉学杂志,2009,25(4):338-340.
[9]Le A,Damico R,Damarla M,et al.Alveolar cell apoptosis is dependent on p38 MAP kinase-mediated activation of xanthine oxidoreductase in ventilator-induced lung injury[J].J Appl Physio,2008,105(4):1282-1290.
[10]Imai Y,Kawano T,Iwamoto S,et al.Intratracheal anti-tumor necrosis factor-alpha antibody attenuates ventilator-induced lung injury in rabbits[J].J Appl Physiol,1999,87(2):510-515.
[11]Ohata H,Iida H,Dohi S,et al.Intravenous dexmedetomidine inhibits cerebrovascular dilation induced by isoflurane and sevoflurane in dogs[J].Anesth Analg,1999,89(2):370-377.
[12]Wheeler K,Klingenberg C,Mccallion N,et al.Volume-targeted versus pressure-limited ventilation in the neonate[J].Cochrane Database Syst Rev,2010,134(11):366-369.
[13]徐莹,田野,赵平.骨髓间充质干细胞应用于急性肺损伤的实验研究[J].中国组织化学与细胞化学杂志,2014,23(4):357-362.
[14]Huang C S,Kawamura T,Peng X,et al.Hydrogen inhalation reduced epithelial apoptosis in ventilator-induced lung injury via a mechanism involving nuclear factor-kappa B activation[J].Biochem Biophys Res Commun,2011,408(2):253-258.
(2016-04-05收稿)
Effects of Different Doses of Dexmedetomidine Hydrochloride on the Expression of Inflammatory Factors in Mechanical Ventilation-associated Lung Injury in Dogs
Li Peng,Chen Dandan,Chen Zhangqiangetal
DepartmentofAnesthesiology,PuaiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
ObjectiveTo establish ventilator-induced lung injury models in dogs and to evaluate the effects of different doses of dexmedetomidine hydrochloride on the expression of inflammatory factors in dogs with ventilator-induced lung injury.MethodsThirty healthy Beagles weighing 10 to 12 kg were randomized into 5 different groups(n=6 each):control group(group C),mechanical ventilation group(group MV)and 3 dexmedetomidine groups(groups Dex1-3).All dogs underwent endotracheal intubation.Those in group C maintained autonomous breathing.Animals in group MV and group Dex1-3 were mechanically ventilated with tidal volume at 20 mL/kg.The ventilation frequency was set at 15 times/min.The MV lasted for 4 h with a PEEP equaling to 2 cmH2O and FIO2kept at 0.5.Dexmedetomidine was given as a loading dose of 0.5,1.0 and 2.0 μg/kg over 20 min,followed by a continuous infusion of 0.5,1.0 and 2.0 μg/(kg·h) intravenously in group Dex.Blood samples were taken from the internal jugular vein before and 1,2 and 4 h after MV for the determination of serum NO,and arterial blood samples were obtained for blood gas analysis.The animals were sacrificed after 4 h MV.The lung tissues were evaluated for W/D lung weight ratio,and myeloperoxidase MPO levels.The expression of NF-κB,TNF-α and iNOS mRNA was detected by RT-PCR.ResultsPaO2was significantly decreased 2 and 4 h after MV as compared with that before MV(P<0.05).The W/D lung weight ratio and the MPO activity were significantly increased in group MV and groups Dex1,Dex2,Dex3 as compared with those in group C(P<0.05).The MPO activity was much lower in groups Dex2,3 than in group MV(P<0.05).MV could lead to a significant increase in serum NO levels(P<0.05).The serum NO levels were profoundly decreased in groups Dex2,Dex3 after 2 h or 4 h MV when compared with those in group MV(P<0.05).The mRNA expression levels of NF-κB,TNF-α and iNOS were up-regulated markedly in group MV as compared with those in group C(P<0.05),which could be conspicuously reversed in groups Dex1,Dex2,Dex3(P<0.05).ConclusionDexmedetomidine can decrease the expression of inflammatory factors in dogs with ventilator-associated lung injury.
dexmedetomidine;ventilator;lung injury;inflammatory factor
,Corresponding author,E-mail:pxhong01@hotmail.com
R563
10.3870/j.issn.1672-0741.2016.04.013
*湖北省卫计委科研基金资助项目(No.WJ2D5MB154)
李鹏,男,1980年生,主治医师,医学硕士,E-mail:lpjmkangfu@163.com

