西瓜花叶病毒(WMV)单克隆抗体的制备及其应用
陈 浙,宋 革,周雪平,吴建祥
(浙江大学生物技术研究所/国家水稻生物学重点实验室,杭州 310058)
西瓜花叶病毒(WMV)单克隆抗体的制备及其应用
陈 浙,宋 革,周雪平,吴建祥
(浙江大学生物技术研究所/国家水稻生物学重点实验室,杭州 310058)
【目的】制备抗西瓜花叶病毒(Watermelon mosaic virus,WMV)的特异性单克隆抗体,并以其为核心建立能快速有效地检测WMV的血清学方法,从而为中国田间西瓜花叶病毒病的诊断和检测、预测预警及科学防控体系的建立提供物质和技术支撑。【方法】用提纯的WMV病毒粒子免疫BALB/c小鼠,经细胞融合和细胞培养、抗体筛选和细胞克隆等杂交瘤细胞技术,获得能稳定分泌抗WMV单克隆抗体的杂交瘤细胞株,将杂交瘤细胞注射入 BALB/c小鼠腹腔制备其单抗腹水,并以制备的单抗为核心建立能准确、特异、灵敏地检测田间植物中 WMV的ACP-ELISA、DAS-ELISA、dot-ELISA、Tissue blot-ELISA和IC-RT-PCR方法,以及能检测单头传毒介体蚜虫体内WMV的dot-ELISA方法。【结果】3株能稳定分泌WMV单克隆抗体的杂交瘤细胞株(2C8、15A8和16C12)及其单抗腹水被制备,3株杂交瘤细胞分泌的单抗腹水的间接ELISA效价均达到了10-6以上,抗体类型及亚类均为IgG1、kappa轻链。Western blot分析发现,这3个单抗均与WMV的外壳蛋白亚基有特异性反应。灵敏度分析结果表明,ACP-ELISA、DAS-ELISA、dot-ELISA和IC-RT-PCR方法检测WMV病叶的灵敏度分别达到1∶163 840、1∶327 680、1∶5 120和1∶1 310 720倍稀释(w/v,g/mL)。特异性分析结果表明,以这3个单抗为核心建立的ACP-ELISA、DAS-ELISA、dot-ELISA、Tissue blot-ELISA和IC-RT-PCR 5种血清学检测方法均能与感染WMV的病叶发生特异性免疫反应,而与感染小西葫芦黄花叶病毒(Zucchini yellow mosaic virus,ZYMV)、黄瓜花叶病毒(Cucumber mosaic virus,CMV)、黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)、马铃薯Y病毒(Potato virus Y,PVY)的植物样品、健康白南瓜、西瓜、葫芦和烟草的植物组织均呈阴性反应,且dot-ELISA方法还能特异性地检测单头蚜虫体内的 WMV,而在检测无毒蚜虫时呈阴性反应。利用建立的血清学检测方法对采自浙江省、江苏省、山东省和海南省的275株葫芦科疑似病株进行检测,结果发现187株植物感染WMV,发病率达68%,说明WMV在中国田间葫芦科植物中广泛流行发生,且血清学方法的检测结果与RT-PCR方法的检测结果完全一致,将部分PCR产物进行核酸测序和序列比对分析,结果表明这些PCR产物是WMV CP基因片段,证明血清学方法检测阳性的样品确实感染WMV。【结论】获得了3株特异、灵敏的WMV单克隆抗体,以其为核心建立的5种血清学方法能准确、灵敏、可靠地应用于田间样品中WMV的检测,从而为中国WMV田间样品的大规模快速检测和诊断、该病害预报预警和科学防控提供物质和技术支撑。
西瓜花叶病毒(WMV);单克隆抗体;ACP-ELISA;DAS-ELISA;dot-ELISA;Tissue blot-ELISA;IC-RT-PCR
0 引言
【研究意义】西瓜花叶病毒(Watermelon mosaic virus,WMV)是世界上第一个鉴定的马铃薯Y病毒属成员,由蚜虫进行非持久性传播[1]。该病毒遍布世界各地,主要流行于温带和地中海地区。WMV在中国广泛发生,已在陕西、山东、云南、辽宁、山西、新疆、河南和黑龙江等地鉴定到不同的分离物[2]。自然条件下,WMV可侵染葫芦科、藜科、豆科等27科170多种植物,并常与黄瓜花叶病毒 (Cucumber mosaic virus,CMV)、小西葫芦黄花叶病毒(Zucchini yellow mosaic virus,ZYMV)和南瓜花叶病毒 (Squash mosaic virus,SqMV)等病毒复合侵染[3]。WMV主要侵害西瓜和甜瓜等各种瓜类作物,近几年在中国的发病率更是呈急剧上升趋势,大部分地区因其造成的损失高达30%—50%,甚至绝产,WMV已经成为制约西瓜和甜瓜高产稳产的最主要因素之一[3-4]。因此,亟需建立一种快速、灵敏且可靠的WMV检测体系,以完善中国西瓜花叶病毒病的预警和监测体系。【前人研究进展】目前国内外针对WMV的检测方法主要包括生物学检测方法、电镜观察检测方法、分子生物学检测方法和血清学检测方法4种。2002年,李凤梅等[5]发现可以用苋色藜和西葫芦等指示植物鉴别 WMV;2015年,宋西娇等[6]用透射电镜负染色观察病毒粒子形态,诊断出采自浙江龙游的疑似南瓜病株为 WMV 和ZYMV 两种病毒复合侵染;ELBESHEHY等[1]根据WMV的CP序列设计引物,用RT-PCR方法检测到了西瓜上的WMV;KWON等[7]在普通RT-PCR的基础上,对多重RT-PCR体系各成分及反应程序进行摸索和优化,建立了一种能同时检测ZYMV、WMV、番木瓜环斑病毒(Papaya ringspot virus,PRSV)3种病毒的多重RT-PCR方法,大大节省了检测成本及时间;孟娟等[8]以构建的重组质粒为模板,用PCR方法合成了相应的地高辛标记的cDNA探针,从而建立了WMV的斑点杂交检测技术体系。但是,生物学检测方法周期长且准确性不高,而电镜观察和分子生物学检测方法需要昂贵精密的仪器及专业的操作人员,均不适于大批量田间样品检测。血清学检测方法凭借其操作简单、特异性好、灵敏度高、快速和适于大批量检测等优点,被广泛应用于植物病毒的检测中。LIN等[9]利用Dr. Jan提供的WMV多抗建立了检测WMV 的ACP-ELISA方法;LECOQ等[10]制备了WMV多抗,并建立了检测WMV的DAS-ELISA方法;DESBIEZ等[11]建立了检测WMV的TAS-ELISA方法;2013年,梁新苗等[12]以制备的WMV单克隆抗体为核心研发了TAS-ELISA试剂盒;而孔德昭等[13]也于2015年利用WMV CP的鼠单抗与兔多抗建立了TAS-ELISA和电化学纸质免疫检测传感器检测方法。【本研究切入点】以上这些方法中,前几种以多抗建立的血清学方法并未见其在田间样品大规模检测中应用的报道,且多抗在特异性、灵敏度等多方面均不如单抗,而后几种方法所利用的WMV单抗的灵敏度均低于1∶640倍稀释(w/v,g/mL),且未建立检测蚜虫的方法。【拟解决的关键问题】以提纯的WMV病毒粒子作为免疫原,采用杂交瘤技术制备抗WMV的高特异性及灵敏度的单克隆抗体,并以其为核心建立能快速、特异、灵敏地检测WMV的ACP-ELISA、DAS-ELISA、dot-ELISA、Tissue blot-ELISA和IC-RT-PCR方法,从而为中国田间WMV的诊断和科学防控提供技术和物质支撑。
1 材料与方法
试验于 2015年在浙江大学农业与生物技术学院完成。
1.1材料
1.1.1病毒 感染WMV的西瓜病叶采自浙江龙游,经RT-PCR鉴定后种植于玻璃温室中。感染WMV的蚜虫是将健康蚜虫饲养在WMV病株上而获毒。感染ZYMV、CMV、黄瓜绿斑驳花叶病毒 (Cucumber green mottle mosaic,CGMMV)、马铃薯Y病毒(Potato virus Y,PVY)的植物及健康白南瓜、西瓜、葫芦和烟草植物均种植于笔者实验室的玻璃温室中。
1.1.2试剂及试验材料 RPMI-1640培养基、HAT、HT、抗体类型及亚类鉴定试剂盒、碱性磷酸酶(alkaline phosphatase,AP)、AP标记的羊抗鼠IgG二抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgG二抗均购自于Sigma公司。硝酸纤维素膜购自Amersham Pharmacia公司。NBT/BCIP底物及TMB显色底物为Promega公司产品。其他试剂为国产分析纯产品。
1.2西瓜花叶病毒的提纯
WMV的提纯参照周雪平等[14]的方法,并作适当的改进:称取200 g病叶,每100 g病叶中加入pH 7.5 的0.5 mol·L-1磷酸盐缓冲液(PB缓冲液)200 mL(含0.01 mol·L-1Na-EDTA和0.1%巯基乙醇),在组织搅拌器匀浆2 min后用双层棉纱布过滤,滤液6 000 r/min离心20 min去植物组织残渣;所得上清液在搅拌过程中加至终浓度为2.5% Triton X-100、4% PEG(分子量为6 000)和0.1 mol·L-1NaCl,然后4℃搅拌4 h以上;11 000 r/min离心15 min去上清;沉淀用pH 7.5的0.5 mol·L-1PB(含0.01 mol·L-1MgCl2和0.5 mol·L-1脲)充分悬浮,6 000 r/min离心15 min后吸出上清置于新的超离管中,沉淀再悬浮、离心,重复3次;合并上清液,33 000 r/min超速离心100 min,沉淀用PB悬浮后8 000 r/min离心15 min,沉淀再悬浮、离心,重复3次;合并上清液加至30%蔗糖垫上,33 000 r/min超速离心100 min;所得沉淀用pH 7.5的0.01 mol·L-1PB(含0.01 mol·L-1MgCl2)悬浮,33 000 r/min超速离心100 min,以去除蔗糖;所得沉淀用0.01 mol·L-1PBS悬浮,所得悬浮液即为病毒提纯液;病毒提纯液经2%磷酸钨(pH 6.7)负染后置JEOL JEM-1200EX电镜下观察粒子形态。纯化的病毒粒子即可用于小鼠的免疫及单抗的制备。
1.3小鼠免疫、细胞融合、筛选及克隆
以提纯的WMV病毒粒子作为免疫原,参照WU等[15]的免疫程序对6周龄的BALB/c小鼠进行免疫。四免之后3 d即可根据SHANG等[16]的方法将小鼠的脾脏细胞与SP2/0鼠骨髓瘤细胞进行细胞融合。筛选时,以健康西瓜汁液为阴性对照,提纯的WMV病毒和感染 WMV的西瓜病汁液(1∶20倍稀释,w/v,g/mL)为筛选抗原,用间接ELISA方法检测细胞培养上清中是否含有特异性抗WMV抗体。用有限稀释法对特异性和灵敏度好的杂交瘤细胞进行 2—3次单克隆化克隆。将最终筛选到的能稳定传代并持续分泌抗WMV单抗的杂交瘤细胞注射入小鼠腹腔制备腹水单抗,纯化后保存于-80℃超低温冰箱待用。
1.4腹水效价测定、抗体类型及亚类的鉴定
将感染WMV的西瓜病汁液(1∶20倍稀释,w/v,g/mL)作为抗原进行包被,采用间接ELISA方法测定腹水效价。并用Sigma公司的免疫球蛋白标准亚类鉴定试剂盒及其产品说明书的方法鉴定WMV单抗的抗体类型和亚类。
1.5Western blot分析单抗的特异性
参照LI等[17]的方法进行Western blot分析,分别取0.1 g感染WMV的西瓜病叶、感染ZYMV的白南瓜病叶、感染CMV的西瓜病叶、感染CGMMV的西瓜病叶、感染PVY的烟草病叶、健康西瓜、白南瓜、葫芦及烟草叶片,用液氮研磨后加入100 μL的2×上样缓冲液,热变性后离心取上清进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)并转膜,以WMV单抗作为一抗,AP酶标记的羊抗鼠 IgG为二抗,进行Western blot,分析WMV单抗的特异性。
1.6ACP-ELISA方法的建立及其检测应用
1.6.1ACP-ELISA方法的建立 参照SHANG等[16]的方法,用方阵试验确定ACP-ELISA一抗和二抗的最适工作浓度,并根据 LIU等[18]的方法建立检测 WMV的ACP-ELISA方法。即将感染WMV的西瓜病叶用液氮研磨,并用0.05 mol·L-1碳酸盐缓冲液(pH 9.6)按1∶30倍稀释(w/v,g/mL)后,加入ELISA板孔中(100 μL/孔),置4℃过夜或37℃温育2—3 h,用PBST洗涤3次,每次5 min;加入含3%脱脂奶粉的PBS封闭液(250 μL/孔),封闭30 min;弃封闭液拍干后,加入含3%脱脂奶粉的WMV单抗稀释液或杂交瘤细胞培养上清(100 μL/孔),37℃孵育1 h;弃二抗反应液后,用PBST洗涤4次,每次5 min,拍干后每孔加入显色底物液100 μL(显色底物液用pH为9.8的10%乙二醇铵和PNPP按1 mL∶1 mg的比例配制),置室温下待其充分显色;显色30—50 min后,用2 mol·L-1氢氧化钠终止反应,将酶标板置于Bio-Rad 680酶标仪上测各孔OD405值,以P/N>3.1作为阳性判断标准。
1.6.2分析ACP-ELISA方法及WMV单抗的特异性 用感染ZYMV、CMV、CGMMV和PVY的植物样品粗提液为检测抗原,同时以感染WMV的西瓜样品为阳性对照,以健康白南瓜、西瓜、葫芦和烟草作阴性对照,用包被液(0.05 mol·L-1碳酸盐缓冲液,pH 9.6)按1∶30倍稀释(w/v,g/mL),离心后加入ELISA板,分析WMV单抗及建立的ACP-ELISA方法检测植物样品的特异性。
1.6.3分析ACP-ELISA方法及WMV单抗的灵敏度 将感染WMV的西瓜病叶用液氮磨碎后,用包被缓冲液从1∶10到1∶1 310 720(w/v,g/mL)倍比稀释病毒粗提液,健康西瓜叶片也作同样倍比稀释。按梯度顺序包被ELISA板,用建立的ACP-ELISA方法测定检测灵敏度。
1.7dot-ELISA和Tissue blot-ELISA方法的建立及其检测应用
1.7.1dot-ELISA和Tissue blot-ELISA方法的建立参照 SHANG等[16]的方法建立检测 WMV的dot-ELISA和Tissue blot-ELISA方法。用方阵实验确定一抗及二抗的最适工作浓度,进行dot-ELISA方法时,将植物样品用液氮研磨后,按1∶20(w/v,g/mL)加入0.01 mol·L-1磷酸缓冲液(PBS,pH 7.4),5 000 r/min离心3 min后得到的上清即为病毒粗提液;蚜虫样品按每头加入10 μL PBS并用牙签捣烂,离心上清即为昆虫病毒粗提液;取2.5 μL粗提液点到硝酸纤维素膜(NC膜)上,室温干燥 10 min;进行 Tissue blot-ELISA方法时,先将硝酸纤维素膜剪成适当大小,铺垫在一层干净的吸水纸上。然后用手术刀片将植物茎迅速横切,叶片需紧卷成筒后用刀片横切,并将横切面在膜上压印3—5 s,印迹膜同样需在室温干燥10 min;将NC膜浸入到含5%脱脂奶粉的PBST封闭液中37℃封闭1 h;然后将NC膜放入含WMV单克隆抗体的5%脱脂奶粉PBST抗体稀释液中,在水平摇床上缓慢摇动1 h;弃一抗反应液,用PBST于摇床上洗涤3次,每次5 min,然后置于用5%脱脂奶粉PBST抗体稀释液稀释的AP或者HRP标记的羊抗鼠IgG二抗反应液中,在水平摇床上缓慢摇动1 h;弃二抗反应液,用PBST洗涤5次,每次5 min,最后用PBS洗涤1次以去除膜表面的吐温-20。 植物样品用每10 mL底物缓冲液(0.1 mol·L-1Tris-HCl,0.1 mol·L-1NaCl,0.025 mol·L-1MgCl2,pH 9.5)加入66 μL NBT和33 μL BCIP底物进行显色反应,肉眼观察结果,阳性显色为紫色,用自来水终止反应,拍照记录结果;而蚜虫样品因用HRP标记的羊抗鼠IgG作为二抗,用TMB底物来进行显色,肉眼观察结果,阳性显色为蓝色,拍照记录结果。
1.7.2dot-ELISA方法的特异性分析 用感染ZYMV、CMV、CGMMV和PVY的植物样品粗提液为检测抗原,同时以感染WMV的西瓜样品和蚜虫为阳性对照,以健康白南瓜、西瓜、葫芦和烟草及无毒蚜作阴性对照,用0.01 mol·L-1PBS(pH 7.4)按1∶30倍稀释(w/v,g/mL),离心后取2.5 μL点于硝酸纤维素膜上,分析单抗及建立的dot-ELISA方法的特异性。
1.7.3Tissue blot-ELISA方法的特异性分析 用感染ZYMV、CMV、CGMMV和PVY的植物样品为检测抗原,同时以感染WMV的西瓜样品为阳性对照,以健康白南瓜、西瓜、葫芦和烟草作阴性对照,将其幼茎或者叶片用刀片横切之后在硝酸纤维素膜上印迹,用建立的Tissue blot-ELISA方法分析WMV单抗及该方法的特异性。
1.7.4dot-ELISA方法的灵敏度分析 将感染 WMV的西瓜病叶用液氮磨碎后,用0.01 mol·L-1PBS(pH 7.4)从1∶20到1∶10 240(w/v,g/mL)倍比稀释病毒粗提液,健康西瓜叶片也作同样的倍比稀释,按梯度顺序取 2.5 μL稀释液点到 NC膜上,用建立的dot-ELISA方法分析检测灵敏度。
1.8DAS-ELISA方法的建立及其检测应用
1.8.1DAS-ELISA方法的建立 选择针对WMV外壳蛋白且灵敏度高、特异性好的抗体,参照LING等[19]将其与 AP(Sigma,Missouri,USA)偶联。将其他的WMV单抗与AP偶联单抗进行一对一配对,并分别分析各种组合的检测灵敏度和特异性,根据CHEN等[20]的方法用灵敏度和特异性最好的捕获抗体和酶标抗体组合建立DAS-ELISA检测方法。将捕获抗体用包被液稀释后,加入ELISA板(100 μL/孔),置4℃过夜或37℃温育2—3 h后用PBST洗涤3次,每次3 min;加入含3%脱脂奶粉的PBS封闭液(250 μL/孔),于37℃孵育30 min;将植物样品用液氮研磨,并用0.01 mol·L-1PBS(pH 7.4)按1∶30倍稀释(w/v,g/mL)后,加入ELISA板孔中(100 μL/孔),37℃温育1 h后用PBST洗涤3次,每次3 min;拍干后往ELISA板中加入用含3%脱脂奶粉PBS抗体稀释液稀释后的AP偶联抗体(100 μL/孔),37℃温育1 h;用PBST洗涤4次,每次3 min,拍干后每孔加入显色底物液100 μL(显色底物液用pH 9.8的10%乙二醇铵和PNPP按1 mL∶1 mg的比例配制),置室温下待其充分显色;显色30—40 min后用2 mol·L-1氢氧化钠终止反应,将酶标板置于 Bio-Rad680酶标仪上测各孔OD405,以P/N>3.1作为阳性判断标准。
1.8.2DAS-ELISA方法的特异性 用感染 ZYMV、CMV、CGMMV和PVY的植物样品粗提液为检测抗原,同时以感染WMV的西瓜样品为阳性对照,以健康白南瓜、西瓜、葫芦和烟草植物组织为阴性对照,用0.01 mol·L-1PBS(pH 7.4)按1∶30倍稀释(w/v,g/mL)后加到已包被捕获抗体的ELISA板中,分析建立的DAS-ELISA方法的检测特异性。
1.8.3DAS-ELISA方法的灵敏度 将感染WMV的西瓜病叶用液氮磨碎后,用0.01 mol·L-1PBS(pH 7.4)从1∶10到1∶1 310 720(w/v,g/mL)倍比稀释,健康西瓜叶片也作同样的倍比稀释。按梯度顺序加到已包被捕获抗体的ELISA板,分析DAS-ELISA方法的检测灵敏度。
1.9IC-RT-PCR的建立
根据 GenBank中报道的 WMV衣壳蛋白基因(CP)序列设计引物:WMV-CP-F: 5′-CATTGAAAA TGGAGTGACACTG-3′(对应CP 4 953—4 974位)和WMV-CP-R:5′-GCCAAAACCTGCATCGCAC-3′(对应CP 5 574—5 592位),并由上海英骏生物技术有限公司合成。参照WU等[15]的方法建立检测WMV的IC-RT-PCR方法。
2 结果
2.1西瓜花叶病毒的提纯
将提纯的西瓜花叶病毒用2%磷酸钨(pH 6.7)负染后置JEOL JEM-1200EX电镜下观察,发现病毒粒子含量很高,粒子形态呈长约750 nm的线状(图1)。

图1 提纯的WMV病毒粒子电镜照片Fig.1 Electron micrograph of the purified WMV
2.2杂交瘤细胞的筛选和克隆
将用WMV提纯病毒免疫后的小鼠脾脏细胞与小鼠骨髓瘤细胞SP2/0进行融合,并用HAT培养基筛选培养 12 d。经观察,24块 96孔细胞板的融合率为100%。当杂交瘤细胞生长至覆盖孔底20%—30%时,采用病叶粗提液包被的ACP-ELISA方法分析细胞上清液中是否含WMV抗体,结果显示有150个孔呈阳性,阳性率为6.5%。选出其中特异性和灵敏度好的细胞孔的细胞,进行3次有限稀释法克隆细胞,最终得到 3株能稳定分泌WMV单克隆抗体的杂交瘤细胞(2C8、15A8和16C12)。
2.3腹水抗体制备、效价测定、抗体类型及亚类鉴定
8周龄的BALB/c小鼠腹腔注射0.3—0.5 mL降植烷,7—10 d后腹腔注射WMV杂交瘤细胞,约7—10 d后小鼠腹部明显膨大,用采血针收集其腹水,每株杂交瘤细胞均获得10 mL左右单抗腹水。腹水纯化后测得IgG含量在7.32—10.27 mg·mL-1,抗体类型及亚类鉴定结果表明,这3个细胞株的抗体类型均为IgG1,轻链均为κ链,间接ELISA方法测得3株单抗腹水效价在10-6—10-7(表1)。

表1 抗WMV单克隆抗体的特性Table 1 Properties of monoclonal antibodies against WMV
2.4ACP-ELISA和Western blot方法的建立及其特性分析
方阵试验结果表明,当检测植物样品时,单抗2C8、15A8和16C12的最适工作浓度为1∶5 000倍稀释,而AP标记的羊抗鼠IgG二抗以1∶8 000倍稀释为佳。根据抗体的最适浓度建立检测植物中 WMV 的ACP-ELISA方法,灵敏度分析表明,以单抗2C8、15A8或16C12为核心建立的ACP-ELISA方法对WMV病叶的检测灵敏度达到1∶163 840倍稀释(w/v,g/mL)(图2)。特异性分析表明,这 3个单抗均只与感染WMV的植物组织发生强烈的阳性反应,而不与感染ZYMV、CMV、CGMMV和PVY的植物组织、健康西瓜、白南瓜、葫芦和烟草的植物组织发生任何反应,且对比差异显著 (图3),说明这3个WMV单抗及建立的ACP-ELISA方法的特异性均很好。
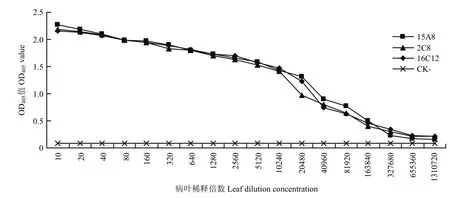
图2 建立的ACP-ELISA方法的灵敏度分析Fig.2 Sensitivity analyses of the developed ACP-ELISA
Western blot分析显示这3个抗体均可以杂到一条近似37 kD的明显条带,与报道的WMV的CP蛋白大小相同,而在感染其他病毒的病叶和健康叶片中没有杂到任何信号,与ACP-ELISA方法的检测结果一致,表明这3个单抗对WMV具有很好的特异性(图4)。
2.5dot-ELISA和Tissue blot-ELISA方法的建立及其特异性和灵敏度分析
方阵试验结果表明,当检测植物样品时,单抗2C8、15A8和16C12的最适工作浓度为1∶5 000倍稀释,而AP标记的羊抗鼠IgG二抗以1∶8 000倍稀释为佳;在检测蚜虫时,单抗15A8和16C12的最适工作浓度均为1∶5 000倍稀释,单抗2C8以1∶4 000倍稀释为宜,而HRP标记的羊抗鼠IgG二抗以1∶7 000倍稀释为佳。以抗体的最适浓度建立检测植物和蚜虫中WMV的dot-ELISA方法,以及检测植物中WMV 的Tissue blot-ELISA方法。dot-ELISA方法特异性分析表明,这3个单抗均只与感染WMV的植物组织和携带WMV的蚜虫发生强烈的阳性反应,而不与感染ZYMV、CMV、CGMMV和PVY的植物组织、健康西瓜、白南瓜、葫芦、烟草的植物组织及不带毒蚜虫发生任何反应,说明这3个单抗及建立的dot-ELISA方法具有很好的特异性(图5)。dot-ELISA方法灵敏度分析表明,以单抗15A8、16C12或2C8为核心建立的dot-ELISA方法对WMV病叶的检测灵敏度达到1∶5 120倍稀释(w/v,g/mL)(图6)。
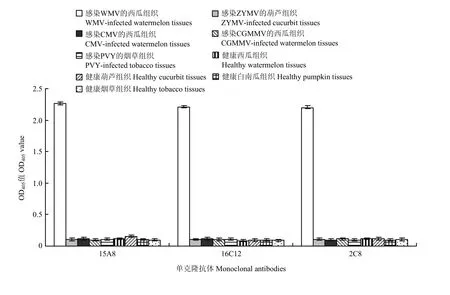
图3 建立的ACP-ELISA方法的特异性分析Fig.3 Specificity analyses of the developed ACP-ELISA

图4 Western blot分析单抗的特异性Fig.4 Specificity analyses of MAbs by Western blot
Tissue blot-ELISA方法特异性分析表明,用建立的Tissue blot-ELISA方法检测感染WMV的西瓜植物组织时呈强烈的阳性反应,而检测感染ZYMV、CMV、CGMMV和PVY的植物组织、健康白南瓜、西瓜、葫芦和烟草的植物组织时呈阴性反应(图 7),说明建立的Tissue blot-ELISA方法具有非常好的特异性。
2.6DAS-ELISA方法的建立及其特异性和灵敏度分析
经不同单抗的组合配对试验发现,当16C12单抗作为捕获抗体,AP偶联15A8单抗作为检测抗体时,DAS-ELISA的检测效果最好。方阵试验结果表明,捕获抗体16C12以1∶5 000倍稀释,AP偶联15A8检测抗体以1∶4 000倍稀释时,DAS-ELISA的检测灵敏度和特异性最好,因此将上述抗体的稀释度作为该方法的最适浓度。根据抗体的最适浓度建立检测WMV的DAS-ELISA方法。特异性分析发现,该方法检测感染 WMV的西瓜植物组织时呈强烈的阳性反应,而检测感染ZYMV、CMV、CGMMV和PVY的植物组织、健康白南瓜、西瓜、葫芦和烟草的植物组织时呈阴性反应,且对比差异显著(图 8),说明该方法具有很好的特异性。灵敏度分析结果表明,该方法对WMV病叶的检测灵敏度达到1∶327 680倍稀释(w/v,g/mL)(图9)。

图5 建立的dot-ELISA方法的特异性分析Fig.5 Specificity analysis of the developed dot-ELISA

图6 建立的dot-ELISA方法的检测灵敏度分析Fig.6 Sensitivity analysis of the developed dot-ELISA
2.7IC-RT-PCR的建立
将单抗15A8作为捕获抗体和设计的引物建立检测WMV的IC-RT-PCR方法,试验发现该方法能从感染WMV的病叶中扩增到与预期大小一致的700 bp左右的特异性条带(图10-A)。用建立的 IC-PT-PCR方法检测1∶1 310 720倍稀释(w/v,g/mL)的感染WMV的西瓜病叶时,仍能够扩增到特异性的700 bp左右基因片段(图10-B),而没有用抗体捕获的对照的灵敏度仅为1∶2 560倍稀释(w/v,g/mL)(图10-C)。将扩增到的目的片段进行克隆、测序和序列分析,结果表明其为WMV的外壳蛋白的基因片段,说明建立的IC-RT-PCR灵敏度高、特异性好,可用于WMV的检测和诊断。

图7 建立的Tissue blot-ELISA方法的特异性分析Fig.7 Specificity analysis of the developed Tissue blot-ELISA
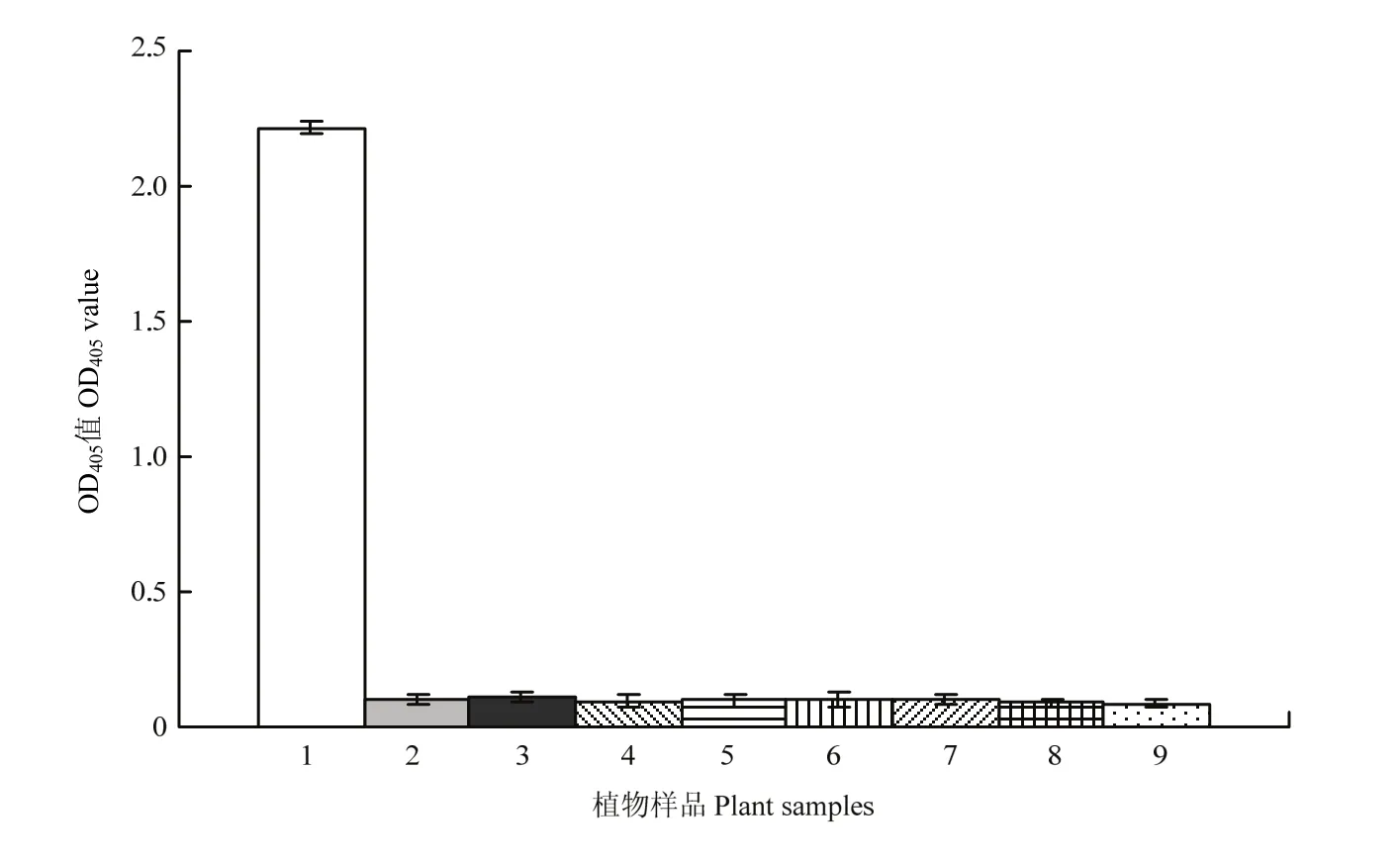
图8 建立的DAS-ELISA方法的特异性分析Fig.8 Specificity analysis of the developed DAS-ELISA
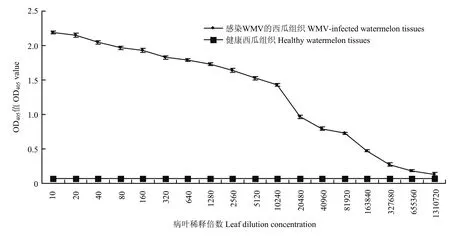
图9 建立的DAS-ELISA方法的灵敏度分析Fig.9 Sensitivity analysis of the developed DAS-ELISA
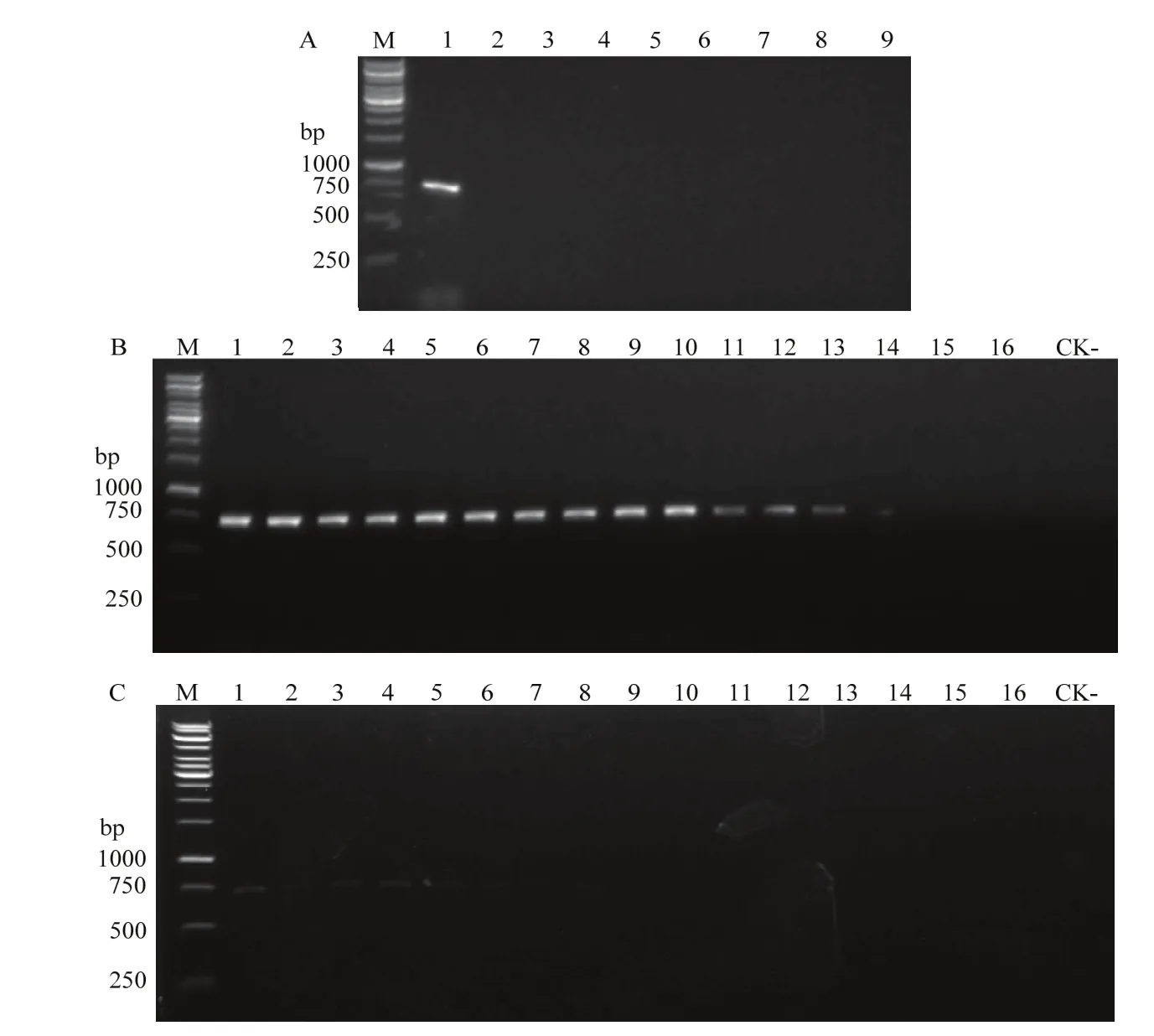
图10 建立的IC-RT-PCR检测WMV的特异性(A)和灵敏度(B、C)Fig.10 Specificity (A) and sensitivity (B,C) analyses of the developed IC-RT-PCR
2.8血清学方法的田间应用
以 WMV单抗为核心建立的 ACP-ELISA、dot-ELISA、Tissue blot-ELISA及DAS-ELISA方法特异性好、灵敏度高,且适于大批量田间样品的检测。利用这4种血清学方法及IC-RT-PCR、RT-PCR对采自浙江省、江苏省、山东省和海南省的275株葫芦科疑似病株进行检测,结果发现其中有187株植物感染WMV,发病率达68%(表2),说明WMV在中国田间葫芦科植物的广泛流行发生。部分代表性的dot-ELISA、Tissue blot-ELISA、DAS-ELISA和IC-RTPCR检测结果如图11所示。血清学方法的检测结果与IC-RT-PCR、RT-PCR方法的检测结果完全一致,部分PCR产物进行核酸测序和序列比对分析表明,这些PCR产物是WMV CP基因片段,证明血清学方法检测阳性的样品确实感染WMV。
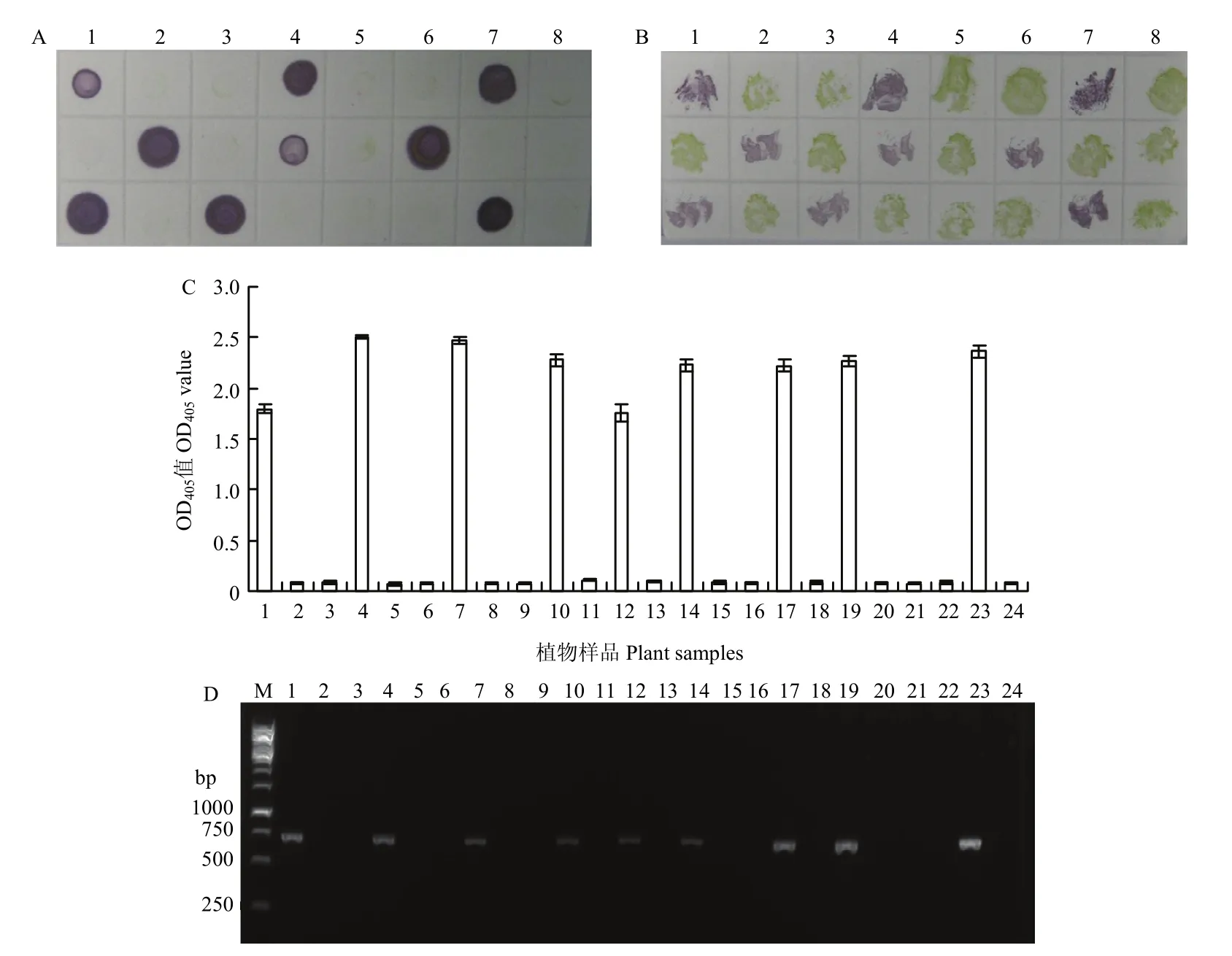
图11 dot-ELISA (A)、Tissue blot-ELISA (B)、DAS-ELISA (C) 和IC-RT-PCR方法 (D) 检测田间样品的代表性结果Fig.11 Representative detection results of field samples by dot-ELISA (A),Tissue blot-ELISA (B),DAS-ELISA (C) and IC-RT-PCR (D)
3 讨论
WMV是瓜类作物病毒最重要的病毒之一。自1954年首先于Florida的西瓜上发现后[21],世界各地相继报道了这种病毒,WMV迅速成为一种全球性的作物病毒,主要流行于温带和地中海地区[22]。中国山西、广西、天津、安徽、辽中地区、陕西、新疆、山东、浙江和江苏等多个地区均有WMV的报道[2]。随着人们生活水平的不断提高,葫芦科作物在日常生活中的相对地位也不断提高,而WMV的存在却导致其损失惨重[9]。近几年西瓜花叶病毒病在中国大部分地区造成的损失高达20%—50%,已成为生产上亟待解决的问题之一[23]。建立快速、特异、灵敏和高通量的检测方法,对于检测、诊断和科学防控西瓜花叶病毒病具有重要实际意义。

表2 田间样品检测Table 2 Detection of field samples
随着生物技术的发展,植物病毒的检测方法也被不断改进,血清学方法更是凭借其特有的优点在实际的检测中得到了广泛的推广和应用。LIN等[9]利用Dr. Jan提供的WMV多抗建立了ACP-ELISA方法,以比较接种后转基因和非转基因植物中 WMV的含量变化;LECOQ等[10]为了检测进口瓜果中的WMV,制备了WMV多抗,并建立了DAS-ELISA方法;DESBIEZ等[11]建立了WMV的TAS-ELISA检测方法,以检测不同地区的WMV分离物,分析其分子变异性。以上这些均是以WMV多抗为核心建立的血清学方法,但并未见其在田间样品大规模检测中应用的报道,且多抗在特异性、灵敏度等多方面均不如单抗。2013年,梁新苗等[12]以制备的 WMV单克隆抗体为核心研发了TAS-ELISA试剂盒,但其抗体的效价只有10-5,且该试剂盒与同属的一些病毒存在弱阳性反应;孔德昭等[13]利用 WMV CP的鼠单抗与兔多抗建立了TAS-ELISA检测方法和电化学纸质免疫检测传感器,其中 TAS-ELISA方法的检测灵敏度仅达到 1∶640 (w/v,g/mL),而电化学纸质免疫检测传感器的灵敏度更低。众所周知,血清学方法的主要缺点是灵敏度不如分子检测方法,导致假阴性结果,而血清学方法的灵敏度主要由抗体的质量决定。另外,还未见有能检测蚜虫中 WMV的抗体及血清学方法的相关报道。
本研究利用提纯的WMV作为免疫原,经细胞融合、筛选、克隆和腹水制备,共获得了7株WMV特异性单克隆抗体,并建立了ACP-ELISA、dot-ELISA、Tissue blot-ELISA和 DAS-ELISA 4种血清学检测方法。该 4种方法均能特异性地检测 WMV,且dot-ELISA、ACP-ELISA和DAS-ELIS方法检测植物样品的灵敏度分别达到1∶5 120、1∶163 840和1∶327 680倍稀释(w/v,g/mL)。据笔者所知,这是该病毒血清学检测方法迄今为止最高的检测灵敏度,从而为该病毒的准确诊断和检测提供可靠的检测技术和检测试剂。而且,在国内外首次建立特异性地检测单头传毒介体蚜虫体内WMV的dot-ELISA方法。Tissue blot-ELISA操作更简单,成本更低,耗时短,尤其适合田间样品的大规模检测和诊断。另外,本研究还建立了检测WMV的IC-RT-PCR方法,它将血清学方法和分子生物学手段进行有机地结合,与常规的RT-PCR检测相比,省去了提取RNA的步骤,避免了RNA提取过程中造成的损失和污染,且提高了血清学方法的检测灵敏度和特异性,该建立的方法对感病植物组织的检测灵敏度最高,达到1∶1 310 720(w/v,g/mL)。这些方法的建立为WMV田间样品的大规模快速检测提供了物质和技术支撑,为中国西瓜花叶病毒病的预报预警体系和科学防控体系的建立打下了基础。
4 结论
以提纯的西瓜花叶病毒粒子为抗原,通过杂交瘤技术获得了3株能稳定传代并分泌WMV单克隆抗体的杂交瘤细胞株2C8、15A8和16C12,并以其分泌的单抗为核心建立了能准确、特异、灵敏地检测田间植物中WMV的ACP-ELISA、DAS-ELISA、dot-ELISA、Tissue blot-ELISA和IC-RT-PCR方法,以及能检测传毒介体蚜虫体内WMV的dot-ELISA方法。建立的5种血清学方法的田间样品检测结果表明,西瓜花叶病毒病在中国葫芦科植物中广泛发生流行。
References
[1] ELBESHEHY E K F,METWALI E M R,ALMAGHRABI O A. Antiviral activity of Thuja orientalis extracts against Watermelon mosaic virus (WMV) on Citrullus lanatus. Saudi Journal of Biological Sciences,2015,22: 211-219.
[2] 周健,顾兴芳,张圣平,苗晗,程斐. 黄瓜对西瓜花叶病毒病抗性的研究进展. 中国蔬菜,2012(10): 7-13. ZHOU J,GU X F,ZHANG S P,MIAO H,CHENG F. Research progress in cucumber resistance to Watermelon mosaic virus. China Vegetables,2012(10): 7-13. (in Chinese)
[3] 张建新,刘起丽,吴云锋. 西瓜花叶病毒外壳蛋白基因的克隆与原核表达. 河南师范大学学报 (自然科学版),2008,36(4): 117-119. ZHANG J X,LIU Q L,WU Y F. Cloning and prokaryotic expression of coat protein gene from watermelon mosaic virus. Journal of Henan Normal University (Natural Science),2008,36(4): 117-119. (in Chinese)
[4] 王慧中,赵培洁,徐吉臣,赵怀,张红生. 转WMV-2外壳蛋白基因西瓜植株的病毒抗性. 遗传学报,2003,30(1): 70-75. WANG H Z,ZHAO P J,XU J C,ZHAO H,ZHANG H S. Virus resistance in transgenic watermelon plants containing a WMV-2 coat protein gene. Acta Genetica Sinica,2003,30(1): 70-75. (in Chinese)
[5] 李凤梅,崔崇士,张耀伟. 西瓜花叶病毒的研究进展. 东北农业大学学报,2002,33(4): 407-411. LI F M,CUI C S,ZHANG Y W. Research advance of Watermelon mosaic virus. Journal of Northeast Agricultural University,2002,33(4): 407-411. (in Chinese)
[6] 宋西娇,陈浙,何步远,李艳敏,王荣洲,吴建祥,洪健. 西瓜花叶病毒和小西葫芦黄花叶病毒复合侵染南瓜的透射电镜诊断. 电子显微学报,2015,34(2): 126-131. SONG X J,CHEN Z,HE B Y,LI Y M,WANG R Z,WU J X,HONG J. Electron microscopic diagnosis of multiple pathogen of Watermelon mosaic virus and Zucchini yellow mosaic virus in infected Cucurbita moschata. Journal of Chinese Electron Microscopy Society,2015,34(2): 126-131. (in Chinese)
[7] KWON J Y,HONG J S,KIM M J,CHOI S H,MIN B E,SONG E G,KIM H H,RYU K H. Simultaneous multiplex PCR detection of seven cucurbit-infecting viruses. Journal of Virological Methods,2014,206: 133-139.
[8] 孟娟,古勤生,林石明,彭斌,刘丽锋,田延平,李莉. 地高辛标记探针检测 5种葫芦科作物病毒的斑点杂交方法. 中国农业科学,2007,40(12): 2741-2746. MENG J,GU Q S,LIN S M,PENG B,LIU L F,TIAN Y P,LI L. Dot-blot hybridization for detection of five cucurbit viruses by digoxigenin-labelled cDNA probes. Scientia Agricultura Sinica,2007,40(12): 2741-2746. (in Chinese)
[9] LIN C Y,KU H M,CHIANG Y H,HO H Y,YU T A,JAN F J. Development of transgenic watermelon resistant to Cucumber mosaic virus and Watermelon mosaic virus by using a single chimeric transgene construct. Transgenic Research,2012,21(5): 983-993.
[10] LECOQ H,DESBIEZ C,WIPF-SCHEIBEL C,GIRARD M. Potential involvement of melon fruit in the long distance dissemination of cucurbit potyviruses. Plant Disease,2003,87: 955-959.
[11] DESBIEZ C,COSTA C,GIRARD C M,LECOQ H. Serological and molecular variability of Watermelon mosaic virus (genus Potyvirus). Archives of Virology,2007,152(4): 775-781.
[12] 梁新苗,李桂芬,马洁,邓丛良,边勇,张永江,李建光,骆卫峰,周琦. 西瓜花叶病毒单克隆抗体及TAS-ELISA试剂盒的研制. 植物检疫,2013,27(2): 53-56. LIANG X M,LI G F,MA J,DENG C L,BIAN Y,ZHANG Y J,LI J G,LUO W F,ZHOU Q. Preparation of the monoclonal antibody against Watermelon mosaic virus and TAS-ELISA kit. Plant Quarantine,2013,27(2): 53-56. (in Chinese)
[13] 孔德昭,朱怡橙,马伟,徐丽广,胥传来. 西瓜花叶病毒三抗体夹心法与纸质免疫检测传感器检测方法的建立. 食品与生物技术学报,2015,34(4): 367-371. KONG D Z,ZHU Y C,MA W,XU L G,XU C L. TAS-ELISA and electrochemical paper assisted immunosensor for the detection of Watermelon mosaic virus. Journal of Food Science and Biotechnology,2015,34(4): 367-371. (in Chinese)
[14] 周雪平,陈集双,李德葆,李尉民. 马铃薯Y病毒组病毒高产量提取方法的建立. 微生物学通报,1994,21(3): 184-186. ZHOU X P,CHEN J S,LI D B,LI W M. A method for high field extraction of potyviruses. Microbiology China,1994,21(3): 184-186. (in Chinese)
[15] WU J X,NI Y Q,LIU H,DING M,ZHOU X P. Monoclonal antibody-based serological assays and immunocapture-RT-PCR for detecting Rice dwarf virus in field rice plants and leafhopper vectors. Journal of Virological Methods,2014,195: 134-140.
[16] SHANG H L,XIE Y,ZHOU X P,QIAN Y J,WU J X. Monoclonal antibody-based serological methods for detection of Cucumber green mottle mosaic virus. Virology Journal,2011,8(1): 228.
[17] LI N,CHEN Z,LIU Y,LIU Y,ZHOU X P,WU J X. Development ofmonoclonal antibodies and serological assays specific for Barley yellow dwarf virus GAV strain. Virology Journal,2015,12: 136.
[18] LIU H,SONG X J,NI Y Q,LU L N,ZHOU X P,WU J X. Highly sensitive and specific monoclonal antibody-based serological methods for Rice ragged stunt virus detection in rice plants and rice brown planthopper vectors. Journal of Integrative Agriculture,2014,13(9): 1943-1951.
[19] LING K S,ZHU H Y,JIANG Z Y,GONSALVES D. Effective application of DAS-ELISA for detection of grapevine leafroll associated closterovirus-3 using a polyclonal antiserum developed from recombinant coat protein. European Journal of Plant Pathology,2000,106: 301-309.
[20] CHEN H,OU Q B,TANG Y,GAO X H,WU L L,XUE C,YU C M,CUI J T,DIAO Y X. Development and evaluation of a DAS-ELISA for rapid detection of Tembusu virus using monoclonal antibodies against the envelope protein. PLOS ONE,2014,9(5): e96366.
[21] DESBIEZ C,JOANNON B,WIPF-SCHEIBEL C,CHANDEYSSON C,LECOQ H. Emergence of new strains of Watermelon mosaic virus in South-eastern France: Evidence for limited spread but rapid local population shift. Virus Research,2009,141: 201-208.
[22] 张建新,吴云锋,王睿,罗朝鹏. 西瓜花叶病毒中国分离株全基因组核苷酸序列测定. 病毒学报,2007,23(2): 153-156. ZHANG J X,WU Y F,WANG R,LUO Z P. Complete nucleotide sequence of Watermelon mosaic virus China isolate. Chinese Journal of Virology,2007,23(2): 153-156. (in Chinese)
[23] 任春梅,程兆榜,缪倩,魏利辉,周益军,范永坚. 江苏省葫芦科作物西瓜花叶病毒的分子鉴定和序列分析. 南方农业学报,2013,44(9): 1464-1470. REN C M,CHENG Z B,MIAO Q,WEI L H,ZHOU Y J,FAN Y J. Molecular identification and sequence analysis for watermelon mosaic virus in Jiangsu. Journal of Southern Agriculture,2013,44(9): 1464-1470. (in Chinese)
(责任编辑 岳梅)
Preparation and Application of Monoclonal Antibodies Against Watermelon mosaic virus (WMV)
CHEN Zhe,SONG Ge,ZHOU Xue-ping,WU Jian-xiang
(Institute of Biotechnology,Zhejiang University/State Key Laboratory of Rice Biology,Hangzhou 310058)
【Objective】The aim of this study is to prepare monoclonal antibodies (MAbs) against Watermelon mosaic virus (WMV) and develop effective serological assays for rapid and reliable virus detection,and to provide technology and materiel fordiagnosis and detection,forecast and early warning and establishment of a scientific prevention and control system of the WMV disease.【Method】Using the purified WMV particles as an immunogen,hybridoma lines secreting MAbs specific for WMV were obtained via cell fusion,cell culture,antibody detection and cell cloning. The hybridomas were injected intraperitoneally into BALB/c mice to produce MAb-containing ascitic fluids. Based on the prepared MAbs,five detection assays,ACP-ELISA,DAS-ELISA,dot-ELISA,Tissue blot-ELISA and IC-RT-PCR were developed for accurately,sensitively and specifically detecting WMV in field plant samples. Besides,a dot-ELISA for specifically detecting WMV in individual viruliferous aphid was established.【Result】Three hybridoma lines (2C8,15A8 and 16C12) steadily secreting MAbs specific for WMV and their MAb-containing ascitic fluids were produced. The titers of ascitic fluids of MAbs were up to 10-6by indirect-ELISA. All these MAbs belong to IgG1 isotype,κ light chain. Western blot analyses indicated that all these three MAbs could specifically react with the coat protein of WMV. The ACP-ELISA,DAS-ELISA,dot-ELISA and IC-RT-PCR could detect WMV in infected plant crude extracts diluted up to 1∶163 840,1∶327 680,1∶5 120 and 1∶1 310 720 (w/v,g/mL),respectively. And the specificity analyses demonstrated that the developed ACP-ELISA,DAS-ELISA,dot-ELISA,Tissue blot-ELISA and IC-RT-PCR had strongly positive immune reactions with WMV-infected plant tissues,but had negative reactions with healthy,ZYMV-,CMV-,CGMMV-infected cucurbitaceous plant tissues or PVY-infected tobacco plant tissues. Besides,the developed dot-ELISA for detecting vector sample had a strongly positive immune reaction with individual viruliferous aphid,and negative reactions with non-viruliferous aphids. A total of 275 cucurbitaceous plant samples showing virus-like symptoms from Zhejiang,Jiangsu,Shandong and Hainan provinces in China were screened for the presence of WMV using the developed assays,and the detection results showed that 187 of the 275 plant samples were infected by WMV and the incidence rate was up to 68%,demonstrating that WMV is prevalent in field cucurbitaceous plants in China. And the detection results of serological assays were in agreement with those of RT-PCR. The sequences of PCR-amplified products were sequenced and compared with the WMV CP sequences. The results indicated that the nucleotide sequences of the PCR-amplified products were WMV CP gene segment,demonstrating that the positive samples tested by serological assays were really infected with WMV.【Conclusion】Three specific and sensitive MAbs against WMV and the five developed assays based on prepared MAbs in this study could accurately,sensitively and reliably detect WMV in field plant or vector samples,which would provide technology and materiel for rapid detection and diagnoses of field large-scale samples,forecast and early warning,scientific prevention and control of WMV disease in China.
Watermelon mosaic virus (WMV); monoclonal antibody; ACP-ELISA; DAS-ELISA; dot-ELISA; Tissue blot-ELISA; IC-RT-PCR
2016-03-31;接受日期:2016-05-16
国家自然科学基金(31272015)、国家公益性行业(农业)科研专项(201203076-05)
联系方式:陈浙,E-mail:chenzhelily@163.com。宋革,E-mail:songge3368@163.com。陈浙和宋革为同等贡献作者。通信作者周雪平,E-mail:zzhou@zju.edu.cn。通信作者吴建祥,E-mail:wujx@zju.edu.cn

