华蟾毒精对小鼠巨噬细胞功能的影响
孟显华,于 洋,郝 璐,刘天明,付 越,李敬双
(锦州医科大学 畜牧兽医学院,辽宁 锦州 121001)
华蟾毒精对小鼠巨噬细胞功能的影响
孟显华,于洋,郝璐,刘天明,付越,李敬双
(锦州医科大学 畜牧兽医学院,辽宁 锦州 121001)
【目的】 阐明华蟾毒精(CBG)对巨噬细胞功能的影响,为CBG的开发和利用提供理论依据。【方法】 利用Balb/c小鼠制备与纯化腹腔巨噬细胞,采用不同质量浓度(0.5,1.0,1.5,2.0 mg/L)CBG作用于巨噬细胞,采用MTT法检测CBG对巨噬细胞吞噬金黄色葡萄球菌的影响;采用Griess法检测CBG对巨噬细胞分泌NO的影响;采用ELISA法检测CBG对巨噬细胞分泌IL-6、TNF-α和GM-CSF的影响。【结果】 CBG质量浓度为1.0,1.5和2.0 mg/L组均能极显著提高巨噬细胞的吞噬功能;CBG质量浓度为0.5 mg/L 组能显著促进巨噬细胞NO的分泌,而 1.0,1.5和2.0 mg/L CBG组均能极显著促进巨噬细胞NO的分泌;CBG质量浓度为1.0,1.5和2.0 mg/L组均能极显著促进巨噬细胞IL-6的分泌; 1.0 mg/L CBG组能显著促进巨噬细胞TNF-α的分泌, 1.5和2.0 mg/L CBG组均能极显著促进巨噬细胞TNF-α的分泌;CBG质量浓度为0.5,1.0,1.5和2.0 mg/L组均能极显著促进巨噬细胞GM-CSF的分泌。【结论】 CBG能提高巨噬细胞的吞噬功能和分泌功能,说明CBG具有良好的抗炎、抗肿瘤和提高免疫等作用。
华蟾毒精;巨噬细胞;吞噬功能;分泌功能
蟾酥为中国的传统中药,具有免疫调节、抗肿瘤、抗炎、局部麻醉、升血压等作用,在人类医学上对各种疾病的治疗作用已经得到国内外的认可。关于蟾酥在动物医学上应用的研究较少,现有研究结果表明其具有免疫调节、抗肿瘤和抗病毒等作用[1-9]。华蟾毒精(CBG)是从蟾酥中分离出的一种单体,也被称为华蟾酥毒基,是含有醚键的甾体化合物,难溶于水,相对分布广,在体内半衰期短且具有很强的毒性。
巨噬细胞几乎存在于机体的所有组织中,在机体众多的生理和病理反应过程中发挥着重要作用,具有较强的吞噬和杀伤能力,既能参与非特异性免疫的生理过程,又能呈递抗原、产生细胞因子和参与特异性免疫应答[10-11]。当机体受到病原体、肿瘤细胞和有毒物质等刺激时,巨噬细胞从未活化状态转变为活化状态,激活的巨噬细胞除了可以直接杀伤病原微生物、吞噬机体衰老细胞,还可释放大量生物活性因子,包括一氧化氮(NO)、肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)、白细胞介素6(IL-6)和粒细胞集落刺激因子(GM-CSF)等以及其他可激活防御反应的物质[12-14],这些生物活性因子参与机体的炎症反应,在先天性免疫预防和获得性免疫应答中更有不可替代的作用。CBG具有局麻、强心、升压和提高机体免疫力等功效,前人对其免疫机制的研究多集中在机体特异性免疫方面,Remko等[15]研究发现,CBG对免疫抑制剂环磷酰胺造成的免疫低下具有缓解作用。Jiang等[16]研究表明,CBG对环磷酰胺引起的小鼠脾脏和胸腺损害有一定的保护作用,可提高T、B淋巴细胞的刺激指数,缓解环磷酰胺引起的T淋巴细胞亚群紊乱。但对于CBG在机体非特异性免疫方面的研究很少,巨噬细胞主要参与机体的非特异性免疫反应,因此本试验研究了CBG对巨噬细胞功能的影响,为CBG的进一步开发和利用提供理论依据。
1 材料与方法
1.1材料
1.1.1试验动物和菌株Balb/c小鼠,体质量 18~22 g/只,购自吉林大学医学部;金黄色葡萄球菌(编号AB91093),由中国典型培养物保藏中心(CCTCC)提供。
1.1.2主要试剂CBG(生产批号:MUST-12062610,成都曼斯特生物有限公司),RPMI-1640培养液(Invitrogen GIBICOTM),胎牛血清(PAA Austria),刀豆蛋白A(Con A)和脂多糖(LPS)(SIGMA,USA),NO检测试剂盒(Promega.USA),IL-6、TNF-α、GM-CSF试剂盒(Bender Medsystem),多粘菌素B硫酸盐(PMB)(SIGMA,USA),一次性0.22 μm除菌过滤器(Millpore公司),D-Hank’s液(北京华迈科生物技术有限责任公司),Tris-NH4Cl溶液(上海优选生物技术有限责任公司),DMEM培养基(北京北方同正生物技术发展有限公司)。
1.2方法
1.2.1小鼠腹腔巨噬细胞的制备与纯化选取体质量为18~22 g/只 Balb/c小鼠,颈椎脱臼处死,于体积分数75%酒精中浸泡消毒3 min,取出沥干,腹腔注射RPMI-1640培养液5 mL,冲洗腹腔,反复抽吸数次,轻揉小鼠腹部2~3 min,然后切开腹壁暴露腹膜,用注射器抽取腹腔液,Tris-NH4Cl溶液溶血,收集腹腔悬液,2 000 r/min离心5 min,弃上清,用PBS洗涤细胞2次。将细胞沉淀用RPMI-1640培养液重悬,Trypan Blue染色计数活细胞达95%以上,将细胞密度调整为5×106mL-1,最后制成悬液。向96孔细胞培养板的每孔加入100 μL细胞悬液,置 37 ℃、体积分数5% CO2培养箱中培养,2 h后去上清,再用RPMI-1640培养液洗细胞培养板1次,去上清,最后每孔加入100 μL RPMI-1640培养液,培养板孔内贴壁细胞即为纯化的小鼠腹腔巨噬细胞。
1.2.2CBG对巨噬细胞吞噬功能的影响取96孔培养板,每孔加入100 μL上述巨噬细胞培养液,再加入不同质量浓度(0,0.5,1.0,1.5和2.0 mg/L)CBG,CBG的质量浓度依据预试验结果确定。培养48 h 后,在每孔中加入107~109CFU/mL金黄色葡萄球菌菌液50 μL,每组均设3个复孔,培养24 h后每孔加入20 μL MTT,继续培养4 h,离心弃上清,沉淀用DMSO溶解,用酶标仪测定570 nm处的OD570值,OD570值越大表示巨噬细胞的吞噬能力越强。
1.2.3CBG对巨噬细胞分泌NO的影响刮取对数生长期的小鼠腹腔巨噬细胞,调整细胞密度为2×105mL-1,接种于24孔培养板中,每孔1 mL;每孔加入1 mL 含不同质量浓度CBG的DMEM培养基,使CBG的质量浓度分别为0,0.5,1.0,1.5和2.0 mg/L。每个质量浓度均设 3个复孔,每孔溶液终体积为 2 mL,置 37 ℃、体积分数5% CO2培养箱中培养 24 h 后离心,取细胞上清液,通过Griess试剂法测定NO浓度,具体操作按NO检测试剂盒的说明书进行。
1.2.4CBG对巨噬细胞分泌IL-6、TNF-α和GM-CSF的影响巨噬细胞处理方法同1.2.3节,培养24 h取样离心,收集上清,采用ELISA 方法检测IL-6、TNF-α和GM-CSF质量浓度,具体操作根据IL-6、TNF-α和GM-CSF检测试剂盒的说明书进行。
1.3数据处理
试验数据均以“平均数±标准差”表示,数据分析用统计学软件SPSS 13.0进行。
2 结果与分析
2.1CBG对巨噬细胞吞噬功能的影响
不同质量浓度华蟾毒精(CBG)对巨噬细胞吞噬功能的影响结果见图1。
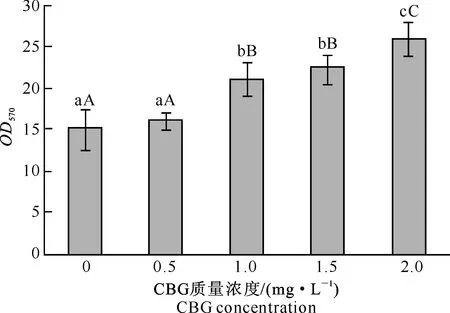
图 1 不同质量浓度华蟾毒精(CBG)对 巨噬细胞吞噬功能的影响图柱上标不同小写字母表示处理间差异显著(P<0.05), 标不同大写字母表示处理间差异极显著(P<0.01),下图同Fig.1 Effect of CBG at different concentrations on phagocytosis of macrophages Different lowercase letters indicate significant difference (P<0.05) between treatments,different uppercase letters indicate extremely significant difference (P<0.01).The same below
由图1可知,与对照组(0 mg/L)相比,0.5 mg/L CBG处理组巨噬细胞的吞噬能力无显著变化,1.0,1.5,2.0 mg/L CBG处理组巨噬细胞的吞噬能力均极显著提高;除1.0与1.5 mg/L CBG处理组差异不显著外,其余质量浓度CBG处理组之间差异均极显著;巨噬细胞的吞噬能力随着CBG质量浓度的提高而增大,且对CBG质量浓度具有依赖性。
2.2CBG对巨噬细胞分泌NO的影响
由图2可知,与对照组(0 mg/L)相比,0.5和1.0 mg/L CBG处理组巨噬细胞NO的分泌量显著提高,1.5和2.0 mg/L CBG处理组巨噬细胞NO的分泌量均极显著提高;CBG不同质量浓度组之间比较,除0.5与1.0 mg/L CBG处理组NO的分泌量差异显著外,其余质量浓度CBG处理组之间NO的分泌量差异均极显著;巨噬细胞NO的分泌量随着CBG质量浓度的提高而增多,且对CBG质量浓度具有依赖性。
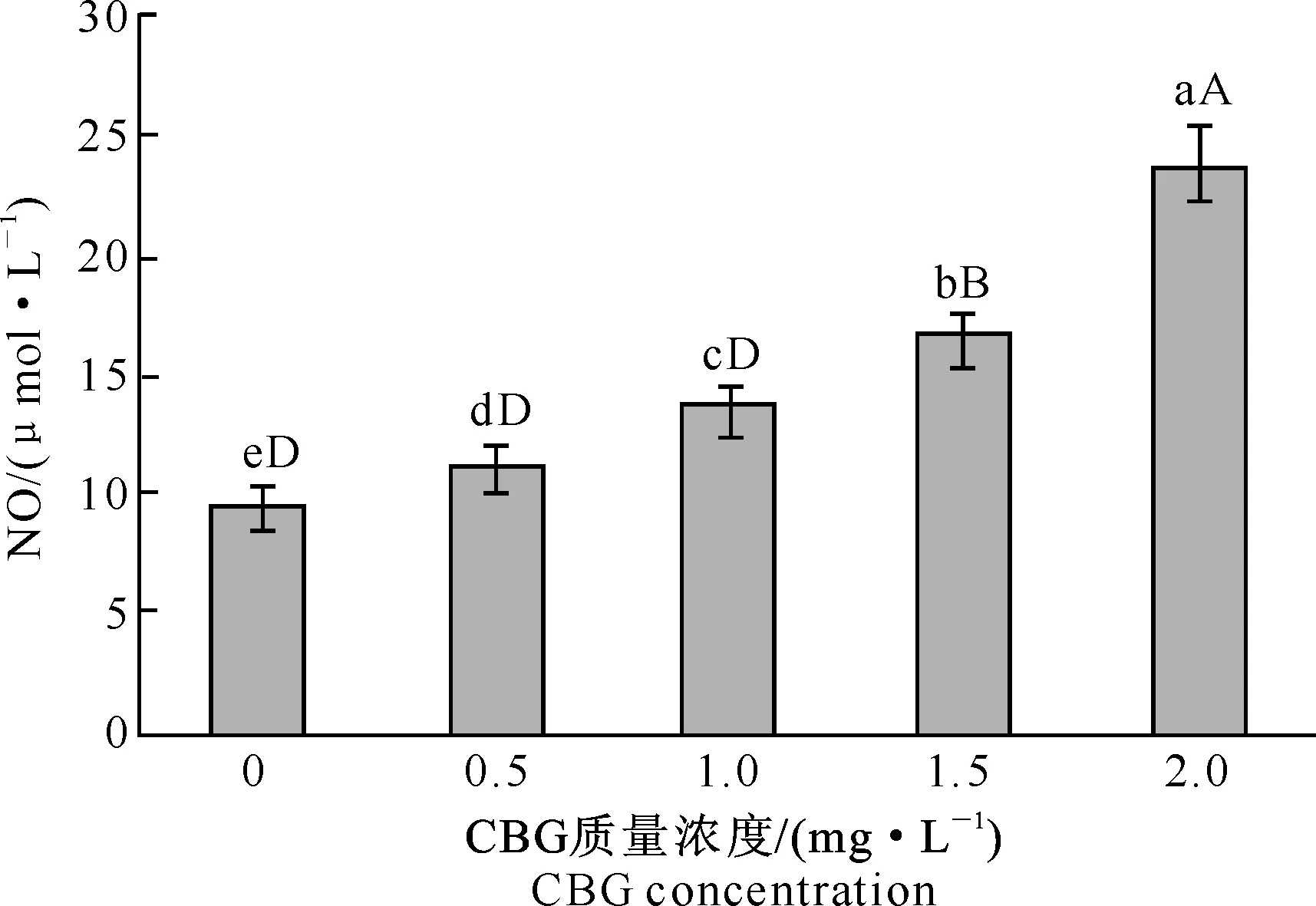
图 2不同质量浓度华蟾毒精(CBG)对巨噬细胞分泌NO的影响
Fig.2Effect of CBG at different concentrations on NO secretion of macrophages
2.3CBG对巨噬细胞分泌IL-6、TNF-α和GM-CSF的影响
2.3.1对IL-6分泌的影响由图3可知,与对照组(0 mg/L)相比,0.5 mg/L CBG处理组巨噬细胞IL-6的分泌量无显著变化,1.0 mg/L CBG处理组巨噬细胞IL-6的分泌量显著提高,1.5和2.0 mg/L CBG处理组巨噬细胞IL-6的分泌量均极显著提高;除0.5与1.0 mg/L CBG处理组差异显著外,其余质量浓度CBG处理组之间差异均极显著;巨噬细胞IL-6的分泌量随着CBG质量浓度的提高而增大,且对CBG质量浓度具有依赖性。
2.3.2对TNF-α分泌的影响由图4可知,与对照组(0 mg/L)相比,0.5 mg/L CBG处理组巨噬细胞TNF-α的分泌量无显著变化,1.0 mg/L CBG处理组巨噬细胞TNF-α的分泌量显著提高,1.5和 2.0 mg/L CBG处理组巨噬细胞TNF-α的分泌量均极显著提高;0.5与1.0 mg/mL CBG处理差异不显著,1.0与1.5 mg/L CBG处理差异显著,其余质量浓度CBG处理组之间差异均极显著;巨噬细胞TNF-α的分泌量随着CBG质量浓度的提高而增多,且对CBG质量浓度具有依赖性。
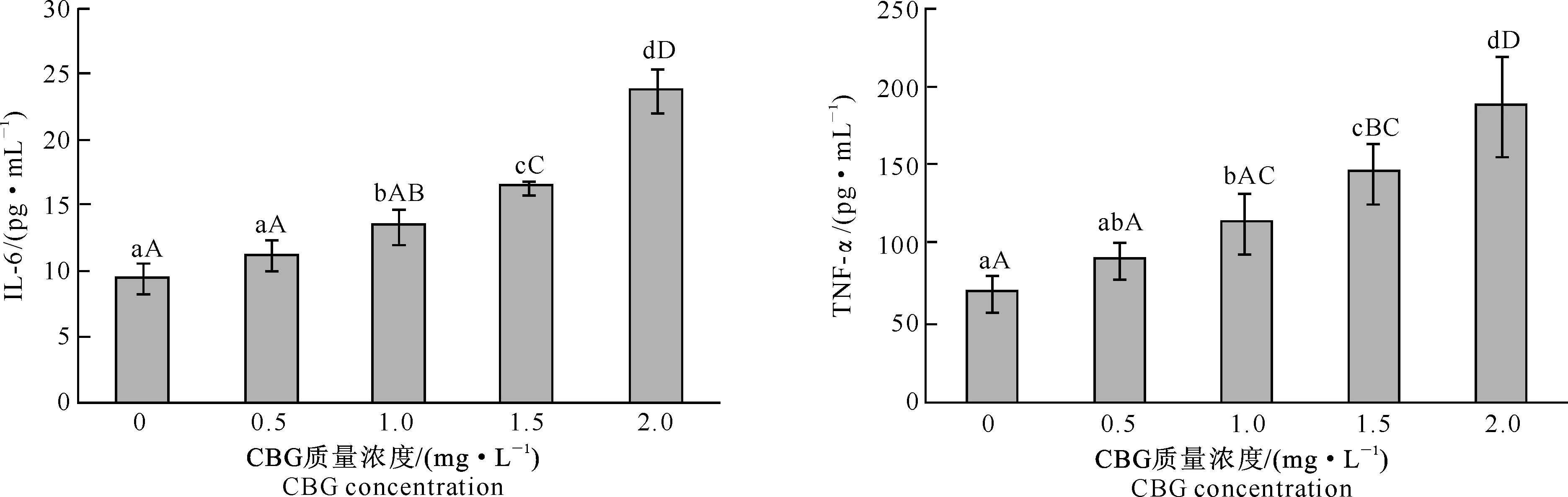
图 3不同质量浓度华蟾毒精 (CBG)对巨噬细胞分泌IL-6的影响
Fig.3Effect of CBG at different concentrations on IL-6 secretion of macrophages
图 4不同质量浓度华蟾毒精(CBG)对巨噬细胞分泌TNF-α的影响
Fig.4Effect of CBG at different concentrations on TNF-α secretion of macrophages
2.3.3对GM-CSF分泌的影响由图5可知,与对照组(0 mg/L)相比,不同质量浓度 CBG处理组巨噬细胞GM-CSF的分泌量均极显著提高;0.5与1.0 mg/L CBG处理组及1.5与2.0 mg/L CBG处理组差异不显著,1.0与1.5 mg/L CBG处理组差异显著,其余质量浓度CBG处理组之间差异均极显著;巨噬细胞GM-CSF的分泌量随着CBG质量浓度的提高而增多,且对CBG质量浓度具有依赖性。
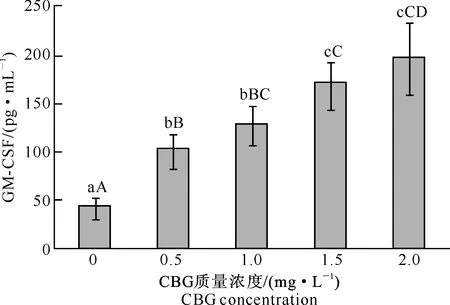
图 5 不同质量浓度华蟾毒精(CBG)对 巨噬细胞分泌GM-CSF的影响Fig.5 Effect of CBG at different concentrations on GM-CSF secretion of macrophages
3 讨 论
巨噬细胞可吞噬外来病原体和机体自身异变细胞,是非特异性免疫的组成部分。巨噬细胞吞噬能力的高低可直接反映机体的免疫水平。本研究结果表明,CBG能显著提高巨噬细胞的吞噬能力,从而提高机体的非特异性免疫功能,这与姜峰等[1]的研究结果是一致的。
NO不仅可以增强巨噬细胞的活性,还在不同的免疫调节反应中起着重要的作用[17-19]。在单核/巨噬细胞中,NO由 iNOS催化底物左旋精氨酸(L-Arg)介导产生,iNOS 的活性可被 LPS或某些细胞因子,如 TNF-α和 IFN-γ 等激活[20]。本研究结果表明CBG可以诱导小鼠腹腔巨噬细胞NO的分泌,从而增强巨噬细胞的活性。
免疫系统细胞的增殖、分化和功能受到一系列细胞因子的调节。IL-6可促进T细胞表面IL-2r的表达,增强IL-1和TNF对Th细胞的有丝分裂作用,促进B细胞增殖、分化并产生抗体;IL-6还能有效地促进TNF和IL-1诱导的恶病质。IL-6主要免疫学功能是加强其他细胞因子的效果。本研究结果表明,CBG可以诱导小鼠腹腔巨噬细胞IL-6的分泌,从而提高淋巴细胞的活性。
TNF-α主要通过诱导肿瘤细胞凋亡、破坏肿瘤组织血管、介导免疫调节作用、放化疗增敏作用等产生抗肿瘤作用,是迄今为止所发现的抗肿瘤活性最强的细胞因子之一。本研究结果表明,CBG可以诱导小鼠腹腔巨噬细胞TNF-α的分泌,从而增强小鼠机体免疫功能,提高抗肿瘤作用。
目前普遍认为,GM-CSF能刺激粒细胞及巨噬细胞等白细胞的增殖、分化及活化作用,从而增强造血功能;能促使效应细胞增强如吞噬细菌及消灭癌细胞等免疫活动。本研究结果表明,CBG可以诱导小鼠腹腔巨噬细胞GM-CSF的分泌,从而增强小鼠机体免疫功能,提高抗肿瘤和抗炎作用。
[1]姜峰,邓旭明,韩小虎,等.蟾酥不同溶剂萃取物对小鼠免疫细胞功能的影响 [J].中国药理学与毒理学杂志,2008,22(1):63-69.
Jiang F,Deng X M,Han X H,et al.Effects of different solvents toad venom extract on immune cell function in mice [J].Chinese Journal of Pharmacology and Toxicology,2008,22(1):63-69.
[2]程相朝,陈树兴,郭曹彰,等.中药蟾酥免疫增强剂对MD鸡外周血液ANAE T淋巴细胞动态的影响 [J].河南农业科学,1998(1):34-36.
Cheng X C,Chen S X,Guo C Z,et al.Traditional Chinese medicine toad venom immune enhancer for MD chicken peripheral blood tlymphocyte ANAE dynamic impact [J].Journal of Henan Agricultural Science,1998(1):34-36.
[3]王福传,韩一超,赵洪恩,等.复方中药蟾酥免疫增强剂对鸡免疫器官组织形态学影响的研究 [J].中国预防兽医学报,2001,23(6):419-421.
Wang F C,Han Y C,Zhao H E,et al.Compound traditional Chinese medicine toad venom immune enhancer on the immune organ histomorphology of chicken research [J].China Preventive Veterinary Journal,2001,23(6):419-421.
[4]于洋,安娜,王小亮,等.蟾酥注射液对小鼠免疫细胞影响的实验研究 [J].中国农学通报,2009,25(22):1-6.
Yu Y,An N,Wang X L,et al.The effect of toad venom injection on the immune cells of mice experiment research [J].China Agriculture Bulletin,2009,25(22):1-6.
[5]于洋,唐雨顺,张玉科,等.蟾酥注射液对马立克氏病疫苗的保护作用 [J].中国农学通报,2011,27(17):38-44.
Yu Y,Tang Y S,Zhang Y K,et al.Toad venom injection on marek’s disease vaccine protection function [J].China Agriculture Bulletin,2011,27(17):38-44.
[6]于洋,唐雨顺,张玉科,等.中药蟾酥免疫增强剂对肉仔鸡免疫器官生长发育及免疫活性细胞的影响 [J].中国农学通报,2011,27(1):403-406.
Yu Y,Tang Y S,Zhang Y K,et al.Traditional Chinese medicine toad venom immune enhancement on immune organs ratewas growth and immune active cells influence [J].China Agriculture Bulletin,2011,27(1):403-406.
[7]李敬双,于洋.蟾酥注射液对马立克氏病预防作用的研究 [J].中国农学通报,2011,27(17):45-49.
Li J S,Yu Y.Toad venom injection on marek’s disease prevention function research [J].China Agriculture Bulletin,2011,27(17):45-49.
[8]李敬双,于洋,唐雨顺,等.蟾酥注射液佐剂对鸡新城疫、传染性支气管炎二联活疫苗免疫效果的影响 [J].中国农学通报,2011,27(20):71-75.
Li J S,Yu Y,Tang Y S,et al.Toad venom injection adjuvants to newcastle disease,infectious bronchitis bigeminal vaccine immunization effect [J].China Agriculture Bulletin,2011,27(20):71-75.
[9]于洋,李敬双.蟾酥注射液对小鼠淋巴细胞影响的研究 [J].中国农学通报,2012,28(5):41-47.
Yu Y,Li J S.The research of toad venom injection in mice lymphocyte [J].China Agriculture Bulletin,2012,28(5):41-47.
[10]Janeway C A,Medzhitov R.Innate immune recognition [J].Annu Rev Immunology,2006(20):197-216.
[11]Kiyohara H,Uchida T,Takakiwa M,et al.Different contributions of side-chains in beta-D-(1->6)-galactans on intestinal Peyer’s patch-immunomodulation by polysaccharides fromAstragalusmongholicsBunge [J].Phytochemistry,2009,71(2):280-293.
[12]Li,R.Extraction,characterization ofAstragaluspolysaccharidesand its immune modulating activities in rats with gastric cancer [J].Carbohydrate Polymers,2009,78(4):738-742.
[13]Yin X L.Enhancement of the innate immune response of bladder epithelial cells byAstragaluspolysaccharidesthrough upregulation of TLR4 expression [J].Biochemical and Biophysical Research Communications,2010,397(2):232-238.
[14]Li S G,Zhang Y Q.Characterization and renal protective effect of a polysaccharide fromAstragalusmembranaceus[J].Carbohydrate Polymers,2009,78(2):343-348.
[15]Remko O,Fang H.Phosphorylation-dependent traffcking of plasma membrane proteins in animal and plant cells [J].Journal of Integrative Plant Biology,2013,55(9):789-808.
[16]Jiang C,Zou Y,Liu X,et al.Dose-dependent effects of lanthanum chloride on wear particle-induced aseptic inflammation in a murine air-pouch model [J].Journal of Rare Earths,2013,31(4):420-427.
[17]Gordon S.Pattern recognition receptors: doubling up for the innate immune response [J].Cell,2002,111(7):927-930.
[18]Bolander Jr F F.The role of nitric oxide in the biological activity of prolactin in the mouse mammary gland [J].Mol Cellular Endocrinol,2001,174(1/2):91-98.
[19]Kozlowska K,Cichorek M,Wachulska M,et al.Role of interleukins and nitric oxide secretion by peritoneal macrophages in differential tumoricidal effect to transplantable melanomas as regarding their biological properties [J].Immunotoxicol,2006,28(2):305-317.
[20]Huang Z,Hoffmann F W,Fay J D,et al.Stimulation of unprimed macrophages with immune complexes triggers a low output of nitric oxide by calcium-dependent neuronal nitric-oxide synthase [J].J Biol Chem,2012,287(7):492-502.
Effect of cinobufagin on macrophage function of mice
MENG Xianhua,YU Yang,HAO Lu,LIU Tianming,FU Yue,LI Jingshuang
(CollegeofAnimalHusbandryandVeterinaryMedicine,JinzhouMedicalUniversity,Jinzhou,Liaoning121001,China)
【Objective】 This study investigated the effect of cinobugagin (CBG) on macrophage function of mice to provide basis for its development and utilization. 【Method】 Balb/c mice were used for preparation and purification of peritoneal macrophages,and CBG with different mass concentrations (0.5,1.0,1.5,2.0 mg/L) were applied on macrophages with blank control.After samples were taken,MTT method was used to detect effect on macrophage phagocytosis of staphylococcus aureus,Griess method was used to detect effect on NO secretion of macrophages,and ELISA method was used to test the effect on secretion of IL-6,TNF-α and GM-CSF.【Results】 CBG groups with mass concentrations of 1.0,1.5,and 2.0 mg/L could significantly increase macrophage phagocytosis.CBG at concentration of 0.5 mg/L group significantly promoted NO secretion,and CBG at concentrations of 1.0,1.5,and 2.0 mg/L significantly promoted NO secretion.CBG at mass concentrations of 1.0,1.5,and 2.0 mg/L significantly promoted secretion of IL-6.CBG at mass concentration of 1.0 mg/L significantly promoted TNF-α secretion,and mass concentrations of 1.5 and 2.0 mg/L significantly promoted TNF-α secretion.CBG at mass concentrations of 0.5,1.0,1.5,and 2.0 mg/L significantly promoted GM-CSF secretion. 【Conclusion】 CBG can enhance macrophage phagocytosis function and secretion function,thus it has good function of anti-inflammatory,anti-tumor and improving immune.
cinobufagin;macrophage;phagocytosis function;secretion funtion
网络出版时间:2016-07-1208:4510.13207/j.cnki.jnwafu.2016.08.010
2014-08-21
辽宁省科技攻关计划项目(2014214016);辽宁医学院校长基金-研究生科技创新基金项目(QM2014005)
孟显华(1990-),女,辽宁朝阳人,在读硕士,主要从事兽医药理学研究。E-mail:549719090@qq.com
李敬双(1963-),女,辽宁锦州人,教授,硕士,主要从事兽医药理学与免疫学的研究。E-mail:ljs4680399@163.com
S859.7
A
1671-9387(2016)08-0061-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160712.0845.020.html

