内蒙古绒山羊骨骼肌蛋白差异表达谱分析
赵 珺,张文广,苏 蕊,刘志红,张燕军,王 乐,付绍印,李金泉
(1 内蒙古农业大学 动物遗传育种重点实验室,内蒙古 呼和浩特010018;2 内蒙古化工职业学院,内蒙古 呼和浩特010010)
内蒙古绒山羊骨骼肌蛋白差异表达谱分析
赵珺1,2,张文广1,苏蕊1,刘志红1,张燕军1,王乐1,付绍印1,李金泉1
(1 内蒙古农业大学 动物遗传育种重点实验室,内蒙古 呼和浩特010018;2 内蒙古化工职业学院,内蒙古 呼和浩特010010)
【目的】 研究内蒙古绒山羊背最长肌、臂三头肌和臀肌的蛋白差异表达谱。【方法】 以3只在相同背景下饲养的绒山羊成年母羊为研究对象,屠宰后取背最长肌、臂三头肌和臀肌3个部位骨骼肌,采用差异双向电泳方法建立蛋白质谱,找出17个差异表达蛋白点,并进行质谱分析。【结果】 成功鉴定并匹配到 15个差异表达蛋白,其中9个与山羊肌肉发育相关。背最长肌中发现的位于FGF2反义链的蛋白的功能主要是独立控制FGF2的表达,同时具有激素调节和抗增殖的作用;背最长肌和臂三头肌中发现的轻链肌球蛋白(MyLC)家族成员,其类型在2种肌肉组织中不同,功能是控制肌肉收缩。背最长肌和臂三头肌中的MyLC蛋白分子质量存在差异。【结论】 建立了绒山羊骨骼肌差异蛋白谱,挖掘到了与肉质相关的蛋白,其主要为控制肌肉收缩的结构蛋白。
绒山羊;骨骼肌;差异蛋白;质谱分析
在当前农业产业结构由粗放型向集约型过渡的情况下,单纯地发展绒山羊或肉羊已经不符合发展需要,发展绒肉兼用品种势在必行。内蒙古绒山羊以其优质的羊绒品质而著称,其所产山羊绒质地柔软、洁白、细度及光泽度好,同时内蒙古绒山羊又具有肉质鲜美、胆固醇含量低、富含多种必需氨基酸和不饱和脂肪酸等特性,如其肉用特性相关的分子机理得到挖掘,则对现实生产具有一定的指导意义,在产生经济效益的同时还能填补国内对绒山羊肉质系统研究的空白。国外学者对山羊肉的品质研究起步较早,并取得了一定的进展[1-2]。我国对羊肉的研究起步较晚,并且多集中在肉的产量和其生长速度方面[3],对品质的研究较少,应用高通量技术(蛋白质组技术和转录组技术)对山羊肉品质的研究则更少。基因组在生物体内相对比较稳定,但其转录及翻译受到许多因素的影响和制约。蛋白质的表达也具有一定的可调节性,表达产物功能更活跃,更接近生物体本质。因此,相对于转录组技术,蛋白质组学在肉类研究中的优越性更为明显。蛋白质组学可以解决蛋白磷酸化、糖基化和水解、裂解等难题[4]。差异蛋白质组学,又称为比较蛋白质组学,通常是对重大生理过程的蛋白质表达进行比较,以对某些关键蛋白进行定性和功能分析,从而揭示生物在生长发育过程中或在受到外界环境刺激后的反应机理。在蛋白质组学研究中,双向电泳是最重要的技术手段,但存在操作繁杂的缺点,实际工作中若要达到熟练应用比较困难。然而双向电泳在反映蛋白质的种类、表达水平的变化等方面表现突出,因此被广泛应用[5]。动物骨骼肌的生长发育是一个非常复杂的过程,受到分子调控网络的精确调节,其分子机制目前还不完全清楚,利用差异蛋白表达谱技术则能更好地阐明骨骼肌差异蛋白的功能和结构。目前,差异蛋白质组学在猪肉品质研究中的应用较多,且多数研究认为肌肉的差异受环境因素的影响较少,主要体现在与糖酵解代谢相关的酶活性的差异上[6]。本研究利用基于双向电泳和质谱技术的差异蛋白质组学分析方法,研究内蒙古绒山羊背最长肌、臂三头肌和臀肌的蛋白差异表达谱,初步筛选与肌肉发育相关的差异蛋白,旨在为从蛋白水平探讨绒山羊肌肉发育的分子基础提供依据,为揭示内蒙古绒山羊的肉质特色提供重要依据。
1 材料与方法
1.1材料
1.1.1研究对象新鲜的绒山羊背最长肌、臀三头肌和臀肌采自内蒙古白绒山羊种羊场。取3只成年周岁母羊,屠宰后取所需肌肉组织临时用液氮保存,后存放于-80 ℃备用。
1.1.2试剂磷酸盐抽提缓冲液(PBS)、Bradford工作液、10×蛋白标准液、1×蛋白标准液、SDS,均为Sigma公司产品;尿素、硫脲、CHAPS、DTT、考马斯亮蓝蛋白含量测定试剂盒,均为Amresco公司产品;蛋白上样缓冲液、甘氨酸、Tris、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、考马斯亮蓝(CBB)G-250,均为Amresco公司产品;IPG干胶条(17 cm)、40 g/L Bio-lyte(pH 3~10)、碘乙酰胺、2-D clean up Kit试剂盒和矿物油,均为Bio.Ra公司产品;其余试剂均为分析纯试剂,其中磷酸、硫酸铵、乙醇、冰醋酸购自国药集团上海化学试剂有限公司,甘油购自国药集团北京化学试剂有限公司;试验用水均为超纯水。
1.1.3主要仪器高速冷冻离心机(德国HERMLE),超声波细胞破碎机(江苏宁波新芝),酶标仪(北京Biotek Synergy2),等电聚焦仪、垂直电泳仪和图像分析软件(美国Bio-Rad公司),扫描仪(UMAX)等。
1.2样品制备及纯化
采用液氮研磨加超声破碎并纯化的方法提取肌肉蛋白。取出-80 ℃保存的山羊肌肉样品,迅速置于冰上。将肌肉样品剪碎并称取30 mg,在研钵中液氮研磨,分装于EP管内,按每g加入10 mL的比例加入裂解液,冰浴超声波破碎:超声5 s,间隔9 s,共10 min;冰浴30 min;4 ℃下15 000 r/min离心15 min;吸取上清(即总蛋白质),采用2-D clean up kit试验剂盒进行纯化,BCA法测定蛋白浓度。
1.3内蒙古绒山羊骨骼肌差异表达蛋白的电泳检测
1.3.1第一向等电聚焦(Isoelectric focusing,IEF)从-20 ℃冰箱中取出长17 cm、pH 4~7的IPG干胶条,室温溶解10 min;同时取出水化上样液,待室温溶解后加入2.5 μL 40 g/L Bio-lyte(pH 4~7)混匀。将混合水化上样液与蛋白样品溶液按体积比4∶1混匀作为上样液。取150 μL上样液(蛋白质量浓度为200 mg/L)加入聚焦槽中,将IPG的保护膜撕下,胶面朝下,对准正负级,滴加矿物油覆盖,进行IEF,设置等电聚焦程序为:50 V水化12 h;250 V线性升压1 h,4次;1 000 V快速升压30 min;1 000 V快速升压2 h;10 000 V快速升压到70 000 V,500 V不超过72 h。
1.3.2第二向电泳(SDS-PAGE)1)灌制二向凝胶。选择适合17 cm IPG胶条的垂直电泳槽,按照Bio-Rad说明书安装垂直电泳系统,在100 mL烧杯中配制12%的分离胶。
2)IPG胶条的平衡。IEF结束后,取出IPG胶条,胶面朝上进行2次平衡,第1次将胶条放入平衡缓冲液Ⅰ(0.375 mol/L Tris-HCL (pH 8.8)、6 mol/L 尿素、20 g/L甘油、2 g/L SDS、2 g/L DTT)中,水平摇床缓慢振摇15 min;第2次换平衡缓冲液Ⅱ(0.375 mol/L Tris-HCL(pH 8.8)、6 mol/L尿素、20 g/L甘油、2 g/L SDS、2.5 g/L 碘乙酰胺)平衡15 min。
3)胶条的转移和封胶。在等待胶条平衡的过程中,用滤纸将电泳槽内已聚合的凝胶上层水分吸干待用;待2次平衡结束之后,取出胶条,用1×新鲜配制的电泳缓冲液淋洗其背面及侧面,随后将胶面朝上浸入到1×新鲜配制的电泳缓冲液中待用,使用前吸干胶条背面多余的液体。在凝胶的上方加入1~2 mL低熔点封胶液,用小镊子将胶条胶面朝上推入凝胶(使胶条与凝胶的胶面完全贴合,不要留有间隙)。待封胶液彻底凝固之后将凝胶转入到电泳槽中。
4)在电泳槽中加入1×电泳缓冲液,接通电源开始第二向电泳分离,先150 V电泳约5 min,再恒定电压250 V电泳约4 h,直至溴酚兰前沿达到底部边缘时停止电泳,将凝胶小心从玻璃板上剥离,做好标记。
1.3.3染色及脱色将凝胶在固定液(体积分数40%乙醇、体积分数10%醋酸)中固定4 h后,置于考马斯亮蓝染色液中,摇床上振摇过夜,次日取出用超纯水脱色直至背景无色。
1.3.4图像扫描与分析脱色后的凝胶用UMAX进行扫描,设定适当的分辨率(一般为300 dpi)和对比度,保存2-DE图像,用PDQuest 2.0软件进行分析。
1.4差异表达蛋白的质谱鉴定
对挖取得到的差异蛋白点用胰酶分解后,进行MALDI-TOF/MS质谱分析,获得肽指纹图谱(Peptide mass fingerprinting,PMF),通过数据库搜索与蛋白文库进行比对分析,获得蛋白质的具体信息。
1.4.1蛋白质胶内酶解(1)斑点切取。用剪刀将 200 μL枪头尖端剪掉1~2 cm,孔的直径为 2~3 mm,用修剪后的吸头从凝胶上戳取蛋白质点,再转入200 μL离心管中(离心管灭菌后浸泡于体积分数为 75%的乙醇,用时取出自然干燥)。(2)脱色、脱水。每管加入 100 μL 脱色液(体积分数为50% 的乙腈、25 mmol/L 碳酸氢铵),室温放置 30 min,吸去脱色液,重复以上步骤脱色至胶块无色透明;加入 60 μL 乙腈使凝胶脱水 10 min。(3)酶解。每块凝胶用胰蛋白酶溶液(10 ng/μL溶于25 mmol/L碳酸氢铵溶液中)覆盖;冰浴30 min,去除多余酶液,加入25 μL 25 mmol/L 碳酸氢铵,37 ℃消化过夜;加体积分数为5% 的甲酸(FA)终止反应。将肽段溶液在冻干机中真空低温冻干,以备质谱鉴定。
1.4.2MALDI-TOF/TOF上机消化胶点样品,将 1 μL 肽溶液点于Anchorchip靶板上;在室温下晾干液滴,再点上 0.1 μL 基质(CHCA);将靶板置于质谱仪中进行检测,设置仪器的参数为:检测模式为反射模式,分辨率为50 000。默认每张一级谱图选择5个母离子进行二级鉴定。
1.4.3数据分析数据库的选择是基于质谱数据的蛋白质鉴定策略中的重要一步,最终鉴定到的蛋白质序列都来源于被选择的数据库。
本研究使用的数据库为NCBI capra hircus(http://www.ncbi.nlm.nih.gov/protein?term=txid9925%5BOrganism%5D&cmd=search),去除冗余数据后有27 519条序列。
2 结果与分析
2.1内蒙古绒山羊蛋白差异表达的双向电泳分析
将双向电泳获得的山羊背最长肌、臂三头肌及臀肌3个部位的2-DE图像进行分析,以差异倍数为2倍作为判定标准,绒山羊3个部位经分析获得差异表达蛋白点共17个(图1)。其中4、8、9、10、13、15、16号来自背最长肌,1、2、3、5、6、11号来自臂三头肌,7、12、14、17号来自臀肌。

图 1 内蒙古绒山羊3个部位骨骼肌差异蛋白2-DE图M.蛋白标样;A.背最长肌;B.臂三头肌;C.臀肌;1~17.差异表达蛋白Fig.1 2-DE of three skeletal muscles of Inner Mongolia cashmere goatM.Protein Marker;A.Longissimus muscle;B.Triceps muscle;C.Glutaeus;1-17.Differential expressed proteins
2.2内蒙古绒山羊骨骼肌肌肉组织蛋白质谱分析
17个蛋白点除5、6号外,其余15个蛋白点可以匹配到对应的蛋白质(得分>50,置信度P<0.05,序列覆盖范围>20%),结果见表1。
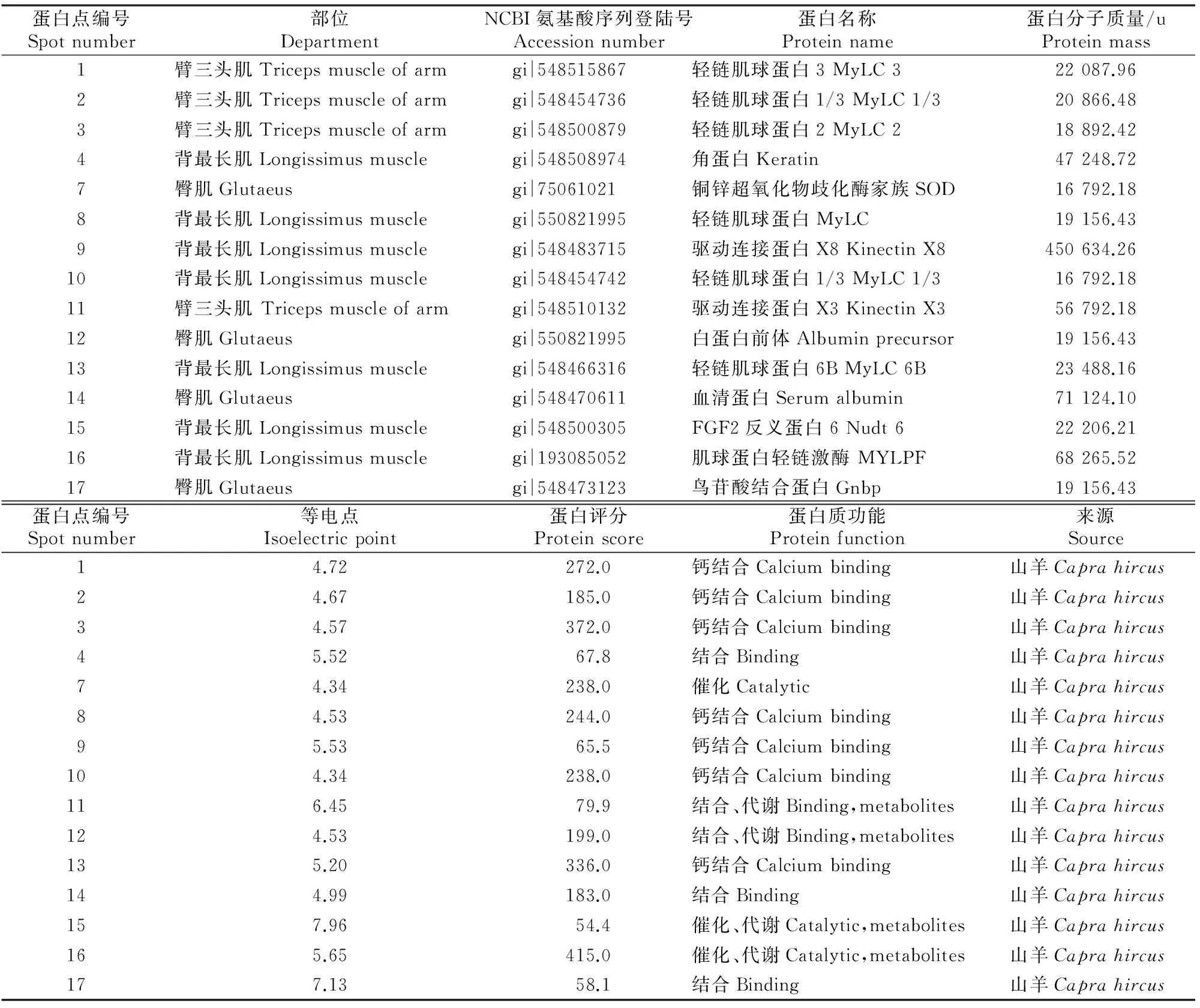
表 1 内蒙古绒山羊骨骼肌差异表达蛋白的质谱鉴定Table 1 MALDI-TOF-MS of different skeletal muscles for cashmere
注:蛋白点编号同图1。
Note:Spot number is same with Fig 1.
由表1可知,这15个蛋白点均来自山羊,根据3个功能本体(细胞组分、分子功能和生物过程)对差异蛋白进行GO功能注释分类,差异蛋白的分子功能以钙结合、催化为主。1、2、3、7、8、10、13、15、16号匹配的蛋白与肌肉发育相关,其中评分较高的差异蛋白点主要为轻链肌球蛋白家族,说明3个部位肌肉的生长发育主要受轻链肌球蛋白的影响。
3 讨 论
双向电泳技术需要大量的试验摸索,不同的研究对象从蛋白提取、加样量、一向电泳程序到电泳条件和最后的染色都需要反复的尝试[7-8],即便是同样的研究对象在作平行时也很难获得一致的结果,所以对于双向电泳而言,条件的建立和优化更为重要。本研究正式试验前对上述所涉及的过程进行了优化,最后在优化的条件下进行试验得到了比较可靠的2-DE图谱。首先,利用液氮研磨法、超声破碎结合蛋白质纯化的方式制备样品,效果优于单纯的液氮研磨法,纯化可以有效地去除样品中的杂质,尤其是其中的盐分,其可以增加导电性,影响聚焦过程,因此纯化是必要的。另外,在胶条长度和pH值选择方面,一般双向电泳中,7 cm胶条分辨率差、上样量小、聚焦时间短,适合做预试验,而长胶条分辨率高、上样量大,适合于分析复杂样品和正式试验,其胶图蛋白点清晰便于质谱鉴定。在pH 的选择方面,发现pH为4~7时得到的蛋白点比pH为3~10更加集中。因此本研究选择17 cm、pH 4~7的IPG干胶条进行试验。此外,上样量也是影响双向电泳结果的因素之一,如果上样量小,得到的蛋白点数少,无法呈现低丰度蛋白,而上样量过大则会影响等电聚焦,图谱会呈簇状,不利于后续蛋白点的分离。本研究预试验通过设置不同的上样量梯度对上样量进行摸索,发现上样量以150 μL(蛋白质量浓度200 mg/L)为好。在染色方面,考虑到后续的质谱鉴定,采用考马斯亮兰染色。结果表明,采用上述条件得到的胶图稳定性和重复性都比较好。
3个部位骨骼肌差异蛋白质的分子功能主要以结合、催化和代谢为主。其中在臀肌中高表达的蛋白7,属于铜锌超氧化物歧化酶家族,其具有助于减少核靶催化活性的棕榈酰化和琥珀酰化以及抑制相邻的铜催化位点活性等功能。有研究认为,琥珀酸脱氢酶的增多标志着肌纤维有氧代谢旺盛,这是红肌纤维的重要特征,表明肌纤维易转变为慢肌纤维[9],据此可知山羊臀肌的肉质比较细嫩。在背最长肌中高表达的蛋白15是Nudt 6,其基因位于FGF2基因相反的链,被认为是2反义基因,其与FGF2基因表达呈反向关系,表明Nudt 6反义转录调节FGF2表达。Nudt 6基因也被证明有激素调节和抗增殖作用,具有独立FGF2表达的垂体行为。FGF2是碱性成纤维细胞生长因子,研究发现在肌肉组织中应用FGF2可以提高肌肉的收缩应力和松弛应力[10]。说明Nudt 6基因对肌肉的收缩应力有调控作用,可以作为肉质的候选基因进行深入研究。
肌球蛋白是一个含有多种同功蛋白的家族,由高度保守的多基因编码,是骨骼肌的主要收缩蛋白。肌球蛋白分子由2个肌球蛋白重链(Myosin heavy chain,MyHC)和4个肌球蛋白轻链(Myosin light chain,MyLC)组成。肌球蛋白轻链所占的比例对肌纤维的生长和类型具有重要的作用[11]。双向电泳只能分离分子质量低于220 ku的蛋白,因此只能显示肌球蛋白轻链,其类型包括快收缩型轻链和慢收缩型轻链[12-13]。肌球蛋白轻链对肌球蛋白酶催化超分子复合体的形成有重要作用,该复合体在肌红蛋白(Mb)启动分化时开始合成,可能在胚胎发育中起重要的作用[14-15],主要在慢收缩肌(氧化型肌肉)中表达[16]。一般快慢纤维可能决定快、慢异构体在混合型纤维肌肉中的比例,如兔和鼠的隔膜含有的快速纤维比例较高,则快速肌球蛋白轻链碱性轻链异构体所占比例更高些[17],这表明快、慢型肌球蛋白轻链基因表达各自的纤维类型。当氧化型(慢收缩肌)肌纤维比例高时,肌肉的品质更优。而当酵解型(快收缩肌)纤维比例高时,肌肉的生长速度则更快。在本研究中,背最长肌中高表达的蛋白16为MYLPF,这与MYLPF基因在天府山羊背最长肌中高表达的研究结果[18]一致。MyLC2基因在臂三头肌中的表达显著高于其他2个部位,显示臂三头肌的酵解型肌纤维比例要高,表明该部位的生长速度可能更快,同时也说明该部位的肉质明显不如背最长肌和臀肌。所有这些结果显示,MyLC家族在内蒙古绒山羊骨骼肌中的表达具有肌纤维特异性。
本研究中,蛋白MyLC 1/3在绒山羊不同的组织中有不同的分子质量,在背最长肌中约为16 ku,在臂三头肌中约为21 ku。有研究发现,具有不同分子质量的2种MyLC 1/3实际上由同一个基因编码[19]。利用抗肌球蛋白碱性轻链抗体进行体内研究,发现早期胚胎相同的肌肉纤维中存在快、慢亚型的表达[20-21]。有研究发现,相同的蛋白在不同种类哺乳动物的组织中存在不同的分子质量[22],而本研究发现在同一种类动物的不同组织也可以有不同分子质量的同种蛋白,这说明分子结构和氨基酸的组成决定了蛋白质的差异,造成同种蛋白质在不同的哺乳动物甚至同种动物的不同组织中具有不同的分子质量,说明蛋白在不同组织的分化情况有差异。
目前对肉质相关蛋白的研究主要集中在与肉质代谢相关的蛋白上,而动物肌纤维中一半以上的蛋白都是与肌肉收缩机制相关的结构蛋白,若能对这些蛋白加以研究,则更有利于对肉质形成机理的理解。本研究建立了内蒙古绒山羊骨骼肌差异蛋白谱,找到了3种骨骼肌的差异蛋白,并挖掘到了与肉质相关的基因,这将有助于揭示该品种不同部位肌肉肉质差异的分子基础,为内蒙古绒山羊肉质的开发及产量的提高提供了科学依据,同时也为其他品种肉质的研究提供了有价值的参考。
[1]Gibb M J.Performance of British Sannen,Boer×British Sannen and Anglo-Nubian castrated male kids from 8 weeks to slaughter at 28,33 or 38 kg live weight [J].Anim.Prod,1993,57:263-271.
[2]Owen J E,Norman G A.Studies on the meat production characteristics of Botswana goat and sheep-part 3 Carcass tissue composition and distribution [J].Meat Science,1978(2):59.
[3]罗军.山羊肉的组织学特性及其与肉用性能关系的研究 [J].中国养羊,1992(2):384.
Luo J.Study on goat histological characteristics and its relation with the meat performance [J].Chinese Journal of Sheep Farming,1992(2):384.
[4]Pandey A,Mann M.Proteomics to study genes and genomes [J].Nature,2000,405(6788):837-846.
[5]Rabilloud T.Two-dimensional gel electrophoresis in proteomi-cs:old,old fashioned,but it still climbs up the mountains [J].Proteomics,2002,2(1):3-10.
[6]Kwasiborski A,Sayd T,Chambon C,et al.Pig longissimus lumborum proteome:part 1.effects of genetic background environment and gender [J].Meat Sci,2008,80:968-981.
[7]徐永杰.猪肌肉组织差异蛋白质组学 [D].武汉:华中农业大学,2010.
Xu Y J.Differential proteome analysis of porcine skeletal muscle [D].Wuhan:Huazhong Agricultural University,2010.
[8]朱雅卿,韩剑众,王彦波,猪骨骼肌双向电泳样品制备及等电聚焦方法研究 [J].中国食品学报,2009,9(3):99-104.
Zhu Y Q,Han J Z,Wang Y B.Studies on sample preparation of 2·DE and IEF method of pig skeletal muscle [J].Journal of Chinese Institute of Food Science and Technology,2009,9(3):99-104.
[9]吴环成,胡燕.肌纤维类型及其转变 [J].长江大学学报(自科版),2005,2(3):107-108.
Wu H C,Hu Y.Muscle fiber types and their transformation [J].Journal of Yangtze University (Nat Sci Edit),2005,2(3):107-108.
[10]葛新发,潘卫东,董贵俊.利用碱性成纤维细胞生长因子包裹的磁性纳米粒对大鼠急性骨骼肌钝挫伤后肌肉收缩力与松弛特性恢复的影响研究 [J].中国运动医学杂志,2010,29(5):538-541.
Ge X F,Pan W D,Dong G J.Study of the contractive strength and muscle relaxation in rat skeletal muscles after acute contusion by using basic gibroblast growth factor-coated magnetic nanoparticles [J].Chinese Journal of Sports Medicine,2010,29(5):538-541.
[11]Chen J,Kubalak S W,Minamisawa S,et al.Selective requirement of myosin light chain 2v in embryonic heart function [J].J Biol Chem,1998,273(2):1252-1256.
[12]Ghatpande S,Shafiq S,Siddiqui M A.Ventricular myosin light chain-2 gene expression in developing heart of chicken embryos [J].Biol Res,2001,34(1):1-6.
[13]Jiang P,Song J,Gu G,et al.Targeted deletion of the MLC1f/3f down-stream enhancer results in precocious MLC expression and mesoderm ablation [J].Dev Biol,2002,243(2):281-293.
[14]Bottinelli R.Functional heterogeneity of mammalian single muscle fibers:do myosin isoforms tell the whole story [J].Pflügers Archiv-European Journal of Physiology,2001,443(1):6-17.
[15]Gong G X.Molecular cloning,sequence identification and expression analysis of novel caprine MYLPF gene [J].Molecular Biology Reports,2013,40(3):2565-2572.
[16]Tannu N S,Rao V K,Chaudhary R M,et al.Comparative proteomes of the proliferating C(2)C(12) myoblasts and fully differentiated myo-tubes reveal the complexity of the skeletal muscle differentiation program [J].Mol Cell Proteomics,2004,3(11):1065-1082.
[17]Price K M,Little W A,Cummins P.Myosin adenosinetriphosphatase activity and light chain subunit com position of human right and left ventriele [J].Biochem J,1980,191:571-580.
[18]Coulombe P A,Omary M B.‘Hard’ and ‘soft’ principles defining the structure,function and regulation of keratin intermediate filaments [J].Curr Opin Cell Biol,2002,14:110-122.
[19]Robert B,Daubas P,Akimenko M A,et al.A single locus in the mouse encodes both myosin light chains 1 and 3,a second locus corresponds to a related pseudogene [J].Cell,1984,39:129-140.
[20]Matsuda G,Maita T,Umegane T.The primary structure of L-1 light chain of chicken fast skeletal muscle myosin and its genetic implication [J].FEBS Lett,1981,126:111-113.
[21]Obinata T,Masaki T,Takano H.Types of myosin light chains present during the development of fast skeletal muscle in chick embryo [J].J Biochem (Tokyo),1980,87:81-88.
[22]Owen J E,Norman G A.Studies on the meat production characteristics of Botswana goat and sheep-part 2 general body composition,carcass measurements and joint composition [J].Meat Science,1977(1):283-287.
Differentially expressed protein profiling of skeletal muscle of Inner Mongolia Cashmere goat
ZHAO Jun1,2,ZHANG Wenguang1,SU Rui1,LIU Zhihong1,ZHANG Yanjun1,WANG Le1,FU Shaoyin1,LI Jinquan1
(1KeyLaboratoryofAnimalBreedingandReproductioninInnerMongoliaAgriculturalUniversity,Hohhot,InnerMongolia010018,China;2InnerMongoliaVocationalCollegeofChemicalEngineering,Hohhot,InnerMongolia010010,China)
【Objective】 This study explored the differentially expressed protein profiling of longissimus muscle,triceps muscle and glutaeus in Inner Mongolia Cashmere goat.【Method】 Three skeletal muscles of three cashmere goats were obtained after being slaughtered.The protein mass spectrometry was established using 2-D difference gel electrophoresis method and 17 differential protein spots were found.【Result】 A total of 15 differential protein spots were successfully identified,among which 9 were related to the development of goat muscles.A protein in glutaeus was identified as a family member of copper zinc super oxide dismutase.A protein in longissimus muscle was annotated as locating at the antisense strand of FGF2 protein,which had the functions of controlling the expression of independent FGF2 and regulating hormone and anti-proliferation.Myosin light chains (MyLC) members were found in longissimus and triceps muscles with different types but same functions of controlling muscles contraction.MLC proteins had different molecular weights in the two muscles.【Conclusion】 The differential protein profiling of skeletal muscles of cashmere goats was established and the proteins related with meat quality were discovered,whose function was controlling muscle contraction.
Cashmere goat;skeletal muscle;two-dimensional electrophoresis;mass Spectrometry
网络出版时间:2016-07-1208:4510.13207/j.cnki.jnwafu.2016.08.001
2014-02-17
国家“863”计划项目(2007AA10Z151);国家自然科学基金项目(31260538)
赵珺(1980-),女,内蒙古赤峰人,副教授,在读博士,主要从事食品营养与检测研究。
E-mail:zhaojunivy@163.com
李金泉(1957-),男,内蒙古土左旗人,教授,博士生导师,主要从事绒山羊绒毛机理及育种研究。
E-mail:lijinquan_nd@126.com
S826.9
A
1671-9387(2016)08-0001-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160712.0845.002.html

