H10N8禽流感病毒血凝素中和抗体的结合位点鉴定
胡金芳,孙春昀,饶木顶,谢良志
1中国医学科学院 北京协和医学院 细胞工程中心,北京 1000052神州细胞工程有限公司新药研发部,北京 1001763北京义翘神州生物技术有限公司生物分子研发部,北京 100176
·论著·
H10N8禽流感病毒血凝素中和抗体的结合位点鉴定
胡金芳1,孙春昀2,饶木顶3,谢良志1
1中国医学科学院北京协和医学院细胞工程中心,北京 1000052神州细胞工程有限公司新药研发部,北京 1001763北京义翘神州生物技术有限公司生物分子研发部,北京 100176
目的制备并筛选H10N8型禽流感病毒血凝素蛋白的中和抗体,并对其抗原结合位点进行鉴定。方法采用基因工程技术制备H10N8血凝素蛋白单克隆抗体,通过假病毒微量中和实验筛选中和抗体,ELISA和Western blot实验确定抗体结合血凝素蛋白的区域,Discovery Studio 3.5模拟与对接分析软件预测抗原结合位点,进而研究其在H10亚型内的保守性。结果获得1株具有假病毒中和活性的H10N8单克隆抗体,该抗体的结合表位在HA1上,且具有H10亚型内的保守性。结论成功制备1株中和抗体,为H10N8禽流感疫苗和单克隆药物的研究提供了基础。
H10N8禽流感病毒;血凝素蛋白;中和抗体;表位
ActaAcadMedSin,2016,38(4):404-410
2013年冬至2014年,江西省报道了3例H10N8型禽流感病毒(avian influenza virus,AIV)感染人的病例,其中2例死亡,相关的研究显示江西和广东活禽市场的部分从业人员和动物体内也携带H10N8病毒[1- 3]。虽然H10N8未达到H5N1的爆发率和高致死率,但是AIV能够通过抗原漂移和抗原转变产生新的亚型,改变病毒的细胞嗜性,扩大宿主范围,从而获得跨越种属屏障引发流感大流行的潜力[4],对畜牧业和公共卫生事业存在潜在的威胁。目前对H10亚型AIV的研究并不深入,缺乏有效的防治手段,传统的抗流感病毒药物有口服生物利用度低、快速选择耐药性病毒等不良反应,而疫苗的生产则往往滞后于流感爆发。相比而言,病毒中和抗体能够阻断病毒和宿主细胞表面特异性受体的结合,干扰病毒包膜与宿主细胞膜的融合,并且可以通过激活补体[5]、促进效应细胞清除病毒或杀伤被感染的细胞等免疫机制抵御流感病毒[6],具有较高的研究和利用价值。本研究利用H10N3_HA蛋白免疫动物获得对H10N8型AIV具有中和活性的单克隆抗体,并对其结合表位进行初步预测,旨在为以后的抗体治疗奠定基础。
材料和方法
材料日本大耳白兔(北京金牧阳实验动物养殖有限责任公司);SfiI、NotI(美国Fermentas);Sinofection®转染试剂,HEK293E细胞,H10N3_HA(Cat. 11693-V08H)、H10N3_HA1(Cat.11693-V08H1)、H10N8_ HA(Cat.40359-V08B)、H10N8_HA1(Cat.40359-V08H1),转移载体pwpxl-luc,包装载体psd,包膜载体pCMV-H10N3-HA,包膜载体pCMV-H10N8-HA(北京义翘神州生物技术有限公司);293T/17人胚肾细胞系(ATCC);293FT人胚肾细胞系(中国医学科学院基础医学研究所基础医学细胞中心);豚鼠血红细胞(中国食品药品检定研究院动物实验室);细胞裂解液、荧光素酶检测系统(美国Promega公司);MG96-PCR仪(杭州朗基科学仪器有限公司);OctetRED生物芯片系统(美国Pall Corporation)。
单克隆抗体的制备及筛选H10N3_HA蛋白免疫日本大耳白兔,获得高滴度免疫效价。取脾用TRIzol试剂盒 (美国Invitrogen)抽提总RNA,以Oligod T为引物用SuperScript Ⅲ 第一链合成系统(美国Invitrogen;Cat. 18080051)将总RNA反转录合成cDNA,采用兔抗体框架区引物对从cDNA中扩增获得抗体的Vκ、Vλ和 VH。将纯化后的VL(Vκ+ Vλ) 和VH基因片段做为模板,用重叠延伸PCR技术在VH和VL之间引入连接子,扩增获得编码单链可变区片段(scFv)的基因。将scFv片段用SfiI和NotI双酶切后通过T4 DNA Ligase(日本TaKaRa;Cat. 2011B)连接到pCANTAB5E (美国GE Healthcare)载体上,构建成抗体噬菌体展示文库。在该载体上,scFv被插入到外壳蛋白结构基因Ⅲ前,形成scFv和gⅢ的融合蛋白展示在噬菌体的表面。scFv构建过程和表达载体图谱见图1。将构建成的噬菌体抗体文库质粒转入大肠杆菌中扩增,加入VCSM1辅助噬菌体,获得噬菌体抗体库。以H10N8蛋白为固相抗原进行“吸附-洗脱-扩增”筛选,对分析出的阳性抗体测序。将抗体的可变区分别与兔κ和IgG恒定区相连接,构建成完整抗体表达载体。利用Sinofection®转染试剂将单个抗体的轻重链表达质粒转入HEK293E细胞中表达,采用蛋白A柱亲和纯化后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定。
抗体与HA和HA1的结合实验利用ELISA和Western blot检测抗体与HA和HA1的结合作用,分别从构象表位和线性表位对抗原抗体结合进行分析。
ELISA结合活性实验:抗体稀释到2 μg/ml,100 μl/孔包被酶标板,4℃过夜。将H10N3_HA、H10N3_HA1、H10N8_HA、H10N8_HA1蛋白和阴性对照(一株带his标签的与流感无关蛋白,Sino Biological Inc.)分别稀释为0.3、0.1、0.033、0.011、0.0037 μg/ml,100 μl/孔加入酶标板,室温作用1 h,洗液洗板3次。然后加入0.5 μg/ml辣根过氧化物酶标记的C-his(Sino Biological Inc.),100 μl/孔,室温孵育1 h后显色终止,测定450 nm处的光密度值。
Western blot实验:H10N3_HA、H10N3_HA1、H10N8_HA、H10N8_HA1蛋白经13%SDS-PAGE分离转移至聚偏二氟乙烯膜,蛋白上样量均为1 μg,将稀释到5 μg/ml的待鉴定抗体与剪切膜室温孵育2 h,洗膜3次,加入山羊抗兔IgG(H+L)抗体(DyLight 800-Labeled;美国KPL公司),使用红外荧光扫描成像系统(Odyssey;美国LI-COR公司)显色。
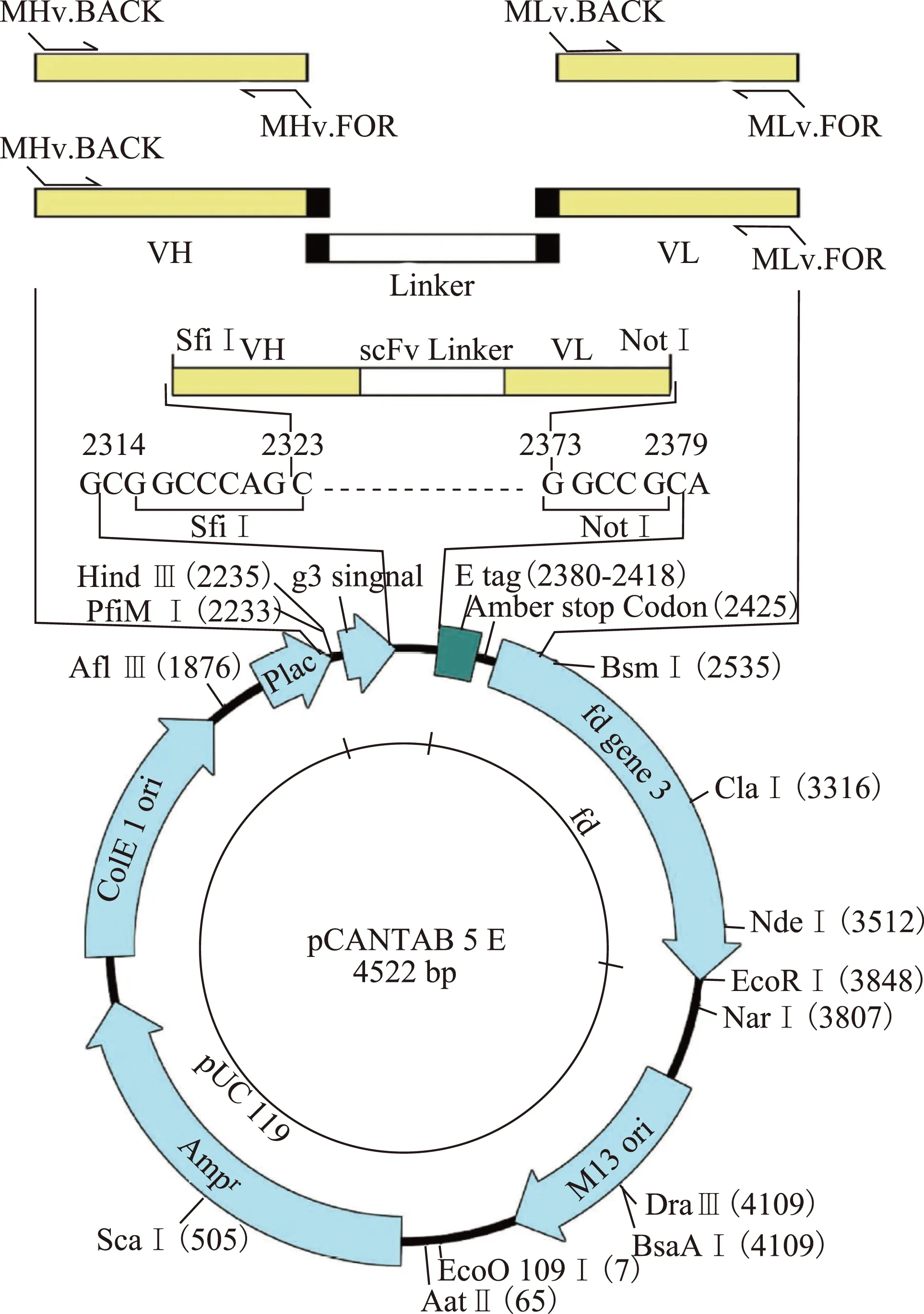
VH:重链可变区;VL:轻链可变区;scFv:单链可变区片段
VH:H variable fragment of heavy chain;VL:L variable fragment of light chain;scFv:single-chain variable fragments
图 1scFv构建过程和表达载体示意图
Fig 1Schematic illustration of the amplification of scFv-encoding genes and the expression vector
Octet RED亲和活性分析将生物素标记的H10N3_HA、H10N3_HA1、H10N8_HA、H10N8-HA1蛋白稀释到4 μg/ml,抗体稀释为终浓度5 μg/ml。设置OctetRED检测程序,按照PBS缓冲液、生物素标记的蛋白、PBS缓冲液、待测抗体、PBS缓冲液的顺序点样,每次250 μl/孔,依次测定出抗体和各抗原的亲和力。
血凝抑制活性鉴定将H10N3_HA、H10N8_HA蛋白按不同起始浓度2倍梯度连续稀释加入96孔血凝板中,50 μl/孔,然后每孔50 μl加入1%豚鼠血红细胞(豚鼠血红细胞用100倍体积的生理盐水稀释,得到1%豚鼠血红细胞),室温静置1 h,测定各个蛋白的血凝效价[7]。抗体2倍梯度连续稀释加入血凝板中,25 μl/孔,然后分别加入4个凝血单位的血凝素蛋白,25 μl/孔,室温孵育1 h,最后每孔50 μl加入1%豚鼠血红细胞,室温静置1 h,以100%抑制凝集的最大稀释度为该抗体的血凝抑制滴度。
假病毒微量中和实验将含有荧光素酶报告基因的转移载体pwpxl-luc、包装载体psd、包膜载体pCMV-H10Nx-HA(H10Nx为H10N3或H10N8)按8∶4∶1比例混合,然后将转染试剂Sinofection®按2.4 μl∶1 μg的比例和质粒混合,多质粒共转染293T/17人胚肾细胞株包装假病毒pseudo-H10N3和pseudo-H10N8。转染后48 h收细胞上清,用0.45 μm滤膜过滤,滤液中加入50 μg/ml甲苯磺酰苯丙氨酰氯甲酮处理的胰蛋白酶(美国Sigma-Aldrich),37℃孵育45 min后感染293FT细胞,计算半数细胞培养物感染量(tissue culture infective dose,TCID50),以100×TCID50/孔作为中和实验的感染剂量。中和实验中,4倍体积100×TCID50的假病毒和1倍体积的不同稀释浓度的抗体混合,4℃孵育1 h后加入接种293FT的96孔板中;感染48 h,吸出培养基,加入50 μl细胞裂解液,静置2 min后将孔板中的细胞裂解液吸取40 μl加入到白色不透明的96孔检测板中,按照化学发光仪(德国Berthold Technologies)和荧光素酶检测试剂(美国Promega)的操作流程进行检测。
结合表位对接分析Protein Data Bank(PDB)检索H10N8_HA序列并分析,鉴定H10N8_HA和抗体的同源性。用Discovery Studio 3.5构建H10N8_HA(A/Jiangxi-Donghu/346/2013,PDB entry:4XQ5)[8]和抗体的同源模型,抗体Fab的三维结构由3个独立的结构模型作为轻链模板、重链模板和界面模板构建。其中轻链模板是埃博拉病毒糖蛋白肽表位抗体Fab片段13F6- 1- 2 (PDB entry:2QHR)的轻链[9],重链模板是兔单抗Fab片段M204 (PDB entry: 4HBC)的重链[10],工作界面模板来自埃博拉病毒糖蛋白肽表位抗体Fab片段13F6- 1- 2 (PDB entry: 2QHR),最后通过MODELLER模块统计空间限制完成相关蛋白结构模型的优化[11],生成H10N8_HA和抗体的同源模型和环区模型。整体模型利用Discovery Studio 3.5的CHARMm进一步优化[12],H10N8_HA和抗体的分子对接过程由ZDock[13]和RDock[14]模块执行,对接模型潜在的抗体表位分析由分析交互模块完成。
结 果
H10N8中和单抗的SDS-PAGE鉴定制备出一株兔单抗,命名为R110,理论相对分子质量为150 000左右,由于糖基化的原因,非还原SDS-PAGE显示抗体R110的实际相对分子质量为190 000~195 000;还原SDS-PAGE在50 000和27 000附近存在条带,分别为抗体的重链和轻链(图2)。
ELISA结合活性结果包被在酶标板上的抗体R110能与不同浓度的HA和HA1蛋白结合,而与阴性对照无结合(图3),抗体的结合量随着HA和HA1蛋白浓度的升高而不断增加,并最终达到饱和,从而证实抗体能够和血凝素蛋白特异性结合。
免疫印迹分析抗体对HA和HA1蛋白的识别在还原SDS-PAGE上,HA蛋白的条带在60 000~70 000,HA1蛋白在40 000~45 000(图4),抗体和4种蛋白都有结合,显示抗体结合位点在HA1上。
Octet RED亲和分析结果抗体R110与4株血凝素蛋白的Octet RED亲和结合见图5,KD值分别为:7.32×10-10mol/L (H10N3_HA)、1.76×10-11mol/L(H10N3_HA1)、2.01×10-10mol/L (H10N8_HA)、3.11×10-12mol/L(H10N8_HA1),显示抗体对HA及HA1蛋白均有较高的亲和力。
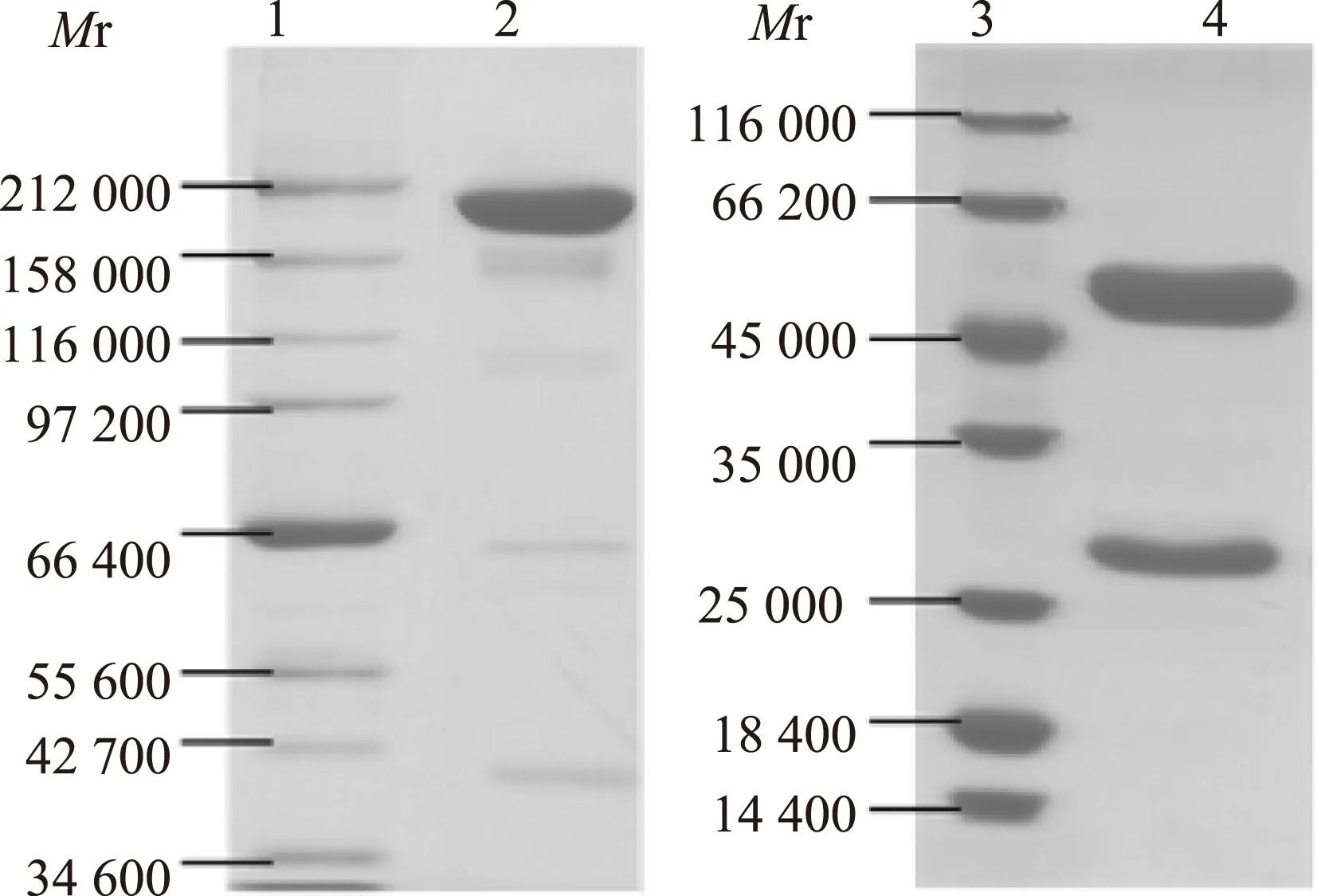
Mr:相对分子质量;1、3:marker;2:单抗R110的非还原电泳条带;4:单抗R110的还原电泳条带
Mr: relative molecular mass;1,3: marker;2: monoclonal antibody R110 under non-reducing condition;4: monoclonal antibody R110 under reducing condition
图 2单抗R110非还原和还原十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析图
Fig 2Analysis of monoclonal antibody R110 by non-reducing and reducing sodium dodecyl sulfate-polyacrylamide gel electrophoresis
血凝抑制实验结果抗体R110与4个凝血单位(4HAU)的血凝素蛋白孵育后加入1%豚鼠血红细胞产生血凝抑制效应,表明HA与受体的结合被阻断,100%抑制H10N3_HA(4HAU:2.0 μg/ml)和H10N8_HA(4HAU:1.4 μg/ml)的浓度分别为2.8 μg/ml、0.63 μg/ml(重复3次平行实验,3个复孔不一致时,取浓度高的1个作为该抗体的效价)。
假病毒微量中和实验结果通过荧光素酶表达量的高低对假病毒感染细胞的活性进行间接判断。48 h后相对荧光素酶测定显示,100 μl H10N3假病毒和H10N8假病毒上清液感染靶细胞后平均相对荧光素酶的值分别为4×105和1×106,具有极高的感染活性。加入抗体R110后,随着抗体浓度的增加,假病毒的感染性下降,表明抗体具有阻止假病毒感染的中和活性。定义病毒中和率(%)=[1-(实验孔相对荧光素酶活性均值-细胞对照相对荧光素酶活性均值)/(病毒对照相对荧光素酶活性均值-细胞对照相对荧光素酶活性均值)]×100%。抗体R110对H10N3和H10N8两种假病毒均有较高的中和活性,当抗体浓度达到约100 ng/ml时,病毒中和率达到接近100%的平台区(图6)。
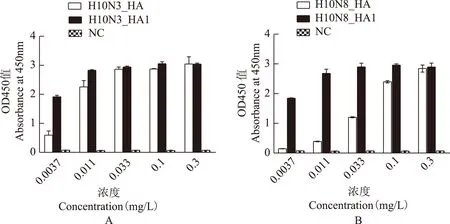
NC:阴性对照
NC:negative control
A.H10N3;B.H10N8
图 3单抗R110与HA及HA1蛋白的ELISA结合活性
Fig 3The analysis of binding function for monoclonal antibody R110 with HA and HA1 protein by ELISA

1:marker;2:R110对H10N3_HA的识别;3:R110对H10N3_HA1的识别;4:R110对H10N8_HA的识别;5:R110对H10N8_HA1的识别
1:marker;2:R110 against H10N3_HA;3:R110 against H10N3_HA1;4:R110 against H10N8_HA;5:R110 against H10N8_HA1
图 4Western blot分析单抗R110对HA和HA1的识别
Fig 4Western blot for monoclonal antibody R110 binding to HA and HA1 protein
结合表位对接分析结果构建抗体R110与H10N8_HA的对接模型(图7),并分析潜在的抗体结合表位(图8),表位区域预测为:Pro172-Arg179(PQTTNTYR)、Ser196-Asn202(SSTQEKN)、Ala229-Ser237(ARPQVNGQS)。
根据H10亚型血凝素基因序列的系统发生树,从NCBI查找该亚型内(H10N1-H10N9)每个亚型的一条代表性HA蛋白序列(H10N1:A/wild bird/Korea/A12/2010;H10N2:A/avian/Israel/824/2005;H10N3:A/duck/Hong Kong/786/1979;H10N4:A/wild bird/Korea/A01/2011;H10N5:A/duck/Mongolia/149/03;H10N6:A/long-tailed duck/Wisconsin/10 OS3919/2010;H10N7:A/goose/Guizhou/829/2012;H10N8:A/Jiangxi/IPB13/2013;H10N9:A/chicken/Jiangsu/RD5/2013),用BioEdit进行多序列比对(图9),结果表明上述位点具有亚型内的保守性。
讨 论
AIV传播给人的必要条件之一是能够感染人体内的宿主细胞,并进行有效的繁殖,其细胞嗜性及宿主范围主要由病毒的HA决定[16],HA是AIV重要的表面抗原糖蛋白,能识别并结合宿主细胞表面的唾液酸受体,介导病毒外膜与细胞内小体膜的融合,在病毒感染宿主细胞的吸附、注入和跨膜过程中发挥关键作用,是禽流感疫苗、中和抗体和诊断试剂的重要靶点[17]。HA蛋白由HA1和HA2两个亚单位通过富含碱性氨基酸的裂解区域连接,以三聚体的形式镶嵌在病毒囊膜的双层类脂膜中。HA三聚体由两部分构成,一部分是3个HA1单体构成的球状头部,另一部分是3个HA2单体及HA1剩余部分组成的柄部,其中球状头部区域含有受体结合位点和抗原决定簇,能够识别细胞膜表面唾液酸受体,在病毒感染的预防和治疗中具有重要的意义。
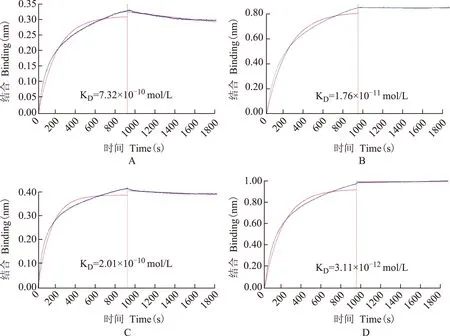
图 5R110与生物素标记的H10N3_HA蛋白(A)、H10N3_HA1蛋白(B)、H10N8_HA蛋白(C)和H10N8_HA1蛋白(D)的亲和活性
Fig 5Affinity of R110 with biotinylated H10N3_HA(A),H10N3_HA1(B),H10N8_HA(C) and H10N8_HA1(D)
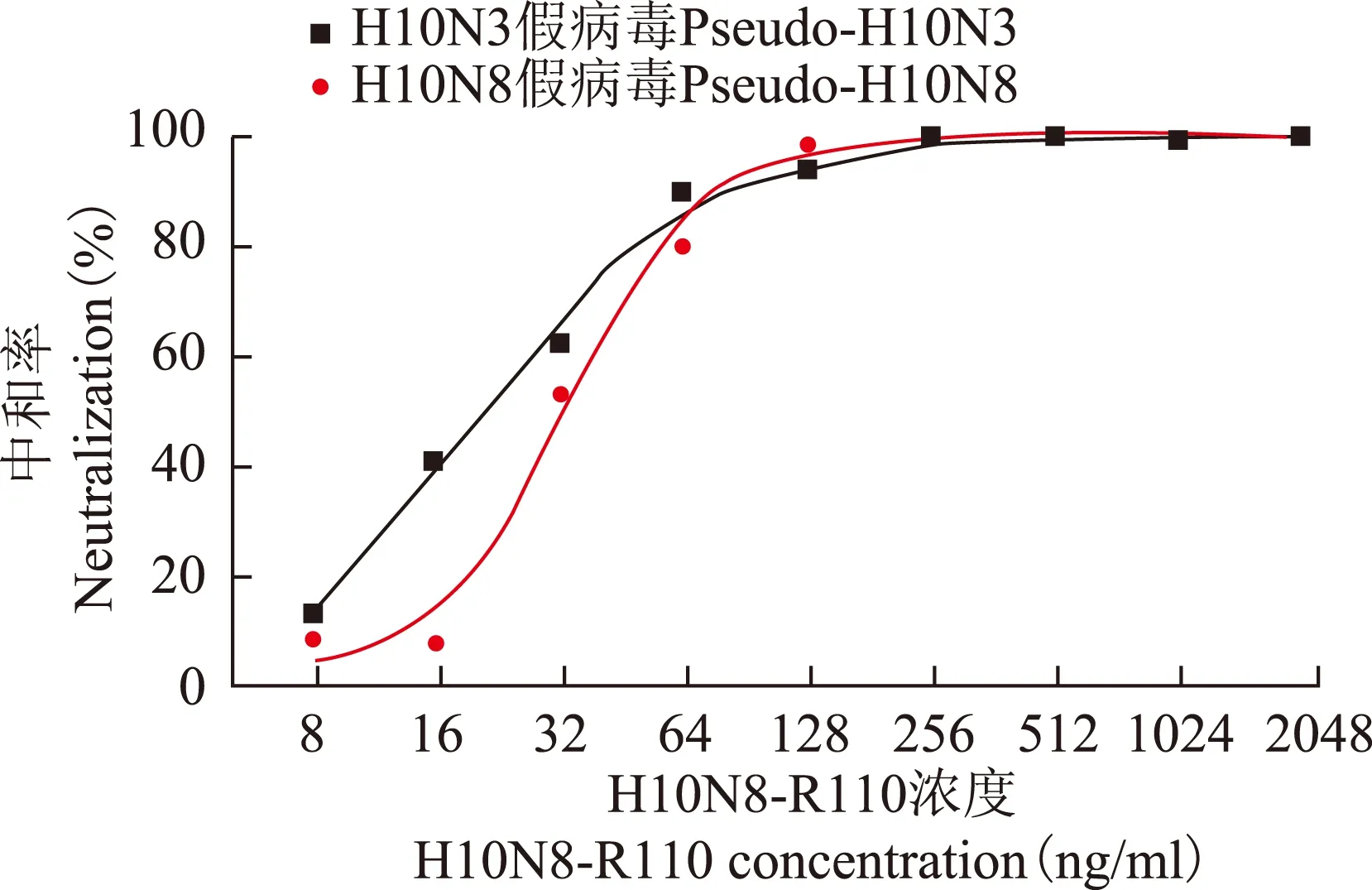
图 6单抗R110对H10N3和H10N8假病毒的微量中和作用
Fig 6Neutralization by monoclonal antibody R110 against pseudo-H10N3 and pseudo-H10N8
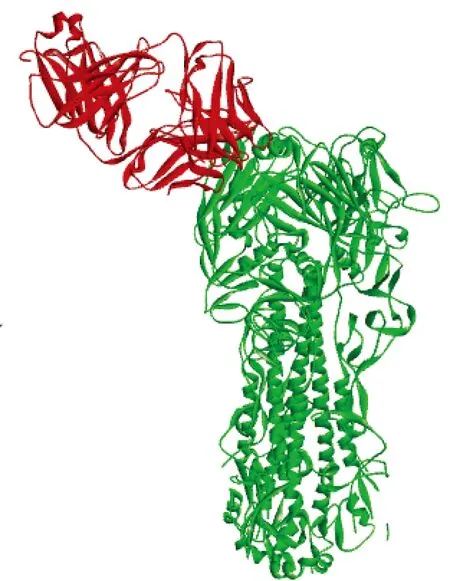
红色:抗体Fab模型;绿色:H10N8-HA结构模型
red color:model of monoclonal antibody Fab;green color:model of H10N8_HA
图 7R110与H10N8-HA 对接模型
Fig 7Molecular docking of H10N8_HA and monoclonal antibody R110 model
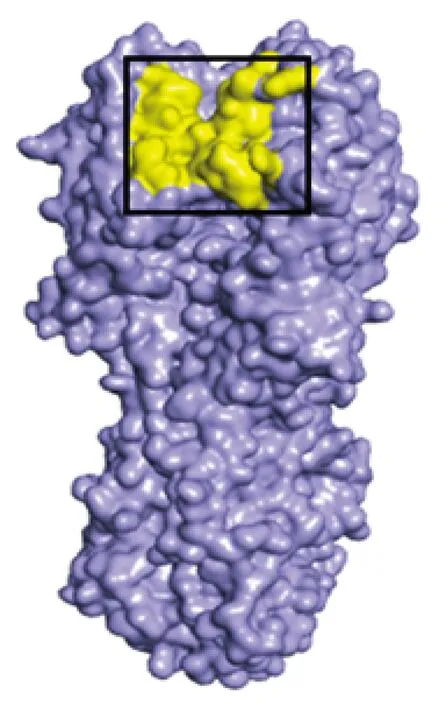
图 8抗原结合表位预测(黄色区域为预测抗体结合表位)
Fig 8Prediction of epitopes on antigen(the yellow region is the predicted epitopes on antigen)

A: Pro172-Arg179(PQTTNTYR);B: Ser196-Asn202(SSTQEKN);C: Ala229-Ser237(ARPQVNGQS)
图 9H10亚型内预测结合表位的保守性比较
Fig 9Comparing the conservation of predicted epitopes in H10 subtypes
本研究利用HA蛋白免疫兔子产生H10N8血凝素抗体,免疫动物所用的蛋白为哺乳动物细胞表达,具有糖基化等细胞修饰,其生物学特性与天然蛋白相似,并且能排除病毒中其他蛋白组分的干扰,与病毒免疫相比更安全,得到中和抗体的概率也更高。假病毒中和实验结果表明该抗体具有中和活性,能够阻止病毒侵入细胞,另外,抗体能够抑制H10N8_HA蛋白的凝血作用,显示其与血凝素蛋白的结合位点可能在HA1亚基上。在此基础上,利用Western blot和ELISA分析抗体R110对HA和HA1蛋白的结合活性,进一步证明该抗体与HA1亚基结合。
HA蛋白变异性很强,由于抗原漂移的高频发生,大多数的中和抗体只能识别特定的流感病毒亚型,本研究显示单抗R110对H10N3禽流感病毒也具有中和活性。根据抗体序列,利用Discovery Studio 3.5模拟与对接分析程序预测潜在的抗原结合表位,然后选择H10亚型内每个亚型的代表性HA序列进行序列比对,发现抗原结合位点在H10亚型内具有保守性,提示可以选择更多亚型的禽流感毒株进行广谱中和活性验证,并进一步鉴定抗原决定簇序列,为相关疫苗和药物的研制提供基础。
综上,本研究获得的单抗可能具有H10亚型内的广谱中和特性,在H10亚型禽流感的预防和早期治疗中具有潜在的临床应用价值。
[1]Qi W,Su S,Xiao C,et al. Antibodies against H10N8 avian influenza virus among animal workers in Guangdong province before November 30,2013,when the first human H10N8 case was recognized[J]. BMC Med,2014,12:205.
[2]Hu M,Li X,Ni X,et al. Coexistence of avian influenza virus H10 and H9 subtypes among chickens in live poultry markets during an outbreak of infection with a novel H10N8 virus in human in Nanchang,China[J]. Jpn J Infect Dis,2015,68(5):364- 369.
[3]Su S,Qi W,Zhou P,et al. First evidence of H10N8 avian influenza virus infections among feral dogs in live poultry markets in Guangdong province,China[J]. Clin Infect Dis,2014,59(5): 748- 750.
[4]Imai M,Watanabe T,Hatta M,et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1virus in ferrets[J].Nature,2012,486(7403):420- 428.
[5]Terajima M,Cruz J,Co MD,et al. Complement-dependent lysis of influenza a virus-infected cells by broadly cross-reactive human monoclonal antibodies[J]. J Virol,2011,85(24):13463- 13467.
[6]Corti D,Lanzavecchia A. Broadly neutralizing antiviral antibodies [J]. Annu Rev Immunol,2013,31(1):705- 742.
[7]Wiriyarat W,Lerdsamran H,Pooruk P,et al. Erythrocyte binding preference of 16 subtypes of low pathogenic avian influenza and 2009 pandemic influenza A(H1N1)viruses[J]. Vet Microbiol,2010,146(3- 4):346- 349.
[8]Zhang H,deVries RP,Tzarum N,et al. A human-infecting H10N8 influenza virus retains a strong preference for avian-type receptors[J]. Cell Host Microbe,2015,17(3):377- 384.
[9]Lee JE,Kuehne A,Abelson DM,et al. Complex of a protective antibody with its Ebola virus GP peptide epitope: unusual features of a V lambda x light chain[J].J Mol Biol,2008,375(1): 202- 216.
[10]Arai H,Glabe C,Luecke H. Crystal structure of a conformation-dependent rabbit IgG Fab specific for amyloid prefibrillar oligomers[J].Biochim Biophys Acta,2012,1820 (12): 1908- 1914.
[11]Sali A,Potterton L,Yuan F,et al. Evaluation of comparative protein modeling by Modeller[J]. Proteins,1995,23(3):318- 326.
[12]Brooks BR,Bruccoleri RE,Olafson BD,et al.Charmm:a program for macromolecular energy,minimization,and dynamics calculations[J]. J Comput Chem,1983,4(2):187- 217.
[13]Chen R,Li L,Weng Z. ZDock:an initial-stage protein-docking algorithm[J]. Proteins,2003,52(1):80- 87.
[14]Li L,Chen R,Weng Z. RDock:refinement of rigid-body protein docking predictions[J]. Proteins,2003,53(3):693- 707.
[15]Qi W,Zhou X,Shi W,et al. Genesis of the novel human-infecting influenza A(H10N8)virus and potential genetic diversity of the virus in poultry,China[J].Euro Surveill,2014,19 (25):50- 62.
[16]Rogers GN,Pritchett TJ,Lane JL,et al. Differential sensitivity of human,avian,and equine influenza A viruses to a glycoprotein inhibitor of infection:selection of receptor specific variants[J].Virology,1983,131(2):394- 408.
[17]SKehel JJ,Wiley DC.Receptor binding and membrane fusion in virus entry:the influenza hemagglutinin[J].Annu Rev Biochem,2000,69(1):531- 569.
Identification of Epitopes for Neutralizing Antibodies Against H10N8 Avian Influenza Virus Hemagglutinin
HU Jin-fang1,SUN Chun-yun2,RAO Mu-ding3,XIE Liang-zhi1
1Cell Engineering Center,CAMS and PUMC,Beijing 100005,China2New Drug R&D Department,Sinocelltech Ltd,Beijing 100176,China3Molecular Biology R&D Department,Sino Biological Inc,Beijing 100176,China
XIE Liang-zhiTel:010- 51029808,E-mail: liangzhi@yahoo.com
ObjectiveTo develop neutralizing monoclonal antibodies (MAbs) against H10N8 avian influenza virus hemagglutinin and to identify the binding sites. MethodsMAbs against hemagglutinin of H10N8 avian influenza virus were developed by genetic engineering. Neutralizing MAbs were screened by microneutralization assay,and then tested by enzyme-linked immunosorbent assay and Western blot to identity the binding sites.The homology modeling process was performed using Discovery Studio 3.5 software,while the binding epitopes were analyzed by BioEdit software. ResultsOne MAb that could neutralize the H10N8 pseudovirus was obtained and characterized. Analysis about epitopes suggested that the antibody could bind to the HA1 region of hemagglutinin,while the epitopes on antigen were conserved in H10 subtypes.ConclusionsOne neutralizing antibody was obtained by this research.The MAb may potentially be further developed as a pre-clinical candidate to treat avian influenza H10N8 virus infection.
avian influenza H10N8 virus;hemagglutinin;neutralizing antibody;epitopes
十二五“重大新药创制”科技重大专项(20142X09102044) Supported by the Key Project of the “Twelfth Five-year Plan”for Medical Science Development of China(20142X09102044)
谢良志电话:010- 51029808,电子邮件:liangzhi@yahoo.com
R373.9
A
1000- 503X(2016)04- 0404- 07
10.3881/j.issn.1000- 503X.2016.04.007
2016- 03- 04)

