改良消化复合植块法培养新生大鼠雪旺细胞
刘 頔,梁晓春,张 宏
1中国医学科学院 北京协和医学院 北京协和医院中医科,北京 1007302中国医学科学院 北京协和医学院 基础医学研究所细胞中心,北京 100005
·论著·
改良消化复合植块法培养新生大鼠雪旺细胞
刘頔1,梁晓春1,张宏2
1中国医学科学院北京协和医学院北京协和医院中医科,北京 1007302中国医学科学院北京协和医学院基础医学研究所细胞中心,北京 100005
目的探讨改良的单酶消化法与组织贴块法相结合的培养雪旺细胞(SCs)的方法,并与经典植块法和普通消化复合植块法进行比较。方法取新生3~5 d的SD大鼠双侧坐骨神经和臂丛神经,分别采用经典植块法、普通消化复合植块法、改良消化复合植块法培养SCs。培养7 d后进行细胞消化和传代,在显微镜下计数并计算细胞总量。用S- 100免疫荧光染色法检测所获细胞的纯度。结果改良消化复合植块法培养的SCs生长增殖速度最快,可获取(1.85±0.13)×106个细胞;普通消化复合植块法次之,可获取(1.10±0.10)×106个细胞;经典植块法所获SCs的生长增殖速度最慢,可获取(0.77±0.03)×106个细胞,3种方法比较差异均有统计学意义(P<0.01)。S- 100免疫荧光染色结果显示,改良消化复合植块法细胞纯度为(95.73±1.51)%,普通消化复合植块法为(84.66±2.68)%,经典植块法为(74.50±4.23)%,3种方法比较差异均有统计学意义(P<0.01)。结论改良消化复合植块法可以在短时间内获得大量高纯度的SCs,为研究周围神经修复再生奠定良好的基础。
雪旺细胞;细胞培养;植块法;消化法
2Department of Cell Resource Center,Institute of Basic Medical Science,CAMS and PUMC,Beijing 100005,China
ActaAcadMedSin,2016,38(4):388-392
雪旺细胞(Schwann cells,SCs)是周围神经系统中重要的胶质细胞,具有形成髓鞘、保护外周神经、促进外周神经轴突的形成等多种作用。近年研究表明SCs在周围神经系统的再生修复中发挥重要作用。当周围神经损伤后,SCs释放细胞因子和趋化因子招募巨噬细胞共同清除崩解的髓鞘[1],其后,SCs分泌具有神经营养活性的因子以促进轴突再生[2]。因此,获得足够高纯度的SCs是研究周围神经系统修复再生的重要基础[3]。本研究采用单酶消化法与组织植块法相结合的方法培养SCs,并比较改良的消化复合植块法与经典的植块法获得的细胞数量及纯度,探讨改良消化复合植块法的效果与可行性。
材料和方法
材料新生3~5 d的SD大鼠12只(购自北京大学医学部)。DMEM高糖培养基(北京协和细胞资源中心);进口胎牛血清(美国Hyclone公司);多聚右旋赖氨酸(美国Sigma公司);Ⅱ型胶原酶(美国Life technology公司);弗斯可林(美国Sigma公司);S- 100β抗体(武汉博士德生物工程有限公司);异硫氰酸荧光素标记山羊抗小鼠IgG(北京中杉金桥生物技术有限公司);含4’6-二脒基- 2-苯基吲哚(4’6-diamidino- 2-phenylindole,DAPI)的荧光封片剂(北京中杉金桥生物技术有限公司)。
DMEM接种培养基的配制:DMEM高糖培养基(180 ml)中分别加入进口胎牛血清(终浓度10%)、Hepes(20 mmol/L)、丙酮酸钠(1 mmol/L)、双抗(青霉素100 U/ml、链霉素100 μg/ml)、谷氨酰胺(2 mmol/L)。
DMEM生长培养基的配制:在接种培养基的基础上加入5 μmol/L的弗斯可林。置4℃冰箱保存备用。
SCs的原代培养出生3~5 d的SD大鼠,75%预冷酒精浸泡10 min,无菌条件下分离大鼠双侧坐骨神经和臂丛神经(冰上操作),置于4℃的含双抗的D-hanks液中。仔细剥离神经外膜,尽可能去除束膜。D-hanks液洗后,用眼科剪将神经组织剪碎至1~2 mm3,等体积均分为经典植块法、普通消化复合植块法和改良消化复合植块法3组。经典植块法将组织块均匀接种于T25培养瓶中;普通消化复合植块法组织块中加入5 ml浓度为0.1%的Ⅱ型胶原酶,37℃消化15 min。258×g离心5 min,倾去上清,将组织块均匀接种于T25培养瓶中;改良消化复合植块法组织块加入5 ml 0.1%的Ⅱ型胶原酶,37℃消化15 min,吸弃上清液后,加入含有20%进口胎牛血清的DMEM培养基终止消化,258×g离心5 min,弃上清,将组织块均匀接种于0.01%多聚右旋赖氨酸包被过的T25培养瓶中。2 h后待组织小块贴附后,经典植块法和普通消化复合植块法的T25培养瓶中分别加入2 ml的接种培养基,改良消化复合植块法的T25培养瓶中加入2 ml的含有5 μmol/L弗斯可林的生长培养基,均置于37℃、5% CO2孵箱中培养。3组细胞均2~3 d换液。
SCs的纯化和传代采用低浓度消化酶和差速贴壁法对SCs进行纯化,即6 d后待改良消化复合植块法细胞长满培养瓶底部80%面积时,进行传代,加入适量0.05%胰蛋白酶,在倒置相差显微镜下控制消化时间,待SCs突起收缩后,立即加入含有20%进口胎牛血清的DMEM培养基中止消化,用吸管轻轻吹打瓶底。将细胞悬液接种至T75瓶,15 min后转另外一侧放置,15 min后将未贴壁细胞悬液重新收集并计数,重新接种到放置有多聚右旋赖氨酸包被的盖玻片的24孔板中。
SCs的鉴定传代培养48 h后,取出盖玻片进行S- 100免疫荧光鉴定,检测步骤如下:(1)取出盖玻片,PBS浸洗后加入4℃预冷的4%多聚甲醛常温固定20 min;(2)PBS漂洗3次×2 min,每个盖玻片加入20 μl 0.1%Triton-X100常温孵育10 min;(3)PBS清洗3次×2 min,加入山羊血清封闭液与非特异性蛋白结合,室温孵育20 min;(4)每个盖玻片加入20 μl 1∶50稀释的山羊抗小鼠S- 100多克隆抗体,4℃过夜,阴性对照组以PBS代替一抗;(5)PBS清洗3次×5 min,每个盖玻片加入20 μl 1∶50稀释的异硫氰酸荧光素偶联山羊抗小鼠IgG,37℃湿盒避光孵育1 h;(6)PBS振洗6次×5 min,每个盖玻片加入DAPI工作液常温孵育5 min后,湿盒避光保存;(7)使用荧光显微镜进行检测,所摄图像以图像分析软件分析。实验重复3次,每组至少计数200个细胞,以S- 100阳性细胞的数目占总细胞的比例为SCs纯度。
统计学处理数据的录入和统计学分析采用SPSS 17.0统计软件包,符合正态分布的计量资料数据采用描述,多组独立样本比较采用单因素方差分析。P<0.05为差异有统计学意义。
结 果
镜下观察12 h后普通消化复合植块法和改良消化复合植块法即可观察到有细胞从组织块游出。多数细胞呈梭形,胞体饱满且较小,立体感强,突起细长,绝大多数呈双极,少数呈多极,核呈卵圆形或长形,为SCs。少量细胞胞体较大,轮廓不规则,透光性较差,为成纤维样细胞。经典植块法组细胞迁出较晚,48 h后方观察到有少量细胞迁出,且成纤维细胞比例较普通消化复合植块法和改良消化复合植块法高。改良消化复合植块法生长增殖速度最快,普通消化复合植块法次之,经典植块法最慢。接种6 d后改良消化复合植块法即长满培养瓶底部80%面积,普通消化复合植块法组约为培养瓶底部60%面积,而经典植块法仅为培养瓶底部40%面积(图1)。
提取细胞数生长7 d后,各组消化后计数,经典植块法可获取(0.77±0.03)×106个细胞,普通消化复合植块法可获取(1.10±0.10)×106个细胞,改良消化复合植块法可获取(1.85±0.13)×106个细胞,3种方法比较差异均有统计学意义(P<0.01)。
免疫荧光结果及纯度荧光显微镜下胞浆呈绿色荧光的为S- 100阳性细胞,即SCs;所有细胞的细胞核经DAPI染为蓝色荧光,而且改良消化复合植块法中绿色荧光阳性细胞比例较其他两组增多(图2)。经计算,经典植块法细胞纯度为(74.50±4.23)%,普通消化复合植块法细胞纯度为(84.66±2.68)%,改良消化复合植块法细胞纯度为(95.73±1.51)%,3种方法比较差异均有统计学意义(P<0.01)。
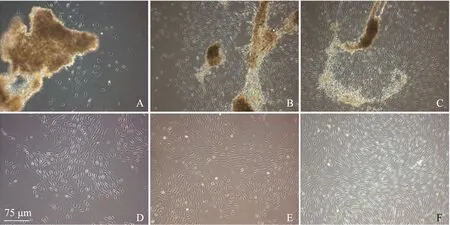
A.经典植块法原代培养48 h;B.普通消化复合植块法原代培养48 h;C.改良消化复合植块法原代培养48 h;D.经典植块法原代培养6 d;E.普通消化复合植块法原代培养6 d;F.改良消化复合植块法原代培养6 d
A.explants-culture method group after 48 hours of primary culture;B.hemi-explants-culture method group after 48 hours of primary culture;C.improved enzyme digestion combined with explants-culture method group after 48 hours of primary culture;D.explants-culture method group after 6 days of primary culture;E.hemi-explants-culture method group after 6 days of primary culture;F.improved enzyme digestion combined with explants-culture method group after 6 days of primary culture
图 1雪旺细胞形态学观察(倒置相差显微镜,×100)
Fig 1Morphological observation of Schwann cells (magnification,×100)
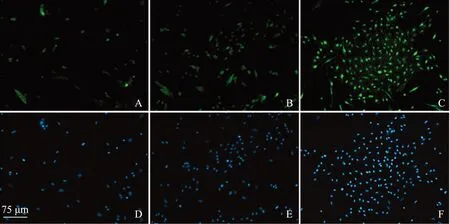
DAPI:4’6-二脒基- 2-苯基吲哚
DAPI: 4’6-diamidino- 2-phenylindole
A.经典植块法S- 100染色;B.普通消化复合植块法S- 100染色;C.改良消化复合植块法S- 100染色;D.经典植块法DAPI染核;E.普通消化复合植块法DAPI染核;F.改良消化复合植块法DAPI染核
A.S- 100 staining of explants-culture method group;B.S- 100 staining of hemi-explants-culture method group;C.S- 100 staining of improved enzyme digestion combined with explants-culture method group;D. DAPI staining of explants-culture method group;E.DAPI staining of hemi-explants-culture method group;F.DAPI staining of improved enzyme digestion combined with explants-culture method group
图 2S- 100免疫荧光鉴定结果(×200)
Fig 2S- 100 immunofluorescence staining(×200)
讨 论
目前SCs培养的传统方法主要有组织贴块法、酶消化法、免疫选择法。但是上述方法均有其局限性,如组织贴块法的生长周期较长,比较费时;酶消化法容易混入大量成纤维细胞,细胞纯度较低;免疫选择法所需的试剂价格昂贵,不适用于大量细胞培养[4]。因此本研究采取改良的单酶消化法与组织植块法相结合的培养方法,在细胞数量和纯度上与经典植块法及普通消化复合植块法进行比较。
新生大鼠周围神经分离的SCs分裂增殖能力较成年大鼠强,且成纤维细胞相对较少,但是新生1~2 d的大鼠外周神经较细小脆弱,且与周围组织粘连,不易于分离。因此,本研究选取新生3~5 d的大鼠,取材相对比较容易,又能保证细胞活力。改良消化复合植块法使用多聚右旋赖氨酸预先包被细胞培养瓶,通过改变培养瓶表面的电荷,促进细胞的黏附作用,更有利于SCs的生长和贴壁[5]。
传统的组织植块法虽然能够保证细胞的活力和纯度,但是培养周期较长,且获取的细胞数量相对较少。因此,本研究利用胶原酶对SCs损伤较小且成纤维细胞对胶原酶较为敏感的特点[6- 7],在组织贴块前先采用0.1%的Ⅱ型胶原酶进行消化,并弃去消化液,在保证细胞活力的前提下不仅能够去除神经外膜,使大部分的成纤维细胞消化,提高SCs的纯度,而且利于组织块中的细胞迁出,缩短培养时间,获取的细胞量也明显增多。细胞计数和细胞鉴定结果显示,消化复合植块法较经典组织植块法获取细胞量增加0.33×106个,细胞纯度提高约10%,有效改善了传统植块法培养时间长、获得的细胞量少的不足,而且克服了必须利用显微外科技术剥除神经外膜带来的不便。
既往研究通常使用有丝分裂抑制剂阿糖胞苷抑制成纤维细胞的增殖[8],但是阿糖胞苷并不是特异性的细胞增殖抑制剂,因此在抑制部分成纤维细胞增殖的同时,对SCs也造成一定的毒副作用。也有研究利用成纤维细胞膜上存在而SCs上不存在的表面抗原Thy- 1.1,在培养液中加入Thy- 1.1抗体及补体,通过补体介导的细胞溶解杀灭成纤维细胞、纯化SCs,虽可提升纯度,但由于补体的非特异性作用可导致SCs的活力下降,且抗体价格昂贵也限制了它的广泛使用[9]。本研究使用改良的纯化方法,首先加入弗斯可林培养SCs,进而采用低浓度的胰蛋白酶消化法和双向差速贴壁相结合的方法纯化SCs。
本研究采用的改良消化复合植块法在接种组织块后加入含有5 μmol/L弗斯可林的生长培养基,以促进SCs的增殖。弗斯可林是一种腺苷酸环化酶的激活剂,可促进神经系统中神经细胞的分化及突起的生长。研究表明弗斯可林在促进SCs增殖分化的同时,能够有效抑制成纤维细胞的生长,因此,既能提高获取SCs的细胞数量,又能有效保证细胞纯度[4,10]。本研究显示,加入弗斯可林后细胞量增加1.7倍,同时细胞纯度提高11%左右。
由于SCs的贴壁主要依靠突起的点斑状黏附,所以较容易被消化下来,而成纤维细胞的胞体和突起均具有贴壁能力,故较难消化。针对两种细胞贴壁能力的不同以及SCs对胰蛋白酶的敏感性[11],在传代时本研究采取低浓度的胰蛋白酶进行快速消化,可以将大部分SCs消化而成纤维细胞仍贴附在瓶底,从而达到纯化SCs的目的。消化后,通过双向差速贴壁的方法,在最大程度降低成纤维细胞数量的同时也减少了SCs的丢失[12],保证了SCs的数量和纯度。
本研究采用的改良复合植块法,不但缩短组织植块法培养周期,又显著提高SCs的数量和纯度,培养方法相对简便、省时,为周围神经损伤修复研究的开展奠定了实验基础。
[1]Hall S. The response to injury in the peripheral nervous system[J]. J Bone Joint Surg Br,2005,87(10):1309- 1319.
[2]Stassart RM,Fledrich R,Velanac V,et al. A role for Schwann cell-derived neuregulin- 1 in remyelination[J]. Nat Neurosci,2013,16(1):48- 54.
[3]Stefanescu O,Enescu DM,Lascar I. Schwann cell cultures: recent advances and novel approaches to the reconstruction of peripheral nerve defects[J]. Rom J Morphol Embryol,2012,53(3):467- 471.
[4]Kaewkhaw R,Scutt AM,Haycock JW. Integrated culture and purification of rat Schwann cells from freshly isolated adult tissue[J]. Nat Protoc,2012,7(11):1996- 2004.
[5]Honkanen H,Lahti O,Nissinen M,et al. Isolation,purification and expansion of myelination-competent,neonatal mouse Schwann cells[J]. Eur J Neurosci,2007,26(4):953- 964.
[6]秦义武,赵劲民,苏伟,等. 单酶消化复合植块法培养雪旺细胞的实验研究[J]. 中国修复重建外科杂志,2012,26(9):1107- 1111.
[7]Haastert K,Seef P,Stein VM,et al. A new cell culture protocol for enrichment and genetic modification of adult canine Schwann cells suitable for peripheral nerve tissue engineering[J]. Res Vet Sci,2009,87(1):140- 142.
[8]Calderon-Martinez D,Garavito Z,Spinel C,et al. Schwann cell-enriched cultures from adult human peripheral nerve: a technique combining short enzymatic dissociation and treatment with cytosine arabinoside (Ara-C) [J]. J Neurosci Methods,2002,114(1):1- 8.
[9]Assouline JG,Bosch EP,Lim R. Purification of rat Schwann cells from cultures of peripheral nerve: an immunoselective method using surfaces coated with anti-immunoglobulin antibodies[J]. Brain Res,1983,277(2):389- 392.
[10]Fregien NL,White LA,Bunge MB,et al. Forskolin increases neuregulin receptors in human Schwann cells without increasing receptor mRNA[J]. Glia,2005,49(1):24- 35.
[11]Wei Y,Zhou J,Zheng Z,et al. An improved method for isolating Schwann cells from postnatal rat sciatic nerves[J]. Cell Tissue Res,2009,337(3):361- 369.
[12]Wu W,Jin Y,Kretlow JD,et al. Purification of Schwann cells from adult rats by differential detachment[J]. Biotechnol Lett,2009,31(11):1703- 1708.
Culturing Schwann Cells from Neonatal Rats by Improved Enzyme Digestion Combined with Explants-culture Method
LIU Di1,LIANG Xiao-chun1,ZHANG Hong2
1Department of Traditional Chinese Medicine,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
LIANG Xiao-chunTel: 010- 69155331,E-mail: xcliang@vip.sina.com
ObjectiveTo develop an improved method for culturing Schwann cells(SCs) by using both enzyme digestion and explants-culture approaches and compared with traditional explants-culture method and general hemi-explants-culture method. MethodsBilaterally sciatic nerves and brachial plexus nerves were dissected from 3 to 5-day-old neonatal SD rats and explants-culture method,general hemi-explants-culture method,and improved enzyme digestion combined with explants-culture method were adopted to culture SCs,respectively. SCs were digested and passaged after 7 days in culture and counted under the microscope. The purity of SCs was identified by S- 100 immunofluorescence staining. ResultsThe SCs of improved method group grew fastest and the total number of cells obtained was(1.85±0.13)×106;the SCs of the hemi-explants-culture method group grew slower than the improved method group and the total number of cells obtained was (1.10±0.10)×106;the SCs of the explants-culture method group grew slowest and the total number of cells obtained was (0.77±0.03)×106.The total number of cells obtained showed significant difference among the three groups(P<0.01). Immunofluorescence staining showed that the SCs purity was (95.73±1.51)% in the improved method group,(84.66±2.68)% in the hemi-explants-culture method group,and (74.50±4.23)% in the explants-culture method group(P<0.01). ConclusionThe improved enzyme digestion combined with explants-culture method can obtain sufficient amount of high-purity SCs in a short time and thus may be applied in further research on peripheral nerve regeneration.
Schwann cells;cell culture;explants-culture method;enzyme digestion method
协和青年科研基金(33320140118)Supported by the Youth Scientific Research Foundation of PUMC (33320140118)
梁晓春电话:010- 69155331,电子邮件: xcliang@vip.sina.com
R445.2
A
1000- 503X(2016)04- 0388- 05
10.3881/j.issn.1000- 503X.2016.04.004
2015- 07- 21)

