几种丛枝菌根真菌对菲污染土壤中球囊霉素含量的影响
杨振亚,阙弘,朱雪竹,周紫艳,陈爽,凌婉婷*
(1.江苏省环境科学研究院,江苏省环境工程重点实验室,南京210036;2.南京农业大学土壤有机污染控制与修复研究所,南京210095)
几种丛枝菌根真菌对菲污染土壤中球囊霉素含量的影响
杨振亚1,2,阙弘2,朱雪竹2,周紫艳2,陈爽2,凌婉婷2*
(1.江苏省环境科学研究院,江苏省环境工程重点实验室,南京210036;2.南京农业大学土壤有机污染控制与修复研究所,南京210095)
以菲为多环芳烃(PAHs)的代表,选用密色无梗囊霉(Acaulospora scrobculata,A.s)、摩西球囊霉(Glomus mosseae,G.m)、根内球囊霉(Glomus intraradices,G.i)、幼套球囊霉(Glomus etunicatum,G.e)和缩球囊霉(Glomus constrictum,G.c),宿主植物为紫花苜蓿(Medicago sativa L.),研究了接种丛枝菌根真菌(AMF)对菲污染土壤中球囊霉素相关土壤蛋白(GRSP,以下简称球囊霉素)含量的影响。供试时间(30~90 d)内,5种AMF均能对宿主植物根良好侵染,与紫花苜蓿建立共生关系,促进菲污染土壤中植物茎叶部和根部的生长;紫花苜蓿对5种AMF的菌根依赖性为108%~249%;接种AMF提高了土壤中GRSP的含量。90 d后接种G.i、G.e、G.m、G.c和A.s处理的土壤中总球囊霉素(T-GRSP)和易提取球囊霉素(EE-GRSP)含量分别达2.90~4.61、0.87~1.33 mg·g-1,比不接种对照组(CK)分别高26.1%~100.0%和10.1%~68.4%;随着培养时间(30~90 d)延长,接种G.i的处理土壤中T-GRSP和EE-GRSP含量显著增大。接种同一AMF菌种(G.i)处理的土壤中T-GRSP和EE-GRSP含量与菲残留量间呈极显著负相关。
丛枝菌根真菌;球囊霉素;多环芳烃;菌根修复
杨振亚,阙弘,朱雪竹,等.几种丛枝菌根真菌对菲污染土壤中球囊霉素含量的影响[J].农业环境科学学报,2016,35(7):1338-1343.
YANG Zhen-ya,QUE Hong,ZHU Xue-zhu,et al.Impacts of arbuscular mycorrhizal fungi on glomalin content in soils contaminated with phenanthrene[J]. Journal of Agro-Environment Science,2016,35(7):1338-1343.
丛枝菌根真菌(AMF)是土壤微生物区系中生物量最大、最重要的成员之一,能与80%以上的陆生植物和绝大多数速生草本植物形成共生体系[1-3]。以往大量研究表明,接种AMF能促进土壤中多环芳烃(PAHs)的降解,进而提出了丛枝菌根修复技术[4]。AMF也可显著地影响植物吸收PAHs。程兆霞等[4]研究得出,接种摩西球囊霉(Glomus mosseae)或幼套球囊霉(Glomus etunicatum)显著提高了三叶草根的芘含量、积累量和根系富集系数;Gao等[5]发现,Glomus mosseae和Glomus etunicatum促进了PAHs(苊)在黑麦草根中的积累,并进一步分析了丛枝菌根中PAHs的亚细胞分布。然而,对于AMF影响土壤中PAHs降解和植物吸收的内在本质,国内外仍然缺乏深入的了解。有学者推测,这可能与AMF菌丝分泌的球囊霉素有关[6]。
球囊酶素(Glomalin)是AMF菌丝产生并脱落进入土壤中的一类糖蛋白,近年来,土壤中球囊酶素的生态和环境效应备受学者关注。1996年,Wright和Upadhyaya[7]首次从土壤中提取并发现了球囊酶素,这也是迄今发现的唯一一类由AMF产生并释放到土壤中的蛋白质;后来,Rillig[8]和Lovelock等[9]进一步将其命名为球囊酶素相关土壤蛋白(GRSP,以下简称球囊酶素)。Driver等[10]发现,球囊酶素不会直接释放到土壤中,而是牢牢地固定在菌丝细胞壁和真菌孢子中,并随着二者衰亡和降解后进入土壤。球囊酶素难溶于水,不被蛋白酶水解、难于降解,在土壤中含量丰富且自然状态下极为稳定。大量数据表明,球囊酶素是土壤有机质的重要组成部分,是土壤中最重要的碳库之一,其含量是腐殖质的2~24倍,占土壤有机碳源的比例可达27%[6]。球囊酶素也是土壤团聚体形成的重要粘合剂,据报道,其粘结土壤颗粒的能力比其他土壤热水提取的碳水化合物强3~10倍,这对于土壤团聚化过程、土壤质地改良、土壤质量提升等意义重大[11]。近些年来,球囊酶素在污染土壤中的作用和功能已成为环境领域研究的一个热点。然而遗憾的是,接种AMF后PAHs污染土壤中球囊酶素如何响应?球囊酶素与土壤中PAHs降解间有何关系?国内外至今对此仍少有了解。
本文以菲为PAHs的代表,以紫花苜蓿(Medicago sativa L.)为宿主植物,分别研究了接种5种AMF对菲污染土壤中总球囊霉素(T-GRSP)和易提取球囊霉素(EE-GRSP)含量的影响,揭示土壤中球囊霉素含量的变化与菲残留的关系,为下一步探讨土壤中球囊霉素对PAHs环境行为的影响提供基础数据。
1 材料与方法
1.1实验材料
菲购自德国Fluka试剂公司,纯度>98%,其分子量为178.23 g·mol-1。二氯甲烷、正己烷、丙酮、甘油、乳酸、层析柱硅胶(200~300目)和无水硫酸钠均为分析纯;甲醇为色谱纯。
供试植物为紫花苜蓿(Medicago sativa L.)。供试AMF购自北京市农林科学院“中国丛枝菌根真菌种质资源库(BEC)”。5种AMF分别为密色无梗囊霉Acaulospora scrobculata(A.s)、摩西球囊霉Glomus mosseae(G.m,BGC GD01A)、根内球囊霉Glomus intraradices(G.i,BGC HEB07D)、幼套球囊霉Glomus etunicatum(G.e,BGC SD03B)、缩球囊霉Glomus constrictum(G.c,BGC NM03B)。
供试土样采自南京市江宁区,为旱作水稻土表层(0~20 cm),土壤类型为黄棕壤,其pH为6.08,有机质含量24.3 g·kg-1,沙粒、粉粒和粘粒含量分别为13.5%、61.8%和24.7%。土样采集后风干,过2 mm筛。实验用沙为河沙,水洗后晾干,过2 mm筛。将土样与河沙按3:1比例混合,121℃下高压灭菌2 h,以杀死原有的AMF孢子,晾干备用。
污染土样制备[12]:配制含菲的丙酮溶液,加入到上述土样中,待丙酮挥发后,充分搅拌混匀后过2 mm筛,制得菲污染土样,置于储藏架上静置15 d后备用。测得污染土样中菲起始含量为52.79 mg·kg-1。
1.2实验方法
称取避光保存的污染土样250 g置于盆钵中,称取菌剂15 g均匀覆于上面,再覆150 g污染土壤,加水至50%田间最大持水量,静置过夜。紫花苜蓿种子用10%H2O2表面消毒10 min、于室温下过夜催芽,待种子白露后播于盆钵中。经2~3 d出苗,出苗1周时两次间苗,每盆留苗6株。实验设置不接种AMF对照处理(CK)和分别接种5种AMF(G.e、A.s、G.m、G.i、G.c)处理,其中CK为接种等量的灭菌后的菌剂,以保证开始各处理土壤微生物区系一致。分设30、45、60、75、90 d 5个采样时间。每一处理3个重复(共4盆)。实验在温室中进行,自然采光,每5 d随机交换盆钵位置,整个植物生长过程中定期浇水。分别收获植株地上部和根部,先后用自来水、去离子水清洗植物样品,用滤纸蘸干其表面水分,置于低温冰箱中保存,待分析。
1.3样品提取及分析
侵染率测定[13]:取新鲜根样,剪成1 cm根段,随机取出部分根样用曲利苯蓝-直线截获法测定根系侵染率,并在显微镜下观察丛枝菌根侵染状况。
植物生物量测定:将植株茎叶部与根部分开,超低温冷冻干燥后分别测定干重。
土壤样品中菲含量测定[14]:取适量冷冻干燥后的土样置于研钵中,磨碎混匀后过2mm筛,取2g土样于30mL玻璃离心管中,加入10mL二氯甲烷溶液后超声萃取1h,4000r·min-1离心10min,取3mL上清液过2 g硅胶柱,用11 mL的二氯甲烷和正己烷溶液(体积比1:1)洗脱,洗脱液收集至旋转蒸发瓶,于40℃下浓缩蒸干。用色谱甲醇定容至4mL,过0.22μm孔径有机相滤膜后用高效液相色谱仪(HPLC)分析。土壤样品中菲的加标回收率为104.4%,相对标准偏差为1.74%。
EE-GRSP提取[7,15]:称取0.25 g待测土样于塑料离心管中,加入2 mL柠檬酸钠浸提剂(20 mmol·L-1、pH 7.0),盖紧后摇匀,置于灭菌锅(103 kPa、121℃)中提取30 min,取出离心管滤干外表面水分,离心6 min(转速10 000 r·min-1),收集上清液。
T-GRSP提取[7,15]:称取0.25g待测土样于塑料离心管中,加入2mL柠檬酸钠浸提剂(50mmol·L-1、pH7.0),盖紧后摇匀。总球囊霉素需要重复提取6次,每次加入浸提剂后摇匀土样,使土样与浸提剂充分接触,之后置于灭菌锅(103 kPa、121℃)中提取60 min,取出离心管滤干外表面水分,离心6min(转速10000r·min-1),将表面上浮物分离并收集上清液于离心管中,4℃备用。
提取液中EE-GRSP和T-GRSP的测定[7]:吸取0.5 mL待测样品上清液于比色管中,加入5 mL经过过滤的考马斯亮蓝G-250染色剂,盖紧后颠倒,显色10 min并进行比色测定(波长595 nm)。测定试验前先配制牛血清蛋白(BSA)标准液,考马斯亮蓝显色后比色测定,绘制牛血清蛋白标准曲线。通过标线比照计算出土壤样品的易提取球囊霉素和总球囊霉素相关土壤蛋白含量,以每克土壤中蛋白质的微克数表示。
2 结果分析与讨论
2.1菌根侵染率
菌根侵染率反映了菌根真菌与宿主植物共生关系的亲合程度,也是衡量真菌在宿主植物根系扩展能力的重要指标,侵染率越高,说明其在宿主根系上扩展的能力越大[16]。60 d和90 d后,接种5种不同AMF的紫花苜蓿均能被AMF侵染,菌根侵染率分别为42.4%~74.1%和29.4%~48.2%(图1)。但不同AMF间存在差异,其中G.i的侵染率最大,60 d和90 d时分别达74.1%和48.2%,A.s的侵染率最小,60 d和90 d时分别为42.4%和29.4%。随着培养时间(30~90 d)延长,菌根侵染率呈先增大后减小的趋势。以G.i为例,培养期内(30~90 d),G.i侵染率为18.5%~74.1%(图2)。培养时间由30 d延长到60 d,G.i侵染率呈显著增大的趋势。这与肖敏等[17]的研究结果相一致。但60~90 d内随着培养时间延长,G.i侵染率则由74.1%下降为54.9%。这一方面可能与供试时间内AMF丛枝的衰老、退化、消解有关[6],另一方面受盆钵和土量制约,植物生长后期所需营养受限所致。
2.2紫花苜蓿生物量和菌根依赖性
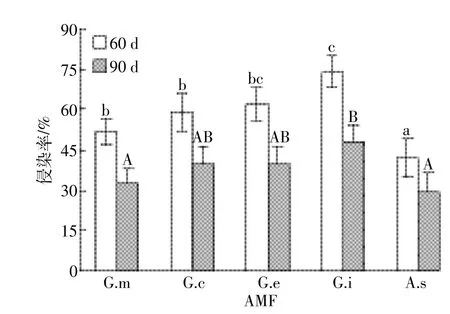
图1 60 d和90 d时AMF菌根侵染率Figure 1 Colonization rate of alfalfa by AMFs after 60 and 90 days
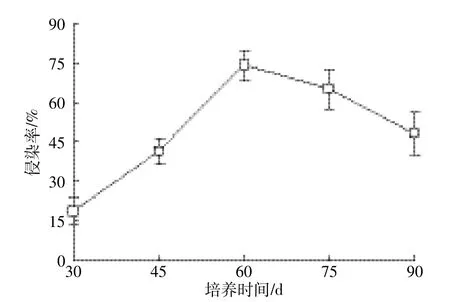
图2 30~90 d时G.i侵染率Figure 2 Colonization rate of alfalfa by G.i after 30~90 days
以往大量研究表明,接种AMF促进了植物根系生长,进而增强了植物对土壤中碳、氮和磷的吸收,改善了植株生长所处的水分状况,并提高了植物叶绿素的含量[18]。本研究发现,与对照相比,90 d收获时接种5种不同AMF均增加了紫花苜蓿地上部、地下部以及整株植株生物量(表1)。但供试5种AMF对紫花苜蓿生长的促进作用存在差异,接种不同AMF处理的植株地上部干重为1.88~3.64 g·pot-1、根干重为1.34~3.78 g·pot-1、整株植株总干重为3.22~7.42 g·pot-1。接种G.i组地上部、地下部和植株总干重最大,分别达3.64、3.78、7.42 g·pot-1,是对照组的2~3倍;接种A.s组的地上部、地下部和植株总干重最小,分别为1.88、1.34、3.22 g·pot-1,与对照组间无显著差异。
Gerdemann首先提出“菌根依赖性”(Mycorrhizal Dependence,MD)的概念,即“在一定土壤肥力条件下植物产生最大生长量对菌根的依赖程度”[19];Menge等[20]以菌根植株干物质量占非菌根植株干物质量的百分数来表示植物对菌根的依赖性,即:
菌根依赖性(MD,%)=菌根植物干重/非菌根植物干重×100%
紫花苜蓿对5种AMF均表现出菌根依赖性。一般而言,菌根真菌对植物根系的侵染状况越好,则对植物生长的促进作用也越显著。本研究中,5种AMF均能与紫花苜蓿建立良好的共生关系(表1),特别是G.i的菌根依赖性最高,达到249%,相比对照组提高了149%;A.s的菌根依赖性最小(108%)。这些结果表明,接种供试AMF有助于紫花苜蓿生长。
2.3AMF对土壤中球囊霉素含量的影响
接种AMF有利于土壤中球囊酶素(GRSP)的产生。培养90 d时,接种G.i、G.e、G.m、G.c和A.s组土壤中总球囊酶素(T-GRSP)含量为2.90~4.61 mg·g-1,比不接种对照组(2.30 mg·g-1)高26.1%~100.0%(图3)。易提取球囊酶素(EE-GRSP)与T-GRSP具有相似的规律。90 d时,接种5种不同AMF的土壤中EEGRSP含量为0.87~1.33 mg·g-1,比不接种对照组(0.79 mg·g-1)高10.1%~68.4%(图4)。与T-GRSP相比,土壤中EE-GRSP较低,各AMF处理土壤中EE-GRSP占T-GRSP的比例为28.9%~37.0%。
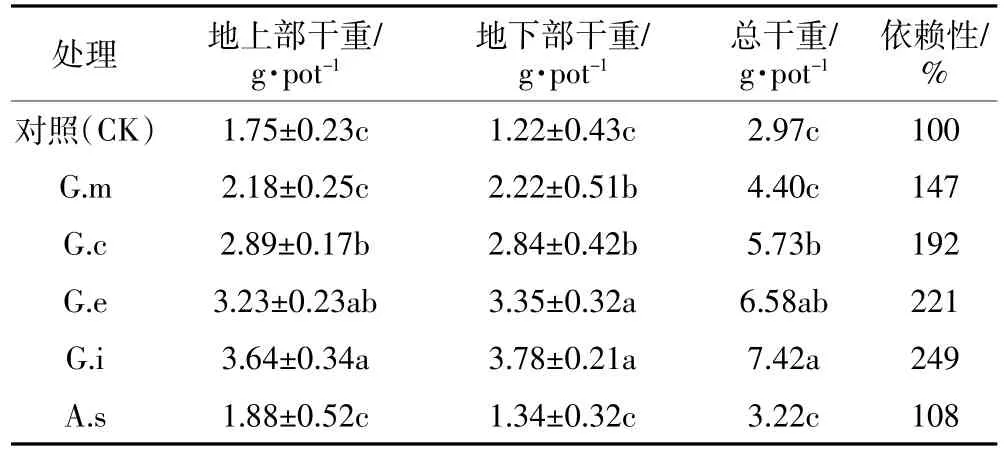
表1 90 d时不同AMF对紫花苜蓿生物量和菌根依赖性的影响Table 1 Effects of AMF on the plant biomass and mycorrhizal dependency of alfalfa after 90 days
进一步分析了不同时间(30~90 d)下接种AMF对土壤中T-GRSP和EE-GRSP含量的影响,结果如图5所示。以G.i处理组为例,随着培养时间(30~90 d)的延长,接种G.i组的土壤中T-GRSP和EE-GRSP含量均呈增大的趋势,分别由30 d时的1.04、0.43 mg·g-1增大为90 d时的4.10、1.33 mg·g-1。30~90 d内,不接种AMF对照组土壤中EE-GRSP含量没有表现出显著的变化,但其T-GRSP含量由0.78 mg·g-1增大至2.30 mg·g-1。与对照处理相比,接种G.i组的土壤中T-GRSP和EE-GRSP含量要高28.7%~82.3%和26.4%~92.5%,且随着培养时间由30 d延长到90 d,接种G.i组的土壤中T-GRSP和EE-GRSP含量与对照组差距变大,90 d时G.i组的T-GRSP和EE-GRSP含量分别比对照组高82.3%和92.5%。上述结果表明,接种AMF可显著增加土壤中T-GRSP和EE-GRSP含量。另外,不管对照组还是接种AMF处理组,其土壤中EE-GRSP要比T-GRSP低得多,仅占T-GRSP的27.1%~43.0%。
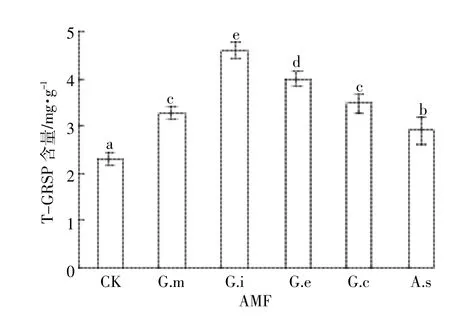
图3 90 d时接种不同AMF土壤中T-GRSP含量Figure 3 The content of T-GRSP in soils with AMF inoculation after 90 days
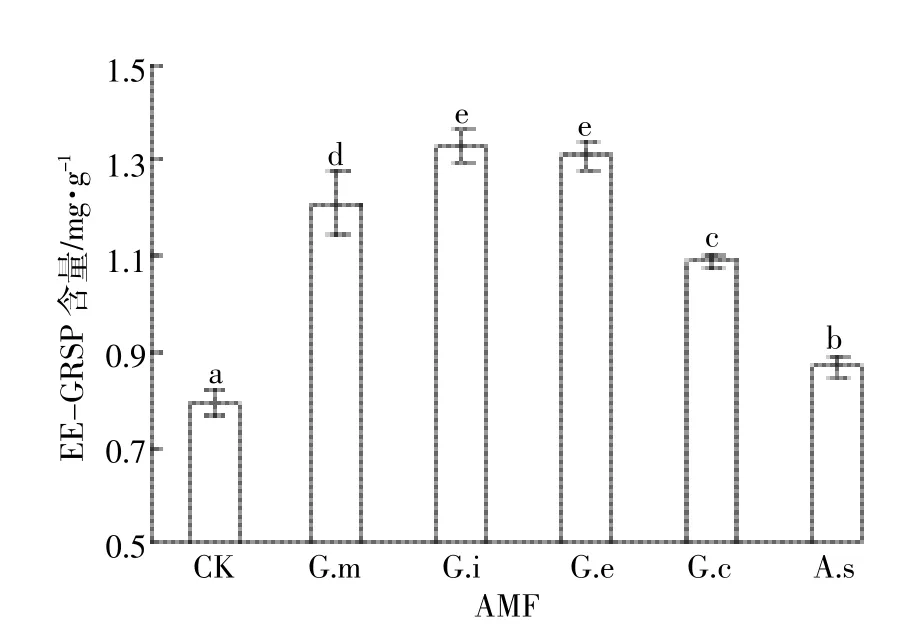
图4 90 d时接种不同AMF土壤中EE-GRSP含量Figure 4 The content of EE-GRSP in soils with AMF inoculation after 90 days
2.4土壤中球囊霉素含量与菲残留的关系
不同处理土样中菲的残留动态如图6。供试土样中菲起始含量均为52.79 mg·kg-1。90 d时,接种5种不同AMF处理土样中菲的残留浓度为0.53~0.96 mg·kg-1,均低于不接种对照处理(G.e和A.s处理与对照间差异未达到显著水平),5种不同AMF处理土样中菲的去除率均>98.1%。
以接种G.i处理组为例,不同时间土壤中菲的残留动态结果见图7。30~90 d随培养时间延长,有植物接种G.i处理、无植物不接种AMF对照处理、有植物不接种AMF对照处理的土样中菲含量均呈不断下降的趋势。但不同处理间差异较大,各处理间土壤中菲含量大小顺序为无植物不接种AMF对照>有植物不接种AMF对照>有植物接种G.i处理。接种G.i显著促进了土壤中菲的去除。30~90 d内,接种G.i土壤中菲的残留含量为0.53~2.13mg·kg-1,分别比相应有植物无AMF对照低25.7%~44.6%。
进一步统计分析了土壤中菲残留与GRSP含量的关系,如图8所示。接种同一AMF菌种(G.i)的各处理间,土壤中T-GRSP和EE-GRSP含量均与菲残留含量呈极显著负相关,即土壤中GRSP含量越高,该土壤中菲残留含量越低、去除率越大。
接种AMF能加速土壤中PAHs的去除,这主要与植物根系分泌作用有关[21]。接种AMF处理提高了植物根系生物量,增加了植物根系分泌物的产生和向土壤中的输入,流入土壤的根系分泌物可促进土壤微生物的生长与繁殖,进而促进土壤中PAHs的降解和去除。AMF侵染也会产生大量GRSP,而GRSP可以保护菌丝免受微生物的侵袭[22]。这种保护机制可以促进菌丝生长,这些伸向土壤中的数量庞大的菌丝可以从土壤中吸收植物营养物质,促进植物生长,间接导致植物向土壤中释放更多的根系分泌物,进而提高了根际微生物的数量和活性,促进土壤PAHs的降解,导致“土壤菲残留量和GRSP含量间显著负相关”这一表观现象。然而,对于GRSP如何影响土壤中PAHs的迁移转化过程,该领域研究国内外仍几近空白,有待进一步探索。
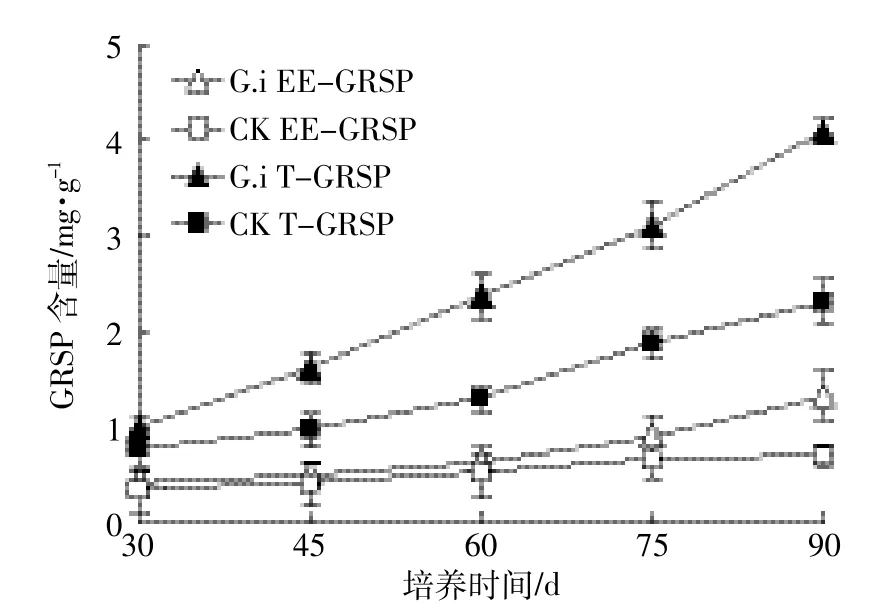
图5 不同时间接种G.i土壤中球囊酶素的含量变化Figure 5 The contents of GRSP in soils with G.i inoculation as a function of cultivation time
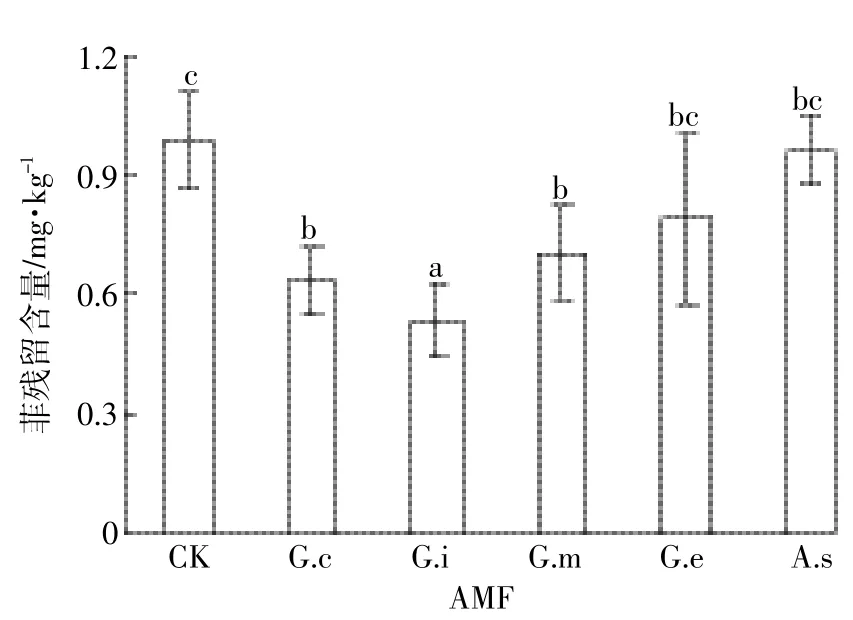
图6 90 d时接种不同AMF的土壤中菲残留量Figure 6 Concentrations of phenanthrene in soils with AMF inoculation after 90 days
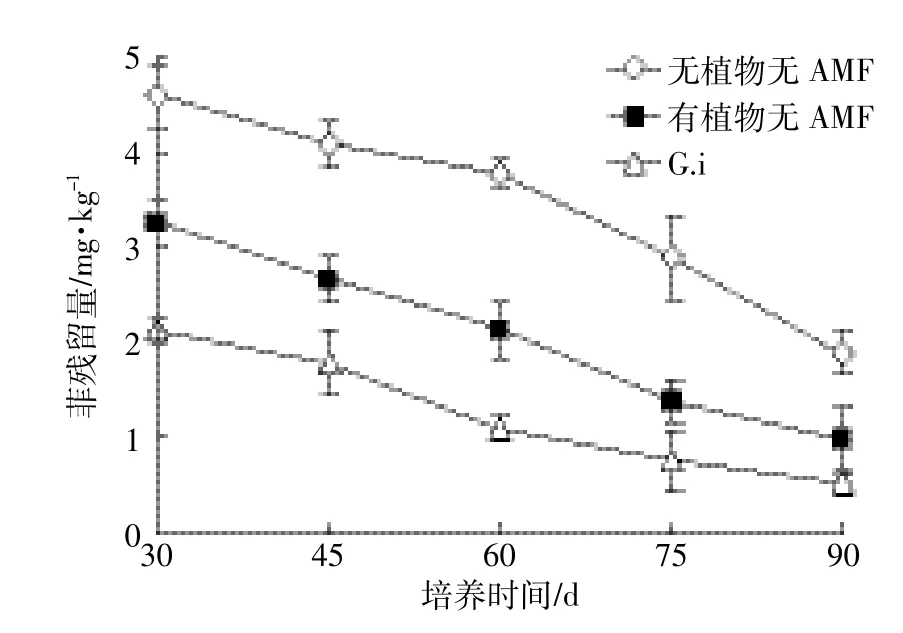
图7 接种不同时间G.i处理土壤中菲的残留量Figure 7 Concentrations of phenanthrene in soils with G.i inoculation as a function of cultivation time
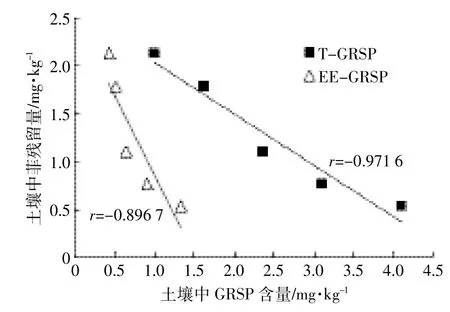
图8 接种G.i处理的土壤中GRSP含量与菲残留量的关系Figure 8 Correlation of GRSP contents with phenanthrene concentrations in soils with G.i inoculation
3 结论
(1)5种AMF均能与紫花苜蓿建立良好的共生关系,促进菲污染土壤中植物茎叶部和根部的生长。紫花苜蓿对5种AMF的菌根依赖性为108%~249%。
(2)接种AMF有利于土壤中GRSP的产生。接种AMF 90 d的土壤中T-GRSP和EE-GRSP含量分别达2.90~4.61 mg·g-1和0.87~1.33 mg·g-1,比不接种对照组高26.1%~100.0%和10.1%~68.4%。随着培养时间(30~90 d)延长,接种AMF(G.i)处理土壤中T-GRSP和EE-GRSP含量显著增大。
(3)接种同一AMF菌种(G.i)的土壤中,T-GRSP和EE-GRSP含量与菲残留量间极显著负相关。
[1]Averill C,Turner B L,Finzi A C.Mycorrhiza-mediated competition between plants and decomposersdrives soil carbon storage[J].Nature,2014,505:543-545.
[2]Hijri M,Sanders I R.Low gene copy number shows that arbuscular mycorrhizal fungi inherit genetically different nuclei[J].Nature,2005,433:160-163.
[3]Cheng L,Booker F L,Tu C,et al.Arbuscular mycorrhizal fungi increase organic carbon decomposition under elevated CO2[J].Science,2012,337(6098):1084-1087.
[4]程兆霞,凌婉婷,高彦征.丛枝菌根对芘污染土壤修复及植物吸收的影响[J].植物营养与肥料学报,2008,14(6):1178-1185. CHENG Zhao-xia,LING Wan-ting,GAO Yan-zheng.Impacts of arbuscular mycorrhizhae on plant uptake and phytoremediation of pyrene in soils[J].Plant Nutrition and Fertilizer Science,2008,14(6):1178-1185.
[5]Gao Y Z,Cao X Z,Kang F X,et al.PAHs pass through the cell wall and partition into organelles of arbuscular mycorrhizal roots of ryegrass[J]. Journal of Environmental Quality,2011,40(2):653-656.
[6]王建,周紫燕,凌婉婷.球囊霉素相关土壤蛋白的分布及环境功能研究进展[J].应用生态学报,2016,27(2):634-642. WANG Jian,ZHOU Zi-yan,LING Wan-ting.Distribution and environmental function of glomalin-related soil protein:A review[J].Chinese Journal of Applied Ecology,2016,27(2):634-642.
[7]Wright S F,Upadhyaya A.Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J].Soil Science,1996,161(9):575-586.
[8]Rillig M C.Arbuscular mycorrhizae,glomalin,and soil aggregation[J]. Canadian Journal of Soil Science,2004,84(4):355-363.
[9]Lovelock C E,Wright S F,Clark D A,et al.Soil stocks of glomalin produced by arbuscular mycorrhizal fungi across a tropical rain forest landscape[J].Journal of Ecology,2004,92(2):278-287.
[10]Driver J D,Holben W E,Rillig M C.Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi[J].Soil Biology and Biochemistry,2005,37(1):101-106.
[11]Singh P K.Role of glomalin related soil protein produced by arbuscular mycorrhizal fungi:A review[J].Agricultural Science Research Journal,2012,2(3):119-125.
[12]宗炯,朱雪竹,凌婉婷,等.多环芳烃污染对丛枝菌根真菌生物学性状的影响[J].农业环境科学学报,2014,33(2):305-312. ZONG Jiong,ZHU Xue-zhu,LING Wan-ting,et al.Effects of polycyclic aromatic hydrocarbons on biological characteristics of arbuscular mycorrhizal fungi[J].Journal of Agro-Environment Science,2014,33(2):305-312.
[13]Phillips J M,Hayman D S.Improved procedures for clearing and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transation of the British Mycological Society,1970,55(1):158-161.
[14]高彦征,朱利中,凌婉婷,等.土壤和植物样品的多环芳烃分析方法研究[J].农业环境科学学报,2005,24(5):1003-1006. GAOYan-zheng,ZHULi-zhong,LINGWan-ting,et al.Analysismethod forpolycyclicaromatichydrocarbonsinsoilandplantsamples[J].Journal of Agro-Environment Science,2005,24(5):1003-1006.
[15]David P J,Garamszegi S,Beltran B.Glomalin extraction and measurement[J].Soil Biology and Biochemistry,2008,40(3):728-739.
[16]Gange A C,Ayres R L.On the relation between arbuscular mycorrhizal colonization and plant benefit[J].Oikos,1999,87(3):615-621.
[17]肖敏,高彦征,凌婉婷.菲、芘污染土壤中丛枝菌根真菌对土壤酶活性的影响[J].中国环境科学,2009,29(6):668-672. XIAOMin,GAOYan-zheng,LING Wan-ting.Effectsof arbuscular mycorrhizal fungi on enzymesactivity in soils contaminated by phenanthrene andpyrene[J].ChinaEnvironmentalScience,2009,29(6):668-672.
[18]Morte A,Looisolo C,Schubert A.Effect of drought stress on growth and water relation of the mycorrhizal association Helianthemum almerienseterfeziaclaveryi[J].Mycorrhiza,2000,10(3):115-119.
[19]Gerdemann J W.Versicular-arbuscular mycorrhizal[M]//The development and function of roots.Ed.by Torry J G,Clarson D T.London:A-cademic Press,1975:575-591.
[20]Menge J A,Johnson E L V,Platt R G.Mycorrhizal dependency of several citrus cultivars under three nutrient regimes[J].New Phytoogist,1978,81(3):553-559.
[21]范淑秀,李培军,何娜,等.多环芳烃污染土壤的植物修复研究进展[J].农业环境科学学报,2007,26(6):2007-2013. FAN Shu-xiu,LI Pei-jun,HE Na,et al.Research of phytoremediation on contaminated soil with polycyclic aromatic hydrocarbons(PAHs)[J]. Journal of Agro-Environment Science,2007,26(6):2007-2013.
[22]李涛,赵之伟.丛枝菌根真菌产球囊霉素研究进展[J].生态学杂志,2005,24(9):1980-1084. LI Tao,ZHAO Zhi-wei.Advances in researches on glomalin produced by arbuscular mycorrhizal fungi[J].Chinese Journal of Ecology,2005,24(9):1980-1084.
Impacts of arbuscular mycorrhizal fungi on glomalin content in soils contaminated with phenanthrene
YANG Zhen-ya1,2,QUE Hong2,ZHU Xue-zhu2,ZHOU Zi-yan2,CHEN Shuang2,LING Wan-ting2*
(1.Jiangsu Key Laboratory of Environmental Engineering,Jiangsu Provincial Academy of Environmental Science,Nanjing 210036,China;2.Institute of Organic Contaminant Control and Soil Remediation,Nanjing Agricultural University,Nanjing 210095,China)
Currently there is little information available about the responses of glomalin-related soil proteins(GRSP)to arbuscular mycorrhizal fungi(AMF)in soils contaminated with polycyclic aromatic hydrocarbons(PAHs).Here an investigation was conducted to examine the impacts of five AMFs on GRSP content in soils contaminated with phenanthrene as a representative PAH.The experimental AMFs were Acaulospora scrobculata(A.s),Glomus mosseae(G.m),Glomus intraradices(G.i),Glomus etunicatum(G.e)and Glomus constrictum(G.c). Host plant was alfalfa(Medicago sativa L.).These five AMFs had good colonization with alfalfa roots after 30~90 days.Inoculating AMFs enhanced GRSP content in phenanthrene-contaminated soils.Total extractable GRSP(T-GRSP)and easily extractable GRSP(EE-GRSP)were respectively 2.90~4.61 mg·g-1and 0.87~1.33 mg·g-1in soils inoculated with AMFs after 90-day cultivation,which were 26.1%~100.0%and 10.1%~68.4%higher than those in soils without AMF inoculation(CK).T-GRSP and EE-GRSP content in soils with AMF(G.i as a representative)was increased with cultivation time from 30 to 90 days,and significantly negatively correlated with residual concentrations of phenanthrene in soils.
arbuscular mycorrhizal fungus;glomalin;polycyclic aromatic hydrocarbons;rhizoremediation
S154.3
A
1672-2043(2016)07-1338-06
10.11654/jaes.2016.07.016
2016-04-03
国家自然科学基金项目(21477056,31270574);农业部公益性行业(农业)科研专项(201503107)
杨振亚(1981—),男,江苏金湖人,工程师,主要研究方向为环境污染评价与控制。E-mail:0517jhyzy@163.com
凌婉婷E-mail:lingwanting@njau.edu.cn

