土壤微生物对邻苯二甲酸二(乙基己)酯胁迫的生态响应
夏庆兵,王军,朱鲁生,王金花,刘文军
(山东农业大学资源与环境学院,山东省高校农业环境重点实验室,山东泰安271018)
夏庆兵,王军*,朱鲁生*,王金花,刘文军
(山东农业大学资源与环境学院,山东省高校农业环境重点实验室,山东泰安271018)
为了探讨和分析典型酞酸酯邻苯二甲酸二(2-乙基己)酯(DEHP)对土壤微生物的生态毒性效应,采用室内避光培养模拟实验,设定DEHP在土壤中的染毒浓度为0、0.1、1、10、50 mg·kg-1,取样时间为7、14、21、28 d,考察了DEHP对3种土壤酶、土壤呼吸和土壤微生物生物量碳、氮的影响。结果表明:在染毒初期,过氧化氢酶活性受到明显抑制,且随DEHP浓度增大抑制作用减弱,抑制率为25.0%~14.3%;0.1~10 mg·kg-1处理组脱氢酶活性受到显著抑制,抑制率分别为86.3%、54.7%和31.7%,但50 mg·kg-1处理组脱氢酶活性则是对照组的2.05倍;染毒前期脲酶对DEHP胁迫不敏感,染毒后期其活性受到抑制,且随DEHP浓度增大抑制作用增强;过氧化氢酶和脲酶活性随时间呈下降趋势,而脱氢酶活性随时间呈先上升后下降的趋势。此外,在DEHP的胁迫下土壤呼吸强度和土壤微生物生物量碳及生物量氮均受到刺激,且随DEHP浓度的增加均呈先升高后降低的趋势,随时间均呈下降的趋势。总体来说,DEHP胁迫下,土壤酶活性、土壤呼吸强度和微生物生物量均发生明显变化,土壤微生物生态环境受到一定影响。
邻苯二甲酸二(2-乙基己)酯(DEHP);土壤呼吸;土壤酶;微生物量;生态效应
夏庆兵,王军,朱鲁生,等.土壤微生物对邻苯二甲酸二(2-乙基己)酯胁迫的生态响应[J].农业环境科学学报,2016,35(7):1344-1350.
XIA Qing-bing,WANG Jun,ZHU Lu-sheng,et al.Ecological effects of di(2-ethylhexyl)phthalate on soil microorganisms[J].Journal of Agro-Environment Science,2016,35(7):1344-1350.
酞酸酯(Phthalic acid esters,PAEs)又称邻苯二甲酸酯,主要作为增塑剂应用于塑料行业,它是目前应用最广泛的一类增塑剂,约占全部增塑剂消费量的70%[1],同时其也是使用量最大的一种环境内分泌干扰物[2]。PAEs易在人体内蓄积[3],给人体健康造成潜在的风险。目前,我国大部分地区农业土壤中已普遍检出PAEs[4-7],其中邻苯二甲酸二(2-乙基己)酯[Di(2-ethylhexyl)phthalate,DEHP]和邻苯二甲酸二丁酯(Dibutyl phthalate,DBP)的污染最为普遍。土壤中的PAEs通常来自农田塑料薄膜、塑料废品、垃圾和污水灌溉,塑料进入农田的主要途径是农膜的使用[8],我国2014年塑料农膜总产量约219万t,若以添加30%的增塑剂来计算,则有近65.7万t增塑剂进入我国农田土壤环境之中。这对我国农田土壤生态系统的健康发展是一个潜在的威胁。
土壤生态系统的活力是农业可持续发展的首要前提,土壤质量被认为是评价环境质量、食品安全和经济活力的综合指标[9]。因此,土壤常被作为土地可持续管理的潜在评价指标。土壤酶是土壤中物质代谢和能量转化的重要因素,土壤中各种生化过程都是在土壤酶的参与下完成的,土壤酶活性反映了土壤中进行的各种生物化学过程的动力和强度。土壤呼吸可用来衡量土壤中微生物的总活性,是表征土壤代谢强度的重要生物学指标,在碳循环过程中也有重要作用。土壤微生物生物量与土壤中的C、N等养分的循环关系密切,可直接或间接反映土壤肥力和土壤环境质量变化[10]。因此关于土壤酶、土壤呼吸和土壤微生物生物量的研究,对评价土壤肥力的形成与提高、土壤生态系统的物质循环等具有重要的意义。
目前关于PAEs类化合物的研究主要集中在毒理学和降解等方面[11-12],在土壤生态中的研究较少且主要集中在微生物的毒性效应方面。土壤微生物数量组成(细菌、放线菌、真菌)以及生物量、基础呼吸、土壤酶等基本生理指标可以用来表征PAEs土壤污染的生态环境效应。本实验基于上述多个有代表性的指标对DEHP的微生物生态效应进行了全面、细致的研究,旨在阐明这种典型PAEs类化合物进入土壤后对土壤微生物生态效应的影响规律,为该类化合物的安全使用和生态安全性评价提供依据,对维持土壤生态系统的持续健康发展具有重要的意义。
1 材料与方法
1.1实验材料
1.1.1土壤材料
土壤样品采集于山东农业大学试验田(36°09′57.7″N,117°09′38.7″E,海拔131 m)。采用五点法取样,除去土壤表面的杂草、枯叶和表层土后,采集耕作层土壤,采样深度2~20 cm。土样取回后,剔除石砾和植物残体等杂物,过20目筛,装入玻璃瓶,于25℃培养箱中保存备用。
土壤理化性质的测定参照《土壤农业化学分析方法》[13]。其理化性质见表1。
1.1.2主要药剂及试剂
DEHP(德国DR认证,西格玛奥德里奇(上海)贸易有限公司)纯度≥99.5%。丙酮(天津凯通)、正己烷(天津永大)、甲苯(天津凯通)、三羟甲基氨基甲烷Tris(北京化工厂)、氯化三苯基四氮唑(华东师范大学化工厂)、氢氧化钠(天津凯通)、重铬酸钾(莱阳康德)、硫酸亚铁铵(天津凯通)、硫酸钾(天津凯通)、柠檬酸(天津凯通)、高锰酸钾(天津大茂)、过氧化氢(天津凯通)、草酸钠(上海广诺)等均为分析纯试剂。
1.1.3主要仪器设备
SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司)、红外控温消煮炉(北京通润源)、KDY-9820凯式定氮仪(北京华威兴业科技)、紫外分光光度计(日本岛津)、万分之一电子分析天平(德国Sartorius)、HPG-280B光照培养箱(哈尔滨东联电子)。
1.2实验方法
1.2.1土壤染毒
向过筛后的土壤样品中加蒸馏水,调节其含水量至最大田间持水量的60%。土壤染毒共设50、10、1、0.1、0 mg·kg-1(丙酮空白对照,CK)5个浓度梯度。分别取5000、1000、100、10 mg·L-1的DEHP标准工作液8 mL和丙酮溶液8 mL,与800 g前处理过的土壤充分混合。将同浓度染毒后的土样分装至12个棕色小瓶中,于25℃培养箱中避光培养,取样时间分别设在染毒后第7、14、21、28 d。

表1 土壤理化性质Table 1 Physical and chemical properties of soil
1.2.2土壤呼吸的测定
土壤呼吸的测定采用密闭静置培养测CO2法[14]。利用一定浓度的NaOH溶液吸收土壤呼吸作用释放出的CO2,再根据NaOH溶液的消耗量计算出CO2的含量。
1.2.3土壤脲酶活性的测定
土壤脲酶活性的测定采用靛酚蓝比色法[14]。脲酶是一种高度专性的酶,能酶促尿素的水解,因此可通过测定产生的氨量来表示脲酶的活性。土壤浸提液中的NH+4,在强碱性介质中与次氯酸盐和苯酚反应,生成水溶性染料靛酚蓝,其深浅与溶液中的NH+4-N含量成正比,在波长578 nm处测得样品的吸光度值,根据由NH+4-N标准溶液绘制的标准曲线,求出氨态氮量,脲酶活性以每克土的NH+4-N的微克数表示。
1.2.4土壤脱氢酶活性的测定
土壤脱氢酶活性的测定采用2,3,5,-三苯基四氮唑氯化物(2,3,5-Triphenyltetrazolium chloride,TTC)比色法[14],以土壤中H+的微升数表示。取5 g土壤样品于具塞三角瓶中,每个三角瓶加入2 mL 1%的TTC溶液和2 mL蒸馏水,充分混匀,置于37℃恒温箱中避光培养6 h。培养结束后,加入5 mL甲醇,剧烈振荡1 min,后静置5 min,再振荡20 s,然后静置5 min。将三角瓶中的物质全部过滤到比色管中,并用少量的甲醇洗涤三角瓶2~3次,洗涤液也全部过滤到比色管中,定容到25 mL,于485 nm下测定吸光度值。
1.2.5过氧化氢酶活性的测定
过氧化氢酶活性的测定采用高锰酸钾滴定法[14]。取2 g土样,置于250 mL三角瓶中,注入40 mL蒸馏水和5 mL 0.3%H2O2溶液。同时设置CK,即三角瓶中注入40 mL蒸馏水和5 mL H2O2溶液而不加入土样。将三角瓶于120 r·min-1振荡20 min后加入5 mL 1.5 mol·L-1硫酸,以稳定未分解的H2O2。再将瓶中悬浊液用中速滤纸过滤。吸取25 mL滤液,用0.02 mol·L-1KMnO4溶液滴定至粉红色终点。以单位土重消耗的0.02 mol·L-1KMnO4溶液毫升数(对照与实验测定的差)表示土壤过氧化氢酶活性。
1.2.6土壤微生物生物量碳、氮的测定
土壤微生物生物量碳的测定采用熏蒸提取-容量分析法,土壤微生物生物量氮的测定采用熏蒸提取-全氮测定法[14]。新鲜土壤经氯仿熏蒸24 h后,加入0.5 mol·L-1K2SO4溶液提取土样。用一定浓度的重铬酸钾(0.018 mol·L-1)-硫酸(12 mol·L-1)混合液氧化微生物生物量碳,剩余的重铬酸钾用硫酸亚铁(0.05 mol·L-1)滴定,根据消耗的重铬酸钾量计算微生物生物量碳含量。吸取过滤液10 mL于消煮管中,同时加入5 mL浓硫酸,2 g混合催化剂,充分混匀,于375℃消煮,消煮完毕用凯式定氮仪定氮,然后用硫酸标准溶液滴定溜出液,滴定终点为紫红色,根据硫酸标准溶液的用量计算土壤微生物生物量氮含量。
1.3数据分析
所有的处理设置三个重复,数据分析采用Excel 2010软件。显著性检验分析采用SPSS 17.0统计软件,利用单因素方差分析(ANOVA)不同处理之间的差异,P<0.05为显著性水平。
2 结果与分析
2.1DEHP对土壤脲酶活性的影响
DEHP对土壤脲酶活性的影响如图1所示。在培养期内,各实验组土壤中脲酶活性随时间均呈降低的趋势,且在第7~14 d下降尤为明显;脲酶对DEHP胁迫不敏感,且出现一定的滞后性。在第7 d,虽然各处理组脲酶活性略高于CK,但它们之间并无显著性差异。第14 d时各实验组的酶活性明显降低,处理组与CK相比开始表现出一定的刺激或抑制效应,具体表现为:0.1 mg·kg-1处理组的脲酶活性与CK相比降低了4.9%,1~50 mg·kg-1处理组的酶活性则分别升高了16.4%、50.0%和36.1%。第21 d和第28 d脲酶活性持续下降,但下降幅度不大;处理组脲酶活性受到抑制,且表现出一定的剂量-效应关系:DEHP浓度越高抑制作用越强。第28 d时,50 mg·kg-1的DEHP对脲酶活性的抑制率能达到40.4%。
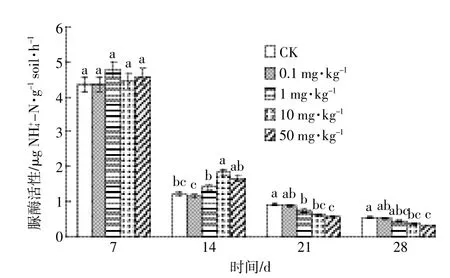
图1 DEHP对土壤脲酶活性的影响Figure 1 Effect of DEHP on soil urease activity
2.2DEHP对土壤过氧化氢酶活性的影响
由图2可以看出,不同浓度DEHP处理的土壤过氧化氢酶活性大体呈现先被抑制后被激活的状态。第7 d时,由于受到DEHP胁迫,各处理组土壤过氧化氢酶活性均被显著(P<0.05)抑制,且随浓度增高抑制作用减弱,0.1~50 mg·kg-1抑制率分别为25.0%、19.1%、14.3%和13.9%。到第14 d,0.1 mg·kg-1和1 mg·kg-1处理组过氧化氢酶活性基本不变,但是10 mg·kg-1和50 mg·kg-1两个处理组的过氧化氢酶活性与第7 d相比分别升高14.6%和13.2%,达到与CK基本一致的水平。第21~28 d,处理组的过氧化氢酶活性转为被激活的状态,且酶活性随DEHP浓度增大呈现先升高后降低的趋势,10 mg·kg-1处理组过氧化氢酶活性最高。染毒后期处理组与CK间的差异性较染毒前期减小。后期过氧化氢酶活性被激活的原因可能为DEHP被逐渐降解,毒性降低并可作为部分土壤微生物的能量被利用,从而使过氧化氢酶的活性相应增强。

图2 DEHP对土壤过氧化氢酶活性的影响Figure 2 Effect of DEHP on soil catalase activity
2.3DEHP对土壤脱氢酶活性的影响
DEHP对土壤脱氢酶活性的胁迫效应如图3所示,各实验组土壤脱氢酶活性随时间呈先升高后降低的趋势,其中50 mg·kg-1的DEHP对土壤脱氢酶始终表现为激活作用。第7 d,0.1~10 mg·kg-1处理组对脱氢酶活性均有显著(P<0.05)抑制作用,抑制率分别为86.3%、54.7%和31.7%,而50 mg·kg-1处理组脱氢酶活性比CK高了104.9%。第14 d,各实验组脱氢酶活性明显上升,1~10 mg·kg-1处理组脱氢酶活性转变为被激活状态,其酶活性已超过CK。第21 d,各实验组脱氢酶活性又普遍降低,且1~10 mg·kg-1处理组酶活性又重新被抑制。在实验后期,脱氢酶的活性趋于平稳,除最高浓度组外,其余各组土壤脱氢酶的活性与CK相比已无显著差异(P>0.05)。
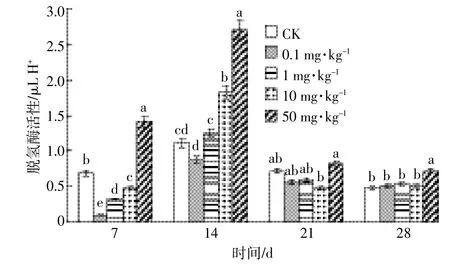
图3 DEHP对土壤脱氢酶活性的影响Figure 3 Effect of DEHP on soil dehydrogenase activity
2.4DEHP对土壤呼吸强度的影响
DEHP对土壤呼吸作用的影响如图4所示。染毒后第7 d,土壤呼吸强度随染毒浓度的增加呈先增强后减弱的趋势,以10 mg·kg-1为拐点,50 mg·kg-1的染毒浓度已产生部分毒性,抑制了部分微生物的呼吸作用,但部分微生物适应后呼吸作用增强,仍高于CK值;4个处理组的土壤呼吸强度均被显著(P<0.05)激活,0.1~50 mg·kg-1处理组呼吸强度分别为CK的1.73、1.89、2.78倍和2.00倍,其中10 mg·kg-1DEHP处理的土样呼吸作用最强。第14 d,各处理组CO2释放量显著降低,但除了10 mg·kg-1处理组外,其余处理组与CK相比差异性依然达到显著(P<0.05)水平。第21 d,4个浓度处理组CO2释放量趋于稳定。第28 d,各处理组土壤呼吸强度与CK基本一致。
2.5DEHP对土壤微生物生物量碳的影响
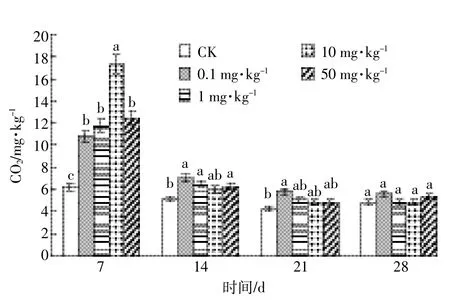
图4 DEHP对土壤呼吸的影响Figure 4 Effect of DEHP on soil respiration
DEHP对土壤微生物生物量碳的影响如图5所示。DEHP对生物量碳的影响规律是:生物量碳随时间呈降低趋势,随浓度升高大体呈先上升后下降的趋势。第7 d,0.1 mg·kg-1处理组生物量碳与CK基本持平,而1~50 mg·kg-1处理组生物量碳则被显著(P<0.05)激活,分别是CK的2.18、2.94倍和1.97倍。第14 d,0.1 mg·kg-1处理组的生物量碳低于CK,而浓度为1~50 mg·kg-1的土壤微生物生物量碳含量依然明显高于CK,达到显著差异(P<0.05)水平。第21 d和第28 d,处理组与CK之间的差距减小,土壤微生物生物量碳趋于稳定。
2.6DEHP对土壤微生物生物量氮的影响
DEHP对土壤微生物生物量氮的影响如图6所示。总体上,不同浓度的DEHP对土壤微生物生物量氮均有激活作用,且生物量氮随DEHP浓度升高呈先上升后下降的趋势。第7 d,4个处理组的土壤微生物生物量氮均升高且与CK相比达到显著差异(P<0.05)水平,当DEHP浓度低于1 mg·kg-1时,生物量氮随浓度升高呈上升趋势,当DEHP浓度高于1 mg· kg-1时,生物量氮呈下降趋势。第14 d,各处理组生物量氮明显下降,但与CK依然有显著差异(P<0.05),当DEHP浓度为10 mg·kg-1时,土壤微生物量氮最高。第21 d时,各组之间的差距减小,但0.1 mg·kg-1处理组生物量氮受到抑制。第28 d,DEHP处理过的土壤中生物量氮依然是被激活的状态,与CK相比分别激活了31.2%、50.0%、105.6%和66.7%。
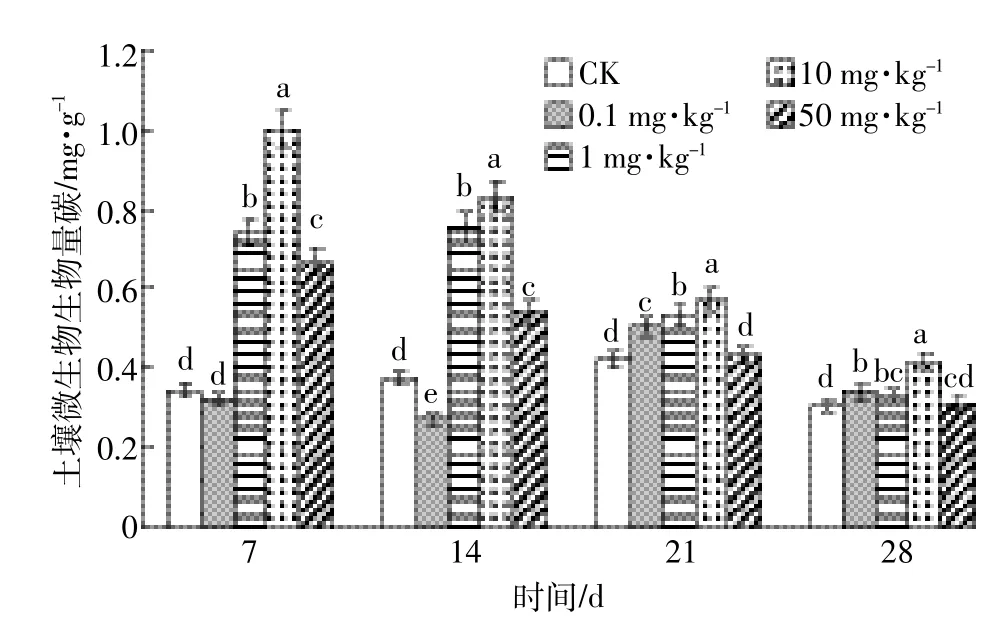
图5 DEHP对土壤微生物生物量碳的影响Figure 5 Effect of DEHP on soil microbial biomass carbon(MBC)
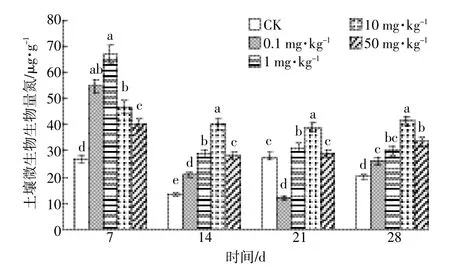
图6 DEHP对土壤微生物生物量氮的影响Figure 6 Effect of DEHP on soil microbial biomass nitrogen(MBN)
3 讨论
土壤酶是推动物质转化的生物催化剂,土壤酶的活性大致反映了某一种土壤生态状况下生物化学过程的相对强度。土壤脲酶活性与土壤中的微生物数量、有机质含量、全氮和速效氮含量呈正相关,人们常用土壤的脲酶活性表征土壤的氮素状况。在本实验的染毒浓度和时间内,DEHP对土壤脲酶活性的影响存在滞后性,王玉蓉等[15]的研究也指出土壤中的脲酶对DEHP污染不敏感。但王鑫宏[16]的研究发现DBP/ DEHP对脲酶均表现为抑制作用。庞国飞等[17]的研究也表明,高浓度的DEHP对土壤酶活性的影响较DBP有一定的滞后效应,且在同等污染浓度下DEHP对脲酶的影响较DBP不明显。出现滞后现象的原因可能为DEHP在降解过程中降解产物与脲酶作用,破坏了脲酶的结构,使脲酶活性受到抑制。Kurane等[18]的研究指出,酞酸酯类化合物的生物降解过程中将出现邻苯二甲酸、醇、酮、双酚化合物、有机酸、CO2和H2O等多种化合物,特别是双酚化合物的出现很可能对脲酶产生抑制作用,已有研究表明,邻苯二酚是脲酶强有力的抑制剂[19]。
土壤过氧化氢酶活性与土壤呼吸强度和土壤微生物活动有关,在一定程度上反映了土壤微生物学过程的强度。王玉蓉等[20]研究了DEHP对土壤过氧化氢酶和转移酶活性的影响,实验结果表明,DEHP处理浓度在100 mg·kg-1范围之内时,主要表现为激活作用,超过100 mg·kg-1时主要表现为抑制作用,这说明在一定浓度范围内DEHP可被微生物分解利用。但当土壤中DEHP浓度达到某一阈值并进一步提高后,DEHP对土壤微生物产生毒性作用,抑制了过氧化氢酶活性。
土壤脱氢酶反映土壤微生物新陈代谢的整体活性,可以作为微生物氧化还原能力的指标,在研究生物动力学中极受人们的重视。秦华等[21]利用盆栽实验研究了100 mg·kg-1浓度的DEHP对黄棕壤中脱氢酶活性的影响,其结果表明施加DEHP显著抑制了土壤脱氢酶的活性,30 d时与CK相比降低了约30%,60 d时尽管有缓慢的回升,但仍明显低于对照。这一实验结果与本研究结果不尽相同,分析原因可能是秦华等设置的DEHP浓度明显高于本研究,导致了DEHP在长时间内对脱氢酶活性的持续抑制。Aldén等[22]的研究表明,碳源是耕地和森林土壤中微生物生长的主要限制因素。一方面,DEHP被部分好氧微生物降解,从而为其提供了大量降解产物作为碳源,使微生物种群数量上升,相应的土壤酶活性也增强;另一方面DEHP对部分微生物产生毒性,导致部分微生物的活性降低,土壤酶活性的降低说明了这一点。
人们通常把测定土壤呼吸强度看作是衡量土壤微生物总的活性指标,或者作为评价土壤肥力的指标之一。王志刚等[23]研究了DMP对黑土土壤呼吸和酶学活性的影响,发现黑土微生物呼吸速率和微生物代谢熵受低浓度DMP促进、高浓度DMP抑制,且抑制效应随DMP污染浓度增加而增大。这与本研究不同浓度DEHP对土壤呼吸均是促进作用的研究结果不尽一致,可能与酞酸酯种类及土壤类型不同有关。高军等[24]的研究结果表明,添加PAEs初期土壤基础呼吸被激活,且激活作用随培养时间的延长而逐渐减弱,但并未出现抑制效应,这一现象与本研究结果相同。郭杨等[25]的研究也发现PAEs污染初期的土壤基础呼吸被激活,但这种激活作用随着培养时间的延长而减弱。其原因可能为50 mg·kg-1DEHP尚未超过土壤微生物的耐受范围,当低浓度DEHP进入土壤后,DEHP不但未对土壤微生物造成毒性作用,还为部分微生物提供了养料,使微生物数量增加,土壤呼吸作用增强。到了染毒处理的中后期,大部分DEHP被降解,微生物的生存环境开始稳定,土壤呼吸强度趋于稳定。
土壤微生物生物量是土壤养分的储存库和植物生长可利用养分的重要来源,它能反映微生物在土壤中的实际含量和作用潜力。南开大学的陈强等[26]研究了DEHP与土壤微生物之间的作用,结果表明,DEHP对微生物产生影响的最低可见响应浓度(LOEC)为10 mg·kg-1,在浓度<10 mg·kg-1时,DEHP可促进细菌的生长。同时,他们还指出高浓度的DEHP对微生物具有抑制作用,但不同生物对DEHP的灵敏度不同。吴雪峰[27]的研究也发现,DEHP浓度为10、20 mg·kg-1的处理对土壤微生物生物量碳、氮影响不大,50、100、200、400 mg·kg-1处理对土壤微生物生物量碳、氮表现出一定的抑制效应,各处理组的生物量碳、氮与CK相比,差异显著。以上的研究结果与本研究结果有诸多相似之处,实验说明土壤微生物可以将低浓度的DEHP作为碳源或氮源利用,当DEHP浓度升高到一定值,土壤微生物生物量碳、氮下降,DEHP的毒性作用开始显现。
4 结论
(1)DEHP胁迫下,3种土壤酶的活性均有变化。脱氢酶和过氧化氢酶活性随DEHP浓度增加呈先降低后升高的趋势,但脲酶的活性变化对DEHP污染不敏感。过氧化氢酶和脲酶活性随时间呈降低趋势且脲酶活性下降趋势更明显,但脱氢酶活性随时间呈先升高后降低的趋势。
(2)在DEHP污染的影响下,土壤呼吸强度和土壤微生物生物量的变化趋势以激活效应为主,且土壤呼吸和土壤微生物生物量的响应与DEHP处理浓度之间呈现一定的剂量-效应关系,即随DEHP浓度增加呈先升高后降低的趋势。
[1]李钟宝,蔡晨露,刘秀梅.邻苯二甲酸酯类增塑剂合成与应用研究进展[J].塑料助剂,2010,82(4):8-15. LI Zhong-bao,CAI Chen-lu,LIU Xiu-mei.Research progress in synthesis and application of phthalate plasticizers[J].Plastics Additives,2010,82(4):8-15.
[2]Nakai M,Tabira Y,Asai D,et al.Binding characteristics of dialkyl phthalates for the estrogen receptor[J].Biochemical and Biophysical Research Communications,1999,254(2):311-314.
[3]Chen J A,Liu H J,Qiu Z Q,et al.Analysis of di-n-butyl phthalate and other organic pollutants in Chongqing women undergoing parturition[J]. Environmental Pollution,2008,156(3):849-853.
[4]Kong S F,Ji Y P,Liu L L.Diversities of phthalate esters in suburban agricultural soils and wasteland soil appeared with urbanization in China[J].Environmental Pollution,2012,170:161-168.
[5]Liu H,Liang H C,Liang Y,et al.Distribution of phthalate esters in alluvial sediment:A case study at Jianghan Plain,Central China[J].Chemosphere,2010,78(4):382-388.
[6]Xu G,Li F S,Wang Q H.Occurrence and degradation characteristics of dibutyl phthalate(DBP)and di-(2-ethylhexyl)phthalate(DEHP)in typical agricultural soils of China[J].Science of the Total Environment,2008,393(2/3):333-340.
[7]郭冬梅,吴瑛.南疆棉田土壤中邻苯二甲酸酯(PAEs)的测定[J].干旱环境监测,2011,25(2):76-79. GUO Dong-mei,WU Ying.Detemination of phthalic acid esters of soil in South of Xinjiang cotton fields[J].Arid Environmental Monitoring,2011,25(2):76-79.
[8]张海光,孙国帅,孙磊,等.典型覆膜作物土壤中邻苯二甲酸酯污染的初步研究[J].中国环境监测,2013,29(4):60-63. ZHANG Hai-guang,SUN Guo-shuai,SUN Lei,et al.Preliminary study on phthalic acid esters pollution of typical plastic mulched crops soils[J].Environmental Monitoringin China,2013,29(4):60-63.
[9]郭鹏鹏,朱鲁生,王军,等.低浓度硫丹对棕壤中主要酶活性及细菌群落结构的影响[J].农业环境科学学报,2014,33(11):2149-2154. GUO Peng-peng,ZHU Lu-sheng,WANG Jun,et al.Effects of low concentration endosulfan on some enzymatic activities and bacterial community structure in brunisolic soil[J].Journal of Agro-Environment Science,2014,33(11):2149-2154.
[10]Haynes R J,Tregurtha R.Effects of increasing periods under intensive arable vegetable production on biological and physical indices of soil quality[J].Biology and Fertility of Soils,1999,28(3):259-266.
[11]刘庆,杨红军,史衍玺,等.环境中邻苯二甲酸酯类(PAEs)污染物研究进展[J].中国生态农业学报,2012,20(8):968-975. LIU Qing,YANG Hong-jun,SHI Yan-xi,et al.Research progress on phthalate esters(PAEs)organic pollutants in the environment[J].Chinese Journal of Eco-Agriculture,2012,20(8):968-975.
[12]骆祝华,黄翔玲,叶德赞.环境内分泌干扰物——邻苯二甲酸酯的生物降解研究进展[J].应用与环境生物学报,2008,14(6):890-897. LUO Zhu-hua,HUANG Xiang-ling,YE De-zan.Advances in research of biodegradation of environmental endocrine disruptors-phthalate esters[J].Chinese Journal of Applied and Environmental Biology,2008,14(6):890-897.
[13]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000. LU Ru-kun.Soil agricultural chemical analysis method[M].Beijing:China Agriculture Science and Technique Press,2000.
[14]李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008:322-404. LI Zhen-gao,LUO Yong-ming,TENG Ying.Methods of soil and environmental microorganism[M].Beijing:Science Press,2008:322-404.
[15]王玉蓉,崔东,刘静,等.增塑剂DEHP对土壤脲酶活性的影响[J].农业科技与装备,2012(6):7-8. WANG Yu-rong,CUI Dong,LIU Jing,et al.Effects of plasticizer DEHP on soil urease activity[J].Agricultural Science&Technology and Equipment,2012(6):7-8.
[16]王鑫宏.DBP/DEHP单一及与Pb复合污染对土壤微生物量碳及土壤酶的影响研究[D].长春:东北师范大学,2010. WANG Xin-hong.Effects of DBP/DEHP on soil microbial biomass carbon and enzyme in single and complex pollution with Pb[D]. Changchun:Northeast Normal University,2010.
[17]庞国飞,高习海,高军.酞酸酯污染对土壤脲酶与磷酸酶的动态影响[J].安徽农业科学,2009,37(36):18075-18077,18107. PANG Guo-fei,GAO Xi-hai,GAO Jun.Dynamic effects of PAEs on soil urease and phosphatase[J].Journal of Anhui Agricultural Sciences,2009,37(36):18075-18077,18107.
[18]Kurane R,Suzuki T,Takahara Y.Induction of enzymes involved in phthalate esters metabolism in Nocardia erythropolis and enzymatic hydrolysis of phthalate esters by commericial lipases[J].Agricultural and Biological Chemistry,1980,44(3):529-536.
[19]关松荫.土壤酶及其研究方法[M].北京:农业出版社,1986:274-340. GUAN Song-yin.Soil enzyme and its research methods[M].Beijing:A-griculture Press,1986:274-340.
[20]王玉蓉,张广才,张昀,等.增塑剂邻苯二甲酸二异辛酯对土壤两种酶活性的影响[J].土壤通报,2012,43(6):1405-1408. WANG Yu-rong,ZHANG Guang-cai,ZHANG Yun,et al.Effects of phthalate plasticizer diisooctyl on two kinds of soil enzyme activity[J]. Chinese Journal of Soil Science,2012,43(6):1405-1408.
[21]秦华,林先贵,陈瑞蕊,等.DEHP对土壤脱氢酶活性及微生物功能多样性的影响[J].土壤学报,2005,42(5):829-834. QIN Hua,LIN Xian-gui,CHEN Rui-rui,et al.Effects of DEHP on soil dehydrogenase activity and microbial functional diversity[J].ActaPedologicaSinica,2005,42(5):829-834.
[22]Aldén L,Demoling F,Bååth E.Rapid method of determining factors limiting bacterial growth in soil[J].Applied and Environmental Microbiology,2001,67(4):1830-1838.
[23]王志刚,胡影,徐伟慧,等.邻苯二甲酸二甲酯污染对黑土土壤呼吸和土壤酶活性的影响[J].农业环境科学学报,2015,34(7):1311-1316. WANG Zhi-gang,HU Ying,XU Wei-hui,et al.Impacts of dimethyl phthalate contamination on respiratory rates and enzyme activities in black soil[J].Journal of Agro-Environment Science,2015,34(7):1311-1316.
[24]高军,陈伯清.酞酸酯污染土壤微生物效应与过氧化氢酶活性的变化特征[J].水土保持学报,2008,22(6):166-169. GAO Jun,CHEN Bo-qing.Effects of PAEs on soil microbial activity and catalase activity[J].Journal of Soil and Water Conservation,2008,22(6):166-169.
[25]郭杨,韩蕊,杜文婷,等.邻苯二甲酸酯复合污染对土壤微生态的影响[J].环境科学研究,2010,23(11):1410-1414. GUO Yang,HAN Rui,DU Wen-ting,et al.Effects of combined phthalate acid ester contamination on soil micro-ecology[J].Research of Environmental Sciences,2010,23(11):1410-1414.
[26]陈强,孙红文,王兵,等.邻苯二甲酸二异辛酯(DEHP)对土壤微生物和动物的影响[J].农业环境科学学报,2004,23(6):1156-1159. CHEN Qiang,SUN Hong-wen,WANG Bing,et al.Effects of di(2-ethylhexyl)phthalate(DEHP)on microorganisms and animals in soil[J].Journal of Agro-Environment Science,2004,23(6):1156-1159.
[27]吴雪峰.DEHP污染对土壤微生物毒理效应研究[D].哈尔滨:东北农业大学,2014. WU Xue-feng.Study on toxicological effect of DEHP on soil microbe[D].Harbin:Northeast Agricultural University,2014.
Ecological effects of di(2-ethylhexyl)phthalate on soil microorganisms
XIA Qing-bing,WANG Jun*,ZHU Lu-sheng*,WANG Jin-hua,LIU Wen-jun
(College of Resource and Environment,Shandong Agricultural University,Key Laboratory of Agricultural Environment in Universities of Shandong,Tai′an 271018,China)
Pollution by phthalic acid esters(PAEs)is becoming more and more serious in the soil environment.Here,a laboratory experiment was performed to evaluate the ecological toxicological effects of di(2-ethylhexyl)phthalate(DEHP),a typical phthalate,on some soil enzymes(urease,catalase,and dehydrogenase),respiration,and microbial biomass in soil under different DEHP rates(0,0.1,1,10 mg and 50 mg DEHP per kg soil)on the 7th,14th,21st,and 28th day after treatments with DEHP.Results showed that soil catalase activity was significantly inhibited and decreased by 25.0%~14.3%compared with the control on the 7th day.Soil dehydrogenase activity decreased by 86.3%~31.7%at 0.1~10 mg·kg-1treatments but increased by 105%at 50 mg·kg-1.However,DEHP suppressed soil urease activity more during later period than during early period.Furthermore,soil urease activity significantly decreased over time,which may relate to nitrogen contents in soil.With DEHP increasing,soil respiration and soil microbial biomass carbon and biomass nitrogen increased,but decreased at higher rates.Compared with the control,however,they were all stimulated,whereas these parameters decreased over time.In conclusion,DEHP has significant ecological effects on soil microbes.
di(2-ethylhexyl)phthalate(DEHP);soil respiration;soil enzyme;microbial biomass;ecological effect
S154.3
A
1672-2043(2016)07-1344-07
10.11654/jaes.2016.07.017
2015-12-24
国家自然科学基金项目(41001152,21377075,21277083);中国博士后基金项目(2013M541947);山东省博士后创新项目(201303054);山东省高等学校科技计划项目(J12LC01)
夏庆兵(1990—),男,硕士研究生,主要从事土壤微生物生态学方面的研究。E-mail:qingbingxia@sina.com
王军E-mail:jwang@sdau.edu.cn;朱鲁生E-mail:lushzhu@sdau.edu.cn

