miR-21对人喉鳞癌Hep2细胞增殖与凋亡的影响
曲 莉
(南阳市中心医院耳鼻喉二病区,河南南阳 473000)
miR-21对人喉鳞癌Hep2细胞增殖与凋亡的影响
曲莉
(南阳市中心医院耳鼻喉二病区,河南南阳 473000)
目的探讨miR-21对人喉鳞癌Hep2细胞增殖与凋亡的影响。方法脂质体LipofectamineTM2000将miR-21 inhibitor和miR-21阴性对照(NC)转入Hela细胞,四甲基偶氮唑蓝(MTT)法检测细胞活力,克隆实验及Hoechst染色分别检测细胞增殖与凋亡情况,Western blot检测人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)、程序化死亡蛋白4基因(PDCD4)、Bax、Bcl-2表达及蛋白激酶B(AKT)磷酸化水平。结果与miR-21 NC比较,miR-21 inhibitor能显著抑制细胞活力[(0.728±0.045)vs.(0.393±0.018),P<0.01],降低细胞克隆数目[(158.38±14.47)vs.(65.52±6.86),P<0.01],提高细胞凋亡率[(8.45±0.67)%vs.(40.23±3.46)%,P<0.01],并上调PTEN、PDCD4、Bax表达,下调Bcl-2表达及降低AKT磷酸化水平(P<0.01)。结论miR-21 inhibitor通过PTEN/AKT信号通路抑制人喉鳞癌Hep2细胞增殖和诱导凋亡,并调节细胞凋亡相关蛋白的表达。
miR-21;人喉鳞癌Hep2细胞;细胞增殖;细胞凋亡
喉鳞癌是我国耳鼻咽喉科常见的恶性肿瘤,占耳鼻咽喉科肿瘤的36%左右,其中喉鳞状细胞癌是其主要病理类型,占90%以上,手术治疗、化学疗法和放射治疗是其主要治疗方式,但对中晚期患者预后及5年生存率效果欠佳[1]。而喉鳞癌发病机制尚未清楚,吸烟、饮酒、病毒感染、环境污染、癌基因的激活及抑癌基因的失活都可能是其病因。miRNA是目前新发现的一类癌基因或抑癌基因,并与肿瘤的发生、发展密切相关,在肿瘤的增殖、凋亡、侵袭等生物学行为中起重要作用[2]。已通过miRNA芯片技术证实48对喉鳞状细胞癌标本中4个miRNA表达量显著上调,包括miR-21[3]。也发现喉鳞状细胞癌患者血清中miR-21表达量显著增高,并与淋巴结转移密切相关,并能作为喉鳞状细胞癌标记物及预后的独立因子[4]。提示miR-21在喉鳞癌中过表达,并作为癌基因参与喉鳞癌的发生、发展。本研究拟通过下调人喉鳞癌细胞中Hep2中miR-21的表达,探讨其对Hep2细胞增殖及凋亡的影响,从而为喉鳞癌的诊断及预后判断提供新的思路。
1 材料与方法
1.1材料
1.1.1细胞株人喉鳞癌细胞Hep2购于中国科学院细胞库,目录号:TCHu21。
1.1.2主要试剂和仪器兔抗Bax,Bcl-2单克隆抗体(Epitmics公司,美国);兔抗PDCD4、PTEN、AKT、p-AKT单克隆抗体(Cell Signaling Technology公司,美国);miR-21 inhibitor及对照miR-21 NC(上海吉玛制药技术有限公司);Hoechst 33258染色试剂盒(碧云天生物技术有限公司);四甲基偶氮唑蓝(MTT)法(Gibco公司,美国);胎牛血清、DMEM培养基(Hyclone公司,美国)。迷你双垂直电泳仪、迷你转印电泳仪(北京六一仪器厂);ChemiDocTMXRS凝胶成像系统(Bio-Rad公司,美国)。
1.2方法
1.2.1MTT法检测Hela细胞活力将人喉鳞癌细胞Hep2接种于96孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染miR-21 inhibitor和miR-21阴性对照(negative control,NC)。48 h后,加入5 mg/mL MTT 20 μL,继续培养4 h后吸弃培养液,每孔加入二甲基亚砜(DMSO) 150 μL,震荡使结晶物充分溶解,于酶标仪560 nm处测OD值,以OD值表示细胞相对活力。
1.2.2集落形成实验将人喉鳞癌细胞Hep2接种于96孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染miR-21 inhibitor和miR-21 NC,48 h后,用含10%甲醛和0.1%结晶紫染液固定染色。轻轻甩去染色液,拍照分析。
1.2.3Hoechst染色将人喉鳞癌细胞Hep2接种于6孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染miR-21 inhibitor和miR-21 NC。48 h后消化收集细胞,后按照Hoechst 33258染色试剂盒说明书进行操作,4%多聚甲醛固定,Hoechst 33258染色液避光染色,在荧光显微镜下观察并拍照。
1.2.4Western blot将人喉鳞癌细胞Hep2接种于6孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染miR-21 inhibitor和miR-21 NC。48 h后消化收集细胞,加入RIPA裂解液裂解,离心即可获得总蛋白。根据BCA试剂盒对蛋白浓度进行测定。蛋白上样,跑SDS凝胶电泳,后湿法转膜。一抗溶液孵育,4 ℃过夜;二抗溶液中室温孵育。在凝胶成像系统中曝光。用“Quantity one”软件对各抗体条带灰度值进行统计。

2 结 果
2.1miR-21 inhibitor对人喉鳞癌细胞Hep2活力的影响人喉鳞癌细胞Hep2细胞转染miR-21 inhibitor和miR-21 NC 48 h后,经MTT实验发现miR-21 inhibitor能显著抑制细胞活力[(0.728±0.045)vs.(0.393±0.018)],差异有统计学意义(P<0.01)。
2.2miR-21 inhibitor对人喉鳞癌细胞Hep2克隆形成及凋亡的影响miR-21 inhibitor能显著减少Hep2细胞克隆数目[(158.38±14.47)vs.(65.52±6.86)],差异有统计学意义(P<0.01),见图1。miR-21 inhibitor亦能显著提高Hep2细胞凋亡率[(8.45±0.67)%vs.(40.23±3.46)%],差异有统计学意义(P<0.01),见图2。
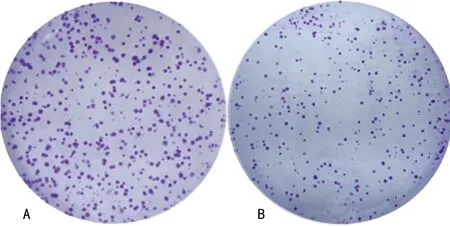
A:miR-21 NC;B:miR-21 inhibitor。
图1miR-21 inhibitor对人喉鳞癌细胞Hep2克隆形成能力的影响
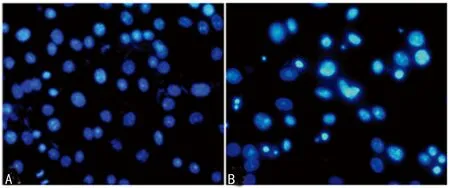
A:miR-21 NC;B:miR-21 inhibitor。
图2miR-21 inhibitor对人喉鳞癌细胞Hep2凋亡的影响
2.3miR-21 inhibitor对人喉鳞癌细胞Hep2中PDCD4、Bax及Bcl-2表达量的影响miR-21 inhibitor能显著上调PDCD4及Bax表达(P<0.01),下调Bcl-2表达(P<0.01),见图3、表1。
2.4miR-21 inhibitor对人喉鳞癌细胞Hep2中PTEN/AKT信号通路的影响miR-21 inhibitor能显著上调PTEN表达(P<0.01),降低AKT磷酸化水平(P<0.01),见图4、表2。
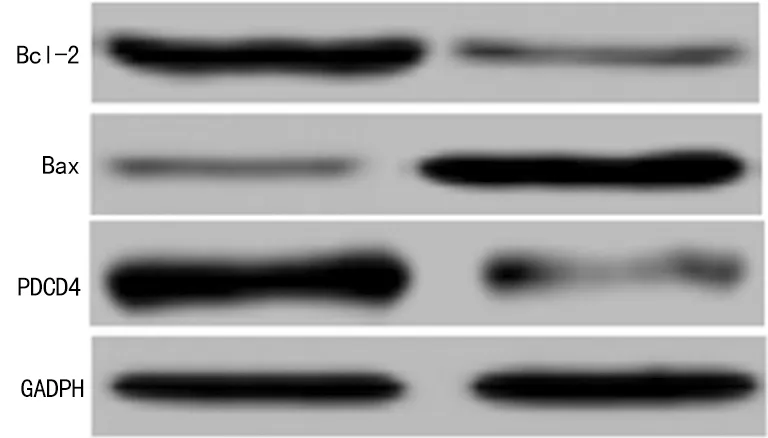
图3 miR-21 inhibitor对人喉鳞癌细胞Hep2中PDCD4、Bax及Bcl-2表达量的影响
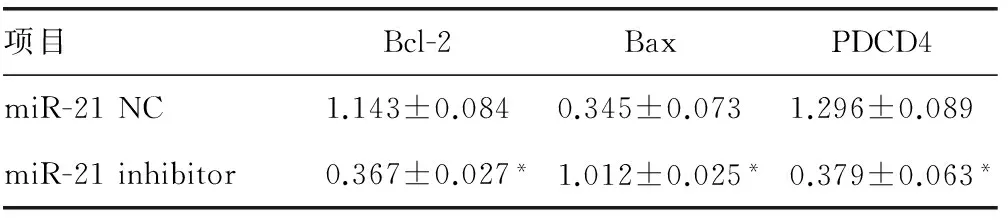
项目Bcl-2BaxPDCD4miR-21NC1.143±0.0840.345±0.0731.296±0.089miR-21inhibitor0.367±0.027*1.012±0.025*0.379±0.063*
*:P<0.01,与miR-21 NC比较。
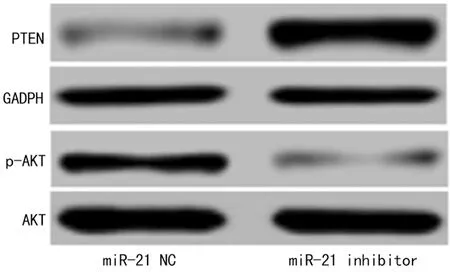
图4 miR-21 inhibitor对人喉鳞癌细胞Hep2中PTEN/AKT信号通路的影响

项目PTENp-AKT/AKTmiR-21NC0.354±0.0260.612±0.062miR-21inhibitor1.043±0.079*0.342±0.035*
*:P<0.01,与miR-21 NC比较。
3 讨 论
miR-21是2001年Lagos-Quintana等在非脊椎动物和脊椎动物中首次发现的,随后在小鼠的神经元细胞及Hela细胞中陆续检测到,已证实miR-21与喉癌、大肠癌、卵巢癌、肺癌等多种肿瘤的发生、发展密切相关,其表达呈上调趋势[2,5]。Cao等[3]通过miRNA芯片分析也证实48例喉鳞状细胞癌标本中4个miRNA表达量显著上调,包括miR-21。Wang等[4]检测52例喉鳞状细胞癌患者及52例声带息肉患者血清中miR-21的表达,发现喉鳞状细胞癌患者血清中miR-21表达量显著增高,可作为喉鳞状细胞癌标记物及预后的独立因子。提示miR-21在喉鳞癌细胞中起致癌miRNA作用,并与喉鳞癌的发生、发展密切相关。此外,miR-21反寡义核苷酸既能在体外显著抑制宫颈癌SiHa细胞增殖,诱导细胞凋亡,并能在体内抑制SiHa细胞裸鼠移植瘤生长,促进其凋亡[6-7]。miR-21 inhibitor亦对胰腺癌、乳腺癌、前列腺癌、舌鳞状细胞癌细胞具有增殖抑制及凋亡诱导作用[8-10]。说明下调miR-21表达能显著地影响多种肿瘤细胞的增殖与凋亡,同时已报道PTEN、PDCD4、Bcl-2等多个蛋白是miR-21在不同肿瘤细胞中的靶基因,通过靶向调节靶基因表达,影响肿瘤细胞的增殖凋亡等行为[11]。所以本研究在此基础上,探讨miR-21是否通过调节相关靶蛋白的表达,从而影响喉鳞癌细胞Hep2的增殖与凋亡。
细胞的凋亡受细胞凋亡基因严格调控,其中研究最为广泛的是Bcl-2家族,Bcl-2可显著促进癌细胞的生长增殖并阻滞癌细胞凋亡,在喉鳞癌组织呈高表达[12]。Bax是Bcl-2家族成员,与Bcl-2形成二聚体,维持细胞增殖凋亡平衡,Bax在喉鳞癌组织中低表达,并参与喉癌细胞凋亡的调控[13]。PDCD4是新近发现的抑癌基因,可通过诱导肿瘤细胞凋亡或阻滞细胞周期,从而抑制肿瘤细胞的生长,其在人乳腺癌、肺癌、肠癌、喉癌等肿瘤中低表达,甚至缺失,与肿瘤的发生、发展密切相关[14-16]。因此上调Bax及PDCD4表达,下调Bcl-2表达,能有效地促进喉癌细胞凋亡,从而抑制癌细胞增殖。本研究结果表明,miR-21 inhibitor能显著抑制Hep2细胞克隆,诱导细胞凋亡,下调Bcl-2的表达,上调Bax及PDCD4的表达。
肿瘤的增殖与凋亡受众多信号通路调控,PI3K/AKT信号通路就是其中一种,其具有抗凋亡通路之称,能与多种人类肿瘤的发生、发展密切相关,能通过下游多种靶蛋白表达,如Bcl-2、PDCD4等,参与调控肿瘤细胞生长、凋亡、血管生成及侵袭等过程。PI3K/AKT上游蛋白PTEN是miR-21的下游靶基因,在众多肿瘤中表达低下,缺失或突变。PTEN能将三磷酸磷脂酰肌醇(PIP3)去磷酸化为二磷酸脂酰肌醇(PIP2),从而负调控PI3K/AKT信号通路,在细胞凋亡中起重要作用。已报道PI3K/AKT在喉鳞癌中异常激活[17]。下调miR-21的表达可通过PTEN/AKT信号通路抑制白血病K562细胞增殖及迁移[18]。推测miR-21也能通过PTEN/PI3K/AKT信号通路影响喉癌细胞增殖凋亡等生物学行为。因此,本研究通过Western blot检测miR-21转染后,细胞中此信号通路蛋白的表达情况,结果表明,miR-21 inhibitor能显著上调PTEN表达,降低AKT磷酸化水平,从而提示miR-21表达量下调后能通过PTEN/AKT信号通路抑制喉鳞癌细胞Hep2增殖并诱导细胞凋亡。
综上所述,miR-21 inhibitor能显著的诱导喉鳞癌细胞Hep2凋亡,并抑制其克隆形成,与下调Bcl-2表达、上调Bax及PDCD4表达有关,可能是通过PTEN/AKT信号通路实现。
[1]Zhang W,Liu Y,Wang CW.S100A4 promotes squamous cell laryngeal cancer Hep-2 cell invasion via NF-kB/MMP-9 signal[J].Eur Rev Med Pharmacol Sci,2014,18(9):1361-1367.
[2]张经波,汪荣泉.mir-21的转录调控及在肿瘤中的作用研究进展[J].重庆医学,2012,41(31):3336-3337,3346.
[3]Cao PY,Zhou L,Zhang J,et al.Comprehensive expression profiling of microRNAs in laryngeal squamous cell carcinoma[J].Head and Neck-Journal for the Sciences and Specialties of the Head and Neck,2013,35(5):720-728.
[4]Wang JT,Zhou YD,Lu J,et al.Combined detection of serum exosomal miR-21 and HOTAIR as diagnostic and prognostic biomarkers for laryngeal squamous cell carcinoma[J].Medical Oncology,2014,31(9):148.
[5]Ludvikova M,Kalfert D,Pesta M,et al.MicroRNA profile in site-specific head and neck squamous cell cancer[J].Virchows Archiv,2014,465(1):321.
[6]Huang Y,He Y,Li J.MicroRNA-21:a central regulator of fibrotic diseases via various targets[J].Curr Pharm Des,2015,21(17):2236-2242.
[7]王晓玫,许静,成志强,等.微小RNA-21反义寡核苷酸对宫颈鳞癌SiHa细胞株细胞生物学特性影响的体内外实验研究[J].中华病理学杂志,2012,41(4):254-259.
[8]Zhu W,Xu B.MicroRNA-21 identified as predictor of cancer outcome:a meta-analysis[J].PLoS One,2014,9(8):e103373.
[9]Wang Y,Zhu Y,Lv P,et al.Targeting miR-21 with AS-miR-21 suppresses aggressive growth of human tongue squamous cell carcinoma in vivo[J].Int J Clin Exp Pathol,2015,8(5):4773-4781.
[10]齐志勇,贾永峰,张治平,等.S100A4、Bcl-2、Survivin在喉癌组织中的表达及临床意义[J].现代中西医结合杂志,2014,23(9):929-932,969.
[11]蔡雯,崔颖,张婷婷,等.Survivin、Bax蛋白在喉病变组织中的表达及临床意义[J].重庆医学,2011,40(20):1988-1990,1994.
[12]Lankat-Buttgereit B,Göke R.The tumour suppressor Pdcd4:recent advances in the elucidation of function and regulation[J].Biol Cell,2009,101(6):309-317.
[13]冯国飞,李培华,尤慧华,等.喉癌组织中程序性细胞死亡因子4的表达及临床意义[J].临床耳鼻咽喉头颈外科杂志,2011,25(1):16-19.
[14]Yao Q,Xu H,Zhang QQ,et al.MicroRNA-21 promotes cell proliferation and down-regulates the expression of programmed cell death 4 (PDCD4) in HeLa cervical carcinoma cells[J].Biochem Biophys Res Commun,2009,388(3):539-542.
[15]Asangani IA,Rasheed SA,Nikolova DA,et al.MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer[J].Oncogene,2008,27(15):2128-2136.
[16]Chen Y,Liu W,Chao T,et al.MicroRNA-21 down-regulates the expression of tumor suppressor PDCD4 in human glioblastoma cell T98G[J].Cancer Lett,2008,272(2):197-205.
[17]杨大志,姬长友.PI3K、p-Akt蛋白在喉鳞癌中的表达及临床意义[J].第三军医大学学报,2007,29(10):935-937.
[18]吴共发,黄绮亭,曾宇婷,等.miR-21通过PTEN/AKT通路抑制白血病细胞K562的迁移和增殖[J].医学研究生学报,2013,26(10):1037-1040.
·经验交流·10.3969/j.issn.1671-8348.2016.24.034
曲莉(1980-),硕士,主治医生,主要从事耳鼻喉疾病的研究。
R739.65
B
1671-8348(2016)24-3411-03
2016-03-04
2016-05-24)

