金花茶茶花HPLC指纹图谱的研究
杨立芳,刘洪存,罗 佳,邓 娴,姜明国,耿丽媛(.广西民族大学,化学化工学院,广西高校微生物与植物资源利用重点实验室,广西高校食品安全与药物分析化学重点实验室,广西南宁530006;.广西民族大学,海洋与生物技术学院,广西六堡茶加工工程技术研究中心,广西南宁530006)
金花茶茶花HPLC指纹图谱的研究
杨立芳1,刘洪存1,罗 佳1,邓 娴1,姜明国2,*,耿丽媛2
(1.广西民族大学,化学化工学院,广西高校微生物与植物资源利用重点实验室,广西高校食品安全与药物分析化学重点实验室,广西南宁530006;2.广西民族大学,海洋与生物技术学院,广西六堡茶加工工程技术研究中心,广西南宁530006)
目的:以10批次的金花茶茶花为研究对象,建立金花茶茶花高效液相指纹图谱。方法:微波法提取金花茶茶花中的有效成分,采用高效液相色谱法建立金花茶茶花的指纹图谱。结果:建立了金花茶茶花HPLC特征指纹图谱共有模式,标定了34个共有峰,10批次金花茶茶花指纹图谱经国家药典委员会规定的相似度计算软件(2004A)计算,共有峰保留时间的相对偏差较小,相似度良好。结论:建立金花茶茶花高液相指纹图谱,建立共有模式,可作为科学评价金花茶茶花质量的检测方法。
金花茶茶花,高效液相色谱,黄酮类,指纹图谱
金花茶(Camellia chrysantha(Hu)Tuyam)为山茶科、山茶属、金花茶组、金花茶系植物[1],主要分布在广西防城港境内热带雨林沟谷地带[2-3],是一种珍贵的药用植物,2010年被批准为新资源食品[4]。金花茶富含多种对人体有益的营养成分,是自然界中营养价值极高的植物之一,在当地被用作传统民间中草药[5],对于治疗咽喉炎、痢疾、高血压、月经不调等疾病有较好的效果[6]。近来研究证明,金花茶主要含有黄酮类[7]、多酚类[5]、三萜类[8]、多糖类及皂甙类化合物,具有抗肿瘤[9]、抗氧化[10]的作用。目前,对金花茶的研究主要包括对基因、遗传的研究,多糖的理化性质研究,多酚、黄酮等物质理化性质的研究,而且主要是对金花茶茶叶的研究,而对金花茶茶花的研究相对较少。金花茶茶花虽然具有很好的生物活性,但由于资源稀缺,价格昂贵等原因,以次充好,以假乱真的现象时有发生。
指纹图谱技术已经广泛应用到茶叶品种鉴别和质量控制等方面,普洱晒青毛茶、苦丁茶、云南普洱茶、广东单枞茶等均有指纹图谱的相关研究。指纹图谱技术是分析天然产物和产品的有效手段[11],是指经过光谱或色谱测定得到的组分群体的特征图谱或图像,可以经济、可靠、便捷的表征产品特性[12],反应产品的全貌,实现对内在质量的综合评价和整体物质的全面控制[13]。
本文拟对金花茶茶花进行HPLC指纹图谱的研究,为科学评价和有效控制金花茶的质量提供科学依据,具有一定的现实意义。
1 材料与方法
1.1 材料与仪器
10批金花茶样品(S1~S10) 分别购买来自不同批次的金花茶茶花样品;样品 经广西梧州茶厂郭维深高级工程师鉴定为金花茶;冰醋酸 分析纯,AR,西陇化工股份有限公司;甲醇 色谱纯,国药集团化学试剂有限公司;乙腈 色谱纯,赛默飞世尔科技(中国)有限公司;其余试剂 均为分析纯;水 超纯水;芦丁(含量91.7%,CAS号:153-18-4)对照品 购自中国药品生物制品检定所。
LC-15C高效液相色谱仪、Uvmini-1240紫外可见分光光度仪 日本岛津;XH-100A微波催化合成/萃取仪 北京祥鹄科技发展有限公司。
1.2 实验方法
1.2.1 供试品溶液的制备 取粉碎后(过60目筛)的金花茶茶花样品4.0 g,置于圆底烧瓶中,依次用30 mL,20 mL超纯水进行微波提取,微波功率为400 W,提取温度为100℃,提取时间为30 min[14],合并上清液,定容到50 mL,摇匀,得到金花茶茶花水提取物,作为供试品溶液。
1.2.2 对照品溶液的制备 精确称量5.0 mg芦丁标准品,加1 mL甲醇混合制成5.0 mg/mL的芦丁对照品溶液,标记为样品S,实验备用。
1.2.3 色谱条件 取1.2.1中供试品溶液20 μL用高效液相色谱仪进行检测,色谱柱:Agilent ZORBAX SB-C18(5 μm,4.6 mm×250 mm),流动相:乙腈(A)-0.5%冰醋酸水溶液(B);流速:1.0 mL/min;检测波长:270 nm;柱温:35℃。
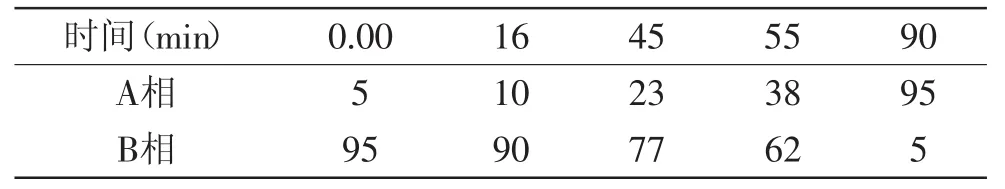
表1 金花茶茶花HPLC梯度洗脱程序Table1 Gradient elution mode for flower of Camellia chrysantha(Hu)Tuyam
1.3 数据处理
应用《中药色谱指纹图谱相似度评价系统》(2004A)分析和绘制金花茶花茶的HPLC指纹图谱。
2 结果与分析
2.1 方法学考察
2.1.1 精密度实验 精密称取1号金花茶茶花样品(S1)4.0 g,按照1.2.1中的方法制备供试品,用1.2.3中的方法进行检测,重复进样5次,考察仪器的精密度。结果表明,各主要色谱峰的相对保留时间的RSD在0.02%~2.26%范围内,相对峰面积RSD值在2.26%~9.12%之间,表明仪器的精密度良好。
2.1.2 稳定性实验 精密称取S1号金花茶茶花样品4.0 g,按照1.2.1中的方法制备供试品,分别在0、2、4、6、12 h进样,用1.2.3中的方法进行检测,考察样品的稳定性。通过计算各主要色谱峰的相对保留时间的RSD在0.09%~1.04%范围内,相对峰面积RSD值在1.70%~8.38%之间,供试品在24 h内稳定性良好。
2.1.3 重复性实验 精密称取S1号金花茶茶花样品4.0 g,共5份,分别按照1.2.1中的方法制备供试品,用1.2.3中的方法进行检测,计算每个样品共有峰的相对保留时间和相对峰面积,并计算RSD,考察实验的重复性。结果表明主要色谱峰的相对保留时间的RSD在0.014%~1.39%范围内,相对峰面积RSD值在0.92%~9.50%之间,符合指纹图谱的要求。
2.2 金花茶茶花指纹图谱的建立
2.2.1 指纹图谱的采集 精确称量S1~S10各个批次的金花茶茶花4.0 g,分别按照1.2.1中的方法制备供试品,采用1.2.3中的方法进行检测,得到各批次金花茶茶花的HPLC指纹图谱(S1-S10)及10批样品的对照图谱(R)。

图1 10批次金花茶茶花指纹图谱Fig.1 HPLC fingerprints of ten batches of flower of Camellia chrysantha(Hu)Tuyam
2.2.2 共有指纹峰的确定 运用《中药色谱指纹图谱相似度评价系统》(2004A)进行指纹图谱数据分析,综合10批次样品的指纹图谱,10批次图谱都匹配的色谱峰标定为共有指纹图谱峰。共确定34个色谱峰为共有峰,如图2所示,计算出相对保留时间和相对峰面积,见表2。

图2 金花茶茶花指纹图谱共有峰Fig.2 Common peaks in the HPLC fingerprint of flower of Camellia chrysantha(Hu)Tuyam

表2 金花茶茶花HPLC指纹图谱相对保留时间和相对峰面积分析Table2 Relative retention time and Relative peak area of main peaks in the HPLC fingerprint of flower of Camellia chrysantha(Hu)Tuyam
2.2.3 参照峰的确定 按照色谱条件进样得到的金花茶茶花指纹图谱,色谱峰多且峰型复杂,采用外标法,芦丁在色谱条件下测定的色谱图保留时间与19号峰保留时间基本相同,故确定19号峰即为芦丁,且该峰与相邻色谱峰分离良好,峰面积适宜,易于识别,具备评价色谱指纹图谱的特征,因此,在指纹图谱上选择19号色谱峰作为参照峰(S)。
2.2.4 共有指纹峰的分析 应用评价系统对共有峰的相对保留时间和相对峰面积进行分析,结果见表2。由表中结果可以看出,十批金花茶的相对保留时间之间的RSD值比较小,说明各批次金花茶的化学成分基本相同,但是相对峰面积的RSD值比较大,这表明生长时间不同、生长地理环境等外界因素不同的情况下,各个批次金花茶之间化学成分含量有一定的差异。
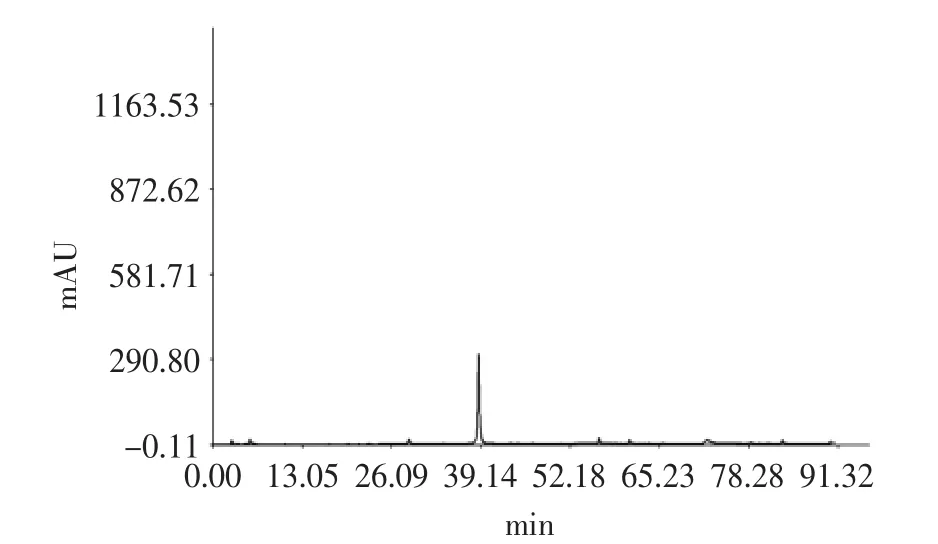
图3 芦丁的高效液相色谱图Fig.3 HPLC figure of Rutin

表3 金花茶茶花HPLC指纹图谱相似度计算结果Table3 Results of similarity analysis in fingerprint for ten batches of flower of Camellia chrysantha(Hu)Tuyam
2.2.5 相似度分析 利用国家药典委员会“中药色谱指纹图谱相似度评价系统A版”,采用多点校正后进行自动匹配,对10批样品的指纹图谱进行相似度分析,分析结果见表3。
3 结论
中国为世界上最早将茶作为饮料的国家[15],茶在国民生活中占据着重要的位置。金花茶作为自然界中唯一绽放金黄色花朵的茶花被国家列为一级保护植物,具有较高的经济价值和药用价值,是极稀缺的养生极品[5]。因此,制定其质量标准极其重要。本研究拟运用HPLC技术构建金花茶花茶HPLC指纹图谱,以期更全面地反映我国金花茶花茶中水提物成分的化学特征,并为其鉴别和质量的客观评价提供思路。
本文对金花茶茶花进行研究,确定了实验的色谱条件,建立了金花茶茶花的指纹图谱,共确定了34个共有峰。实验方法经过方法学考察,符合建立指纹图谱的各项要求,可作为金花茶茶花质量控制与科学评价的有效方法。
[1]颜栋美,李仁菊.XDA-200对金花茶多酚的纯化研究[J].食品工业科技,2008,29(1):137-139.
[2]赵彦华,田呈瑞,徐长波,等.金花茶饮料工艺的研究[J].食品科学,2005,26(9):323-326.
[3]Wei X,Jiang YS,Jiang S Y,et al.Photosynthetic characteristics of an endangered species Camellia nitidissima and its widespread congener Camellia sinensis[J].Photosynthetica,2008,46(2):312-314.
[4]林华娟,田晓春,秦小明,等.金花茶多糖单一成分的化学结构特征解析[J].食品科学,2013,34(3):141-146.
[5]林华娟,秦小明,曾秋文,等.金花茶茶花的化学成分及生理活性成分分析[J].食品科技,2010,35(10):88-91.
[6]黄变才.广西民族医药简编[M].广西:广西壮族自治区卫生局药品检验所,1980:82.
[7]Zhou XingWen,Fan ZhengQi,Chen Yue,et al.Functional analyses of a flavonol synthase-like gene from Camellia nitidissima reveal its roles in flavonoid metabolism during floral pigmentation [J].Journal of Biosciences,2013,38(3):593-604.
[8]Sokol'skii I N,Ban'kovskii A I,Zinkevich E P.Triterpene Glycosides from Camellia oleifera and Camellia sasanqua[J].Khimiya Prirodnykh Soedinenii,1975,1:102-103.
[9]曾秋文,林华娟,秦小明,等.金花茶皂甙的分离纯化研究[J].食品科技,2010,35(10):233-237.
[10]秦小明,林华娟,宁恩创,等.金花茶叶水提物的抗氧化活性研究[J].食品科技,2008,2:189-191.
[11]袁洁,尹京苑,高海燕.指纹图谱在白酒中的应用研究进展[J].食品科学,2008,29(11):680-684
[12]蒋剑波,周志刚,彭利军.湘西原香醋紫外光谱指纹图谱特性分析[J].食品科学,2012,33(06):162-165.
[13]肖维强,戴宏芬,黄炳雄,等.石硖龙眼HPLC指纹图谱的研究[J].食品科学,2009,30(4):154-157
[14]秦小明,宁恩创,杨宏,等.金华茶叶药用保健成分提取新工艺研究[J].食品工业科技,2005,26(10):122-124
[15]TapanKMondal,AmitaBhattacharya,LaxmikumaranMalathi,et al.Recent advances of tea(Camellia sinensis)biotechnology [J].Plant Cell,Tissue and Organ Culture,2004,76:195-254.
Development of an HPLC fingerprint for flower of Camellia Chrysantha(Hu)Tuyam
YANG Li-fang1,LIU Hong-cun1,LUO Jia1,DENG Xian1,JIANG Ming-guo2,*,GENG Li-yuan2
(1.School of Chemistry and Chemical Engineering,Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources,Key Laboratory of Guangxi Colleges and Universities for Food Safety and Pharmaceutical Analytical Chemistry,Guangxi University for Nationalities,Nanning 530006,China;2.School of Marine Sciences and Biotechnology,Guangxi Liupo Tea Engineering and Technology Centers,Guangxi University for Nationalities,Nanning 530006,China)
Objective:To establish HPLC fingerprints for quality control of the flower of Camellia Chrysantha(Hu)Tuyam.collected from different locations.Methods:The effective compounds were extracted by microwave method and detected by HPLC.Results:34 HPLC peaks was marked as the common peak of ten batches samples by the traditional medicine fingerprint similarity calculation software.Conclusion:The established chromatographic fingerprint was proved to be a scientific quality evaluation method for flower of Camellia Chrysantha(Hu)Tuyam.
Camellia chrysantha(Hu)Tuyam;HPLC;flavonoids,fingerprint
TS207.3
A
1002-0306(2016)06-0086-04
10.13386/j.issn1002-0306.2016.06.008
2015-07-24
杨立芳(1969-),女,博士,教授,研究方向:天然产物化学成分及活性研究,E-mail:yanglf1990@163.com。
姜明国(1973-),男,博士,教授,研究方向:生物技术与生物活性评价,E-mail:mzxyjiang@163.com。
广西高校科学研究项目(YB2014101)。

