HPLC法测定不同产地党参中党参炔苷和丁香苷的含量
陈前锋,邓小艳,祝慧凤(西南大学药学院,重庆400715)
HPLC法测定不同产地党参中党参炔苷和丁香苷的含量
陈前锋,邓小艳,祝慧凤*
(西南大学药学院,重庆400715)
建立高效液相色谱法同时测定不同产地党参中党参炔苷和丁香苷含量的方法。采用Thermo scientific C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈和水为流动相进行梯度洗脱,流速为1.0 mL/min,检测波长266 nm,柱温为25℃。实验结果表明,党参炔苷与丁香苷色谱峰分离良好。二者分别在10~200 μg/mL与0.5~10 μg/mL范围内与峰面积呈良好的线性关系。平均加样回收率分别为100.65%与98.78%。党参炔苷和丁香苷在10个不同产地的党参中含量分别介于0.1963~1.4532 mg/g与0.0051~0.0951 mg/g。该方法操作简便、快速,结果稳定可靠,适用于党参2种主要成分的定量分析。
党参,高效液相色谱法,党参炔苷,丁香苷,含量测定
常用中药党参为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.、素花党参Codonopsis pilosula Nannf.var.modesta(Nannf.)L.T.Shen或川党参Codonopsis tangshen Oliv.的干燥根,味甘性平,具有补中益气,健脾益肺,除烦渴之功能,可用于治疗脾肺虚弱,气短心悸,食少便溏,内热消渴等症[1]。党参同时因其补气健脾之功效,常被用于炖鸡、炖瘦肉等。党参中主要含有多糖、聚炔类、酚酸、木脂素等多种类型的化学成分[2]。党参至今尚无统一的质量控制方法,我国2010年版药典仅收载了党参炔苷为对照的薄层定性鉴别方法,并没有相应的定量检测方法。目前关于党参成分含量测定的文献多集中在党参炔苷、多糖、苍术内酯III、党参内酯等成分[3-6]。之前在对党参化学成分进行系统研究的过程中发现党参炔苷和丁香苷为不同产地和品种党参的共有活性成分。党参炔苷对乙醇造成的胃黏膜损伤有很好的保护作用,与党参补中益气的传统功效相符,为党参胃粘膜保护作用的活性成分[7-8]。丁香苷具有抗疲劳、抗脑缺血、增强适应性等药理作用[9-11]。为了确保党参合理有效的使用,使党参的质量评价有具体的定量指标,本实验拟采用高效液相色谱法对3种不同基源和不同产地的党参中党参炔苷和丁香苷的含量进行研究,为党参的质量评价提供科学依据。
1 材料与方法
1.1 材料与仪器
党参 从党参主产地收集党参药材10批,样品经重庆市中药研究院彭锐研究员、西南大学药学院祝慧凤副教授鉴定,采集产地见表1,所有样品均经纯净、干燥处理;党参炔苷、丁香苷对照品 购自四川省维克奇生物科技有限公司,批号分别为120802、120904,纯度≥98%;色谱甲醇 重庆科试化学有限公司,色谱纯;甲醇 天津市科密欧化学试剂有限公司,分析纯;乙腈 天津市科密欧化学试剂有限公司,色谱纯;水 超纯水;微孔滤膜 天津津腾公司。
分析型高效液相色谱仪 Hitachi公司:LC-2130泵,L-2450二极管阵列检测器;RE-52A旋转蒸发仪、SHZ-III型循环水真空泵 上海亚荣生化仪器厂;FA2004B电子天平 上海精天电子仪器有限公司;AB135-S分析天平 METTLER TOLEDO;小型超纯水仪 VEOLIA WATER;KQ5200DB型数控超声波清洗器 昆山市超声仪器有限公司。

表1 不同产地党参药材的收集Table1 Codonopsis Radix collected from different areas
1.2 实验方法
1.2.1 色谱条件 Thermo scientific C18色谱柱(250 mm×4.6 mm,5 μm);流动相组成为A(乙腈)-B(水),梯度洗脱程序:0~10 min,5%A;10~20 min,5%~15%A;20~30 min,15%~25%A;30~50 min,25% ~75%A。柱温为25℃室温,检测波长为266 nm,流速1 mL/min,进样量10 μL。
1.2.2 对照品溶液的制备 精密称取党参炔苷对照品10.0 mg和丁香苷对照品10.0 mg分别于10 mL和100 mL容量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得浓度为1.0 mg/mL的党参炔苷标准贮备液和浓度为0.1 mg/mL的丁香苷标准贮备液。精密移取党参炔苷标准液1.0 mL、丁香苷标准液0.5 mL于5 mL的容量瓶中,加入甲醇稀释至刻度,摇匀,即得混合标准液。
1.2.3 样品溶液的制备 分别取各批党参药材粉末(过80目筛)1.0 g,精密称定,置100 mL圆底烧瓶中,精密加入50 mL甲醇,浸泡15 min后超声处理30 min,过滤,滤液减压回收溶剂至近干,然后加入少量甲醇溶解并转移至10 mL容量瓶中,加甲醇至刻度,摇匀,0.45 μm微孔滤膜过滤,取其滤液,4℃保存待测。
1.2.4 标准曲线及线性范围 取混合标准液进行稀释,将其配制成党参炔苷浓度分别为200、100、50、20、10 μg/mL和丁香苷浓度分别为10、5、2.5、1、0.5 μg/mL的混合标准品溶液,精密吸取10 μL进样,以峰面积(Y)对样品浓度(X)进行线性回归,得到2种对照品的回归方程、相关系数与线性范围。
1.2.5 方法学考察 精密度实验:精密吸取1.2.2项下方法制备的混合标准液10 μL,按1.2.1项下色谱条件连续进样6次,记录峰面积。
重复性实验:中国药典95版有关于巫山庙党的记载:“党参味甘平、功能是补中气不足,润肺之和,尤以巫山庙党最佳”。C2为庙党,在党参样品中具有一定的代表性。取C2号样品共6份,按1.2.3项下方法平行制备样品溶液,按1.2.1项下色谱条件进样,记录峰面积。
稳定性实验:取C2号样品溶液,分别在0、3、6、9、18、24 h进样测定,记录峰面积。
回收率实验:精密称取已知含量的C2号样品约0.5 g,共6份,精密加入党参炔苷和丁香苷的对照品溶液,混匀,按1.2.3项下方法平行制备样品溶液,按1.2.1项下色谱条件进样,记录峰面积,计算回收率。
1.2.6 样品含量的测定 取各地党参样品按1.2.3项下方法制备样品溶液,按1.2.1项下色谱条件进样,记录峰面积,用标准曲线法计算含量。
1.2.7 系统聚类分析 以所测10个不同产地样品中党参炔苷与丁香苷的含量数值为变量,采用SPSS 19.0统计分析软件对样品进行系统聚类分析(离差平方和法,Ward's Method),利用欧氏距离(Euclidean Distance)作为样品的测度,纵坐标为样品编号。
2 结果与分析
2.1 色谱条件的选择
以乙腈-水为流动相进行梯度洗脱,流速为1.0 mL/min,可快速有效分离党参炔苷和丁香苷,结果见色谱图,图1(a,b)分别为混合标准品色谱图和样品色谱图。结果证明,在该色谱条件下,目标成分与其他杂峰分离良好。
2.2 线性关系考察结果
丁香苷与党参炔苷含量测定的回归方程、相关系数与线性范围见表2。结果表明,在给定的浓度范围内线性关系良好。
2.3 方法学考察
2.3.1 精密度实验 精密度实验结果见表3。丁香苷和党参炔苷峰面积的RSD分别为1.12%、0.93%,表明该方法具有良好的精密度。
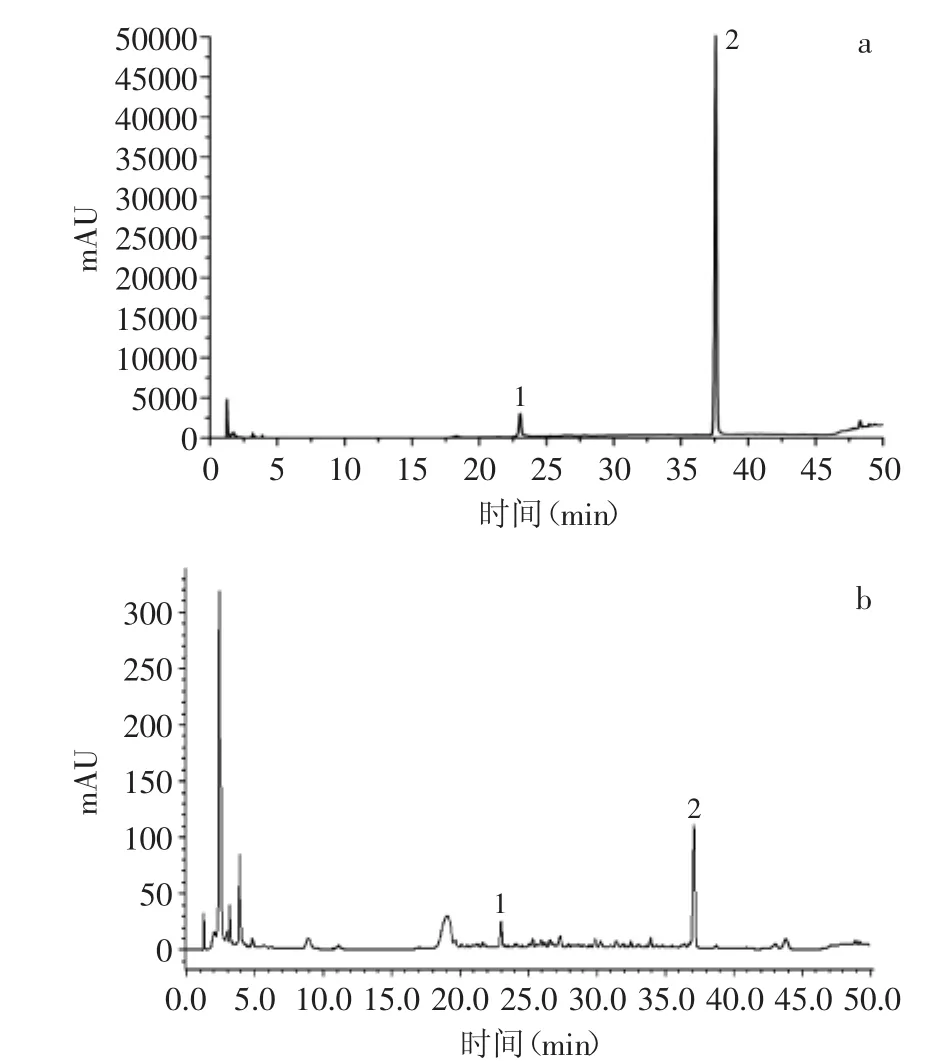
图1 对照品与C8号党参样品色谱图Fig.1 HPLC chromatograms of reference substances and No.C8 sample

表2 丁香苷和党参炔苷的线性关系和线性范围(n=6)Table2 The calibration curves and linear ranges of syringin and lobetyolin(n=6)
2.3.2 重复性实验 重复性实验结果见表4。丁香苷和党参炔苷峰面积的RSD分别为1.83%、1.44%,表明该方法的重复性良好。
2.3.3 稳定性实验 稳定性实验结果见表5。丁香苷和党参炔苷峰面积的RSD分别为1.05%、1.27%,表明样品溶液在24 h内稳定。
2.3.4 加样回收率实验 回收率计算结果见表6和表7。结果显示,丁香苷与党参炔苷的平均回收率分别为98.78%与100.65%,RSD分别为1.47%与2.78%,表明丁香苷与党参炔苷的加样回收率良好。

表6 丁香苷加样回收实验结果Table6 Results of the recovery test of syringin
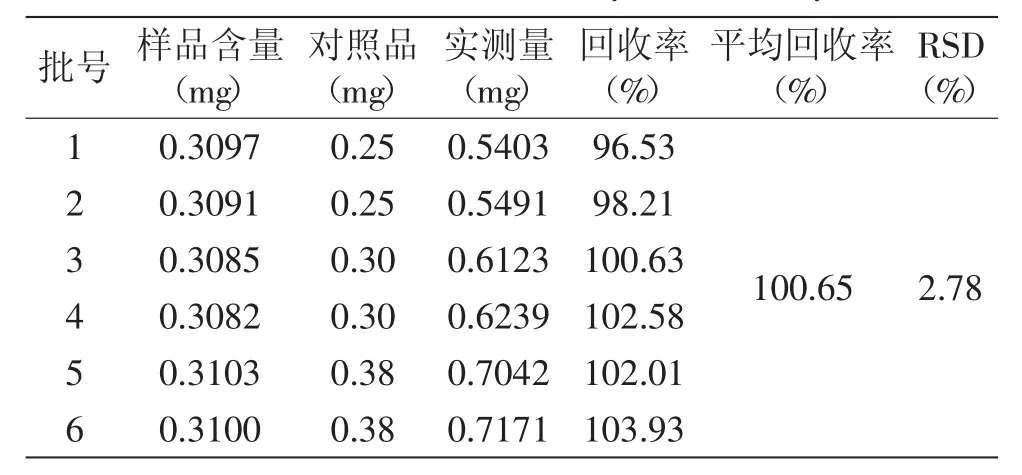
表7 党参炔苷加样回收实验结果Table7 Results of the recovery test of lobetyolin
2.4 样品测定结果
以外标法计算10个不同产地样品中丁香苷与党参炔苷的含量,结果见表8。测定结果表明,10批采自不同地区的党参中党参炔苷和丁香苷的含量有较大差异,其中C8云南昭通的党参中党参炔苷和丁香苷含量均为最高,分别为1.4532、0.0951 mg/g;C7贵州威宁的党参中党参炔苷含量最低,为0.1963 mg/g,山西长治的党参中丁香苷含量最低,为0.0051 mg/g。

表3 精密度实验结果Table3 Results of precision
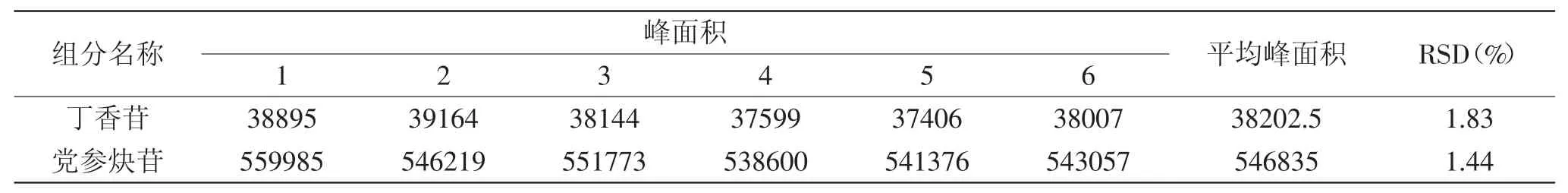
表4 重复性实验结果Table4 Results of repeatability

表5 稳定性试验Table5 Results of stability
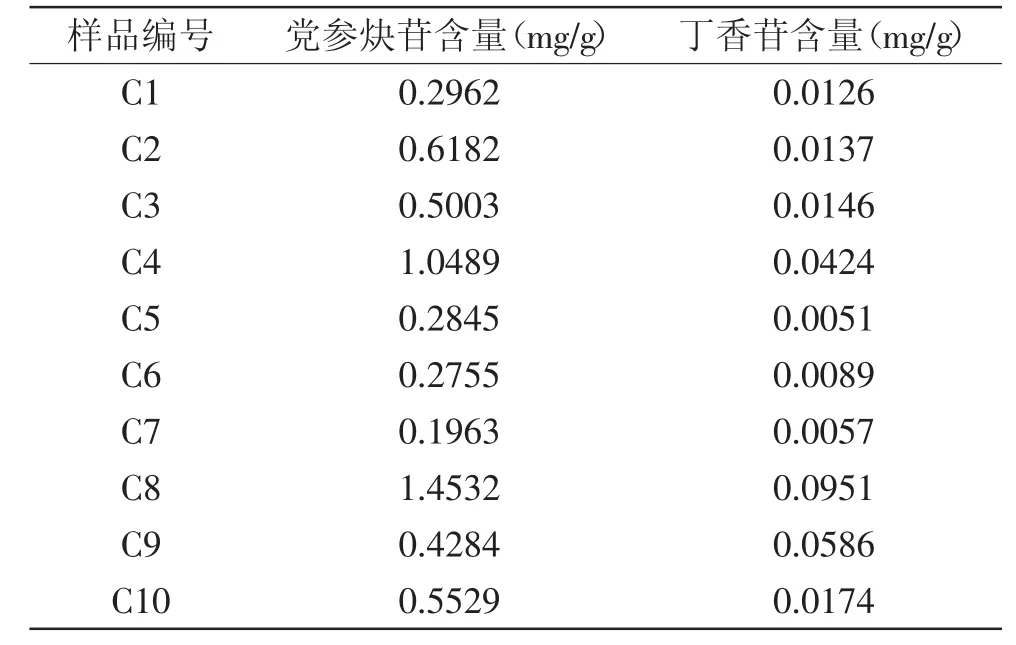
表8 样品含量测定结果Table8 Results of content determination of various samples
2.5 系统聚类分析
10个不同产地样品的系统聚类分析结果见图2。当聚类重新标定距离为25时,10批样品聚为两大类,样品C4、C8聚为第一类,其余样品聚为第二类。当聚类重新标定距离为5时,样品C2、C3、C9、C10聚为第二小类,其余样品聚为第三小类。结合含量测定结果发现,第一类样品C4、C8是党参炔苷含量最高的2份样品,1份为四川凉山样品,1份为云南昭通样品。第二类样品C2、C3、C9、C10为党参炔苷含量的较高组,第三类样品C1、C5、C6、C7则是党参炔苷含量最低的4份样品。由党参炔苷含量的降序排列折线图(图3)可知,党参炔苷含量由高向低排列时,样品顺序与聚类分析结果一致,因此党参炔苷的含量对党参质量具有显著影响。由图3可知,丁香苷含量与党参炔苷含量具有较好的相关性,因此党参炔苷和丁香苷含量均较高时,才能保证党参质量。因此,在对党参药材质量评价时,综合考察党参炔苷和丁香苷的含量,可以更全面地控制党参质量。

图2 党参炔苷和丁香苷含量测定结果聚类树状图Fig.2 Cluster analysis dendrogram based on the content of lobetyolin and syringin

图3 样品党参炔苷含量降序排列折线图Fig.3 Line chart based on the lobetyolin content in various samples in descending order
3 结论
本实验建立了同时测定党参中党参炔苷和丁香苷含量的HPLC方法,该方法具有分离效果好、灵敏度高、精密度高、回收率好的特点,并采用系统聚类法加以验证,证明该法可作为党参药材质量控制的方法之一,为多指标控制党参药材的质量提供了实验基础。
[1]国家药典委员会.中华人民共和国药典2010年版(一部)[M].北京:中国医药科技出版社,2010:264.
[2]冯佩佩,李忠祥,原忠.党参属药用植物化学成分和药理研究进展[J].沈阳药科大学学报,2012,29(4):307-311.
[3]宋英,周小初,宋崎,等.党参中多糖的含量测定方法研究[J].中国药业,2008,17(23):9-10.
[4]杨静,苏强,刘恩荔,等.不同产地党参苍术内酯III和党参炔苷含量测定[J].山西医科大学学报,2010,41(8):698-702.
[5]庞维荣,双少敏,刘养清.RP-HPLC法测定党参内酯和党参炔苷的含量及相关性研究[J].世界中西医结合杂志,2008,3 (2):89-91.
[6]时军,马方励,廖华卫,等.HPLC法测定不同产地党参药材中党参炔苷的含量[J].广东药学院学报,2011,27(1):51-53.
[7]Wang ZT,Du Q,Xu GJ,et al.Investigations on the protective action of Condonopsis pilosula(Dangshen)extract on experimentally-induced gastric ulcer in rats[J].Gen Pharmacol,1997,28(3):469-473.
[8]宋丹,王峥涛,李隆云,等.党参炔苷对胃溃疡模型大鼠胃黏膜损伤保护作用的研究[J].中国中医急症,2008,17(7):963-964.
[9]Gong X,Zhang L,Jiang R,et al.Hepatoprotective effects of syringin on fulminant hepatic failure induced by D-galactosamine and lipopolysaccharide in mice[J].J Appl Toxicol,2014,34(3):265-271.
[10]Sharma U,Bala M,Kumar N,et al.Immunomodulatory active compounds from Tinospora cordifolia[J].J Ethnopharmacol,2012,141(3):918-926.
[11]Yin L,Yang YH,Wang,MY,et al.Effects of syringin from Phellodendron chinensis on monosodium urate crystal-induced inflammation and intercellular adhesion molecule-1(ICAM-1)expression[J].Afr J Pharm Pharmaco,2012,6(21):1515-1519.
Determination of lobetyolin and syringin in Codonopsis Radix from different places by HPLC
CHEN Qian-feng,DENG Xiao-yan,ZHU Hui-feng*
(School of Pharmaceutical Sciences,Southwest University,Chongqing 400715,China)
To establish a HPLC method for simultaneous determination of lobetyolin and syringin in Codonopsis Radix from different places.The HPLC system consisting of Thermo scientific C18Column(4.6 mm×250 mm,5 μm)and a gradient elution system of acetonitrile-water as the mobile phase was adopted.The flow rate was set at 1.0 mL/min,the detection wavelength was 266 nm,and the column temperature was 25℃.The results indicated that the chromatographic peaks of lobetyolin and syringin could be separated well.The linear ranges for lobetyolin and syringin were 10~200 μg/mL and 0.5~10 μg/mL,respectively.The average recoveries were 100.65%and 98.78%,respectively.The lobetyolin content and syringin content in Codonopsis Radix from ten places was ranged from 0.1963~1.4532 mg/g and 0.0051~0.0951 mg/g,respectively.The simple,quick,reproducible and reliable method could be used for determination of two main components in Codonopsis Radix.
Codonopsis Radix;HPLC;lobetyolin;syringin;content assay
TS207.3
A
1002-0306(2016)06-0064-04
10.13386/j.issn1002-0306.2016.06.004
2015-07-21
陈前锋(1980-),男,博士,讲师,研究方向:天然药物化学,E-mail:cqf2011@swu.edu.cn。
祝慧凤(1971-),女,博士,副教授,研究方向:中药治疗疾病的物质基础与药理机制,E-mail:zhfbsci@126.com。
校地合作项目(104290-41003012);2013年重庆高校创新团队建设计划资助项目;中央高校基本科研业务费创新团队项目(XDJK2013A025);中央高校基本科研业务费项目(XDJK2013C145);西南大学博士基金项目(SWU111076);西南大学药学实验教学中心资助的创新实验项目。

