DhHP-6替代过氧化物酶在葡萄糖检测中的应用
侯玥,董占梅,马野,赵宝珠,郭晓楠,于源华
(1.长春理工大学 生命科学技术学院,长春 130022;2.吉林省公安厅物证鉴定中心,长春 130000)
DhHP-6替代过氧化物酶在葡萄糖检测中的应用
侯玥1,董占梅2,马野1,赵宝珠1,郭晓楠1,于源华1
(1.长春理工大学生命科学技术学院,长春130022;2.吉林省公安厅物证鉴定中心,长春130000)
过氧化物酶(POD)是催化H2O2氧化反应的生物酶,很多涉及氧化反应的临床诊断试剂盒都采用这个原料。但天然的POD易失活、价格高、实验条件和储存环境都很苛刻。拟开发一种模拟酶替代过氧化物酶。次血红素六肽(DhHP-6)是一种生物小分子,由于它稳定、实验条件温和、成本较低等优点,成为近年关注热点。将次血红素六肽(DhHP-6)替代过氧化物酶催化H2O2氧化,通过偶联还原型色原N-乙基-N-(2-羟基-3-磺酸基丙基)-3,5-二甲氧基苯胺(DAOS)和4-氨基安替比林4-(AAP)进行显色反应,将该体系应用于葡萄糖氧化酶(GOD)催化体系,实现血液中葡萄糖含量的测定。实验结果表明,在最佳条件下,H2O2的线性范围为0.69~22.0mmol/L;葡萄糖测定的线性范围为0.35~22.0mmol/L。将本法用于血样中葡萄糖测定,重复性:CV=2.6%(n=20);稳定性:3小时内,浓度CV≤5.0%;与商品血清葡萄糖试剂进行比较,R≥0.98,平均回收率达到96.4%。结果为过氧化物酶的模拟酶研究与开发提供实验技术基础。
次血红素六肽;模拟酶;葡萄糖测定。
过氧化物酶(POD)由于选择性好和活性高,广泛应用于血清中葡萄糖和尿酸等小分子含量的测定[1]。但天然POD易失、价格高、实验条件和储存环境都很苛刻。已有研究发现,肌红蛋白、Fe3O4等能作为POD的模拟酶应用于葡萄糖的测定中[2-5],王丽萍等根据抗坏血酸过氧化物酶的结构主体,设计并合成了具有很高POD活性的一种含亚血红素的短肽-次血红素六肽(Deutero hemin-His-Peptide,DhHP-6)[6,7]。本文采用DhHP-6代替POD催化过氧化氢(H202),氧化偶联还原型色原N-乙基-N-(2-羟基-3-磺酸基丙基)-3,5-二甲氧基苯胺(DAOS)和4-氨基安替比林(4-AAP)显色反应,用于H202的测定,将该体系与葡萄糖氧化酶(GOD)催化体系偶联,实现了血液中葡萄糖含量的测定。
1 仪器与试剂
UV-2550紫外-可见分光光度计(日本岛津);DAOS(美国ICN公司);4-AAP(天津市化学试剂研究所);3.0%H2O2(德州新康消毒制品有限公司生产);葡萄糖(Glucose)标准液(长春汇力生物);葡萄糖氧化酶(GOD,Sigma);DhHP-6(吉林大学生命科学院王丽萍教授馈赠);血样来自解放军461医院;试剂中所用水均为去离子水。
实验试剂:A:0.2mmol/L Good’s缓冲液,pH7.0,内 含 有 12mmol/LDAOS、10mmol/L 4-AAP、30KU/L葡萄糖氧化酶。B:1.0mmol/L (1.23mg/mL)DhHP-6。
对比试剂:长春汇力生物葡萄糖测定试剂盒(吉械注准2009第20152400093号)。
2 实验部分
2.1实验原理
葡萄糖氧化酶(GOD)催化葡萄糖产生葡萄糖酸和H202,用DhHP-6代替POD催化H2O2氧化偶联DAOS和4-AAP偶联的反应。利用氧化产物在592nm波长处的吸收,实现血液中葡萄糖含量的测定。
2.2实验方法
2.2.1DhHP-6过氧化物酶模拟酶的性质实验
取2支10mL具塞试管,加入实验试剂A 5.0mL,实验试剂B 1.0mL(1.23mg DhHP-6),其中一支加入3.0%H2O20.1mL,用去离子水定容到10mL,混合均匀后在37℃时反应10min,然后在UV-2550紫外-可见分光光度计上测定产物的吸收光谱,如图1所示。
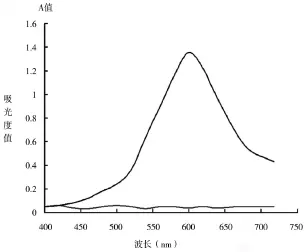
图1 H202-4-A AP-DAOS-DhHP-6的反应产物吸收光谱1显色产物,2试剂空白,不加H202的试剂
2.2.2DhHP-6过氧化物酶模拟酶的线性实验
取3.0%H2O20.05ml(882mmol/L)加入蒸馏水19.95ml(40倍稀释)。制成浓度为22.0mmol/L的H2O2溶液。然后分别稀释成浓度11.0、5.50、2.75、 1.375、0.687mmol/L按表1进行实验操作,37℃反应10min,在UV-2550紫外-可见分光光度计上592nm测定产物的吸光度A值,结果如图2所示。
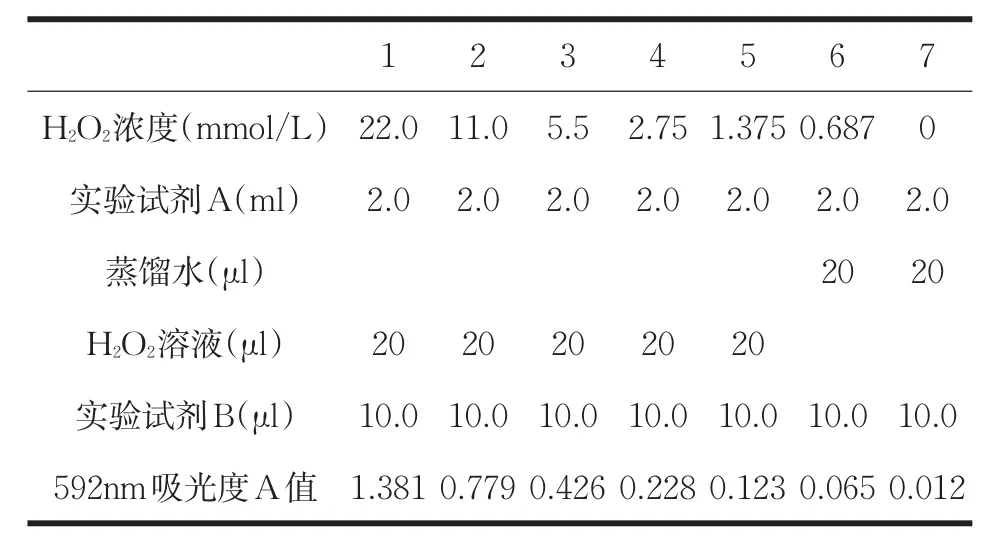
表1 DhHP-6模拟POD测定H2O2(10分钟)
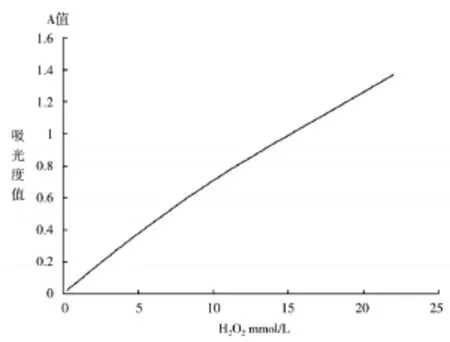
图2 H202-4-A AP-DAOS-DhHP-6测定H202的反应线性
2.2.3DhHP-6过氧化物酶模拟酶测定葡萄糖及与商品试剂盒的比较
取葡萄糖标准液(22.0mmol/L)加入蒸馏水分别稀释成浓度11.0、5.50、2.75、1.37、0.69、0.34mmol/L,按表2进行实验操作,37℃反应10min,在UV-2550紫外-可见分光光度计上592nm测定产物的吸光度A值,同时与长春汇力生物产生的葡萄糖测定试剂盒进行比较。结果如图3所示。

表2 DhHP-6模拟POD测定葡萄糖(10分钟)
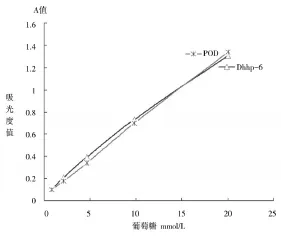
图3 DhHP-6测定葡萄糖及与商品试剂盒的比较
2.2.4DhHP-6酶模拟酶测定葡萄糖的重复性、稳定性实验
取20支试管,分别加入5.50mmol/L的葡萄糖标准液10μl、实验试剂A 2.0ml、实验试剂B10μl,37℃反应10min,在UV-2550紫外-可见分光光度计上592nm测定产物的吸光度A值,计算平均值、标准差和变异系数。
取葡萄糖标准液(22.0mmol/L)加入蒸馏水分别稀释成浓度11.0、5.50、2.75、1.37、0.69、0.34mmol/L,按表2进行实验操作,37℃反应,分别在1/6小时(10分钟)、1.0小时、3.0小时和24小时在UV-2550紫外-可见分光光度计上592nm处测定吸光度A值。结果如图4所示。
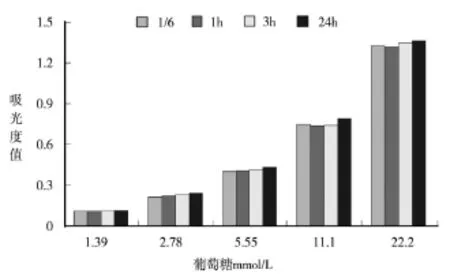
图4
2.2.5回收率实验
取6份葡萄糖含量不同的血液样品各1.0m1,每2管分别加入2.0、5.0、10.0mmol/L的葡萄糖溶液各1.0m1,37℃10分钟在在UV-2550紫外-可见分光光度计上592nm处测定吸光度A值。测定回收率。
3 结果与讨论
3.1DhHP-6作为模拟酶的光谱特征
UV-2550紫外-可见分光光度计上进行光谱扫描显示,DhHP-6催化H202与DAOS-AAP体系所得产物的吸收光谱最大吸收波长在592nm,与POD催化相同体系的最大吸收波长一致(图1),证明DhHP-6具有与POD相同的催化特性,可作为POD的模拟酶进行应用。
3.2DhHP-6催化H2O2的线性实验
在0.687-22.0mmol/L范围内,DhHP-6催化H2O2呈线性关系(图2),证明DhHP-6有较好的催化H2O2能力。
3.3DhHP-6测定葡萄糖及与商品试剂盒的比较
在0.34~22.2mmol/L范围内,DhHP-6催化葡萄糖呈线性关系(图3),证明DhHP-6可应用于GOD-DAOS-AAP体系测定葡萄糖。同时与长春汇力生物生产的葡萄糖测定试剂盒进行比较,相关系数r=0.9871。
3.4DhHP-6模拟酶测定葡萄糖的重复性、稳定性实验
20份5.55mmol/L的葡萄糖标准液的重复性实验结果为:平均值=5.57mmol/L、标准差=0.144mmol/ L、变异系数=2.6%。证明DhHP-6作为模拟酶测定葡萄糖有较好的重复性;
DhHP-6模拟酶测定0.34-22.0mmol/L葡萄糖过程中,在37℃反应后,分别在1/6小时(10分钟)、1.0小时、3.0小时和24小时592nm处测定吸光度A值(图4)。结果证明DhHP-6模拟酶在显色后有较好的稳定性。
3.5回收率实验
用葡萄糖含量不同的3个血液样品,分别加入3.0mmol/L和5.0mmol/L的葡萄糖溶液各1m1后测定回收率,每个试样均测定3次,葡萄糖的平均回收率值为96.4%,与葡萄糖氧化酶偶联过氧化物酶在相同体系中测定葡萄糖的回收率97%相近。
4 结论
本文以DhHP-6模拟酶替代POD,实现了对H2O2和葡萄糖含量的测定。DhHP-6可以作为POD的模拟酶,从理论上证实了以亚血红素为靶分子肽类模拟物DhHP-6具有很高的过氧化物酶活性[7]。作为一种新的模拟酶,它具有合成工艺化、质量稳定、价格低廉、易储存等优点,具有广阔的应用前景。本实验结果为DhHP-6模拟酶研究与开发应用提供了实验技术基础。
[1]尚红,王毓三,申子瑜.全国临床检验操作规程[M].北京:人民卫生出版社,2015:231.
[2]韩爱霞,常瑞,牛丽红,等.用肌红蛋白作为过氧化物酶模拟酶光度测定葡萄糖[J].分析化学,2004,32(8):1123.
[3]Kim MI,Shim J,Li T,et a1.Fabrication of nanoporousnanocompositesentrappingFe3O4magnetic nanoparticles and oxidases for colorimetric biosensing [J].Chemistry,2011,12;17(38):10700-107007.
[4]Jiang X,Sun C,Guo Y,et al.Peroxidase-like activity of apoferritin paired gold clusters for glucose detection[J].Biosens Bioelectron,2015,64:165-170.
[5]Zhang Weimin,Ma Diao,Dun Jianxiu.Prussian blue nanoparticlesas peroxidase mimetics forsensitive colorimetric detection of hydrogen peroxide and glucose[J].Talanta,2014,120:362-367.
[6]WANG Liping,LIU Yali,YANG Hui,et al.Synthesis and anti-cataract activity of a novel peroxidase mimetics[J].Chemical Journal of Chinese universities,2004,25(11):2171-2173.
[7]Yali L,Lili G,Roger WR,et al.The method improvement of synthyesis and purification of deuterohemin[J].Acta Sci.Nat.Univ.Jilin,2001,1:91-92.
The Application of DhHP-6 Substitutes for Peroxidase in the Detection of Glucose
HOU Yue1,DONG Zhanmei2,MA Ye1,ZHAO Baozhu1,GOU Xiaonan1,YU Yuanhua1
(1.School of Life Science and Technology,Changchun University of Science and Technology,Changchun 130022;2.Public Security Department Material Evidence Identification Center of Jilin Provincial,Changchun 130000)
Peroxidase(POD)is a biological enzyme that catalyzes the oxidation of H2O2,that material of reagent kit relate to oxidation.Conditions for natural POD were harsh that easily inactivity,high price,difficult experimental conditions and storage line.This study develop mimic enzyme instead of peroxidase.DhHP-6 is small molecule that became the hotspot for stability,safe experimental conditions and low cost.In this experiment,(DhHP-6)replace the peroxidase for catalyzed H2O2oxygen.The chromogenic reaction is through coupling N-Ethyl-N-(2-hydroxy-3-sulfopropyl)-3,5-dimethoxyaniline sodium salt(DAOS)and 4-Aminoantipyrine(4-APP).This system was applied to the glucose oxidase (GOD)catalytic system for determination of the blood glucose.Experimental results show that,under the optimal conditions,H2O2linear region between 0.69~22.0mmol/L,Linear range of glucose determination between 0.35~22.0mmol/L. The method applied to determination of serum glucose,repeatability CV=2.6%(n=20),stability:concentration CV≤5.0% in 3 hours.Compared with commercial glucose kits,R≥0.98,the average recovery rate is 96.4%.It is helpful for mimic enzyme replaced peroxidase to develop and basical research.
DhHP-6;mimic enzyme;determination of glucose
O652
A
1672-9870(2016)03-0139-04
2016-01-10
侯玥(1988-),女,博士,讲师,E-mail:hy46155@126.com
于源华(1962-),女,教授,博士生导师,E-mail:yuyuanhua8888@126.com

