自制氧化铅电极降解苯酚的试验研究
金贻芳,于萍,罗运柏
(武汉大学化学与分子科学学院,湖北武汉430000)
自制氧化铅电极降解苯酚的试验研究
金贻芳,于萍,罗运柏
(武汉大学化学与分子科学学院,湖北武汉430000)
以钛片为基底,SnO2+Sb2O5为中间层,自制氧化铅电极用于苯酚的电化学降解。试验结果表明,自制电极具有良好的苯酚去除效果:在室温为15℃,电极间距为15 mm,电流密度为16 mA/cm2,苯酚溶液pH为6.3,导电介质Na2SO4浓度为0.25 mol/L时,电解300 mL初始质量浓度为100 mg/L的苯酚,4 h后去除率可达91.89%。研究降解过程中苯酚初始浓度、pH、导电介质、电流密度、电极间距等因素对苯酚降解过程的影响。在此基础上对苯酚降解影响较大的初始浓度、pH、电流密度3个因素优化,通过响应曲面分析交互影响和单因素影响,结果表明,三者交互影响不大,苯酚初始浓度影响最大,pH影响最小,与单因素影响分析结果吻合。
自制氧化铅电极;苯酚;电化学降解;响应曲面法
苯酚是废水主要污染物之一,不经处理的含酚废水会挥发进入大气或渗入地下,污染大气、地下水和农作物。由于其具有降解缓慢性、生物积累性和毒性,且分布广泛,对环境造成了巨大的影响。废水有机污染物的处理主要采用生物降解法和物理化学法,目前生物法应用较多。生物法主要利用了水中微生物的新陈代谢来降解污染物,将其转化为无害的有机物。生物法耗能少、处理能力强,但是受废水酸碱性及初始浓度等因素影响大,操作应用受到制约〔1-2〕。电化学方法是物理化学法的一个重要分支,相比传统处理技术,电化学反应比普通化学反应氧化还原能力更强;过程清洁、周期短、后处理简单;设备占地面积小,具有良好的灵活可控性。在电化学方法中,电极是一个非常重要的因素。笔者试验选择采用金属氧化物电极,与其他种类电极相比,氧化物电极在电催化氧化方面具有更强的催化活性,能够提高电化学反应的电流效率,且不易被污染〔3〕。在钛基体表面涂敷催化涂层制作中间层,电镀PbO2制作外层,所得电极催化性能好、外界影响小、适用范围广。在此基础上采用响应曲面法(RSM)建立连续变量曲面模型,对影响去除过程的因素及其交互作用进行评价,确定最佳水平范围,探寻苯酚去除的最佳条件。
1 试验部分
1.1试验试剂和仪器
主要试剂:苯酚、三氯化锑、五水四氯化锡、4-氨基安替比林、铁氰化钾、硝酸铅、硝酸铜、氯化铵、氨水,国药集团化学试剂有限公司,以上试剂均为AR级。
主要仪器:紫外分光光度仪(UV-1700,岛津),电源(PXN-605D,深圳兆信),pH计(雷磁PHS-3C,上海仪电)。
1.2试验装置
试验采用自制的电解槽进行电解,在槽壁镶嵌间距一定的卡槽固定电极,方便控制电极间距。试验装置如图1所示。
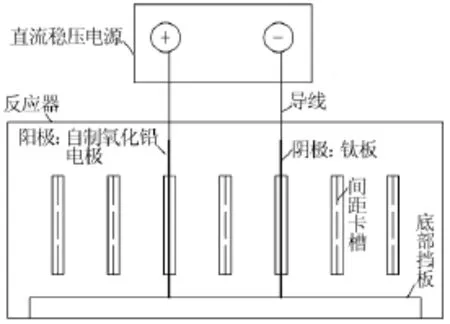
图1 试验装置示意
1.3检测方法
苯酚的含量采用4-氨基安替比林直接分光光度法测量〔4〕。
1.4电极制备
将钛片(47 mm×50 mm×1 mm),打磨至呈银白色金属光泽,用去离子水冲洗干净,放入10%的NaOH溶液中,于70℃水浴锅中加热1 h以除去钛片表面的油污。再置于15%的草酸溶液中于65℃水浴锅中蚀刻1h后,用去离子水冲洗干净。称取0.24g三氯化锑和1.53 g五水四氯化锡,n(三氯化锑)∶n(四氯化锡)=1∶4,溶于40 mL无水乙醇制成中间层溶液。将钛片放入85℃烘箱内烘干,均匀刷上一层中间层溶液,放入85℃烘箱内20 min左右使乙醇蒸发完毕后,再放入550℃马弗炉20 min左右高温烧结。从马弗炉中取出钛片,冷却至室温后再刷中间层溶液—85℃烘箱—550℃马弗炉,重复3次,其中最后一次在马弗炉内煅烧1 h即制成电镀片。称取硝酸铅40 g,硝酸铜30 g,溶于1 000 mL水中,加入硝酸调节pH=1。按照钛片、电镀片、钛片顺序固定,电镀片接电源正极,两个钛片接负极,70℃水浴,20 mA/cm2电镀3.5 h,取出洗净,保存在去离子水中〔2〕。
1.5试验方法
1.5.1单因素影响试验
对苯酚去除过程中影响较大的5个因素(苯酚初始浓度、pH、电流密度、电极间距、电解质浓度)进行了单因素影响试验研究〔5-7〕。一般条件为:常温常压,300 mL质量浓度为100 mg/L的苯酚溶液,电极间距为15 mm,恒定电流密度为16 mA/cm2,不加酸碱,苯酚溶液pH为6.3左右,导电介质为0.25mol/L的Na2SO4,反应总时间为2.5h,每隔30min取样检测。
1.5.2响应曲面分析
根据单因素影响试验所得结果,选择影响较大的因素,利用响应曲面法对有限的试验点进行分析得到模型,预测苯酚去除效果最好的工艺条件。
2 结果与讨论
2.1单因素影响试验
2.1.1苯酚初始浓度对苯酚去除率的影响
考察不同苯酚初始浓度对苯酚去除率的影响,结果如图2所示。

图2 不同苯酚初始浓度对苯酚去除率的影响
由图2可见,随着初始浓度逐渐增加,苯酚的去除率逐渐降低。2.5 h反应结束时,苯酚初始质量浓度为50、100、150、200、300 mg/L时,苯酚的去除率分别为85.66%、77.42%、78.06%、68.51%、67.59%。电流密度和电极面积一定时,电极产生相对固定量的羟基自由基(·OH)〔6〕。苯酚初始浓度越高,·OH可充分接触苯酚,因此·OH利用率高,但最终去除率越低。苯酚初始浓度较低时,·OH过量,除了与苯酚发生反应外,过量的·OH还可以O2的形式释放。在氧化铅电极上,PbO2(·OH)→1/2O2+PbO2+H++e-,析氧反应为副反应,会降低·OH利用率和电催化效率。尽管最终去除率较高,但装置的经济效益低。综合考虑,苯酚初始质量浓度选择100 mg/L。
2.1.2pH对苯酚去除率的影响
考察不同pH对苯酚去除率的影响,结果如图3所示。
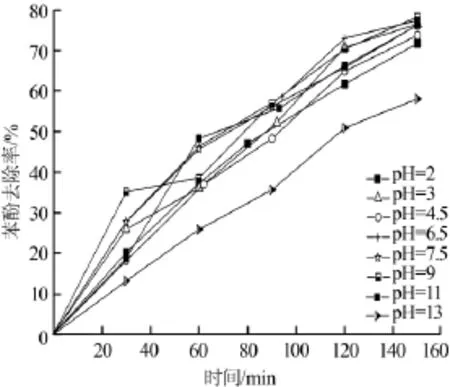
图3 不同pH对苯酚去除率的影响
由图3可见,在pH=13时,苯酚去除率明显下降,为58.05%。其他pH时,曲线趋势大致相同。苯酚直接氧化过程在酸性、碱性介质中的活化能一样,因此在酸碱溶液中苯氧自由基产生的数量大致相同,但溶液的酸碱值会直接影响电极表面羟基自由基的产生,使苯酚间接氧化过程受到影响〔6-7〕。pH较低,易发生析氢反应。pH增大,会提高OH-的浓度,有利于·OH的产生,但溶液的析氧及过氧电位会随之降低增加副反应。同时,pH过大,反应产物CO2生成。·OH与的反应速率大于·OH与有机物的反应速率,消耗大量·OH,降低了间接氧化效率。
氧化铅电极用于苯酚去除时,不同的掺杂中间层会导致不同的最佳pH区域,且去除率差别较大〔2,5〕。笔者试验中,pH=9时去除率最大,这可能是该电极·OH产生的最佳状态点。pH在3~9范围内,苯酚去除率均在75%左右,差别不大。由此可知,苯酚电化学降解时虽然受溶液酸碱性影响,但并不十分敏感,自制电极耐受性好。
2.1.3导电介质浓度对苯酚去除率的影响
纯苯酚溶液导电率非常小,无法产生电流,必须加外加电解质,笔者试验加入Na2SO4。考察0.05、0.15、0.25、0.35、0.45、0.55 mol/L导电介质对苯酚去除率的影响,结果表明,2.5 h反应结束时,苯酚的去除率分别为77.13%、78.72%、77.42%、72.58%、75.79%、73.30%。适当加入导电介质,可增强溶液的导电性能,提高反应中电子的传递速率,提高·OH与有机物反应速率,增加苯酚去除率。导电介质浓度增加至一定程度时候,对去除率的提高程度不明显。总体而言,电解质浓度对于苯酚降解影响不大,加入导电介质的主要作用是使溶液产生电流,使反应能够顺利进行。如果是工业废水或其他混合物,导电效果好时不需要额外加入导电介质,但要考虑混合物中的其他物质对体系的影响。
2.1.4电流密度对苯酚去除率的影响
考察不同电流密度对苯酚去除率的影响,结果如图4所示。
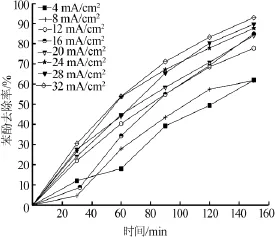
图4 不同电流密度对苯酚去除率的影响
由图4可见,随着电流密度的逐渐增大,苯酚的去除率逐渐提高,超过一定范围后,随着电流密度增大,去除率提高程度并不明显。电流密度增大,单位时间内产生的羟基自由基量增多,提高了苯酚间接氧化速率。同时,电流密度增大,苯酚与电极表面的电子传递速率增大,提高了苯酚直接氧化速率〔7〕。
反应过程中有许多气泡冒出,溶液变成深浅不同的棕褐色,表示不同程度的中间产物积累。电流密度越大,溶液表面泡沫越多,析氧副反应越剧烈,气泡覆盖在电极表面,减小实际参与反应的催化面积,电流效率下降。同时,大量氧气从电极表面析出,会加快电极外层PbO2涂层脱落,导致电极使用寿命大大降低。电流密度越大,相应电压越大,耗能越大。综合考虑,单因素影响试验中,电流密度取16 mA/cm2。
2.1.5电极间距对苯酚去除率的影响
考察电极间距分别为15、30、45、60、75、90 mm对苯酚去除率的影响,结果表明,电极间距对苯酚去除率影响复杂。2.5 h反应结束时,苯酚的去除率分别为77.99%、75.95%、73.08%、76.29%、76.28%、76.13%。随着电极间距增大,电流效率先降低再增加最后趋于平稳。电极板间的距离减小,相应地减小了对流、扩散传质的传质距离,增大传质浓度梯度,降低传质阻力,提高传质推动力,强化传质效果,使苯酚去除率增大〔2〕。电极间距越小电流效率越高,因此实际应用中电极间距都很小。但电极间距太小,易导致电极击穿,此外,板间距离的减小受到设备限制,增加了反应器的加工难度和操作难度。间距过近时,电极易接触在一起导致短路,增加危险性,影响操作的稳定性。综合考虑,试验采用的极板间距离为1格,即15 mm。
2.2降解条件的优化
2.2.1试验模型的建立
根据2.1试验结果可知,苯酚去除影响较大的3个因素是苯酚初始浓度、pH、电流密度。根据单因素影响结果,选取苯酚初始浓度、pH、电流密度3个因素作自变量,每个因素取三水平,以(-1,0,1)编码,采用Box-Behnken的方法设计共17个试验点的试验方案如表1所示。2.5 h苯酚的去除率为响应值,试验结果如表2所示。

表1 响应面因素水平及编码
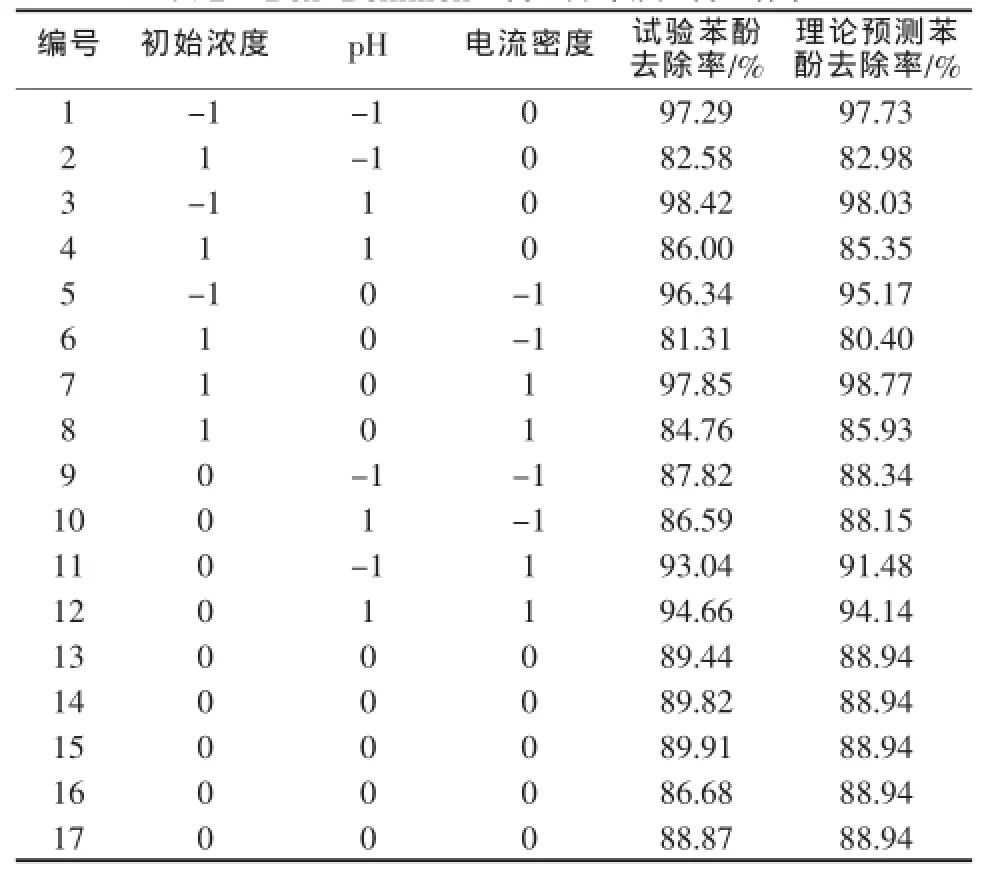
表2 Box-Behnken试验设计及试验结果
将表2中试验值回归拟合,得各因素对响应值的影响式:
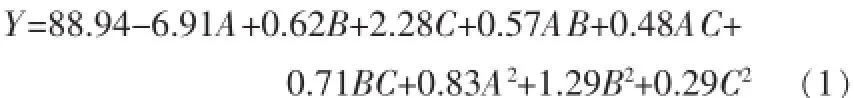
式中:Y——去除率推算理论值,%;
A——初始质量浓度,mg/L;
B——pH;
C——电流密度,mA/cm2。
根据此式所得理论预测值与试验值接近,试验效果好。
2.2.2方差分析
对模型显著性和方程的相关系数进行F检验,回归方程方差分析如表3所示。

表3 回归方程方差分析表
由表3可见,F值是方差齐性检验值,计算得该模型F0.95(9.7)=3.68,F0.99(9.7)=6.72。模型的F= 19.08>6.72,表示整个模型是显著的;失拟度的F= 2.07<3.68,失拟度相对纯误差不显著,表示整个模型是符合要求的。
P值是显著性检验值,P值越大,结果可信水平越低,样本中变量的关联越不可靠,P>0.05时组分无显著意义,P<0.05式模型组分是显著的。A、C组分显著,交互项AB、AC、BC不显著,交互项对去除率影响不大。
相关系数R2是回归平方和与总平方和的比值,反映了回归方程的解释能力,计算得R2=96.08%,R2接近于1,各因素对去除率的影响有96.08%可由该式子解释,只有3.92%属于随机因素影响,因此该回归方程是合适的。为了剔除自变量个数对R2的影响,引入了调整的R2值AdjR2,计算得AdjR2=91.05%。R2与AdjR2值较接近,回归方程拟合优度好,此二次模型近似于真实的曲面。
2.2.3响应曲面分析
根据式(1)分析交互项对苯酚去除率影响,结果如图5所示。
由图5可见,底部曲线为等高线,该线各点处苯酚去除率相同。与B、C方向比较时,A因素响应面曲线较陡,且A值较小时去除率更高。在底部等高线图中,A等高线密度明显高于沿B、C方向移动的密度,说明A对去除率的影响较B、C更为显著,这一结论与方差分析表中A对应的P<0.000 1结果一致。C因素响应面曲线较陡,C等高线移动密度大于B,C因素影响大于B。pH一定时,去除率随电流密度增大而逐渐增大,但电流密度达到32 mA/cm2,2.5 h苯酚去除率已经可达90%以上,再增加电流密度,去除率增加有限,能耗大。在电流密度一定时,随着pH增大,去除率先降低再增大,但幅度均不大。
各响应面对应的等高曲线均未呈明显椭圆形,表明各因素之间的交互作用并不明显〔9〕。苯酚初始浓度影响最大,电流密度其次,pH影响最小,电极酸碱耐受性较好,这与之前单因素影响分析结果大致相同。
2.2.4最优条件的确定及验证
利用Design-Expert数据分析软件的优化功能,使苯酚去除率取最大值,得出最优降解条件为:苯酚质量浓度50.09 mg/L,pH为8.87,电流密度为31.81 mA/cm2,2.5h去除率为100%。在此条件下进行3次验证试验,平均实际去除率为99.87%,与预测值符合。

图5 苯酚初始质量浓度、pH、电流密度三者的响应面3D图
3 结论
(1)自制氧化铅电极降解苯酚去除效果好,在室温为15℃,电极间距为15 mm,电流密度为16 mA/cm2,不加酸碱,苯酚原溶液pH为6.3,导电介质Na2SO4浓度为0.25 mol/L时,电解300 mL初始质量浓度100mg/L的苯酚,4h后苯酚去除率达91.89%。
(2)单因素影响试验中,初始浓度越低,去除率越大。电流密度越大,去除率越高。pH影响复杂,除强酸强碱性外,去除率相差不大,电极酸碱耐受性好。导电介质使溶液导电,但对去除率影响不大。电极间距越小,去除效果越好,但实际应用和安全因素会限制间距。
(3)曲面响应模型显著,二次模型近似于真实曲面。苯酚初始浓度影响最大,pH影响不大,各因素间交互影响不显著,与模型方差分析结论符合。最优降解条件:苯酚质量浓度为50.09 mg/L,pH为8.87,电流密度为31.81 mA/cm2。在此条件下,苯酚去除率达99.87%。
[1]景长勇,楼静,廉冬青,等.电化学降解苯酚废水的试验研究[J].工业安全与环保,2010,36(2):16-17.
[2]高平.钛基SnO2-Sb电极的制备及电催化氧化苯酚过程的研究[D].哈尔滨:哈尔滨工程大学,2012.
[3]施航,陈阵,苏有勇,等.有机废水的电催化法降解研究现状[J].化学工程师,2011,25(5):32-36.
[4]蔡裕丰,吴春妍.4-氨基安替比林直接光度法测定污水中高浓度挥发酚[J].干旱环境监测,2012,31(3):59-61.
[5]ArslanG,YaziciB,ErbilM.TheeffectofpH,temperatureandconcentration on electrooxidation of phenol[J].Journal of Hazardous Materials,2005,124(1/2/3):37-43.
[6]Wu Di,Liu Miao,Dong Deming,et al.Effects of some factors during electrochemical degradation of phenol by hydroxyl radicals[J].Sciense Direct,2007,85(2):250-256.
[7]Bielicka-Daszkiewicz K,Krawczyk P,Nowicka K.Examination of benzoquinone electrooxidation pathway as crucial step of phenol degradation process[J].Electrochimica Acta,2012,80(10):22-26.
[8]Yahiaoui I,Aissani-Benissad F,Fourcade F,et al.Response surface methodology for the optimization of the electrochemical degradation of phenol on Pb/PbO2electrode[J].Environmental Progress&Sustainable Energy,2011,31(4):515-523.
[9]陈锡赘,魏学军,林先燕,等.中心组合设计—响应面法优化天冬多糖提取工艺[J].黔南民族医专学报,2011,24(4):238-241.
Experimental study on the home-made lead oxide electrode for the degradation of phenol
Jin Yifang,Yu Ping,Luo Yunbai
(College of Chemistry and Molecular Sciences,Wuhan University,Wuhan 430000,China)
Using titanium plate as substrate,and SnO2+Sb2O5as an intermediary,the lead oxide electrode for electrochemical degradation of phenol is made.The experimental results show that the homemade electrode has very good phenol removing effect.When the room temperature is 15℃,electrode spacing 15 mm,current density 16 mA/cm2,pH 6.3,and conductive medium Na2SO4concentration 0.25 mol/L,300 mL of phenol,whose initial mass concentration is 100 mg/L,is electrolyzed for 4 h,the removing rate can reach 91.89%.The influences of the factors,such as initial concentration of phenol,pH,conductive medium,current density,electrode spacing,etc.on the phenol degradation process are studied.On the basis of these results,the three factors that have more influences on phenol degradation,including initial concentration,pH and current density,are optimized,by response surface method,interactive influence and single-factor influence.The results show that the interactive influences of the three are not obvious.The initial concentration of phenol has the largest influence,and pH has the least influence.It is in line with the analytical result of single factor influence.
homemade lead oxide electrode;phenol;electrochemical degradation;response surface method
X703.1
A
1005-829X(2016)05-0055-05
金贻芳(1992—),硕士。E-mail:2014202030140@whu. edu.cn。
2016-02-17(修改稿)

