Lactobacillus plantarumA491的筛选及其在苜蓿青贮中的应用研究
郭琳娜,王雁萍,汤明威,杨慧晓,赵珊珊,杨逢源
(郑州大学 河南省离子束生物工程重点实验室,河南郑州450001)
科学实验研究
Lactobacillus plantarumA491的筛选及其在苜蓿青贮中的应用研究
郭琳娜,王雁萍*,汤明威,杨慧晓,赵珊珊,杨逢源
(郑州大学 河南省离子束生物工程重点实验室,河南郑州450001)
为筛选适合苜蓿青贮用乳酸菌,本研究对64株苜蓿附生乳酸菌进行多糖利用能力的考察,结果显示有5株乳酸菌能较好利用葡聚糖和木聚糖产酸,进一步的抑菌活性试验筛选出对李斯特氏菌、大肠杆菌和沙门氏菌都有较好抑菌活性的菌株A491。通过生理生化试验、16S rRNA基因序列分析及recA基因扩增试验将筛选菌株A491鉴定为植物乳杆菌(Lactobacillus plantarum)。将菌株A491进行苜蓿青贮应用研究,青贮95 d后,与自然青贮和添加商业添加剂的处理组相比,添加菌株A491处理组的乳酸含量较高(P<0.05),而pH较低(4.62)(P<0.05),有害菌较少,发酵品质较好。表明菌株A491在苜蓿青贮中具有潜在的应用价值。
乳酸菌;葡聚糖;木聚糖;抑菌活性;苜蓿;青贮
[Abstract]To screen the lactic acid bacteria for alfalfa silage,64 strains of lactic acid bacteria were isolated from alfalfa and their ability of polysaccharide utilization were measured.The results showed that 5 strains could use glucan and xylan to produce acid,and their antimicrobial activity were measured.A491 was selected by its excellent antimicrobial activity of Listeriosis,Escherichia coli and Salmonella enterica.The physiological and biochemical identification,sequence analysis of 16S rRNA and recA gene amplification experiments indicated that A491 was Lactobacillus plantarum.A491 and commercial inoculants were selected on alfalfa silage as additives.After 95 days,the silages inoculated with strain A491 presented better fermentation quality,with higher contents of lactic acid(P<0.05)and lower pH values(4.62)(P<0.05),less harmful bacteria,compared with the control and the silages inoculated with commercial inoculants.A491 showed the potential application value in alfalfa silage.
[Key words]lactic acid bacteria;glucan;xylan;antimicrobial activity;alfalfa;silage
紫花苜蓿(Medicago sativa)是一种大面积种植的经济饲草,青贮处理可使其具有较高的营养价值。在青贮过程中,乳酸菌将可溶性糖转化为乳酸,降低pH,抑制有害微生物生长(Pang等,2012)。然而,通常苜蓿自然附生的乳酸菌数量较少,可溶性糖含量低(3.07%~4.56%)(Jones等,1992),虽然胞壁结构性糖(主要是葡聚糖及木聚糖成分)含量丰富,但不易被利用(单春乔等,2009)。传统的青贮乳酸菌基本属于利用可溶性糖的乳酸菌,因此,筛选出能够分解利用植物细胞壁结构性糖并具有较好抑菌活性的乳酸菌作为青贮添加剂,可以改善可溶性糖含量低、大量有害菌附生的发酵状况,进而提高苜蓿青贮的品质,具有较高的实用价值。
苜蓿自然附生乳酸菌对其材料本身具有较好的生长适应性。本试验旨在从苜蓿附生乳酸菌中筛选能利用葡聚糖和木聚糖产酸且抑菌效果较好的优良菌株,研究其作为添加剂对苜蓿发酵品质和营养价值的影响,为青贮应用提供参考。
1 材料与方法
1.1试验材料
1.1.1供试菌株和苜蓿材料供试乳酸菌菌株共64株,分离自紫花苜蓿样品,均为实验室保存;青贮苜蓿样品:在河南郑州收获的品种为三得利的初花期苜蓿;混合多种乳酸菌,分离自亚芯苜蓿草专用青贮剂(购置于台湾亚芯生物科技有限公司)。
1.1.2抑菌试验的指示菌株沙门氏菌(Salmonella enterica)、大肠杆菌(Escherichia coli)、李斯特氏菌(Listeriosis),均为实验室保存。
1.1.3recA基因扩增试验用到的标准菌株Lactobacillus(L).casei JCM 16167T、L.paraplantarum DSM 10667T、L.pentosus JCM 1558T、L.plantarum JCM 1149T、L.argentoratensis JCM 16169T。
1.1.4试剂及培养基MRS培养基、NA培养基、PDA培养基、EMB培养基、CLO培养基、1%葡聚糖溶液 (Dextran MW:10000,BR 99%)、1%木聚糖溶液(Xylan MW:10000,BR 99%)、过氧化氢酶和API 50。
1.2试验方法
1.2.1利用多糖产酸乳酸菌的筛选将菌株分别接种于1%葡聚糖或1%木聚糖溶液中,30°C培养24 h,测定pH,不加菌的1%葡聚糖或1%木聚糖溶液作为对照组。
1.2.2抑菌活性的测定采用牛津杯双层平板法进行乳酸菌发酵上清液抑菌试验(石金舟,2005)。
1.2.3乳酸菌的鉴定根据乳酸菌生理生化特性、碳源发酵特性和16S rRNA的基因序列进行初步鉴定(Pang等,2011),根据recA基因扩增产物对乳杆菌进行进一步鉴定(Torriani等,2001)。
1.2.4苜蓿青贮饲料的制作收割后的初花期苜蓿材料在室温晾晒至水分在60%左右,将切成2 cm左右长短的100 g苜蓿材料放入青贮袋中,每个青贮袋中加入100 μL乳酸菌菌液,混匀,抽真空后密封,室内25°C放置。其中,不加菌的青贮饲料作为对照(Ni等,2015)。
1.2.5微生物分析将10 g饲料样品加入到90 mL无菌蒸馏水中,振荡混匀,10倍梯度稀释,取10-1、10-3和10-5倍稀释液各20 μL,分别涂布于各培养基。乳酸菌用MRS培养基计数,霉菌和酵母菌用PDA培养基计数,大肠杆菌用EMB培养基计数,好氧菌用NA培养基计数;取10-1和10-2倍稀释液各1 mL,于75℃水浴锅加热15 min后,取20 μL涂布于CLO培养基,用于梭状芽孢杆菌计数。MRS培养基和CLO培养基需放置于厌氧培养装置,其他培养基放置于普通恒温培养箱,30℃静置培养48 h(Ni等,2015)。
1.2.6青贮饲料的发酵品质和化学成分分析用0.45 μm滤纸过滤10-1稀释液,通过抽提发酵产物测定其pH值及有机酸成分并处理数据。将适量的青贮饲料样品置于65℃烘箱48 h,烘干水分后粉碎,进行中性洗涤纤维、酸性洗涤纤维、粗脂肪、粗灰分和粗蛋白质的成分分析并处理数据(Ni等,2015)。
2 结果与分析
2.1利用多糖产酸乳酸菌的筛选从64株供试乳酸菌中筛选到5株菌在仅含1%葡聚糖或1%木聚糖的溶液中产酸较好,结果如表1所示。这5株菌在两种溶液中均能产酸降低溶液的pH值。其中在葡聚糖溶液中产酸较好的菌株是A519和A528,在木聚糖溶液中产酸较好菌株的是A491和A500。

表1 乳酸菌在1%葡聚糖或1%木聚糖溶液中发酵24 h的pH
2.2乳酸菌的抑菌活性在指示菌相同浓度下,筛选的 5株菌中有 3株菌(A491、A502、A528)对李斯特氏菌、大肠杆菌和沙门氏菌有较好的抑制作用,其中对三种指示菌抑制作用最好的菌株是A491(图1)。
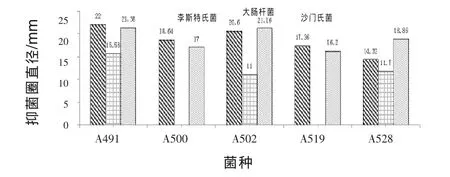
图1 乳酸菌的抑菌活性
2.3优良菌株的菌种鉴定对菌株A491进行生理生化指标的测定。结果表明,A491是革兰氏染色阳性、过氧化氢酶反应阴性的同型发酵杆菌;能够在5~45℃温度范围生长,在50℃条件下生长微弱;能够在NaCl浓度≤6.5%(m/V)的环境中生长;能够在pH 3.0~9.0条件下生长。
碳源发酵结果表明,A491能够利用的碳源较广泛,能够很好地利用L-阿拉伯糖、核糖、半乳糖、葡萄糖、果糖、甘露糖、甘露醇、山梨醇、α-甲基-D-甘露糖苷、N-乙酰-葡糖胺、苦杏仁苷、熊果苷、七叶灵、柳醇、纤维二糖、麦芽糖、乳糖、蜜二糖、蔗糖、海藻糖、棉子糖等,微弱利用赤癣醇、D-阿拉伯糖、D-木糖、山梨糖、α-甲基-D-葡萄糖苷、菊糖、松三糖、拢牛儿糖、葡萄糖酸盐。
将菌株A491的16S rRNA(约1500 bp)基因序列在GeneBank中使用Blast程序进行比对,结果表明,菌株A491与多株植物乳杆菌的16S rRNA基因序列相似性达99%以上。将其序列使用MEGA 5.02软件,采用Neighbor-joining法构建系统进化树(图2)。
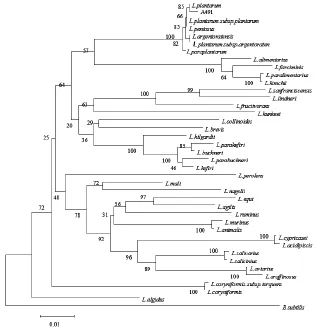
图2 菌株A491的16S rRNA序列系统进化树
将菌株A491的rccA基因组扩增产物和标准菌株比对,结果如图3所示。菌株A491的扩增条带与标准菌株 Lactobacillus plantarum JCM 1149T一样扩增出318 bp的产物。所以将A491鉴定为Lactobacillus plantarum。
根据形态学、生理生化特性、碳源发酵特性、16S rRNA基因序列以及recA基因扩增,将筛选的菌株A491鉴定为植物乳杆菌。
2.4苜蓿样品营养成分及微生物含量分析苜蓿收割后立即进行营养成分和微生物含量分析,苜蓿样品的pH值为5.89,在室内晾晒12 h后水分含量约为69.83%。粗蛋白质、粗脂肪、粗灰分、酸性洗涤纤维及中性洗涤纤维含量如表2所示。在该苜蓿样品中乳酸菌、好氧菌、大肠杆菌、酵母菌含量较丰富,并含有一定量的霉菌。
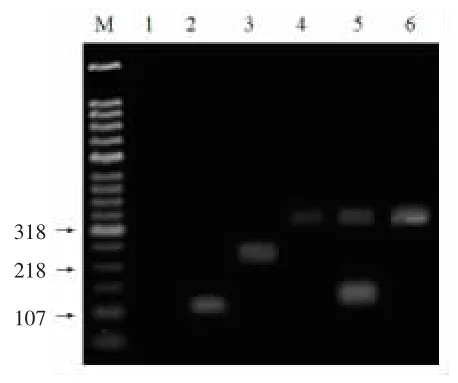
图3 菌株A491的recA基因扩增产物

表2 青贮前苜蓿样品的化学成分及微生物多样性分析
2.5苜蓿青贮饲料青贮品质分析以不加菌的自然青贮作为对照,各组青贮95 d时微生物含量如表3所示。三个处理中的酵母菌和梭状芽孢杆菌数量均低于检测线。除对照的自然青贮中检测到霉菌,其他处理组中均未检测到霉菌。与对照组和商业添加剂处理组相比,A491处理组中乳酸菌和大肠杆菌数量较少,未检测到好氧菌。
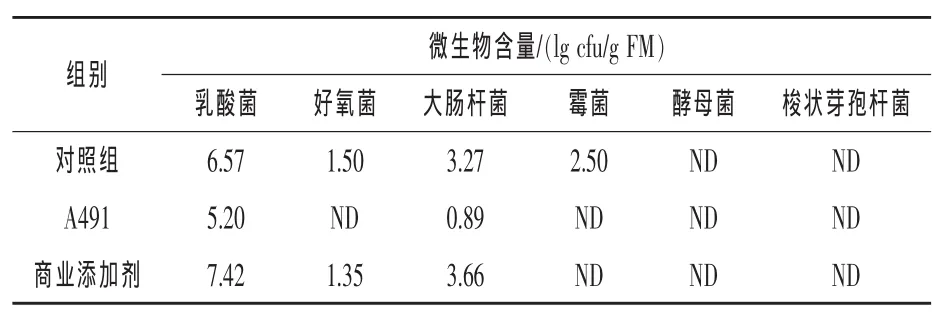
表3 青贮95 d各组微生物多样性分析
青贮95d后各组发酵品质和化学成分分析结果如表4所示。与对照组和商业添加剂处理组相比,A491处理组的pH值较低(P<0.05),有机酸中乳酸含量较高(P<0.05),乙酸含量差异不显著(P>0.05),未检测到丙酸和丁酸;化学成分中粗脂肪含量较高(P<0.05),DM、粗蛋白质、中性洗涤纤维和酸性洗涤纤维含量差异不显著 (P>0.05)。与对照组和A491处理组相比,商业添加剂处理组的粗灰分含量较高(P<0.05)。
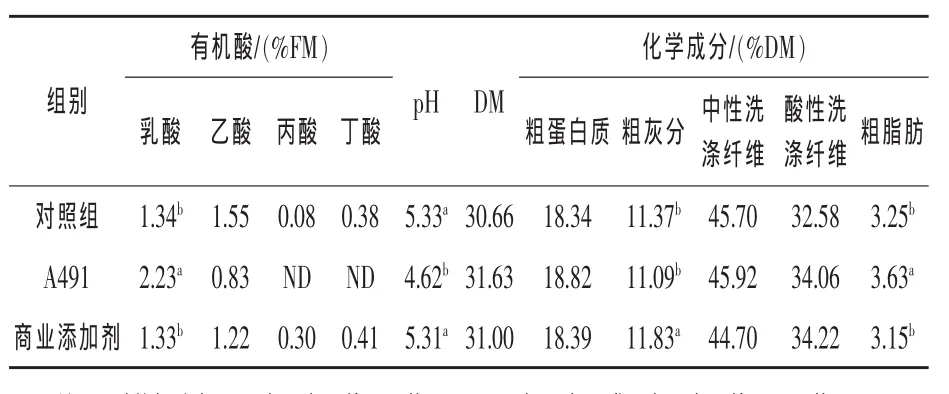
表4 青贮95 d各组发酵品质和化学成分分析
3 讨论
植物细胞壁结构性糖主要成分是纤维素和半纤维素,分别由葡聚糖和木聚糖组成。研究发现,添加纤维素酶更有利于乳酸菌发酵(李希茜等,2009),但使用纤维素酶的成本较高。由于生存适应性,一些植物附生乳酸菌的糖代谢会发生相应改变,也能分解葡聚糖和木聚糖等植物细胞壁多糖,有的还能够利用木糖发酵产生乳酸(Siezen等,2008)。因此,筛选能够利用结构性糖的乳酸菌具有可行性,其应用于苜蓿青贮具有使用方便和经济的特点。
本研究通过比较发酵葡聚糖和木聚糖纯溶液性能对供试乳酸菌进行筛选,发现乳酸菌利用葡聚糖和木聚糖产酸能力普遍较弱,但菌株间存在差异,从中筛选到对葡聚糖和木聚糖均有一定利用能力的菌株A491,该菌株发酵木聚糖纯溶液性能最好,这与其在碳源发酵试验中可利用的碳源较多,包括纤维二糖和D-木糖的结果相符。
新鲜苜蓿表面附着大量有害菌,尤其是大肠杆菌较多(McGarvey等,2013)。本研究考察了筛选菌株对革兰氏阳性菌中的李斯特氏菌、革兰氏阴性菌中的沙门氏菌和大肠杆菌的抑菌效果。发现A491对三种指示菌的抑菌活性均最强,应用在青贮饲料中有利于降低腐败的风险。
苜蓿青贮结果显示,在青贮95 d时,A491处理组、商业添加剂处理组及自然青贮的对照组与青贮前的苜蓿样品相比pH均有所降低。与对照组和商业添加剂处理组相比,A491处理组在青贮95 d时乳酸菌数量较低,可能与A491处理组在青贮15 d内乳酸菌数量均较高,可利用碳源消耗较大,使得青贮后期用于乳酸菌生长的碳源不足,致使数量减少有关(数据未给出)。添加A491进行苜蓿青贮,青贮饲料pH值较低,大肠杆菌数量较少,霉菌数量低于检测线,能够有效改善青贮品质,这可能与菌株A491具有一定的结构性糖利用能力以及较好的抑菌活性有关。本研究中,自然青贮95 d开封时也无酸臭气味,腐败不明显,这与检测到丁酸含量较低的结果相符,可能与苜蓿材料本身的品质和袋装青贮的厌氧条件控制较好有关。
4 结论
从64株苜蓿附生乳酸菌中筛选出能够利用葡聚糖和木聚糖发酵产酸并具有较好抑菌活性的乳酸菌菌株A491,其在苜蓿青贮中应用发酵品质较好。试验结果对青贮用乳酸菌的开发具有一定的参考价值。
[1]李希茜,韩建国,玉柱.添加剂对紫花苜蓿青贮发酵品质和体外消化率的影响[J].中国奶牛,2009,8:20~24.
[2]单春乔,张琪,秦淑杰,等.产纤维素酶芽饱菌在动物生产上的应用研究[A].中国畜牧兽医学会动物传染病学分会,中国畜牧兽医学会家畜传染病分会第七届全国会员代表大会暨第十三次学术研讨会论文集[C].中国畜牧兽医学会动物传染病学分会,2009.4.
[3]石金舟.产细菌素乳酸菌的筛选鉴定和细菌素发酵条件的研究:[硕士学位论文][D].合肥:安徽农业大学,2005.
[4]Jones B A,Satter L D,Muck R E.Influence of bacterial inoculant and substrate addition to lucerne ensiled at different dry matter contents[J].Grass and Forage Science,1992,47(1):19~27.
[5]McGarvey J A,Franco R B,Palumbo J D,et al.Bacterial population dynamics during the ensiling of Medicago sativa(alfalfa)and subsequent exposure to air[J].Journal of Applied Microbiology,2013,114(6):1661~1670.
[6]Ni K K,Wang YP,LiDX,,et al..Characterization,identification and application of lactic acid bacteria isolated from forage paddy rice silage[J]. PLOS ONE,2015,10(3):e0121967.doi:10.1371/journal.pone.0121967.
[7]Pang H L,Tan Z F,Qin G Y,et al.Phenotypic and Phylogenetic Analysis of Lactic Acid Bacteria Isolated from Forage Crops and Grasses in the Tibetan Plateau[J].The Journal of Microbiology,2012,50:63~71.
[8]Pang H L,Zhang M,Qin G Y,et al.Identification of lactic acid bacteria isolated from corn stovers[J].Animal Science Journal,2011,82,642~653.
[9]Siezen R J,Starrenburg M J,Boekhorst J,et al.Genome-scale genotypephenotype matching of two Lactococcus lactis isolates from plants identifies mechanisms of adaptation to the plant niche[J].Applied and Environmental Microbiology,2008,74(2):424~436.
[10]Torriani S,Felis G E,Dellaglio F.Differentiation of Lactobacillus plantarum,L.pentosus,and L.paraplantarum by recA gene sequence analysis and multiplex PCR assay with recA gene derived Primers[J].Appl Environ Microbiol,2001,67:3450~3454.■
S816.7
A
1004-3314(2016)11-0006-04
10.15906/j.cnki.cn11-2975/s.20161102
河南省重点科技攻关项目(152102110045、152102310064);河南省基础与前沿技术研究项目(162300410131);郑州大学研究生教学改革项目(YJSJY201407);郑州大学大学生创新创业训练计划项目(2015xjxm165)

