乳腺实性乳头状癌的临床病理分析
张爱兵 李 俊
江苏省高邮市人民医院病理科 高邮 225600
乳腺实性乳头状癌的临床病理分析
张爱兵李俊
江苏省高邮市人民医院病理科高邮225600
乳腺肿瘤;实性乳头状癌;临床病理
乳腺实性乳头状癌(solid papillary carcinoma,SPC)是一种少见的、恶性程度较低的肿瘤,组织学上表现为肿瘤细胞紧密排列成膨胀的、界限清楚的结节,结节内的乳头血管轴心纤细且不明显,在低倍镜下看似实性结构,部分结节外周缺乏肌上皮,常有神经内分泌分化和伴细胞内、外黏液,部分肿瘤也可呈浸润性生长[1]。由于SPC发病率低、国内外对其相关研究较少,故其免疫表型、分子遗传学特征和生物学行为目前尚未被充分认识。本文收集3例SPC临床病理资料,查阅相关文献后对其临床病理特征、鉴别诊断及预后进行探讨,旨在提高对SPC的认识。
1 资料与方法
收集江苏省高邮市人民医院经病理确诊的乳腺SPC标本3例。标本经10%中性福尔马林固定,常规脱水,石蜡包埋,厚4 μm切片,行苏木精-伊红(HE)染色。光镜观察肿瘤组织形态。免疫组化染色采用En Vision两步法,微波修复,所用抗体ER、PR、C-erbB2、p63、Calponin、CK5/6、Ki-67、CgA、Syn及免疫组化试剂盒均购自上海基因科技试剂公司。所用抗体均为工作浓度,设阴性和阳性对照。结果判断标准为:只要肿瘤细胞核出现棕褐色或黄色颗粒则视为ER和PR阳性,按照染色强弱依次分为+++、++和+;C-erbB-2为细胞膜着色,依据细胞膜着色的完整性和染色强度分为0(无表达)、+、++、+++;Ki-67为细胞核着色,阳性着色的肿瘤细胞占肿瘤细胞的百分比,为Ki-67的阳性指数;p63为细胞核着色,Calponin、CK5/6、CgA和Syn为细胞质着色,≥10%的肿瘤细胞在有效着色部位着色视为阳性。
2 结果
2.1临床资料例1,女,68岁,发现乳头溢液3天。查体:右侧乳房乳头内上方可扪及一约2.0 cm×1.5 cm肿块,质地中等,活动度尚可,界限欠清。乳腺钼靶片示乳腺癌。术中冰冻诊断为实性乳头状癌,患者家属考虑到患者年龄偏大、肿瘤恶性程度较低而拒行乳腺癌改良根治术。术后密切随访,4个月后患者于原切口附近发现一直径0.8 cm质硬结节而再行肿块切除术,术后病理同第1次。例2,女,47岁,发现右侧乳房肿块2月余就诊。B超示:右侧乳房乳头外上见1.7 cm×1.2 cm的低回声团块,边界尚清,形态欠规则,内未见异常彩色血流,考虑为乳腺增生性病变而行肿块切除术,术后病理诊断为实性乳头状癌。后行单纯乳房切除术,术后辅助化疗4疗程。例3,女,74岁,因乳头溢液1周就诊。B超示:左侧乳房内侧见1.8 cm×1.5 cm的低回声团块,边界欠清,形态不规则,呈分叶状,内见短线状血流信号,提示为乳腺癌。术中冰冻病理诊断为实性乳头状癌,遂行乳腺癌改良根治术,术后辅以化疗。3例患者随访6~48个月(平均25.8个月),例1患者于术后4月复发再次行肿块切除术,术后继续随访至今与另2例患者均无瘤生存。
2.2病理检查巨检:例1送检灰红色组织一块3.0 cm×2.5 cm,切面见一灰褐色囊实性肿块2.0 cm×1.5 cm,囊内含暗褐色液体,肿块质地中等,界欠清;第二次送检组织间见一直径0.8 cm质硬灰红色结节。例2送检3.0 cm×2.5 cm组织一块,切面见一灰红色肿块1.5 cm×1.3 cm,实性,部分区域半透明、胶冻样。例3送检肿块一个2.0 cm×1.5 cm,切面实性,灰黄色、局部黏冻样。
本组3例镜检形态基本相同,最显著的特点是在实性乳头状病变的基础上出现不同程度的黏液分泌。肿瘤细胞在乳腺终末导管小叶单位内膨胀性生长,充填部分至整个导管腔,形成实性片状结构(见图1),因肿瘤细胞黏附性强,乳头状结构不明显,但可见围绕透明样化的纤维血管轴心呈栅栏状或玫瑰花样排列,形成假菊形团样结构(见图2)。细胞外黏液量多少不等,分割瘤细胞呈不规则簇状或沉积于纤维血管轴心,或以黏液湖形式出现在肿瘤细胞群中(见图3),使得瘤细胞围绕血管的乳头状结构不明显,但在没有黏液的区域仍可见到乳头状结构。肿瘤细胞形态较温和,呈卵圆形、多边形或梭形,印戒状(因细胞核受细胞内黏液挤压而成)或浆细胞样。细胞界限多较清楚,镶嵌状排列,胞质较丰富,嗜酸或淡染。胞核居中或偏位(浆细胞样)(见图4),圆形或短梭形,核染色质多细致淡染,可见小而居中的核仁。肿瘤细胞核轻度或中度异型,核分裂象不活跃且分布不均,偶见病理性核分裂象。所清扫腋窝淋巴结均未见癌转移。
免疫组化染色结果:3例肿瘤细胞ER、PR均呈弥漫性强阳性表达,CgA及Syn(见图5)不同程度的阳性表达,Ki-67阳性指数3%~12%,具体免疫组化染色结果见表1。
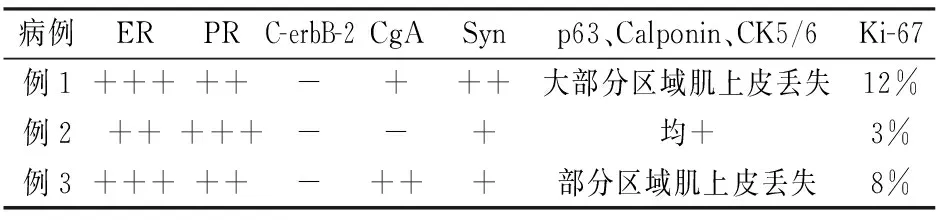
表1 3例SPC的免疫组化结果
注:“-”代表阴性;“+”代表阳性
3 讨论
乳腺SPC由Maluf和Koerner1995年首先提出,文献报道其发病率仅为1.7%[2],2003年版WHO乳腺肿瘤组织学分类将其归入导管内乳头状癌的实体变型[3],2012年版WHO乳腺肿瘤组织学分类中“导管内乳头状病变”增加了SPC这一类型,并视其为乳头状癌的一个独立实体而加以单独描述[1,4]。
3.1临床特征SPC好发于60岁以上老年女性,文献报道<50岁的患者最高占比为5%。乳头血性或浆液血性溢液和(或)乳腺肿块是SPC的主要临床表现。超声检查中90%的恶性乳头状病变为实性、边界清楚的低回声不均质团块,本组患者符合此特点。病变部位以乳头和乳晕周围2 cm以内的乳腺组织为主,部分患者表现为导管内乳头状肿瘤,可伴有导管扩张或积液。SPC临床预后良好,即使伴有浸润者也是如此,但也有转移的报道[5],故肿块局部扩大切除应慎行,本组例1患者行肿块局部扩大切除术后4个月复发。
3.2病理特征
3.2.1巨检肿瘤周边可见到纤维性包膜,切面常呈灰褐色或灰黄色,部分因血液外溢可形成囊性腔隙,囊内常含有暗褐色液体。部分呈灰白色质地较硬肿块,特别是伴有浸润性癌时。
3.2.2镜检SPC镜下诊断要点如下:①肿瘤细胞在乳腺终末导管小叶单位内膨胀性生长,充填部分至整个导管腔,形成圆形、卵圆形或不规则形界限清楚的结节状团块。团块间见纤细的、伴有不同程度玻璃样变性的纤维血管轴心,此种纤维血管间隔也是其命名为乳头状癌的理由[4],轴心周围的细胞呈栅栏状或假菊形团样排列;②肿瘤细胞形态较温和,呈卵圆形、多边形、梭形,印戒状或浆细胞样,胞质较丰富,嗜酸或淡染;③常常伴有细胞内或细胞外黏液分泌和神经内分泌分化,但并非诊断SPC所必需[1,4],当存在大片状黏液中漂浮破碎或不规则腺管时,应考虑合并浸润性黏液癌[4];④SPC的肿瘤细胞还可以派杰样方式累及其周围导管壁以及导管内乳头状瘤,有些导管腔面可见残留扁平的非肿瘤性上皮。部分病例可见经典型导管内乳头状瘤被SPC的肿瘤细胞所累及[5,6]。
3.2.3免疫组化大部分SPC病例ER和PR阳性、C-erbB-2阴性;肿瘤细胞不表达基底型CK(如34βE12、CK5/6和CK14等),只有残留的腺上皮、部分乳头轴心和导管周缘肌上皮可以表达基底型CK;肌上皮标记p63和Calponin染色大部分SPC病例显示乳头轴心和导管周缘肌上皮阳性,其表达可呈灶性阳性或分散非完整性,也可呈连续完整阳性;神经内分泌标记(如CgA、Syn和NSE等)阳性是SPC的重要特点,它有助于确诊SPC,但并非诊断所必需[6、7]。本组免疫组化检测结果与文献报道相同。
3.3诊断及鉴别诊断虽然诊断名称是乳头状癌,但SPC的乳头结构常被血管周的黏液所掩盖,加之瘤细胞异型性不明显,导致SPC诊断困难。当乳腺肿瘤中出现伴有血管周黏液、实片状、核异型性很小的肿瘤性细胞巢时,首先应想到SPC可能。SPC可以伴有浸润,以伴神经内分泌分化的癌和黏液癌最常见,也可以是非特殊型浸润性乳腺癌和浸润性小叶癌,此时病理诊断应体现浸润癌的范围和具体类型[8]。有时准确区分实性乳头状癌是原位病变或是浸润性病变存在一定的困难,对于某些膨胀性生长的结节,但周围缺乏肌上皮时应该如何准确分类目前尚存在争议[9,10]。
SPC主要的鉴别诊断是:①小叶原位癌,当小叶原位癌呈实片状改变时,可出现类似于SPC的单一的浆细胞样和印戒样细胞,但细胞缺乏黏附性,无实性乳头状结构,不表达E-cadherin及CgA、Syn可鉴别。②导管内乳头状瘤:亦可见纤维血管轴心,但围绕在轴心周围的细胞一般不成栅栏状,增生的腺上皮排列杂乱无章、缺乏极性,不易见到细胞内外黏液,免疫组化提示肿瘤细胞可以表达CK5/6 和CK14,一般不表达神经内分泌标记。③乳腺肌上皮肿瘤:瘤细胞可呈梭形、透明细胞样或浆细胞样,且往往产生细胞外基质,但缺乏细胞外黏液,肿瘤细胞S-100蛋白、p63、CD10和SMA等阳性,而SPC则为阴性。④神经内分泌癌:典型神经内分泌癌缺乏血管周黏液和乳头状结构,SPC表达内分泌标记物只能说明其有神经内分泌分化。⑤黏液癌:由于SPC经常合并黏液癌且黏液癌发病率远远高于SPC,因此合并存在时SPC成分往往被忽略。但黏液癌可发生在各个年龄段,大体观察切面浸润且有反光现象,镜下表现为黏液湖中漂浮不规则腺管或小的实性细胞岛(一种特殊的浸润方式)。
综上所述,乳腺SPC在临床特点、病理形态学以及免疫表型上都具有其独特的特点,应作为一种特殊的乳腺癌类型。本组随访资料显示SPC恶性程度较低、预后良好,包括本组例1患者术后4月复发再次手术后均无瘤生存至今,平均随访时间25.8(6~48)个月。尽管乳腺SPC在病理形态学上很有特征,但其诊断还得结合免疫组化共同确定。当大部分细胞均显示CgA和Syn、NSE阳性时,可以作出明确诊断。由于目前国内外鲜有SPC的大宗病例报道,对于其免疫表型、分子遗传学特征、生物学行为以及预后均有待进一步研究。
[1] Lakhani S R,Ellis I O,Schnitt S J,et al.WHO classification of tumours of the breast[M].4th ed.Lyon: IARC Press,2012:108-109.
[2] Otsuki Y,Yamada M,Shimizu S,et al.Solid-papillary carcinoma of the breast:clinicopathological study of 20 cases[J].Pathol Int,2007,57(7):421-429.
[3] Tavassoli F A,Devilee P.World Health Organization classification of tumours.Pathology and genetics of tumours of the breast and female genital organs[M].Lyon:IARC Press,2003:35-36.
[4] 杨文涛,朱雄增.2012版WHO乳腺肿瘤分类解读[J].中华病理学杂志,2013,42(2):78-80.
[5] 李香丹,杨文涛,孙抒,等.乳腺实性乳头状癌73例临床病理诊断[J].临床与实验病理学杂志,2010,26(1):35-39.
[6] 魏兵,步宏,陈卉娇,等.乳腺实体型乳头状癌的临床病理研究[J].中华病理学杂志,2006,35(10):589-593.
[7] 钟定荣,孙萍萍,梁智勇.乳腺实性乳头状癌22例临床病理分析[J].诊断病理学杂志,2010,17(3):165-168.
[8] 罗华荣,徐铖,郑海红,等.乳腺实性乳头状癌的临床病理特征[J].温州医科大学学报,2015,45(5):364-368.
[9] 刘标,周晓军.解读2012年WHO乳腺肿瘤分类[J].临床与实验病理学杂志,2012,28(11):1185-1187.
[10] 张立英,皋岚湘,丁华野,等.乳腺实性乳头状癌临床病理分析[J].临床与实验病理学杂志,2015,31(9):971-975.
R737.9
B
1001-9510(2016)04-0309-04
2016-05-10)
张爱兵,E-mail:1027675391@qq.com

