木犀草素预处理对大鼠肾脏缺血再灌注损伤的保护作用*
苏庆国 蔡虹静 张 冰 梅延辉 曹景源
1 滨州医学院附属医院泌尿外科 滨州 256603;2 滨州医学院基础医学院病理生理学教研室
木犀草素预处理对大鼠肾脏缺血再灌注损伤的保护作用*
苏庆国1蔡虹静2张冰1梅延辉1曹景源1
1 滨州医学院附属医院泌尿外科滨州256603;2 滨州医学院基础医学院病理生理学教研室
目的研究不同剂量木犀草素预处理对大鼠肾脏缺血再灌注的影响,并探讨其可能的机制。方法将雄性SD大鼠随机分为5组(n=10),即假手术组、缺血再灌注(IRI)组、木犀草素低剂量组、木犀草素中剂量组、木犀草素高剂量组,采用无创动脉夹夹闭双侧肾蒂22 min后松开恢复血流的方法复制肾缺血再灌注损伤动物模型。木犀草素预处理组分别在术前1周开始给予木犀草素灌胃,剂量由低到高分别为50 mg/(kg·d-1)、100 mg/(kg·d-1)、200 mg/(kg·d-1),假手术组和IRI组给予等体积生理盐水灌胃。再灌注24 h后分别检测各组血清中尿素氮(BUN)、肌酐(Cr)含量、肾组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性、MDA含量及血清中TNF-α、IL-6含量,并观察肾组织HE染色病理改变。结果与IRI组比较,木犀草素预处理各组血清BUN、Cr含量明显降低(P<0.01),肾组织中SOD 和GSH-Px活性明显增高(P<0.05或P<0.01),MDA含量显著降低(P<0.05或P<0.01),血清TNF-α、IL-6含量明显降低(P<0.05或P<0.01),并呈剂量—效应关系。IRI组肾组织切片光镜下可见大量肾小管上皮细胞肿胀、坏死,肾间质高度充血、炎细胞浸润,木犀草素预处理各组肾组织病变减轻较明显。结论木犀草素预处理可以抑制氧化应激,减少炎症因子释放,对IRI大鼠肾脏有明显的保护作用。
木犀草素;肾脏缺血再灌注损伤;氧化应激
肾脏缺血再灌注损伤(renal ischemia reperfusion injury, RIRI)是临床上常见的病理过程,多发生于急性大量失血、中毒性休克、急性肾损伤、肾血管手术、肾脏移植等过程中[1],可导致急性肾衰竭,甚至危及生命。肾脏是高灌注器官,对缺血缺氧比较敏感,所以早期的再灌注治疗是挽救肾脏功能的重要策略。但是再灌注本身也可能对肾脏造成更严重的损伤,称为缺血再灌注损伤(ischemia reperfusion injury, IRI)。研究表明,其发生机制与活性氧的大量生成导致蛋白质、脂质、染色体的过氧化损伤[2-3],细胞内钙超载,白细胞激活导致大量炎症因子释放等方面密切相关,抗氧化、抑制炎症反应等措施在一定程度上有助于预防或减轻缺血再灌注损伤的发生。
木犀草素(毛地黄黄酮,luteolin)是一种具有代表性的天然黄酮,属弱酸性四羟基黄酮类化合物,黄色结晶粉末,可溶于乙醚、甲醇、乙醇等有机溶剂及碱性溶液中,微溶于水,正常条件下稳定,广泛分布在芹菜、甜椒、辣椒、落花生等蔬菜果实及一些天然药物中[4]。木犀草素具有多种药理活性,例如抗肿瘤、抗氧化、抗炎、抗过敏、抗纤维化等作用[5]。目前研究发现,木犀草素对脑[6-7]、心肌的缺血再灌注损伤[8]均可以通过其抗氧化、抗炎等方面性质发挥保护作用,使机体的重要脏器在血液再灌注过程中损伤减轻,及时恢复功能,但对肾脏缺血再灌注损伤是否有影响尚未见报道。本实验借助大鼠肾脏缺血再灌注模型,从氧化应激和炎症反应两方面,研究木犀草素对IRI是否有保护作用,并探讨其中的机制。
1 资料与方法
1.1实验对象雄性SD大鼠50只,6周龄,体质量250~300 g,购自山东大学实验动物中心。所有大鼠均适应性喂养1周之后开始实验。
1.2试剂木犀草素(98%)购自陕西慧科植物开发有限公司,尿素氮(BUN)试剂盒、肌酐(Cr)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒、肿瘤坏死因子-α(TNF-α)试剂盒及白细胞介素-6(IL-6)试剂盒购自南京建成生物工程研究所,其余试剂均为国产分析纯。
1.3方法
1.3.1实验分组及处理雄性SD大鼠50只,随机分成5组,每组10只,分别为假手术组、缺血再灌注(IRI)组、木犀草素低剂量组、木犀草素中剂量组、木犀草素高剂量组。
手术前1周开始,木犀草素预处理的3组大鼠每天给予木犀草素灌胃1次,剂量由低到高分别为50 mg/(kg·d-1)、100 mg/(kg·d-1)、200 mg/(kg·d-1),假手术组和IRI组给予等体积生理盐水灌胃。
1.3.2模型建立肾脏缺血再灌注大鼠模型的建立参考文献方法[9],大鼠术前禁食12 h,不限饮水,用3%戊巴比妥钠(1 mL/kg)经腹腔注射进行全身麻醉后,仰卧位固定于手术台上,备皮,消毒。沿腹正中线做切口打开腹腔,上至剑突,下至耻骨联合,逐层分离暴露双侧肾脏,游离出双侧肾动脉,采用无创动脉夹夹闭双侧肾蒂,22 min后松开动脉夹,用5-0尼龙缝合线缝合腹部。再灌注24 h后进行心室取血和留取肾脏组织标本。假手术组仅切开腹腔并游离双侧肾动脉,但不结扎。手术前后情况观察:术中夹闭双侧肾动脉后,可见肾脏由鲜红色变为紫黑色,恢复血流灌注后,可见肾脏迅速由紫黑色变为鲜红色;若术后1~2 h,大鼠苏醒并逐渐恢复活动,视为造模成功。若肾脏血流恢复后颜色未恢复正常,术后3 h大鼠仍未苏醒,或术中大出血死亡,则视为造模未成功。
1.3.3检测方法再灌注24 h后分别对实验大鼠进行心室采血6~8 mL,以3 000 r/min离心后分离上层血清,测定血清中BUN、Cr含量(全自动生化分析仪),严格按照试剂盒说明书操作,用酶联免疫吸附法(ELISA)检测TNF-α、IL-6含量。取大鼠肾组织置于匀浆器中,按重量体积比加入9倍的生理盐水制备成10%的肾组织匀浆,立即放入-20℃冰箱中保存。严格按照试剂盒说明书要求,测定肾组织SOD、GSH-Px活性及MDA含量。
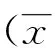
2 结果
2.1木犀草素预处理对大鼠血清BUN、Cr含量的影响与假手术组比较,IRI组大鼠血清BUN、Cr含量均出现明显增高(P<0.01);与IRI组比较,木犀草素低、中、高剂量组大鼠血清BUN、Cr含量均有显著降低(P<0.01),且有明显的剂量-效应关系(见表1)。
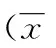
表1 各组大鼠血清BUN和Cr含量比较±s)
注:与假手术组比较,*P<0.01;与IRI组比较,△P<0.01
2.2木犀草素预处理对大鼠肾组织SOD、GSH-Px活性及MDA含量的影响与假手术组比较,IRI组大鼠肾组织抗氧化酶SOD、GSH-Px活性有明显降低(P<0.01),MDA含量明显升高(P<0.01);而木犀草素预处理各组大鼠肾组织SOD、GSH-Px活性较IRI组均有明显升高(P<0.05或P<0.01),MDA含量较IRI组也有显著降低(P<0.05或P<0.01),并呈剂量-效应关系(见表2)。
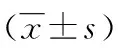
表2 各组大鼠肾组织SOD、GSH-Px活性及MDA含量比较
注:与假手术组比较,*P<0.01;与IRI组比较,△P<0.05,△△P<0.01
2.3木犀草素预处理对大鼠血清TNF-α、IL-6含量的影响与假手术组比较,IRI组大鼠血清TNF-α、IL-6含量均明显增高(P<0.01);与IRI组比较,木犀草素预处理各组大鼠血清TNF-α、IL-6含量均有明显降低(P<0.05或P<0.01),并呈剂量-效应关系(见表3)。
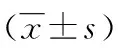
表3 各组大鼠血清TNF-α和IL-6含量比较
注:与假手术组比较,*P<0.01;与IRI组比较,△P<0.05,△△P<0.01
2.4木犀草素预处理对大鼠肾组织形态学的影响 光镜下可见假手术组肾小球、肾小管结构完整,肾间质未见明显异常。IRI组可见大量肾小管上皮细胞肿胀、坏死,部分肾小管管腔扩张,管腔内可见红细胞、细胞碎片或蛋白性液体,肾间质高度充血、炎细胞浸润较明显。木犀草素预处理各组与IRI组相比,随剂量增加肾组织病变均有明显减轻,仅见少部分肾小管管腔扩张,偶见管型,肾间质炎细胞浸润不明显。木犀草素高剂量组肾脏只有较轻微的充血,基底膜完整,结构清晰,肾小球、肾小管结构接近正常。上述各组均未见肾小球明显病理改变。
3 讨论
缺血再灌注损伤指在缺血基础上恢复血流后组织损伤反而加重,甚至发生不可逆性损伤的现象[10]。肾脏血流量非常丰富,对缺血缺氧尤其敏感,因此临床上失血性休克、急性肾脏损伤等的治疗或肾移植过程中,肾脏血流重新灌注,均可能发生IRI,导致肾功能衰竭。
研究表明,IRI是导致肾移植后早期移植物功能不全的最重要的非免疫性因素,同时它还可以增加移植器官发生急性和慢性排斥反应的机会,引起移植晚期的肾功能丧失[11]。在多种因素诱发肾小管上皮细胞损伤时,氧自由基大量产生而引起的氧化应激是主要的损伤机制[12]。通过抗氧化剂维持细胞的氧化还原平衡并保护细胞免受氧化损伤,已日益引起研究人员的关注。SOD和GSH-Px是体内抗氧化系统的重要组成部分:SOD主要通过歧化反应清除过氧化氢和超氧阴离子,从而保护细胞免受毒性氧自由基的损伤;GSH-Px可使过氧化氢分解为氧和水,对于保护细胞膜的完整和各种生物大分子的功能起到了重要的作用。MDA是氧自由基攻击细胞膜的不饱和脂肪酸,是脂质过氧化反应的产物,可反映脂质过氧化的程度。在本实验中,IRI组大鼠血清BUN、Cr水平明显升高,SOD 和GSH-Px活力降低,MDA含量增高,光镜下可见大量肾小管上皮细胞肿胀、坏死,部分肾小管管腔扩张,腔内可见蛋白性液体、红细胞或细胞碎片,提示脂质过氧化损伤。而木犀草素预处理各组大鼠血清BUN、Cr水平明显降低,肾组织中SOD和GSH-Px活性明显增高,MDA含量显著降低,并呈剂量-效应关系,肾组织形态学有明显改善,说明木犀草素可能通过增强抗氧化酶活性,减少氧自由基生成,减轻脂质过氧化,对抗氧化应激,对IRI大鼠肾脏起到保护作用。
在缺血再灌注损伤中,炎症反应同样发挥着重要作用,其中炎症细胞聚集和炎症因子释放为关键步骤。在血液重新灌注过程中,大量炎症细胞被激活,释放各种细胞因子,包括TNF-α、IL-6、IL-8等。其中,TNF-α是缺血再灌注损伤炎症反应的最主要因子,它由活化的巨噬细胞分泌,TNF-α释放增多后又可以促进更多细胞因子的释放(如IL-6等),增加细胞粘附分子的表达,影响中性粒细胞的粘附、聚集,并最终引起组织细胞的更严重损伤。因此抑制TNF-α这一主要因子的表达,在一定程度上可以抑制肾脏缺血再灌注的炎症反应,减轻炎症因子对肾脏组织细胞的损害。在本实验中,IRI组大鼠血清BUN、Cr水平明显升高,TNF-α、IL-6含量也有显著增高,光镜下可见大量肾小管上皮细胞肿胀、坏死,肾间质高度充血、炎细胞浸润明显,提示大量炎细胞激活,发生炎症反应。而木犀草素预处理各组大鼠血清BUN、Cr水平明显降低,TNF-α、IL-6含量也有显著降低,并呈剂量-效应关系,肾组织形态学有明显改善,说明木犀草素可能通过抑制炎细胞活化,减少炎症因子生成,从而抑制炎症反应,对IRI大鼠肾脏起到保护作用。
综上所述,木犀草素预处理对IRI大鼠肾脏有明显的保护作用,其机制可能与木犀草素增强抗氧化酶活性,减轻脂质过氧化,减少炎症因子生成,抑制炎症反应有关。
[1] Erdogan H,Fadillioglu E,Yagmurca M,et al.Protein oxidation and lipid pemxidation after renal ischemia reperfusion injury: Protective effects of erdostein and N-acetyl-cysteine [J].Urol Res,2006,34(1):41-46.
[2] Jacobsen D W.Homocysteine and vitamins in cardiovascular disease[J].Clin Chem,1998,44(8):1833-1843.
[3] Wald D S,Wald N J,Morris J K,et al.Folic acid,homocysteine,and cardiovascular disease:judging causality in the face of inconclusive trial evidence[J].BMJ,2006,333(7578):1114-1117.
[4] 吕畅,王红芳,阎雪莹.木犀草素抗氧化作用研究进展[J].黑龙江医药,2015,28(5):1019-1022.
[5] Yuan L,Wang J,Xiao H,et al.MAPK signaling pathwaysregulate mitochondrial-madiated apoptosis induced by isoorientin in human hepatoblastoma cancer cells[J].Food Chem Toxicol,2013,53(1):62-68.
[6] Zhang S,Qi Y,Xu Y,et al.Protecctive effect of flavonoid-rich extract from Rosa laevigata Michx on cerebral ischemia-reperfusion injury through suppression of apopotosis and inflammation[J].Neurochem Int,2003,63(5):522-532.
[7] Qiao H,Zhang X,Zhu C,et al.Luteolin downregulates TLR4,TLR5,NF-κB and p-p38MAPK expression,upregulates the p-ERK expression,and protects rat brains against focal ischemia[J].Brain Res,2012,1448 (1):71-81.
[8] 樊维娜,孙经武.木犀草素预处理对心肌缺血再灌注损伤大鼠炎症反应及细胞凋亡的影响[J].陕西中医,2015,6(11):1558-1560.
[9] 杨岳,谢席胜,艾娜,等.黄芪三七合剂对大鼠肾缺血再灌注损伤的作用及机制研究[J].华西医学,2013,28(4):500-504.
[10] 王建枝,殷莲华. 病理生理学[M].8版. 北京:人民卫生出版社,2013:152.
[11] Djamali A. Oxidative stress as a common pathway to chronic tubulointerstitial injury in kidney allografts[J].Am J Physiol Renal Physiol,2007,293(2):445-455.
[12] Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].Int J Biochem Cell Biol,2007,39(1):44-84.
Protective effects of luteolin pretreatment on renal ischemia reperfusion injury in rats
SU Qingguo1CAI Hongjing2ZHANG Bing1MEI Yanhui1CAO Jingyuan1
1 Department of Urology, Binzhou Medical University Hospital,Binzhou 256603,P.R.China;2 Department of Pathophysiology, College of Basic Medical Sciences, Binzhou Medical University
ObjectiveTo investigate the effects of different doses of luteolin pretreatment on renal ischemia reperfusion in rats, and to explore its possible mechanism.MethodsMale SD rats were randomly divided into 5 groups (n=10), the sham operation group, ischemia reperfusion (IRI) group,low dose group of luteolin,middle dose group of luteolin,and high dose group of luteolin,and we replicated renal ischemia reperfusion injury animal model by clamping bilateral renal pedicles for 22 min to restore blood flow using non-invasive artery clamp.Every luteolin pre treated groups in 1 week before the operation were respectively to given luteolin gavage dose from low to high were 50 mg/(kg·d-1),100 mg/(kg·d-1),200 mg/(kg·d-1).Sham operation group and IRI group were given volume of saline.Twenty-four hours after reperfusion,serum blood urea nitrogen (BUN), creatinine (Cr) and renal tissue superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) activity,MDA content and serum TNF-α,IL-6 content were detected.The renal tissues were stained with HE staining and pathological changes were observed.ResultsCompared with those in the IRI group,in luteolin pre treatment groups,serum BUN and Cr levels decreased significantly(P<0.01), the activity of SOD and GSH-Px increased significantly in the renal tissue(P<0.05 orP<0.01), the content of MDA decreased significantly(P<0.05 orP<0.01),serum TNF-α and IL-6 were significantly decreased(P<0.05 orP<0.01) and there was a dose-effect relationship. The renal tissue sections of IRI group by light microscopy showed a large number of renal tubular epithelial cell swelling,necrosis,renal mass degree of congestion,and inflammatory cell infiltration.In each luteolin pre processing groups,pathological changes of renal tissue were reduced significantly.ConclusionLuteolin pre treatment can inhibit the oxidative stress,reduce the release of inflammatory factors and has obvious protective effect on the kidney of IRI rats.
Luteolin,renal ischemia-reperfusion injury,oxidative stress
滨州医学院科技计划(BY2013KJ39)
蔡虹静,E-mail:caihjing81@126.com
R285
A
1001-9510(2016)04-0254-04
2016-05-09)

