半夏防御酶系对Fusariumoxysporum和Phytophthoraparasitica侵染的动态反应
孙新荣, 仲彩萍*, 裴建文, 孙万仓
(1. 甘肃省定西市渭源县农业技术推广中心,748200; 2. 天水师范学院,现代农业与陇东南动植物资源研究保护开发中心,天水 741001; 3. 甘肃农业大学农学院,兰州 730070)
半夏防御酶系对Fusariumoxysporum和Phytophthoraparasitica侵染的动态反应
孙新荣1,仲彩萍1*,裴建文2,孙万仓3
(1. 甘肃省定西市渭源县农业技术推广中心,748200; 2. 天水师范学院,现代农业与陇东南动植物资源研究保护开发中心,天水741001; 3. 甘肃农业大学农学院,兰州730070)
尖孢镰刀菌(FusariumoxysporumSchlecht)和寄生疫霉(PhytophthoraparasiticaDastur)分别为引起半夏块茎腐烂病和疫病的病原,为探索半夏在受到这2种病原侵染时的生理生化反应,采用室内盆栽方法,研究超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)5种寄主防御酶活性在块茎腐烂病和疫病发生过程中的变化趋势。结果表明,半夏在接种2种病原菌后,分别于第2天和第3天出现发病症状,第5天病情指数分别高达70.3、70.6;SOD活性都于接种后第1天达到高峰,POD活性都于接种后第3天达到高峰,CAT活性都于接种后第2天达到高峰,PAL活性分别于接种后第2天和第3天达到高峰,而PPO活性分别于接种后第3天和第4天有小幅上升。初步表明,在寄主显症之前或发病初期酶活性达到高峰的SOD、POD、CAT、PAL在半夏抗病生理机制中起着重要作用,在半夏抗病种质筛选时需要重点关注。
半夏;块茎腐烂病;疫病;防御酶
在甘肃清水县半夏规范化种植(GAP)基地,由尖孢镰刀菌(FusariumoxysporumSchlecht)侵染引起的块茎腐烂病和寄生疫霉(PhytophthoraparasiticaDastur)侵染引起的叶部疫病是危害半夏生长的主要病害。一般年份块茎腐烂病发病率为15%~30%,叶部疫病发病率高达20%以上,造成产量损失高达30%以上[1-2]。实验室前期报道了块茎腐烂病和叶部疫病病原鉴定以及药剂防治的结果。但半夏属药用植物,为确保绿色中药材生产,应以筛选、种植抗病品种作为有效的防治途径。目前国内有关半夏病害的研究报道很少,也没有鉴定出抗性材料。因此,本试验选用甘肃半夏主栽品种‘桃叶半夏’(感病品种)为试验材料,比较5种寄主防御酶活性在接种后的变化动态,初步探讨半夏接种尖孢镰刀菌和寄生疫霉后发病进程与酶活性变化之间的关系,旨在为半夏抗病品种选育中生理指标的选择提供理论依据。
1 材料与方法
1.1材料
供试半夏:选用甘肃清水县半夏GAP生产基地的主栽品种‘桃叶半夏’,3月20日种植于装有灭菌土的花盆中,每盆36株。
供试菌种:尖孢镰刀菌(F.oxysporum)和寄生疫霉(P.parasitica)由感病植株分离获得,经柯赫氏法则验证为致病菌[1-2]。
1.2方法
1.2.1接种及取样
分别于6月1日和7月5日采用灌根法和叶部针刺法将尖孢镰刀菌和寄生疫霉接种到定植于无菌土中的成株期健康半夏植株上。接种前每盆定植30株,每个处理接种3盆,每盆接种30株。分别于接种前和接种后1、2、3、4、5 d采集接种植株和对照植株叶片,每次取不同盆中发病程度一致的病叶10片,液氮处理后,-20 ℃冰箱保存待用。3次重复。
灌根接种法[3]:接种前将PSA上培养5 d的尖孢镰刀菌菌落用无菌水配成1.0×106个/mL的孢子悬浮液,每盆接种量100 mL,以无菌水灌根作为对照。3次重复。
针刺接种法[3]:预先在胡萝卜琼脂(CA)平板上培养寄生疫霉备用。接种前将种植于灭菌土中的半夏健康植株叶片用无菌水洗净,然后用70%乙醇擦洗组织表面,晾干后用灭菌针轻微刺伤叶子表皮。然后用6 mm灭菌打孔器在培养了5 d的寄生疫霉菌落边缘打取菌丝块,将菌丝块反贴到叶片上,将无菌湿棉团敷在菌丝块上,套上透光度好的白色塑料袋保湿5 d,以不接种并相同方法保湿的叶片作对照。3次重复。
1.2.2SOD、POD、PPO、CAT酶液制备与活性测定
称取0.5 g叶片,加入0.05 mol/L磷酸缓冲液(pH 7.8),在冰浴上研磨成匀浆后定容至8 mL,12 000 r/min(4 ℃)离心20 min,上清液即为粗酶提取液,4 ℃冰柜中保存;SOD、POD活性测定参照李合生等[3]的方法;PPO活性测定参照朱广廉等[4]的方法;CAT活性测定参照邹琦[5]的方法。每处理3次重复。
1.2.3PAL酶液制备与活性测定
称取0.5 g叶片,加入0.1 g聚乙烯吡咯烷酮(PVP),再加入0.05 mol/L的硼酸缓冲溶液50 mL(pH 8.8,含有0.005 mol/L巯基乙醇),冰浴匀浆,10 000 r/min离心15 min,上清液用于酶活性测定;PAL活性测定参照邹芳斌等[6]的方法。每处理3次重复。
1.2.4病害调查
分别于接种后观察发病情况并计算病情指数。病害分级标准见表1。
2 结果与分析
2.1接种后病害发生情况
2.1.1接种尖孢镰刀菌后半夏发病情况
半夏接种尖孢镰刀菌后第2天开始发病。此时地上部分正常,地下根系也正常,仅块茎出现腐烂症状,腐烂部分用手捏易脱皮,且有少量糊状物流出,并伴有臭味。发病后第2 天病情指数由12.5增加到70.3,第5天时根系部分已出现坏死且伴有恶臭味,地上叶片部分出现萎蔫(表2)。
2.1.2接种寄生疫霉后半夏发病情况
半夏叶部接种寄生疫霉后第3天开始发病。发病叶片出现明显的水浸状斑点,发病后第3天病情指数由7.5增加到70.6,部分斑病已扩大至占整叶片的1/2以上,第5天时部分叶片已出现萎蔫(表2)。接种一周时萎蔫倒苗。
2.2酶活性变化动态
2.2.1SOD活性变化动态
接种尖孢镰刀菌和寄生疫霉后叶片中SOD活性迅速升高,并且在第1天达到高峰,然后开始下降,但始终高于对照(图1)。SOD活性峰值分别为257.97 U/(g·min)和129.86 U/(g·min),最大增幅分别比对照高77.1%和59.9%。
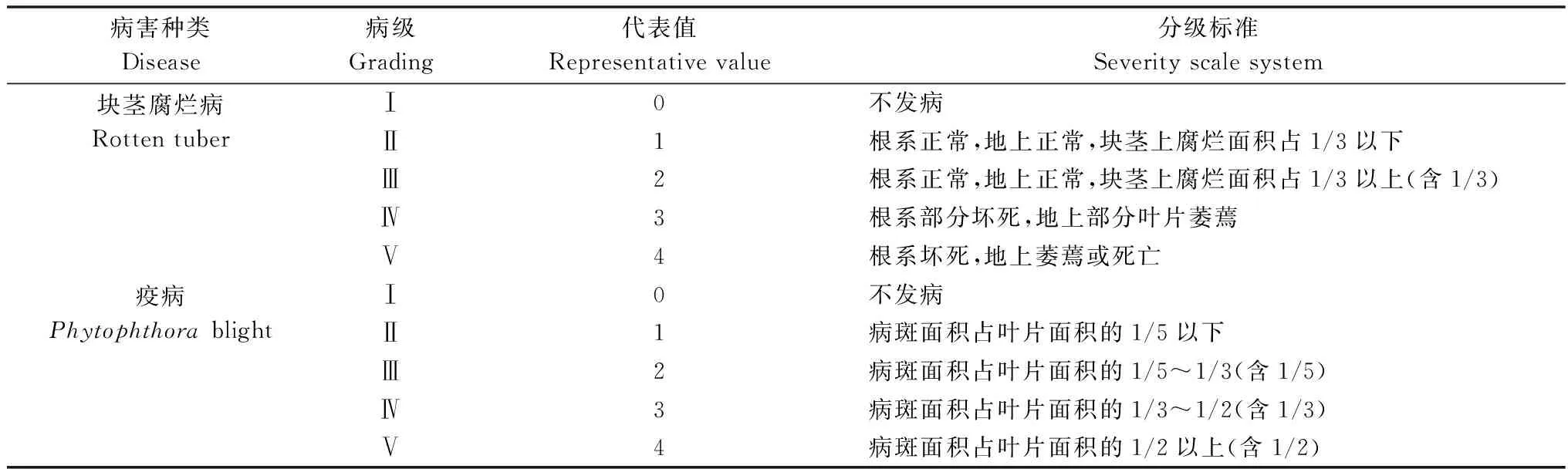
表1 半夏块茎腐烂病和疫病严重度分级标准Table 1 Severity scale system of Pinellia ternate after inoculated with Fusarium oxysporum and Phytophthora parasitica
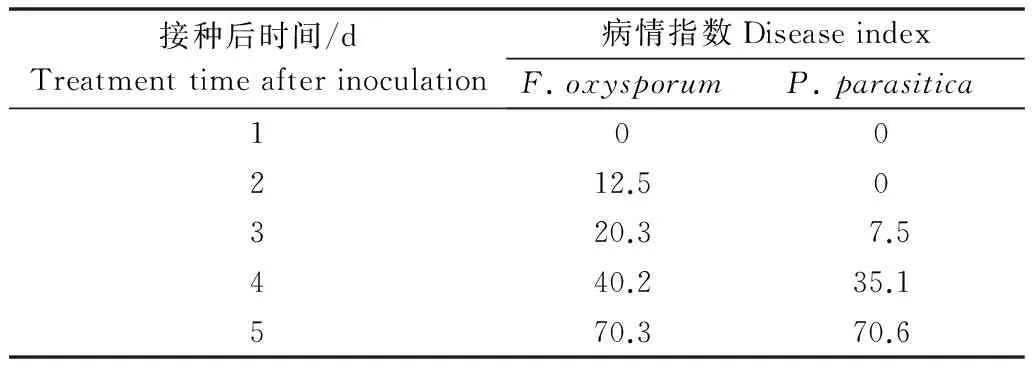
表2 接种尖孢镰刀菌和寄生疫霉后半夏发病情况Table 2 Disease index of Pinellia ternate after inoculated with Fusarium oxysporum and Phytophthora parasitica
2.2.2POD活性变化动态
接种尖孢镰刀菌和寄生疫霉后叶片中POD活性都出现上升,并且在第3天达到高峰,3天后又开始下降。接种尖孢镰刀菌比接种寄生疫霉后POD活性上升速度较快,并且上升幅度也较大,而下降速度也较快,分别于第4天和第5天接近于对照(图2)。POD活性峰值分别为436.61 U/(g·min)和117.95 U/(g·min),最大增幅分别比对照高559.7%和197.8%。
2.2.3CAT活性变化动态
接种尖孢镰刀菌和寄生疫霉后叶片中CAT活性呈先升高后下降趋势,都在第2天达到高峰,峰值分别为69.28 U/(g·min)和38.95 U/(g·min),最大增幅分别比对照高52.3%和210.0%。第2天后都开始下降,接种尖孢镰刀菌的CAT活性下降至低于对照,而接种寄生疫霉的CAT活性在第4天又略有升高,然后低于对照(图3)。
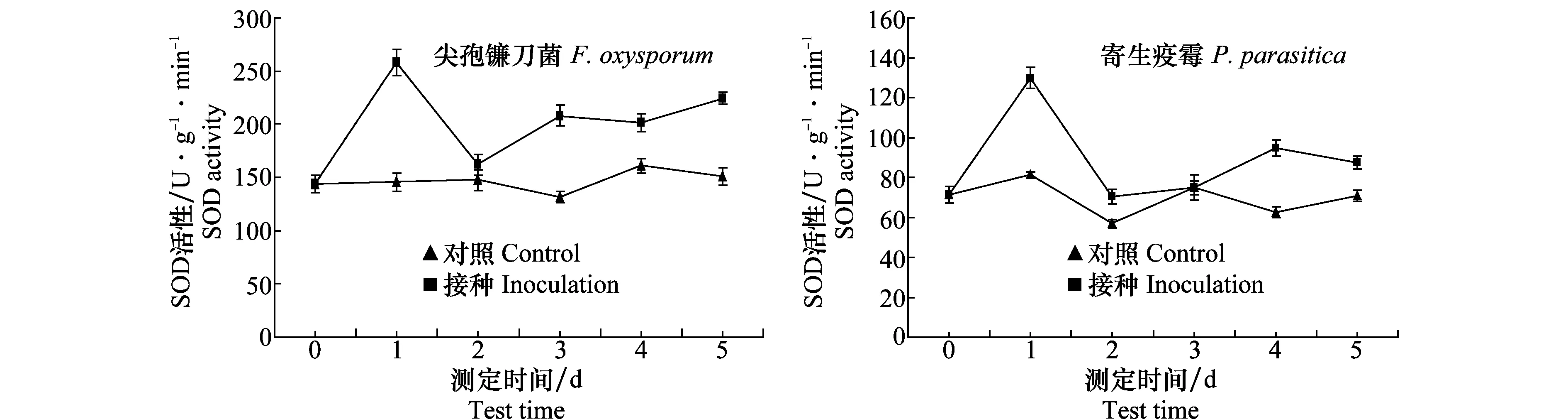
图1 接种尖孢镰刀菌和寄生疫霉后半夏叶片SOD活性Fig.1 Change of SOD activity after inoculated with Fusarium oxysporum and Phytophthora parasitica in Pinellia ternate
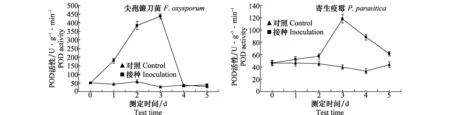
图2 接种尖孢镰刀菌和寄生疫霉后半夏叶片POD活性Fig.2 Change of POD activity after inoculated with Fusarium oxysporum and Phytophthora parasitica in Pinellia ternate
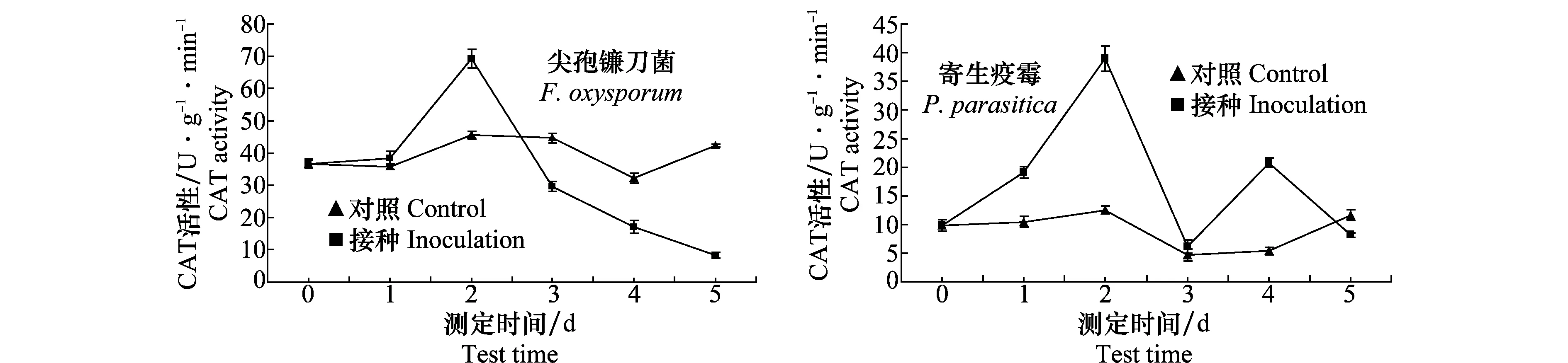
图3 接种尖孢镰刀菌和寄生疫霉后半夏叶片CAT活性Fig.3 Change of CAT activity after inoculated with Fusarium oxysporum and Phytophthora parasitica in Pinellia ternate
2.2.4PPO活性变化动态
接种尖孢镰刀菌前2天叶片中PPO活性无明显变化趋势,第3天明显升高,第4天达到峰值;接种寄生疫霉前3天叶片中PPO活性无明显变化,感病后期第4天出现突然升高(图4)。接种尖孢镰刀菌和寄生疫霉后第4天时病情指数分别高达40.2和35.1,此时PPO活性的升高可能是感病后的生理反应。
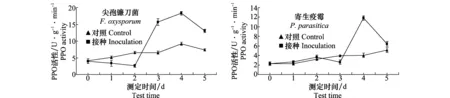
图4 接种尖孢镰刀菌和寄生疫霉后半夏叶片PPO活性Fig.4 Change of PPO activity after inoculated with Fusarium oxysporum and Phytophthora parasitica in Pinellia ternate
2.2.5PAL活性变化动态
接种尖孢镰刀菌和寄生疫霉后叶片中PAL活性呈先升高后下降趋势,分别于第2天和第3天达到高峰,然后开始下降(图5)。接种尖孢镰刀菌比接种寄生疫霉后PAL活性上升速度快,峰值分别为790.59 U/(g·h)和190.57 U/(g·h),最大增幅分别比对照高200.0%和265.2%。
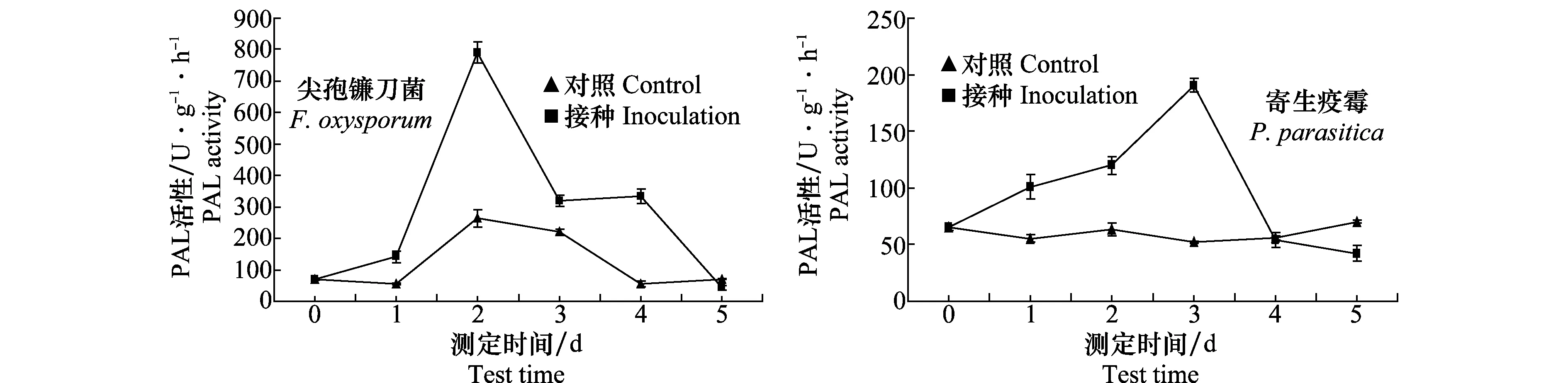
图5 接种尖孢镰刀菌和寄生疫霉后半夏叶片PAL活性Fig.5 Change of PAL activity after inoculated with Fusarium oxysporum and Phytophthora parasitica in Pinellia ternate
3 讨论
接种尖孢镰刀菌和寄生疫霉后半夏分别于第2天和第3天出现发病症状,并且病害随时间延长逐渐加重,病情变化较快,第5天时病情指数分别高达70.3和70.6,而且少数叶片已出现萎蔫,这和大田发病情况基本一致。可能与半夏植株矮小(大田栽培地上部分高6 cm左右)、叶柄纤细弱小(叶柄粗2.5 mm左右)有关,一旦发病就很快出现倒苗。
植物体内的SOD、POD、CAT、PPO和PAL等防御酶都与抗病性有关。SOD、POD与CAT共同组成一个防御体系,能有效清除植物体内的自由基和过氧化物[7]。从本试验结果看,接种尖孢镰刀菌和寄生疫霉后SOD活性高峰都出现在第1天,即在发病前。CAT活性高峰都出现在第2天,即在发病初期。POD活性高峰都出现在第3天,但在接种尖孢镰刀菌后的第2天POD活性已接近高峰,因此POD高活性也出现在发病初期。说明这个体系在半夏防御病原侵染中起重要作用。PAL则是苯丙烷类代谢途径中的第一个关键酶,与植物抗毒素及酚类化合物的形成密切相关[8-9]。本试验中PAL活性高峰分别出现在第2天和第3天,即在发病初期,也是半夏重要的防御反应。另外,‘桃叶半夏’接种尖孢镰刀菌和寄生疫霉2种病原后SOD、POD、CAT、PPO、PAL活性变化趋势基本一致,对不同病原菌的反应没有明显特异性。
PPO通过催化木质素及醌类化合物形成,使细胞免受病菌的侵害[10]。房保海等在烟草上研究表明PPO活性与植物抗病性紧密相关,抗感病品种早期PPO活性均升高,后期下降[11]。刘守伟等在黄瓜上研究表明抗感品种PPO活性都先升后降[12]。本试验表明,接种2种病原菌后PPO活性在发病前期无明显变化,发病后期突然升高的表现也是寄主染病后的生理变化。邵登魁等在白菜型冬油菜白粉病病程中发现PPO活性变化与病害侵染无明显相关性[13]。可见,在寄主显症之前或发病初期达到活性高峰的SOD、POD、CAT、PAL在半夏抗病生理机制中起着重要作用,在半夏抗病种质筛选时需要重点关注。
本研究只是初步探讨了‘桃叶半夏’接种尖孢镰刀菌和寄生疫霉后SOD、POD、CAT、PPO、PAL活性变化动态以及发病进程与酶活性变化之间的关系,对不同地方品种防御酶活性变化规律以及外界化合物诱导抗性方面有待进一步深入研究。
[1]裴建文,孙新荣,呼丽萍,等.半夏疫病病原鉴定和防治研究[J].植物保护,2010,36(6):103-107.
[2]孙新荣,呼丽萍,刘艳梅,等.半夏块茎腐烂病病原鉴定和药效比较[J].中国中药杂志,2010,35(7): 837-841.
[3]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:146-147,164-165.
[4]朱广廉,钟海文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990:37-39.
[5]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000: 166.
[6]邹芳斌,司龙亭,李新,等.黄瓜枯萎病抗性与防御系统几种酶活性关系的研究[J].华北农学报,2008,23(3):181-184.
[7]徐鹏,李浩然,曹志艳,等.玉米抵御鞘腐病菌侵染的生理机制[J].植物保护学报,2013,40(3):261-265.
[8]Pellegrini L, Rohfritsch O, Fritig B,et al. Phenylalanine ammonia-lyase in tobacco. Molecular cloning and gene expression during the hypersensitive reaction toTobaccomosaicvirusand the response to a fungal elicitor[J].Plant Physiology,1994,106:877-886.
[9]Dorey S, Kopp M, Geoffroy P, et al.Hydrogen peroxide from the oxidative burst is neither necessary nor sufficient for hypersensitive cell death induction,phenylalanine ammonia lyase stimulation,salicylic acid accumulation,or scopoletin consumption in cultured tobacco cells treated with elicitin[J].Plant Physiology,1999,121:163-171.
[10]Schneider S, Ullrich W.Differential induction of resistance and enhanced enzyme activities in cucumber and tobacco caused by treatment with various abiotic and biotic inducers [J].Physiological and Molecular Plant Pathology,1994,45:291-304.
[11]房保海,张广民,迟长凤,等.烟草低头黑病菌毒素对烟草丙二醛含量和某些防御酶的动态影响[J].植物病理学报,2004,34(1):27-31.
[12]刘守伟,吴凤芝,马艳玲.枯萎病菌对不同抗性黄瓜品种几种酶活性的影响[J].植物保护,2009,35(1):82-85.
[13]邵登魁,裴建文,雷建明,等.白菜型冬油菜白粉病病程中超氧化物歧化酶和过氧化物酶及多酚氧化酶的变化[J].西北农业学报,2006,15(5):118-122.
(责任编辑:田喆)
Dynamic responses of the defensive enzymes inPinelliaternatetoFusariumoxysporumandPhytophthoraparasitica
Sun Xinrong1,Zhong Caiping1,Pei Jianwen2,Sun Wancang3
(1. Extension Station of Agricultural Technology, Weiyuan County, Dingxi, Gansu748200, China; 2. Protection and Research Institute of Modern Agriculture and Animal and Plant Resources of Southeast Gansu, Tianshui Normal University, Tianshui741001, China; 3. College of Agronomy, Gansu Agricultural University, Lanzhou730070, China)
The activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), polyphenol oxidase (PPO) and phenylalanine ammonia-lyase (PAL) were studied in the leaves of peach-leaf typePinelliaternatainoculated withFusariumoxysporumSchlecht andPhytophthoraparasiticaDastur. The results showed that the disease index ofP.ternateinoculated withF.oxysporumandP.parasiticawere 70.3 and 70.6 on the fifth day, respectively. The peaks of SOD, POD and CAT, treated withF.oxysporumandP.parasitica, were observed on the first, third and second day, respectively. The peak of PAL inoculated withF.oxysporumandP.parasiticawere observed on the second day and the third day. The activities of PPO inoculated withF.oxysporumandP.parasiticarose slightly on the 3rd day and the 4th day, respectively. These results preliminarily showed that the activity of SOD, POD, CAT and PAL should be considered in screening varieties.
Pinelliaternate;rotten tuber;Phytophthorablight;defensive enzyme
2015-02-09
2015-04-27
天水市重大科技攻关项目(2005-18)
E-mail:zcp620727@163.com
S 435.67
A
10.3969/j.issn.0529-1542.2016.02.019

