姜黄素抑制胰腺癌转移的实验研究
冀润利 陈凯 许威
·论著·
姜黄素抑制胰腺癌转移的实验研究
冀润利陈凯许威
目的探讨姜黄素是否具有抑制体内外胰腺癌的作用及其作用机制。方法不同浓度姜黄素处理胰腺癌细胞株AsPC-1 72 h后,MTT法检测细胞存活率,并选择姜黄素的最佳浓度。经最佳浓度姜黄素处理细胞后采用AnnexinV-FITC/PI双染流式细胞术检测AsPC-1早期细胞凋亡;观察姜黄素对AsPC-1细胞迁移及侵袭的影响。建立胰腺癌原位瘤裸鼠模型,分别用低剂量(20 mg/kg体重)、高剂量(40 mg/kg体重)姜黄素对胰腺癌原位模型裸鼠进行灌胃治疗,8周后处死裸鼠,观察肿瘤转移情况,免疫组化法检测裸鼠肿瘤组织中CD34、NF-κB、MMP-9的表达。结果不同浓度姜黄素处理AsPC-1细胞后呈剂量依赖性地抑制细胞生长,增加细胞凋亡,以6 μmol/L姜黄素为最佳剂量。6 μmol/L姜黄素处理后,AsPC-1细胞的迁移覆盖率从未处理细胞的70%下降到10%,穿膜细胞数从136个/200倍透视野下降到17个/200倍视野,两组差异均有统计学意义(P值均<0.05)。姜黄素治疗裸鼠胰腺癌移植瘤后,移植瘤体积从未治疗组的(97.8±15.3)mm3缩小至低剂量组的(44.3±9.7)mm3及高剂量组的(28.1±7.1)mm3;远处转移灶数量从(108.3±6.7)个下降至(29.5±4.5)个及(8.9±2.4)个;瘤组织CD34表达量从20.5±2.3下降至10.3±1.2及7.9±3.2;MMP-9表达量从85.2±2.3下降至53.2±1.2及34.2±3.1,差异均有统计学意义(P值均<0.05)。结论姜黄素能够抑制体内外胰腺癌肿瘤转移,其作用可能是通过抑制CD34、MMP-9表达来实现。
胰腺肿瘤;肿瘤转移;姜黄素
Fund program:National Natural Science Foundation of China(81173393);Forces Foundation of Logistics University of Chinese People′s Armed Police(WHM201222);Xiqing Hospital Foundation(xqlx201406)
胰腺癌预后差主要是由于其早期诊断困难、无高效的药物治疗及癌细胞药物抵抗等因素导致的[1-2]。因此,研究胰腺癌的病理机制及发展新的治疗药物至关重要。姜黄素(curcumin)是从姜科、天南星科根茎中提取的一种化学成分,其药理作用已经被广泛研究[3],目前被证明具有抗炎、抗氧化、促进伤口愈合、抗肿瘤等作用[4]。另有研究表明[5],姜黄素有调节多种信号通路,如NF-κB、Akt、Notch、mTOR及Hedgehog等通路的作用。虽然越来越多的研究证明姜黄素有抗肿瘤的作用,但其作用机制尚未清楚。本研究探讨姜黄素抗肿瘤的机制,期待为临床提供更有力的理论支持。
材料与方法
一、材料
人胰腺癌细胞系AsPC-1来自天津中医药大学基础研究实验室,常规培养、传代。MTT、AnnexinV-FITC/PI检测试剂盒购自Sigma公司。姜黄素购自Sigma公司,用二甲基亚砜(DMSO)溶解,配制成不同浓度。细胞侵袭小室及基底膜类似物(matrigel)购于BD公司,CD34、NF-κB和MMP-9抗体均购自Sigma公司。雄性BALB/c-nu/nu品系小鼠,体重20~25 g,5~6周龄,购自中国科学院上海动物实验中心,饲养于天津中医药大学动物实验中心,温度为(24±2)℃,相对湿度为40%~60%。饲养1周使其适应实验环境。
二、实验方法
1.细胞增殖抑制率检测:采用MTT法检测细胞的增殖抑制率。收集对数生长期AsPC-1细胞,制成单细胞悬液,接种到96孔板,每孔4×103个细胞。培养24 h后分别加入2、3、4、5、6、7、8、9 μmol/L姜黄素,对照组细胞加入0.1% DMSO处理细胞,继续培养72 h后加入5 mg/ml MTT 20 μl,再培养4 h后加入150 μl DMSO,上酶标仪检测各孔490 nm处的吸光值(A490值),计算细胞增殖抑制率。实验重复3次,并计算IC50值。
2.细胞凋亡检测:采用Annexin V-FITC/PI双染流式细胞术检测早期凋亡细胞。取对数生长期AsPC-1细胞,以每孔5×105个细胞铺于6孔板,培养过夜后加入IC50值的姜黄素浓度继续培养24 h,胰蛋白酶消化离心后,PBS洗两次,应用AnnexinV-FITC/PI 检测试剂盒检测细胞凋亡,按说明书操作。
3.细胞迁移及侵袭能力检测:取AsPC-1细胞接种于6孔板,培养至细胞90%融合时用200 μl枪头尖端紧贴培养孔底部,与底部垂直,在直视下缓慢均匀地推动枪头从培养孔的一侧到另一侧成一直线划移,PBS洗掉漂浮细胞后加入IC50值的姜黄素孵育0、20 h,倒置显微镜下观察细胞的迁移。参照文献[6]的方法,采用Transwell小室进行细胞侵袭实验。
4.实验动物模型制备及分组:取对数生长期AsPC-1细胞2×106个注射于裸鼠皮下,待其长成大概1 cm3的瘤块后取出,剪成1 mm3的组织块。腹腔麻醉裸鼠后开腹,剪开胰腺被膜,将组织块埋于胰尾近脾动脉处。共制备27只荷瘤裸鼠,按体重随机分成对照组、低剂量姜黄素组和高剂量姜黄素组,每组9只。术后4周,低剂量姜黄素组和高剂量姜黄素组分别给予20 mg/kg体重及40 mg/kg体重的姜黄素灌胃,每周3次,持续给药2周,对照组裸鼠相应用0.1% DMSO 0.2 ml灌胃。术后8周处死裸鼠,观察移植瘤生长及转移情况,取瘤组织用甲醛固定,石蜡包埋、切片,采用免疫组化法检测移植瘤组织CD34、 NF-κB和MMP-9蛋白表达。以胞质或胞核内出现棕色颗粒为阳性表达。在400倍镜下随机选取20个视野,计数各视野CD24阳性表达细胞数及NF-κB、MMP-9阳性细胞总细胞数的百分率。
三、统计学处理

结 果
一、各组AsPC-1细胞的增殖抑制率及细胞凋亡
2、3、4、5、6、7、8、9 μmol/L姜黄素处理72 h后AsPC-1细胞的增殖抑制率分别为18.9%、38.7%、42.7%、44.9%、55.6%、61.7%、62.5%、67.9%,呈剂量依赖性地抑制细胞的生长,其IC50值为6 μmol/L,故在此后研究中采用6 μmol/L的姜黄素浓度。
2、3、4、5、6、7、8、9 μmol/L姜黄素处理72 h后AsPC-1细胞的凋亡率分别为6.9%、11.7%、13.5%、18.1%、22.3%、23.1%、25.1%、27.3%,呈剂量依赖增加细胞凋亡(图1)。

图1 对照组及3、6 μmol/L姜黄素组的细胞凋亡(1A、1B:流式细胞法,1C、1D:荧光显微镜下 ×400)
二、各组AsPC-1细胞的迁移及侵袭能力
对照组细胞向划痕区迁移,迁移细胞覆盖了70%以上的划痕区,而6 μmol/L姜黄素组少数细胞向划痕区迁移,仅覆盖约10%的划痕区(图2)。

图2 不同孵育时间对照组(2A)及6 μmol/L姜黄素组(2B)的细胞迁移(×200)
对照组、6 μmol/L姜黄素组的穿膜细胞数分别为136个/200倍视野和17个/200倍视野,6 μmol/L姜黄素组显著少于对照组,差异有统计学意义(χ2=15.68,P<0.05,图3)。
三、裸鼠移植瘤的生长及转移
裸鼠处死后,对照组及低、高剂量姜黄素治疗组裸鼠胰腺移植瘤的体积分别为(97.8±15.3)mm3、(44.3±9.7)mm3、(28.1±7.1)mm3,治疗组显著小于对照组,差异有统计学意义(χ2=24.89,P<0.05)。胰腺肿瘤发生远处转移,转移部位主要是肝、肠壁、腹壁等,肠系膜转移最多,各组裸鼠的转移灶数目分别为(108.3±6.7)、(29.5±4.5)、(8.9±2.4)个,治疗组显著少于对照组,差异有统计学意义(χ2=18.74,P<0.05)。

图3 对照组(3A)及6 μmol/L姜黄素组(3B)的穿膜细胞(×200)
四、胰腺移植瘤组织CD34、NF-κB、MMP-9蛋白表达
除低剂量姜黄素组移植瘤NF-κB表达与对照组无显著差异外,两姜黄素治疗组裸鼠移植瘤组织CD34、NF-κB、MMP-9蛋白表达均较对照组显著下降,差异均有统计学意义(表1)。
讨 论
胰腺癌是比较严重且愈后不佳的恶性肿瘤之一,其发病率在我国呈上升趋势。由于胰腺癌早期诊断十分困难且易侵犯周围的组织器官并发生远处转移,多数患者临床确诊后已经失去了手术治疗的最佳时机,即使进行了手术治疗,预后仍不乐观,其5年生存率仅为6%,并且大约95%的患者都会出现癌症复发[7]。

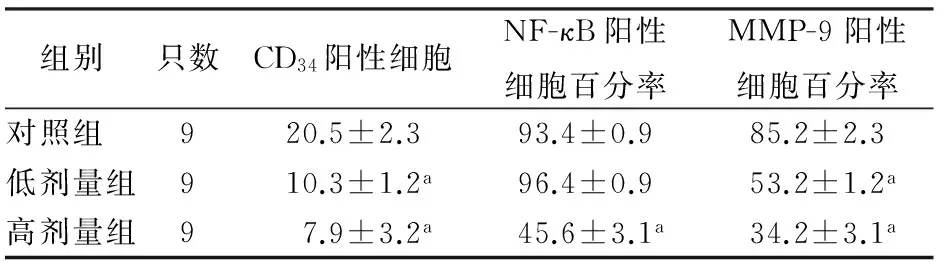
组别只数CD34阳性细胞NF-κB阳性细胞百分率MMP-9阳性细胞百分率对照组 920.5±2.393.4±0.985.2±2.3低剂量组910.3±1.2a96.4±0.953.2±1.2a高剂量组97.9±3.2a45.6±3.1a34.2±3.1a
注:与对照组比较,aP<0.05
姜黄素是一种天然植物提取物,具有很多药理作用,包括抗肿瘤、抗感染、抗氧化以及促进伤口愈合等作用,其抗肿瘤的作用机制在于作用于生长调节因子、转录因子、凋亡因子、黏附因子、血管生成调节因子和细胞信号分子等。研究证实,姜黄素对胃癌、肝癌、结肠癌等肿瘤的生长及转移具有抑制作用,然而姜黄素对胰腺癌的抗肿瘤作用及其机制尚不明确。本研究结果显示,姜黄素呈剂量依赖性抑制高转移性的胰腺癌AsPC-1细胞的增殖,同时促进细胞的凋亡;能够抑制AsPC-1细胞的迁移及侵袭能力。体内实验结果显示,姜黄素能抑制裸鼠胰腺原位移植瘤的生长及转移。
肿瘤转移是一个多步骤、多因素介导的生物学过程,肿瘤转移与细胞粘附、定向迁移、穿透基底膜、血管生成等因素密切相关。基质金属蛋白酶(matrix metalloproteinase, MMPs)是一种依赖于锌离子的肽链内切酶家族,参与细胞外基质的降解,几乎可以降解除多糖以外全部的细胞外基质成分。肿瘤细胞可以通过分泌MMPs降解毛细血管内皮细胞下的基质膜和细胞外基质Ⅳ型胶原,从而使内皮细胞向外进行迁移并增殖,导致新的血管和基底膜的形成,在肿瘤细胞浸润周围组织并进入血管和淋巴管发生远距离转移中发挥着重要的作用。MMP-9是MMPs家族中的重要一员,在恶性肿瘤组织中高表达,且表达水平与肿瘤的预后密切相关,此外MMP-9还可以调控血管内皮生长因子(VEGF),抑制肿瘤血管的生成[8-9]。NF-κB 作为一个转录因子蛋白家族,与肿瘤的发生、发展及血管生长等关系密切,此外NF-κB能够在转录水平调控MMP-9基因,从而直接影响MMP-9蛋白表达[10]。IκBα 的磷酸化是NF-κB活化的关键步骤,姜黄素可通过下调IκBα的磷酸化,减少细胞NF-κB抑制物IκBα蛋白,从而降低NF-κB的活化[11]。肿瘤的生长和转移依赖于血管的生成,本实验检测了CD34在肿瘤组织中的表达情况,以反映肿瘤的微血管密度,CD34作为介导肿瘤转移的基因之一,在胰腺癌转移中起重要作用[12]。
本研究结果显示,姜黄素能够抑制胰腺移植瘤组织NF-κB、MMP-9、CD34的表达,通过减少基质蛋白的降解和抑制血管新生等途径抑制胰腺癌细胞的转移。
[1]Costello E, Greenhalf W, Neoptolemos JP. New biomarkers and targets in pancreatic cancer and their application to treatment[J]. Nat Rev Gastroenterol Hepatol, 2012, 9(8): 435-444.
[2]杨尹默.胰腺癌外科治疗的热点与难点[J].中华消化外科杂志,2015,14(8):612-614.DOI:10.3760/cma.j.issn.1673-9752.2015.08.004.
[3]Gupta SC, Kismali G, Aggarwal BB. Curcumin, a component of turmeric: from farm to pharmacy[J]. Biofactors, 2013, 39(1): 2-13.
[4]Park W, Amin AR, Chen ZG, et al. New perspectives of curcumin in cancer prevention[J]. Cancer Prevention Research, 2013, 6(5): 387-400.
[5]Beevers CS, Zhou H, Huang S. Hitting the golden TORget: curcumin′s effects on mTOR signaling[J]. Anti-cancer Agents Med Chem, 2013, 13(7): 988-994.
[6]Wu Q, Wang R, Yang Q, et al. Chemoresistance to gemcitabine in hepatoma cells induces epithelial-mesenchymal transition and involves activation of PDGF-D pathway[J]. Oncotarget, 2013, 4(11): 1999-2009.
[7]American Cancer Society. Cancer Facts & Figures 2015[M].Atlanta: American Cancer Society;2015.
[8]周琎,潘超,杨士勇,等. 胰腺癌组织HSP90α、VEGF-C蛋白表达及其临床意义[J]. 中华胰腺病杂志,2015,15(2):129-131.DOI:10.3760/cma.j.issn.1674-1935.2015.02.018.
[9]吴俊本,张洁,成丕光,等. 胰腺癌组织中MMP-2、MMP-9的表达[J]. 中华胰腺病杂志,2012,12(1):30-32.DOI:10.3760/cma.j.issn.1674-1935.2012.01.010.
[10]Scheffel DL, Hebling J, Scheffel RH, et al. Inactivation of matrix-bound matrix metalloproteinases by cross-linking agents in acid-etched dentin[J]. Oper Dent, 2014, 39(2): 152-158.
[11]田芳,柴玉荣,江亚南,等.姜黄素通过下调IκBα磷酸化抑制食管鳞癌细胞的体外增殖[J].基础医学与临床, 2011, 31(7):767-772.
[12]Wang WQ, Liu L, Xu HX, et al. Intratumoral SMA enhances the prognostic potency of CD34 associated with maintenance of microvessel integrity in hepatocellular carcinoma and pancreatic cancer[J]. PloS One, 2013, 8(8): e71189.
(本文编辑:屠振兴)
Anti-metastasis effect of curcumin on human pancreatic cancer
JiRunli,ChenKai,XuWei.
SecondDepartmentofGastroenterology,AffiliatedHospitalofLogisticsUniversityofChinesePeople′sArmedPoliceForces,Tianjin300162,China
Correspondingauthor:JiRunli,Emai:tjjrli@126.com
ObjectiveTo investigate whether curcumin could inhibit the metastasis of pancreatic cancer in vitro and in vivo and its mechanism. MethodsPancreatic cancer AsPC-1 cells were treated with different concentrations of curcumin. After 72 hours, cell survival rate were detected by MTT and the appropriate concentration of curcumin was selected. After treated with 6 μmol/L curcumin, early apoptosis of AsPC-1 cells were detected by Annexin V-FITC/PI double staining flow cytometry, and the effects of curcumin on the migration and invasion of AsPC-1 cells were observed. After establishment of the orthotopic nude mouse model of pancreatic cancer, the mice were orally treated with low dose (20 mg/kg body weight) and high dose (40 mg/kg body weight) of curcumin respectively. Eight weeks later mice were sacrificed to observe the tumor metastasis, immunohistochemical methods were used to detect the positive expressions of CD34, NF-κB and MMP-9 in the tumor tissue. ResultsCurcumin of different concentrations could inhibit the proliferation of AsPC-1 cells and induce its apoptosis in a dose dependent manner, and 6 μmol/L was the best dose of curcumin. After 6 μmol/L curcumin treatment, the migration coverage of AsPC-1 decreased from 70% to 10%, the number of penetrating cells decreased from 136/ 200x magnification to 17/200x magnification, and the difference between the two groups was statistically significant (P<0.05). In the nude mouse model of pancreatic cancer, the size of the tumor decreased from (97.8±15.3)mm3to (44.3±9.7)mm3in high dose group and (28.1±7.1)mm3in low dose group, the number of distant metastasis decreased from 108.3±6.7 to 29.5±4.5 and 8.9±2.4, the expression of CD34decreased from 20.5±2.3 to 10.3±1.2 and 7.9±3.2, and the expression of MMP-9 decreased from 85.2±2.3 to 53.2±1.2 and 34.2±3.1, and the difference was statistically significant (P<0.05). ConclusionsCurcumin can inhibit the metastasis of pancreatic cancer both in vitro and in vivo, and its effect may be related to the inhibition of expressions of CD34and MMP-9.
Pancreatic neoplasms;Neoplasm metastasis;Cucurmin
10.3760/cma.j.issn.1674-1935.2016.01.004
300162天津,武警后勤学院附属医院消化二科(冀润利、陈凯、许威);天津中医药大学研究生院(冀润利)
冀润利,Emai: tjjrli@126.com
国家自然科学基金(81173393);武警后勤学院种子基金面上基金项目(WHM201222);西青医院院级面上资助项目(xqlx201406)
2015-05-07)

