分子动力学模拟二硫键对大豆11S球蛋白结构及表面活性的影响
董 振,李军生 ,阎柳娟,黄国霞,王 微
(1.广西科技大学 生物与化学工程学院, 广西 柳州 545006 ;2.广西糖资源绿色加工重点实验室,广西 柳州 545006;3广西高校糖资源加工重点实验室, 广西 柳州 545006)
科研与开发
分子动力学模拟二硫键对大豆11S球蛋白结构及表面活性的影响
董 振,李军生 ,阎柳娟,黄国霞,王 微
(1.广西科技大学 生物与化学工程学院, 广西 柳州 545006 ;2.广西糖资源绿色加工重点实验室,广西 柳州 545006;3广西高校糖资源加工重点实验室, 广西 柳州 545006)
采用分子动力学模拟分析了二硫键对天然和还原状态下大豆11S球蛋白结构及其表面活性的影响。模拟结果表明,二硫键断裂后蛋白质分子稳定性降低,蛋白质分子的构象和二级结构发生变化;二硫键全部断裂会增大蛋白质分子的柔性,有利于表面活性的提高。而断开Cys88-298和Cys12-45、Cys88-29之间的二硫键会增大蛋白质疏水区域的溶剂可及表面,说明这两种断裂方式会增大蛋白质分子在界面的吸附量,有利于界面张力的降低,可以有效提高蛋白质的表面活性。
分子动力学模拟;11S球蛋白;二硫键;表面活性
表面活性剂在日常生活、工业生产中占据重要位置,年使用量不断增加。据统计[1],2012年全球表面活性剂的产量超过1200万吨,仅我国在2013年的产量就超过200万吨。目前市面上见到的多是化学类表面活性剂,它的存在会导致土壤、水质等污染,给生态环境带来了不小的压力[2]。用做杀菌消毒剂的阳离子表面活性剂对环境污染最大,阴离子表面活性剂次之。表面活性剂排放到水中很容易引起鱼类的中毒,这些污染的食品进入人体后会因为对多种酶的抑制作用降低人体免疫力。因此我们急需开发一种更为绿色、环保的表面活性剂。
大豆11S含有较多疏水性、亲水性氨基酸,理论上具备表面活性剂的性质。11S球蛋白中含有较多二硫键,将交替出现的碱性亚基和酸性亚基连接成一个二聚体,是维持蛋白质结构稳定的主要因素之一[3];正因为如此,碱性亚基含有的大部分疏水性氨基酸被包裹在分子内部,导致天然11S球蛋白表面的疏水性氨基酸含量较少,其表面活性较差。
为了开发蛋白质基表面活性剂,本实验室进行了大量研究[4-6],前期工作已经证实二硫键断裂可以大幅提高蛋白质的表面活性,但是受实验手段和技术的限制,断开二硫键后大豆11S球蛋白结构的变化情况以及功能性质变化的微观理论至今没有明确的解释。分子动力学模拟随着计算机性能的提高得到应用,使解释分子微观变化的原因成为可能。本文主要采用动力学采用排列组合的方式模拟二硫键对维持大豆11S球蛋白结构稳定的重要性,并揭示二硫键对大豆11S球蛋白表面活性的影响。
1 模型与方法
1.1 大豆11S球蛋白模型
蛋白质数据库中搜索蛋白质序列,以大豆11S球蛋白为模版(编号为1FXZ)采用在线建模的方法补齐缺失的氨基酸,形成完整的蛋白质结构模型。然后删除三聚体中的其他原子得到Asn10-Leu336含有两个二硫键的结构模型,如图1所示。天然大豆11S球蛋白链上的胱氨酸保持原有状态,模拟未断裂状态下的结构体系。而还原状态下的11S球蛋白在半胱氨酸上依次添加H+离子模拟蛋白质二硫键断裂的状态。
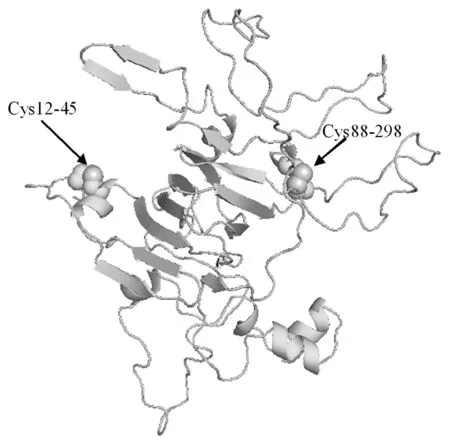
图1 大豆11S球蛋白的结构模型(Asn10-Leu336)
1.2 模拟方法
模拟温度设置为300K,选择GROMACS的全原子立场和SPC水模型。在蛋白质周围加入 的水分子形成一个水盒子模拟体系作为周期性边界进行动力学模拟。为保持体系成电中性,需添加9个正离子。模拟数值准确有效需要稳定的模拟体系,首先,模拟体系采用40000步最速下降法进行能量最小化。模拟过程中,采用PME[7]算法计算长程静电相互作用,积分步长设置为2fs,在NVT(保持原子数、体积、温度恒定)系综下,保持7S碱性蛋白原子不变,体系平衡且对水优化800ps;然后采用NPT(保持原子数、压力、温度恒定)系综,对11S大豆球蛋白和水分子体系进行平衡800ps。在该系综条件下,保持体系压强P恒定,整个盒子模拟体系的体积持续变化,当模拟体系稳定时,其体系的体积会围绕在一定值处上下波动,选择该体积平均值作为体系模拟的体积。模拟全程可以使用VMD软件观察每个阶段体系和蛋白质分子的构象变化。
2 结果与讨论
2.1 不同状态半胱氨酸相对位置分析
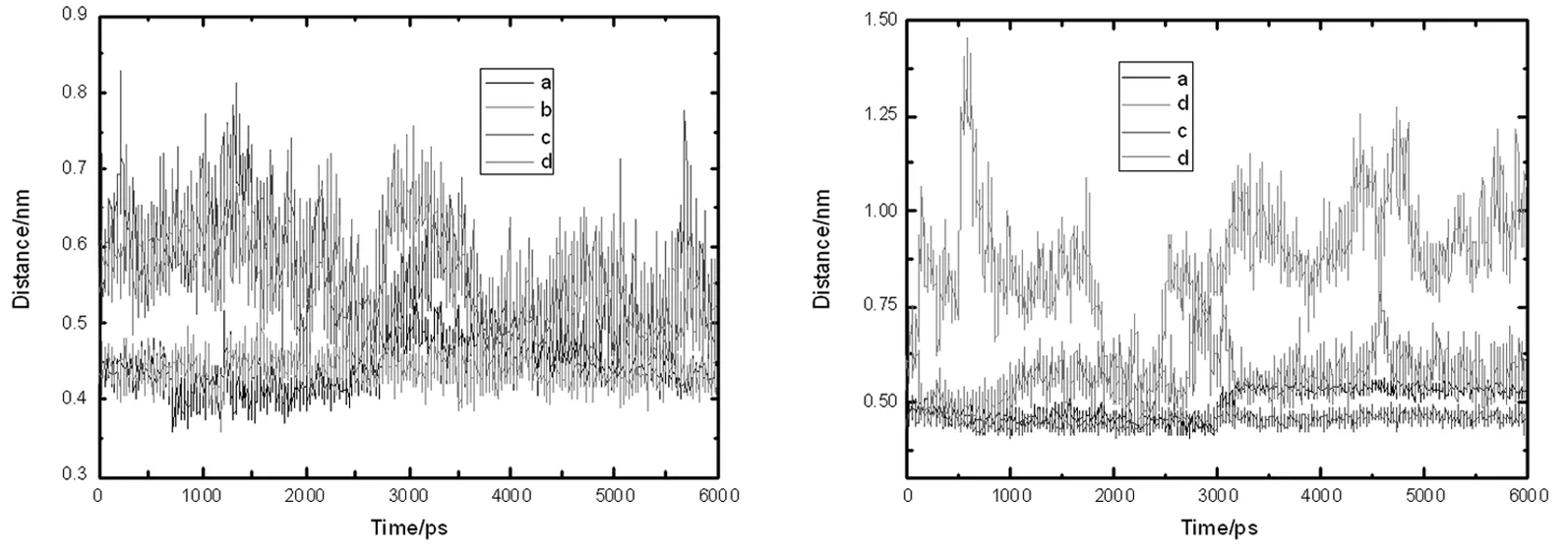
图2 不同状态大豆球蛋白中半胱氨酸残基之间的距离,A图为cys12-45之间的位置变化图,B为cys88-298之间的位置变化图,a:天然11S球蛋白,b:断开Cys88-298,c:断开Cys12-45,d:断开Cys88-298和 Cys12-45
天然大豆球蛋白含有2对二硫键。首先考察在模拟过程中半胱氨酸的位置变化,判断二硫键是否断裂,模拟结果如图2所示。由图可知,天然蛋白质具有完整的二硫键,半胱氨酸残基的运动受到了该键的限制,只在小范围内做谐振运动,当二硫键被断开后,可以发现半胱氨酸的运动范围较大,距离较远。
2.2 二硫键对均方根偏差(RMSD)的影响
RMSD可以用来分析蛋白质在模拟体系中运动变化情况,其值越大表明在分子在运动过程中蛋白质整体结构及稳定性变化越大[8]。通过RMSD的计算除了可以判断模拟体系是否达到平衡要求之外,还可以得出不同断裂位置的二硫键对维持11S球蛋白结构稳定的影响。如图3所示,黑色线条代表天然大豆11S球蛋白的RMSD变化趋势,所有模拟体系均在3.5ns时候维持恒定。从图2可以看出,断开其中任何一条二硫键都可以改变蛋白结构稳定性。其中变化幅度最大的是断开Cys12-45、Cys88-298之间的二硫键,在这种状态下蛋白质结构展开程度最大。而断开Cys88-298之间的二硫键在模拟后期蛋白质的结构稳定性增加表明蛋白质结构展开后又出现了相互吸引,这可能是在后期由于疏水相互作用等非二硫键的原因导致分子相互吸引造成的。从整体RMSD角度分析,断开Cys88-298的稳定性变化最小,说明断开仅仅Cys88-298之间的二硫键对蛋白质表面活性的提高影响可能不大。

图3 断裂不同位置二硫键的11S球蛋白模拟轨迹RMSD,a:天然11S球蛋白,b:断开Cys88-618,c:断开Cys12-618,d:断开Cys88-618和 Cys12-618
Figure.3 Root mean square fluctuations of different cleaved disulfide bond position in glycinin, a: native glycinin,b: cleaved Cys88-618, c: cleaved Cys12-618, d: cleaved Cys88-618 and Cys12-618
2.3 二硫键对涨落均方根(RMSF)的影响
为了考察二硫键对大豆11S球蛋白构象和功能的影响,我们对体系中蛋白质骨架的涨落均方根进行深入的研究。如图4所示,11S球蛋白有6个较大的loop区,所有loop区都表现出较高的分子涨落,同天然大豆11S球蛋白相比,断开不同位置的二硫键的蛋白质的涨落有明显的不同。在第一个loop区,断开Cys12-45和Cys12-45、Cys88-298二硫键的蛋白表现出比天然蛋白质更大的分子柔性,断开Cys88-298二硫键在该区域的分子柔性均下降。在第二个loop区域,断开Cys88-298和Cys12-45、Cys88-298之间的二硫键都会增加蛋白质分子的柔性。值得注意的是在第3和第5个loop区,断开任何一个二硫键都会使分子分柔性下降。而在第4个loop结果与第4和第5个loop结果恰恰相反,分子柔性都呈增大趋势。而在第六个loop,断开任何一个二硫键都会提高蛋白质分子的柔性且提高幅度没有差异。从所有蛋白质的RMSF可以看出,断开全部二硫键后,几乎所有的loop区都大于天然大豆11S球蛋白的分子柔性。对于二硫键断开后RMSF较小的原因,Qiu[9]认为可能是形成了范德华力或疏水相互作用造成的。蛋白质分子分柔性越大,乳化性等功能性质越好[10]。因此,断开Cys12-45、Cys88-298二硫键能够大大提高大豆11S蛋白的分子柔性,从而提高蛋白质的乳化(稳定)性和起泡(稳定)性。从该RMSF结果分析可以得出,断开不同位置的二硫键对蛋白质的功能性质影响不同,有选择、控制性的断开二硫键才能有针对性的提高11S球蛋白的表面活性。

图4 断裂不同位置二硫键的11S球蛋白模拟轨迹RMSF,a:天然11S球蛋白,b:断开Cys88-618,c:断开Cys12-618,d:断开Cys88-618和 Cys12-618
Figure.4 Root mean square fluctuations of different cleaved disulfide bond position in glycinin, a: native glycinin, b: cleaved Cys88-618, c: cleaved Cys12-618, d: cleaved Cys88-618 and Cys12-618
2.4 二硫键对回旋半径的影响
分析蛋白质的回旋半径采用GROMACS自带的g_gyate程序。回旋半径的大小反应蛋白质在模拟过程中体积和构象的变化,可以判断蛋白质分子结构的紧密程度。回旋半径越大说明蛋白质分子越膨胀。从图5可以看出,二硫键断裂后蛋白质结构发生了变化,全部断开的蛋白质结构变化最大,在1500~3500ps之间该蛋白质回旋半径最大,表明在此阶段蛋白质结构体系膨胀幅度最大。在整个模拟过程中只有断开Cys88-298二硫键蛋白质的回旋半径几乎始终小于天然蛋白质,表明断开Cys88-298二硫键可能不利于功能性质的改善。在模拟后期断开Cys88-298和Cys12-45二硫键都会使得蛋白体系膨胀,而断开Cys88-298二硫键并没有使体系得到膨胀,说明断开Cys88-298之间的二硫键对蛋白质结构展开不利。模拟同RMSD结果一致,因此我们可以推断,对蛋白质结构变化作用最大的是Cys12-45二硫键。
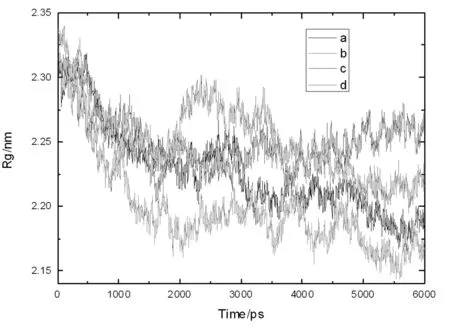
图5 断裂不同位置二硫键的11S球蛋白模拟轨迹回旋半径,a:天然11S球蛋白,b:断开Cys88-618,c:断开Cys12-618,d:断开Cys88-618和 Cys12-618
Figure.5 Radius of gyration plots of different cleaved disulfide bond position in glycinin, a: native glycinin, b: cleaved Cys88-618, c: cleaved Cys12-618, d: cleaved Cys88-618 and Cys12-618
2.5 二硫键对疏水溶剂可及表面的影响
采用GROMACS模拟软件自带的g_sas程序可以计算蛋白质的溶剂可及表面(SASA)。由图6可知,在模拟初期所有断开二硫键的蛋白质的SASA值大于天然蛋白质,说明二硫键断开后蛋白质结构变的疏松,此时蛋白质结构展开表面疏水性增大[11],疏水基团伸进极性溶剂中。随着模拟的进行,SASA值减小,这可能是因为疏水性互作用增大导致蛋白质结构致密程度增加。在模拟阶段后期断开Cys12-45、Cys88-298二硫键都断开的蛋白质SASA最大,表明此时的蛋白质伸展程度最大[12],结构最为疏松。刘国宇[13]认为分子的SASA值越小说明表面活性剂在界面的吸附量能力越大,在界面的饱和吸附量越大,降低界面张力的能力越强。因此,该实验模拟表明断开Cys88-298和Cys12-45、Cys88-29二硫键的蛋白质降低界面张力的能力最强,由于两种蛋白的SASA值差别较小,所以可以推断断开Cys88-298二硫键对蛋白质在界面的吸附效果影响较大。
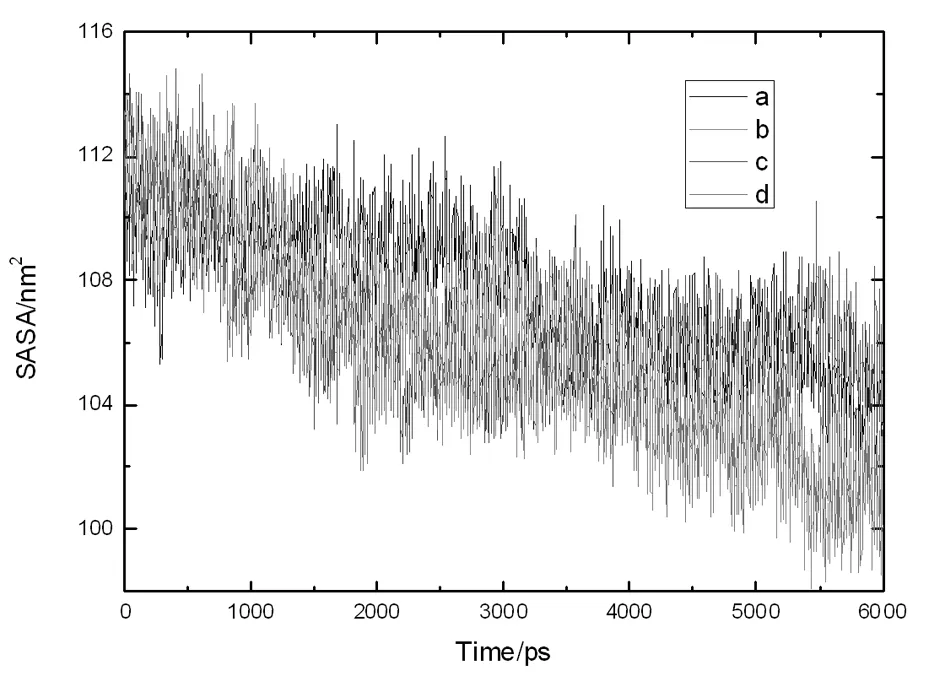
图6 断开不同位置二硫键11S球蛋白的溶剂可及表面,a:天然11S球蛋白,b:断开Cys88-618,c:断开Cys12-618,d:断开Cys88-618和 Cys12-618
Figure.6 Solvent accessible surface area of different cleaved disulfide bond position in glycinin, a: native glycinin, b: cleaved Cys88-618, c: cleaved Cys12-618, d: cleaved Cys88-618 and Cys12-618
2.6 二硫键对二级结构的影响

图7 4种体系的随时间变化的二级结构图,a:天然11S球蛋白,b:断开Cys88-298, c:断开Cys12-45,d:断开Cys88-298和 Cys12-45
Figure.7 Secondary structures as a function of simulation time for four different proteins, a: native glycinin, b: cleaved Cys88-298, c: cleaved Cys12-45, d: cleaved Cys88-298 and Cys12-45
为了进一步研究二硫键对11S球蛋白结构的影响,我们用DSSP软件对模拟后蛋白质结构二级结构进行分析[14]。如图7所示。从上到下依次为断开Cys65-78、Cys70-94、Cys81-89,Cys65-78、Cys81-89,Cys65-78,从图可以看出,整个体系没有新的条带出现,随着二硫键断裂个数增加,N10-P22原有的无规则含量逐渐增加,R62-Q71无规则卷曲含量增加,而V238-T295之间混乱程度增加。β-折叠变化不大,L201-L223α-螺旋含量依次增加(图中蓝色部分),β-转角含量降低(图中黄色部分),说明二硫键断开后,蛋白质的二级结构发生了变化。变化程度与断开二硫键的个数成正比,这说明二硫键断与蛋白质结构稳定有直接关系,断开后蛋白质稳定性降低。
3 结论
本文采用分子动力学模拟分析了二硫键对大豆11S球蛋白结构及其表面活性进行了初步探索。模拟结果显示,二硫键断裂后分子的二级结构产生变化,断开不同位置和不同个数二硫键对蛋白质结构和表面活性的影响也不相同,二硫键全部断开会增大大豆11S球蛋白的分子柔性,有利于提高分子的表面活性,只断开Cys88-298和Cys12-45、Cys88-29可能更有利蛋白质分子在界面的吸附;二硫键断裂后蛋白质分子不在受二硫键的影响,分子结构变得膨胀,溶剂进入分子内部增大了疏水区域与溶剂的接触面积。通过以上模拟结果分析我们可以推断,断开二硫键的位置和个数对蛋白质的结构产生较大影响,这将直接影响11S球蛋白表面活性的展示,因此在提高蛋白质表面活性的过程中需要控制性的打开二硫键。本研究结果将为蛋白质基表面活性剂的开发提供一定的参考依据,对于断开二硫键对表面活性的影响需要进一步研究。
[1] 魏志华. 国内外表面活性剂的现状与发展趋势[J]. 中国石油和化工经济分析, 2014(9): 46-50.
[2] 张学佳, 纪 巍, 康志军, 等. 水环境中表面活性剂的危害及其处理方法[J]. 石化技术与应用, 2008(6): 581-586.
[3] 孟祥勋. 大豆种子贮藏蛋白研究[J]. 东北农业大学学报, 1997(2):97-103.
[4] 李军生,李丽娜,程海涛,等. 通过打开蛋白质二硫键制备蛋白质基表面活性剂的方法:CN,101590382[P].2009-12-02.
[5] 王 微,李军生,阎柳娟, 等. 氧化变构-海藻酸钠复合修饰对大豆分离蛋白表面活性的影响[J].饲料研究,2016(5):42-46,51.
[6] 董 振,李军生,阎柳娟, 等. 过氧乙酸氧化对大豆11S球蛋白表面活性及其结构的影响[J]. 食品工业,2016(4):50-54.
[7] Darden T, York D, Pedersen L. Particle mesh Ewald: An N-log (N) method for Ewald sums in large systems[J]. The Journal of chemical physics, 1993, 98(12): 10089-10092.
[8] 艾义新, 卢俊瑞, 辛春伟, 等. 计算机模拟三氯生对FabI活性口袋及Loop区的调控机制[J].物理化学学报,2014(3):559-568.
[9] Qiu X, Abdel‐Meguid S S, Janson C A, et al. Molecular basis for triclosan activity involves a flipping loop in the active site[J]. Protein Science, 1999, 8(11): 2529-2532.
[10] 阮奇珺. 大豆蛋白热诱导二硫键连接物的形成及巯基变化亚基水平研究[D].无锡:江南大学, 2015.
[11] 段谟杰. 蛋白质结构预测与结构比对方法的研究[D].武汉:华中科技大学, 2009.
[12] 刘夫锋, 董晓燕, 孙 彦. 海藻糖抑制淀粉质多肽42构象转变的分子动力学模拟[J]. 物理化学学报, 2010(6): 1643-1650.
[13] 刘国宇, 顾大明, 丁 伟, 等. 表面活性剂界面吸附行为的分子动力学模拟[J]. 石油学报(石油加工), 2011(1): 77-84.
[14] 董晓燕, 都文婕, 刘夫锋. 多肽抑制剂抑制淀粉质多肽42构象转换的分子动力学模拟和结合自由能计算[J].物理化学学报,2012(11):2735-2744.
(本文文献格式:董 振,李军生 ,阎柳娟,等.分子动力学模拟二硫键对大豆11S球蛋白结构及表面活性的影响[J].山东化工,2016,45(16):1-4,8.)
Molecular Dynamics Simulation of Impact of Disulfide Bonds on Surface Activity and Structure of Glycinin
DongZhen,LiJunsheng*,YanLiujua,HuangGuoxia,WangWei
(1.Faculty of Biological and Chemical Engineering, Guangxi University of Science and Technology,Liuzhou 545006,China; 2.Guangxi Key Laboratory of Green Processing of Sugar Resources, Liuzhou 545006,China; 3.Key Laboratory for Processing of Sugar Resources of Guangxi Higher Education Institutes,Liuzhou 545006,China)
Molecular dynamics simulations were used to analyze the impact of disulfide bonds on the structure and surface activity of native and reduced glycinin in Soybean. The simulation results shown that the stability of glycinin decreased after the cleaving of disulfide bonds and conformation and secondary structure of glycinin was changed,disulfide bonds were cleaved will increase the flexibility of the reduced glycinin, which was conducive to the improvement of surface active. Cys88-298 and Cys12-45, Cys88-29 were cleaved will increases the solvent accessible surface of hydrophobic domains in protein, indicating that the two modes will increase protein molecular adsorption on the interface, which was conducive to the surface tension decreased and enhances the activity of the protein on the surface.
molecular dynamics simulations; glycinin; disulfide bond; surface activity
2016-06-07
国家自然科学基金项目(21466006);广西高等学校高水平创新团队及卓越学者计划资助(桂教人〔2014〕7 号)
董 振(1990—),江苏人,硕士研究生,主要从事蛋白质基表面活性剂研究;通讯联系人: 李军生。
R914
A
1008-021X(2016)16-0001-04

